Alcalino
Se han realizado experimentos para intentar la síntesis de ununenio (Uue), que probablemente sea el próximo miembro del grupo; ninguno tuvo éxito.
Su descubrimiento del rubidio se produjo al año siguiente en Heidelberg, Alemania, y lo encontró en el mineral lepidolita.
Varias pruebas eliminaron la posibilidad de que el elemento desconocido sea torio, radio, plomo, bismuto o talio.
masa, vida media relativamente larga de 270 días y disponibilidad en cantidades significativas de varios microgramos,[38] para hacer un objetivo lo suficientemente grande como para aumentar la sensibilidad del experimento al nivel requerido; El einsteinium no se ha encontrado en la naturaleza y solo se ha producido en laboratorios, y en cantidades más pequeñas que las necesarias para la síntesis efectiva de elementos superpesados.
[48] Los metales alcalinos, debido a su alta reactividad, no aparecen de forma natural en estado puro.
La química del francio no está bien establecida debido a su radioactividad extrema;[64] por tanto, la presentación de sus propiedades aquí es limitada.
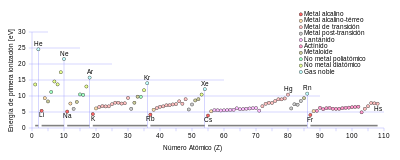
[72] Todos presentan un sistema cristalino cúbico, y tienen colores de llama distintivos porque su electrón externo se excita muy fácilmente.
Todos los metales alcalinos son altamente reactivos y nunca se encuentran en formas elementales en la naturaleza.
Su gran poder como agentes reductores los hace muy útiles para liberar otros metales de sus óxidos o haluros.
También se pensó que el cesio era radiactivo a principios del siglo XX,[103][104] aunque no tiene radioisótopos naturales.
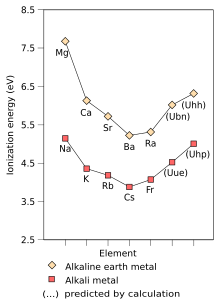
La tendencia resultante es que las densidades de los metales alcalinos aumentan en la tabla, con la excepción del potasio.
Los metales alcalinos forman una serie completa de compuestos con todos los aniones generalmente encontrados, que ilustran bien las tendencias del grupo.
[132] Cuando un metal alcalino se cae al agua, produce una explosión, de las cuales hay dos etapas separadas.
[137] Los compuestos intermetálicos de los metales alcalinos con los elementos más pesados del grupo 13 (aluminio, galio, indio y talio), como NaTl, son conductores pobres o semiconductores, a diferencia de las aleaciones normales con los elementos anteriores, lo que implica que el metal alcalino involucrado tiene perdió un electrón a los aniones Zintl involucrados.
Cuando los metales alcalinos reaccionan con los elementos más pesados en el grupo de carbono (silicio, germanio, estaño y plomo), se forman sustancias iónicas con estructuras en forma de jaula, como los siliciuros M4Si4 (M = K, Rb o Cs), que contiene M+ y iones tetraédricos Si4−4.
La energía de la red se maximiza con iones pequeños y altamente cargados; los metales alcalinos no forman iones altamente cargados, solo forman iones con una carga de +1, por lo que solo el litio, el metal alcalino más pequeño, puede liberar suficiente energía reticular para hacer que la reacción con nitrógeno sea exotérmica, formando nitruro de litio.
[151] El nitruro de sodio (Na3N) y el nitruro de potasio (K3N), aunque existen, son extremadamente inestables, propensos a descomponerse nuevamente en sus elementos constituyentes, y no se pueden producir haciendo reaccionar los elementos entre sí en condiciones estándar.
[160] Además, el pequeño tamaño de los iones Li+ y O2− contribuye a que formen una estructura reticular iónica estable.
Sin embargo, bajo condiciones controladas, se sabe que todos los metales alcalinos, con la excepción del francio, forman sus óxidos, peróxidos y superóxidos.
[170] Los metales alcalinos se encuentran entre los elementos más electropositivos en la tabla periódica y, por lo tanto, tienden a unirse iónicamente a los elementos más electronegativos en la tabla periódica, los halógenos (flúor, cloro, bromo, yodo y astatina), formando sales conocidas como haluros de metales alcalinos.
Finalmente, pueden usarse para sintetizar otros compuestos organometálicos a través del intercambio metal-halógeno.
Los metales alcalinos se disuelven en amoniaco líquido u otros solventes donantes como aminas alifáticas o hexametilfosforamida para dar soluciones azules.
Debido a la presencia de electrones solvatados, estas soluciones son agentes reductores muy potentes utilizados en síntesis orgánica.
[201] No se ha hecho tanto trabajo para predecir las propiedades de los metales alcalinos más allá del ununenio.
[241] El iridoceno (que implica iridio) presumiblemente sería aún más potente, pero no está muy bien estudiado debido a su inestabilidad.
[252] Sus iones monopositivos son paramagnéticos y no aportan color a sus sales, como los de los metales alcalinos.
[272] : 74 Como resultado de su extrema rareza en la naturaleza,[273] mayoría del francio se sintetiza en la reacción nuclear 197Au+18O → 210Fr + 5n, produciendo francio-209, francio-210 y francio-211 .
Pueden eliminarse pequeñas cantidades de litio por reacción con agua fría, pero los metales alcalinos más pesados deben disolverse en el isopropanol menos reactivo.
[307] La ingestión excesiva de litio causa somnolencia, dificultad para hablar y vómitos, entre otros síntomas,[307] y envenena el sistema nervioso central,[307] cual es peligroso ya que la dosis requerida de litio para tratar el trastorno bipolar es solo un poco más baja que la dosis tóxica.
[332] El exceso de cesio puede conducir a hipocalemia, arritmia y paro cardíaco agudo,[333] pero tales cantidades normalmente no se encontrarían en las fuentes naturales.