Rodoceno
El rodoceno, formalmente bis(η5-ciclopentadienil)rodio (II), es un compuesto químico con la fórmula [Rh(C5H5)2].
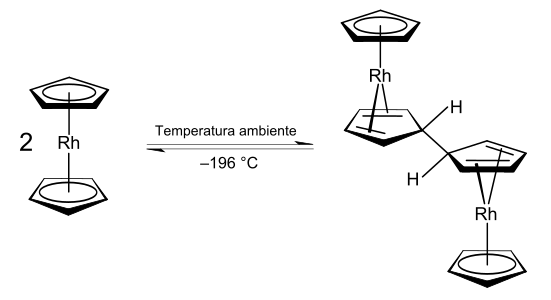
[3] El radical [Rh(C5H5)2] se obtiene por encima de los 150 °C o enfriado con nitrógeno líquido a −196 °C.
La síntesis original utiliza un anión ciclopentadienilo y tris(acetilacetonato)rodio(III);[11] Se han publicado otros enfoques, incluida la transmetalación redox en fase gaseosa[15] y el uso de precursores de «medio sándwich» (con un único enlace háptico).
En investigación médica se han examinado las aplicaciones de compuestos de rodio y sus derivados[19], y se han descrito varias aplicaciones potenciales para un derivado del rodioceno como radiofármaco para tratar pequeños cánceres.
[20][21] Los derivados de rodoceno también se utilizan para sintetizar metalocenos enlazados, que permiten estudiar las interacciones metal–metal.
[12] La formulación original incluía solo los enlaces metal-alqueno,[25] pero el modelo se amplió con el tiempo para cubrir sistemas como los de metal-carbonilos (incluyendo [Ni(CO)4]) donde es fundamental la retrodonación de electrones π.
[10] El descubrimiento despertó un renovado interés en el campo de la química organometálica,[8][9] en parte debido a la estructura propuesta por Pauson y Kealy (que se muestra a la derecha) era incompatible con los modelos existentes de enlace y no explicaba su inesperada estabilidad.
La estructura tipo «sándwich» fue deducida y publicada independientemente por tres grupos en 1952: Robert Burns Woodward y Geoffrey Wilkinson investigaron la reactividad a fin de determinar la estructura[27] y demostraron que el ferroceno sufre reacciones similares a una molécula aromática típica (como el benceno),[28] Ernst Otto Fischer no solo dedujo la estructura tipo «sándwich», sino que también comenzó a sintetizar otros metalocenos, incluyendo el cobaltoceno,[29] mientras que Eiland y Pepinsky confirmaron, mediante cristalografía de rayos X, la estructura del complejo.
Los siguientes datos están calculados usando un electrodo de calomelanos saturado (SCE) en acetonitrilo: Estos datos indican claramente la estabilidad del ferroceno neutral y de los cationes cobaltocenio y rodocenio.
En el mismo estudio, intentaron detectar iridoceno exponiendo sales de iridocenio en condiciones oxidantes, pero fracasaron incluso a pH elevado.
Esto explica las primeras dificultades para el aislamiento del rodoceno en disolución.
[2][4][5] Es esta forma monomérica la que muestra la estructura escalonada tipo «sándwich» típica.
[Nota 4] El rodio normalmente posee un estado de oxidación I o III en sus compuestos estables.
Esto ocurre porque el acoplamiento oxidativo de los dos ligandos ciclopentadienilo produce un nuevo ligando con menor hapticidad que dona menos electrones al centro metálico.
Fischer y sus colegas plantearon la hipótesis de que la formación de este derivado del rodoceno ocurría en dos pasos separados: por un lado la protonación y por otro la reducción, pero no publicaron ninguna evidencia para apoyar esta propuesta.
[4] Si un fluido derretido que contenga catión rodocenio es tratado con sodio o metales de potasio y sublimado en un dedo frío refrigerado con nitrógeno líquido, el resultado es un material negro policristalino.
Un método similar puede utilizarse para preparar el dímero del iridoceno.
[44] [(η5-C5tBu3H2)Rh(η5-C5H5)]BF4 forma un cristal monoclínico incoloro perteneciente al grupo espacial P21/c con una densidad de 1.486 g cm−3.
[44] Estos resultados son consistentes con una coordinación η5 del ligando al centro metálico.
La mayor variación en el ligando sustituido se atribuye a las distorsiones necesarias para aliviar la tensión estérica impuesta por los sustituyentes tert-butilo vecinos, que, a pesar de su influencia, no impiden que el complejo sea también de coordinación η5.
[44] En el sistema de iridocenio sustituido, los estudios con voltamperometría cíclica muestra reducciones irreversibles a temperaturas tan bajas como −60 °C.
Sus cristales de color verde oliva se descomponen rápidamente en disolución y en pocos minutos en el aire, demostrando una sensibilidad al aire considerablemente mayor que los complejos análogos de cobalto, aunque es mucho más estable que el rodoceno en sí.
[17] El cobaltoceno es un agente reductor de un electrón en investigación, ya que es soluble en disolventes orgánicos no polares,[18] y su par redox es lo suficientemente estable para ser utilizado como patrón interno en voltametría cíclica.
Usando isótopos radiactivos 103Ru se produce un radiofármaco, rutenocenil–haloperidol, con una gran afinidad por tejidos pulmonares, pero no cerebrales en ratones y ratas.
[20] La desintegración beta del 103Ru produce el isótopo metaestable 103mRh en un compuesto rodocenil-haloperidol que, como otros derivados del rodoceno, tiene una configuración de 19 electrones de valencia, por lo que es inestable y rápidamente se oxida a la especie catiónica rodocenio–haloperidol.
Se ha propuesto que el 103mRh pueda ser usado en radioterapia para tumores pequeños.
También se pueden formar metalocenos enlazados mediante la introducción de varios sustituyentes metalocenilos en un único ligando ciclopentadienilo.
Visto desde este punto, los termetalocenos se asemejan a los patrones abajo-arriba-abajo de una cigüeña.
Esta reacción produce un intermediario neutro con ligandos ciclopentadienil–ciclopentadieno unidos cuyo enlace se asemeja a la encontrada en el dímero del rodoceno.
Estos ligandos reaccionan a continuación con el carbocatión de trifenilfosfato para general la sal del metaloceno, [(η5-C5H5)Rh(μ-η5:η5-C5H4–C5H4)Fe(μ-η5:η5-C5H4–C5H4)Co(η5-C5H5)](PF6)2, según la siguiente reacción:[60][61] ... Recent work has shown the existence of a growing class of metalloenzymes having organometallic ligand environments – considered as the chemistry of metal ions having C-donor ligands such as CO or the methyl group».