Enzima
En 1878 el fisiólogo Wilhelm Kühne (1837-1900) acuñó el vocablo «enzima», que viene del griego ενζυμον, «en levadura», para describir este proceso.
Tras haber mostrado que las enzimas pueden funcionar fuera de una célula viva, el próximo paso era determinar su naturaleza bioquímica.
Sin embargo, en 1926, James B. Sumner demostró que la enzima ureasa era una proteína pura y la cristalizó.
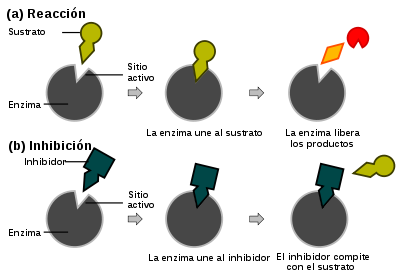
Con base en sus resultados dedujo que ambas moléculas, la enzima y su sustrato, poseen complementariedad geométrica, es decir, sus estructuras encajan exactamente una en la otra,[32] por lo que este modelo ha sido denominado como modelo de la «llave-cerradura», refiriéndose a la enzima como a una especie de cerradura y al sustrato como a una llave que encaja de forma perfecta en dicha cerradura.
[33] En este modelo se postula un anclamiento de tres puntos, lo que vuelve a la catálisis enzimática selectiva a tres niveles: En 1958, Daniel Koshland sugiere una modificación al modelo de la llave-cerradura: las enzimas son estructuras bastante flexibles y así el sitio activo podría cambiar su conformación estructural por la interacción con el sustrato.
En algunos casos, como en las glicosidasas, el sustrato cambia ligeramente de forma para entrar en el sitio activo.
[35] El sitio activo continua dicho cambio hasta que el sustrato está completamente unido, momento en el cual queda determinada la forma y la carga final.
Cabe destacar que este efecto entrópico implica la desestabilización del estado basal,[46] y su contribución a la catálisis es relativamente pequeña.
Sin embargo, otras enzimas requieren la unión de moléculas no proteicas denominadas cofactores para poder ejercer su actividad.
[52] Un ejemplo de una enzima que contiene un cofactor es la anhidrasa carbónica, en la cual el zinc (cofactor) se mantiene unido al sitio activo, tal y como se muestra en la figura anterior (situada al inicio de la sección "Estructuras y mecanismos").
Las enzimas que requieren un cofactor pero no lo tienen unido son denominadas «apoenzimas» o «apoproteínas».
La mayoría de los cofactores no se unen covalentemente a sus enzimas, pero sí lo hacen fuertemente.
Sin embargo, los grupos prostéticos pueden estar covalentemente unidos, como en el caso de la tiamina pirofosfato en la enzima piruvato deshidrogenasa.
Las coenzimas son pequeñas moléculas orgánicas que transportan grupos químicos de una enzima a otra.
[57][58] Al igual que sucede con todos los catalizadores, las enzimas no alteran el equilibrio químico de la reacción.
Bajo estas condiciones, la enzima únicamente catalizará la reacción en la dirección permitida desde un punto de vista termodinámico.
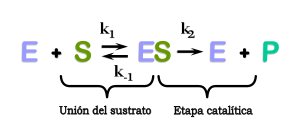
La cinética enzimática es el estudio de cómo las enzimas se unen a sus sustratos y los transforman en productos.
[62] Su trabajo fue desarrollado más en profundidad por George Edward Briggs y J. B. S. Haldane, quienes obtuvieron las ecuaciones cinéticas que se encuentran tan ampliamente extendidas en la actualidad.
Sin embargo, cuando la enzima orotidina 5'-fosfato descarboxilasa está presente en el medio, ese mismo proceso tarda apenas 25 milisegundos.
Aquellas condiciones que desnaturalizan una proteína, como temperaturas elevadas, pH extremos o altas concentraciones de sal, dificultan o impiden la actividad enzimática, mientras que elevadas concentraciones de sustrato tienden a incrementar la actividad.
Las irreversibles se unen covalentemente a la enzima sin posibilidad de revertir la modificación, siendo útiles en farmacología.
Sin embargo, por sus características se suele presentar como opuesta a la competitiva, con la que es comparada frecuentemente.
Debido a que los inhibidores modulan la función de las enzimas, suelen ser utilizados como fármacos.
Además, las enzimas también están implicadas en funciones mucho más exóticas, como la producción de luz por la luciferasa en las luciérnagas.
La glucosa, por ejemplo, puede reaccionar directamente con el ATP de forma que quede fosforilada en uno o más carbonos.
En ausencia de enzimas, esta reacción se produciría tan lentamente que sería insignificante.
[84] Otro ejemplo es cuando se produce una mutación en los genes de la línea germinal que codifican las enzimas implicadas en la reparación del ADN.
[87][88] Estos esfuerzos han comenzado a tener algunos éxitos, obteniéndose algunas enzimas que catalizan reacciones no existentes en la naturaleza.
Debido al elevado precio de dichos cofactores, estos procesos no serían económicamente competitivos.
En el pasado reciente se identificaron algunos compuestos sintéticos económica y funcionalmente muy prometedores, como homólogos biomiméticos de cofactores naturales.