Enlace covalente
[3][4] Cuando átomos distintos de no metales se unen en una forma iónica, uno de ellos resultará más electronegativo que el otro, por lo que tenderá a atraer la nube electrónica del enlace hacia su núcleo, generando un dipolo eléctrico.
[5] Esta polarización permite que las moléculas del mismo compuesto se atraigan entre sí por fuerzas electrostáticas de distinta intensidad.
El vocablo «covalencia» en relación con la unión fue utilizada por primera vez en 1919 por Irving Langmuir en artículo del Journal of the American Chemical Society titulado «The Arrangement of Electrons in Atoms and Molecules» (La distribución de electrones en átomos y moléculas).
Walter Heitler y Fritz London dieron la primera explicación con éxito de un enlace químico aplicando la mecánica cuántica, en concreto del hidrógeno molecular, en 1927.
Sin embargo la teoría del enlace covalente o también conocido como la idea de la compartición de electrones, la cual está basada en el átomo cúbico, se enfrentó a varias dificultades conceptuales, ya que esta teoría tuvo como competencia al modelo del enlace iónico.
Lewis asumió por muchos años que, si los electrones están pareados en el átomo magnéticamente, es fácil entender cómo dos electrones no pareados en átomos diferentes pueden acoplarse magnéticamente y formar la ligazón no polar.
Segundo: los dos núcleos positivos atraen a los dos electrones con el fin de producir una molécula más estable que la de los átomos separados, en consecuencia se forma un enlace y con ello resulta una molécula más estable que la anterior.
[11] Sin embargo, cuando los átomos son distintos, los electrones compartidos no serán atraídos por igual, de modo que estos tenderán a aproximarse hacia el átomo más electronegativo, es decir, aquel que tenga una mayor apetencia de electrones.
Este fenómeno se denomina polaridad (los átomos con mayor electronegatividad obtienen una polaridad más negativa, atrayendo los electrones compartidos hacia su núcleo), y resulta en un desplazamiento de las cargas dentro de la molécula.
Se podría decir que al átomo más electronegativo no le gusta compartir sus electrones con los demás átomos, y en el caso más extremo, deseará que el electrón le sea cedido sin condiciones formándose entonces un enlace iónico.
No obstante, según el químico Raymond Chang, esta diferencia de electronegatividad entre los átomos debe ser de 2,0 o mayor para que el enlace sea considerado iónico (Chang, 371).
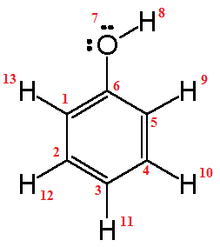
En una molécula de agua, la ligazón que une al oxígeno con cada hidrógeno es un enlace polar.
En esta ligazón, los electrones son atraídos fundamentalmente por el núcleo del átomo más electronegativo, generando moléculas cuya nube electrónica presentará una zona con mayor densidad de carga negativa y otra con mayor densidad de carga positiva (dipolo).Los enlaces covalentes no polares se forman entre dos átomos del mismo elemento o entre átomos de diferentes elementos que comparten electrones de manera más o menos equitativa.
Los compuestos de coordinación o también denominados complejos, normalmente están unidos a varios aniones circundantes conocidos como ligandos.