Inhibidor enzimático
Los inhibidores enzimáticos son moléculas que se unen a enzimas y disminuyen su actividad.
Puesto que el bloqueo de una enzima puede matar a un agente patógeno o corregir un desequilibrio metabólico, muchos medicamentos actúan como inhibidores enzimáticos.
Al contrario de lo que ocurre con el sustrato y los inhibidores irreversibles, los inhibidores reversibles generalmente no experimentan reacciones químicas cuando se unen a la enzima y pueden ser eliminados fácilmente por dilución o por diálisis.
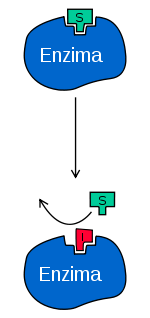
En el esquema clásico de Michaelis-Menten mostrado abajo, una enzima (E) se une a su sustrato (S) para formar el complejo enzima-sustrato (ES).
En la catálisis, este complejo se rompe para liberar el producto (P) y la enzima (E).
Sin embargo, la ecuación de Michaelis-Menten modificada asume que la unión del inhibidor a la enzima alcanza el equilibrio, el cual puede ser un proceso muy lento para los inhibidores con constantes secundarias nanomolares de disociación.
Sin embargo, puede ser complicado estimar Ki y Ki' con precisión en estos diagramas, por lo que es recomendable estimar estas constantes usando métodos más fiables de regresión no lineal,[6] según lo descrito arriba.
[11] Los inhibidores irreversibles normalmente modifican una enzima covalentemente, con lo que la inhibición no puede ser invertida.
Los inhibidores irreversibles suelen contener grupos funcionales reactivos como mostazas nitrogenadas, aldehídos, haloalcanos o alquenos.
Los inhibidores irreversibles son generalmente específicos para un tipo de enzima y no inactivan a todas las proteínas.
Por ejemplo, el pH y las temperaturas extremas causan la desnaturalización de casi todas las proteínas, pero este no es un efecto específico.
El parámetro kobs/[I] es válido siempre y cuando el inhibidor no se encuentre a concentraciones saturantes (en cuyo caso tendríamos que kobs = kinact).
[14] Como se muestra en la figura de la izquierda, los inhibidores irreversibles forman inicialmente un complejo reversible y no covalente con la enzima (EI o ESI), que reaccionará posteriormente para producir una modificación covalente en lo que se denomina el "complejo del punto muerto" EI*.
Una técnica complementaria a esta es la huella peptídica, que implica la digestión de proteínas nativas o modificadas con una peptidasa como la tripsina.
[16] No todos los inhibidores irreversibles forman uniones covalentes con la enzima que tienen como diana.
Algunos inhibidores reversibles se unen tan fuertemente a su objetivo que son prácticamente irreversibles.
En estos casos, algunos de estos inhibidores se unen rápidamente a la enzima formando un complejo EI de baja afinidad, que después experimenta una reacción más lenta hacia un complejo EI* muy fuertemente unido (ver la imagen arriba).
[18] Este lento reajuste posterior normalmente implica un cambio conformacional cuando la enzima se pliega alrededor de la molécula inhibidora.
La enzima hidroliza el enlace entre el fósforo y el flúor, pero el residuo de fosfato se mantiene unido a una serina en el centro activo, inactivándolo.
Esta forma reactiva del DFMO reacciona posteriormente con un residuo de cisteína o lisina en el centro activo para inactivar la enzima irreversiblemente.
Esto permite que el GMPc no sea degradado y pueda permanecer activo durante períodos más largos de tiempo.
Por ejemplo, las bacterias presentan una gruesa pared celular compuesta principalmente de un polímero denominado peptidoglicano.
El diseño de fármacos se ve muy facilitado en estos casos en los que la enzima diana es esencial para la supervivencia del patógeno y no está presente o es muy diferente en humanos.
Sin embargo, las rutas metabólicas no están únicamente reguladas por medio de la inhibición, la activación enzimática es igualmente importante.
Este inhibidor se une con una alta afinidad a la tripsina, previniendo así su actividad.
[38][39] Es un caso único entre los neurotransmisores, ya que la mayoría de ellos, como la serotonina, la dopamina o la noradrenalina, son reabsorbidos en la brecha sináptica.
El triclosán se une a la proteína transportadora enoil‐acil reductasa (ENR), codificada por el gen FabI.
Las toxinas naturales suelen ser pequeñas moléculas orgánicas con tanta diversidad que probablemente existan inhibidores para la mayoría de los procesos metabólicos.
[49] Las proteínas también pueden llegar a ser venenos naturales, como es el caso del inhibidor de tripsina (discutido anteriormente) encontrado en algunas legumbres.
Un ejemplo es el ricino, una proteína tóxica extremadamente potente, que se encuentra en la planta Ricinus communis.