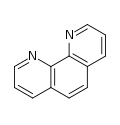
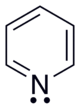
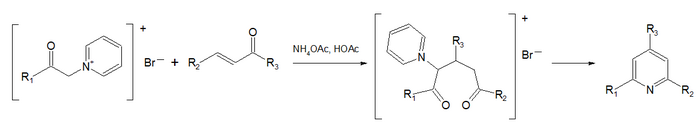
Piridina
La piridina impura fue, sin dudas, preparada por los primeros alquimistas al calentar huesos animales y otra materia orgánica,[4] pero la referencia documentada más temprana se adjudica al científico escocés Thomas Anderson.
Sin embargo en este caso también la IUPAC no aconseja el uso optando por el nombre común piridil en vez del sistemático.
[17] El derivado catiónico formado por la adición de un electrófilo al nitrógeno es llamado piridinio.
La piridina se presenta en un sinfín de compuestos relacionados con la vida (pero no en su forma pura), entre ellos el NAD, la nicotina, la vitamina B3 o niacina (cuya falta causa pelagra), y la vitamina B6 o piridoxina.
Ejemplos de estos alcaloides son la maytolina, maytina, acantotamina, evonina, neoevonina, euonimina, hipocratinas, emarginatinas.
[38] Esta diferencia se debe en parte a la menor simetría mostrada por las moléculas individuales de piridina (C2v vs.
Un trihidrato (pyridine·3H2O) es conocido, también cristaliza en un sistema ortorrómbico en el grupo espacial Pbca, los parámetros de red son a = 1244, b = 1783, c = 679 pm y ocho unidades de fórmula por celda unidad (medido a 223 K).
Todos los desplazamientos citados son para solventes libres de otras sustancias.
En reacciones orgánicas se comporta tanto como una amina terciaria experimentando la protonación, alquilación, acilación y N-oxidación en el átomo de nitrógeno.
Y por lo tanto, experimenta más lentamente la sustitución electrófila aromática, que es típica de los derivados del benceno.
La piridina es protonada mediante una reacción con un ácido formando un ion poliatómico positivamente cargado llamado piridinio.
[49] El ácido picolínico que es un derivado sustituido de la piridina, forma complejos fuertes debido al efecto quelante.
[51] La piridina posee un sistema conjugado de seis electrones π que se encuentran deslocalizados sobre el anillo.
La molécula es plana y sigue la regla de Hückel para los sistemas aromáticos.
A diferencia del benceno, la densidad electrónica no se encuentra distribuida uniformemente en el anillo, hecho que explica el efecto inductivo negativo en el átomo de nitrógeno.
[52] Pero aun así, posee una energía superior a la del furano, tiofeno y pirrol.
Se conocen muchos análogos de la piridina donde el N es reemplazado por otros heteroátomos.
El reemplazo de un CH en la piridina por un segundo nitrógeno da lugar a los diazoheterociclos.
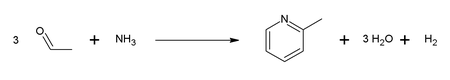
Primero, se forma la acroleína en una Condensación de Knoevenagel a partir del acetaldehído y el formaldehído.
El producto, consiste de una mezcla de piridina, piridinas metiladas simples (picolina) y (lutidina); su composición depende del catalizador usado y por lo tanto, la reacción puede ser adaptada a las necesidades del que ejecuta la reacción.
Mientras que la activación térmica requiere altas presiones y temperaturas, la cicloadición foto-inducida ocurre a condiciones ambientales normales con CoCp2(cod) (Cp = ciclopentadienilo, cod = 1,5-ciclooctadieno) como catalizador y puede ser realizada incluso en agua.
Emil Knoevenagel mostró que las piridinas sustituidas asimétricamente podrían ser producidas mediante este proceso.
Las comunes alquilaciones y acilaciones, como las alquilaciones y acilaciones de Friedel Crafts, usualmente no ocurren debido a que solo conducen a la adición al átomo de nitrógeno.
Las sustituciones en las posiciones 2- y 4- de la piridina llevan a un complejo σ energéticamente desfavorable.
[44] La nitración directa de la piridina requiere condiciones extremas y da solamente un bajo rendimiento.
La reacción de la piridina con bromo molecular en ácido sulfúrico a 130 °C produce rápidamente 3-bromopiridina.
[44][45] Muchas sustituciones son experimentadas fácilmente, pero no con la piridina sola sino con piridinas sustituidas con bromo, cloro, flúor o ácido sulfónico que toman el rol de grupo saliente.
Los compuestos que realizarán el ataque nucléofilo pueden ser alcóxidos, tiolatos, aminas y amoníaco (a presión elevada).
[45][87] Análogamente al benceno, las sustituciones nucleófilas en piridina pueden resultar en la formación de un intermedio heteroarino.
[44] La piridina experimenta una serie de reacciones radicalarias, las cuales son usadas en su dimerización en bipiridinas.