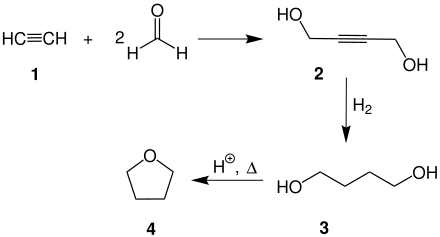
Furano
Otro derivado importante, el furfural fue descrito por Johann Wolfgang Döbereiner en 1831 y caracterizado nueve años después por John Stenhouse.
El furano como tal fue preparado por vez primera por Heinrich Limpricht en 1870, aunque en esa ocasión fue denominado tetrafenol.
Los carbonilos de aldehído o cetona son requeridos para que el sistema sea aromático.
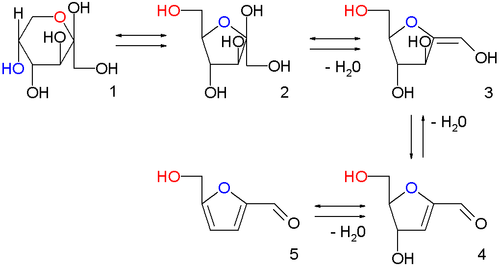
Otros sistemas relacionados se pueden obtener por el mismo principio para obtenerse sistemas furanoides parcial o totalmente insaturados: Se puede lograr la aromatización del anillo furanoide de una pentofuranosa para formar furfural.
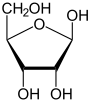
Las hexosas, sin importar si son furanosas o piranosas, forman el hidroximetilfurfural (HMF) por un procedimeinto análogo: Estas reacciones son fundamento de la prueba de Seliwanoff, una prueba química que se usa para distinguir aldosas y cetosas.
El furano posee seis electrones deslocalizados: cuatro pertenecientes a los dobles enlaces y dos del átomo de oxígeno (uno de los dos pares no enlazados solamente, que se encuentra en un orbital perpendicular al plano del anillo).
El oxígeno posee además otro par de electrones que no está deslocalizado.
El furano es un compuesto plano e igualmente a sus homólogos (tiofeno y pirrol), es un sistema π excedente debido a la distribución de 6 electrones π deslocalizados en cinco átomos; la densidad electrónica es por lo tanto claramente más importante que en sus análogos del benceno.
El furano reacciona lentamente con cloruro de hidrógeno ya sea como ácido acuoso concentrado o en un disolvente orgánico no hidroxílico.
En condiciones suaves, en medio acuoso acidificado, el furano hidroliza dando lugar al correspondiente compuesto 1,4-dicarbonílico.
La reacción con bromo en dimetilformamida o en dioxano a temperatura ambiente sin problemas produce 2-bromo y 2,5-dibromofuranos.
[31] Se pueden formar furilbencensulfonas con ácidos arilsulfónicos: La alquilación de Friedel-Crafts tradicional no es generalmente factible en la serie del furano debido en parte a que el catalizador produce polimerización y en parte porque se producen productos polialquilados.
A continuación se enunciarán los más comunes: La litiación con alquilitios procede selectivamente en una posición.
Es útil también para sintetizar nitrofuranos, un grupo de fármacos con actividad antibacteriana, antituberculosa e incluso antitumoral.
Estos furanos se producen biosintéticamente por deshidratación natural de pentosas y hexosas.
El furfural se encuentra presente naturalmente en los volátiles de frutas y verduras.





























































![Figure 2: Derivatives of FDCA[8][9]](http://upload.wikimedia.org/wikipedia/commons/thumb/8/80/Conversions_of_FDCA.tif/lossy-page1-450px-Conversions_of_FDCA.tif.jpg)