Punto crítico (termodinámica)
Si se miden las densidades del líquido y del vapor en función de la temperatura y se representan los resultados, puede determinarse la temperatura crítica a partir del punto de intersección de ambas curvas.
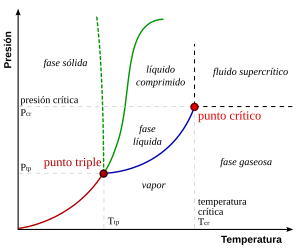
Por simplicidad y claridad, la noción genérica de punto crítico se introduce mejor discutiendo un ejemplo específico, el punto crítico vapor-líquido.
En el agua, el punto crítico ocurre a 647.096 K (373.946 °C) y 22.064 megapascales (217.75 atm).
[1] En las proximidades del punto crítico, las propiedades físicas del líquido y el vapor cambian drásticamente, y ambas fases se vuelven cada vez más similares.
Por ejemplo, el agua líquida en condiciones normales es casi incompresible, tiene un coeficiente de expansión térmica bajo, tiene una constante dieléctrica alta y es un excelente solvente para electrolitos.
Cerca del punto crítico, todas estas propiedades se transforman en exactamente lo contrario: el agua se vuelve compresible, expandible, un dieléctrico pobre, un mal solvente para los electrolitos y prefiere mezclarse con gases no polares y moléculas orgánicas.
Esto significa que en el punto crítico:[3][4][5] Por encima del punto crítico existe un estado de la materia que está continuamente conectado (puede transformarse sin transición de fase) tanto al estado líquido como al gaseoso.
El británico Michael Fisher (1931-2021) y el nortemaericano Benjamin Widom (1927- ),[6] han desafiado el conocimiento común de los libros de texto de que toda distinción entre líquido y vapor desaparece más allá del punto crítico, e identificaron una línea p - T que separa estados con diferentes propiedades estadísticas asintóticas (línea Fisher-Widom).
[7] La existencia de un punto crítico fue descubierta por primera vez por Charles Cagniard de la Tour en 1822[8][9] y nombrado por Dmitri Mendeleev en 1860[10][11] y Thomas Andrews en 1869.
para la ecuación de Van der Waals, se puede calcular el punto crítico como Sin embargo, la ecuación de van der Waals, basada en la teoría de campo medio, no es válida cerca del punto crítico.
Para analizar las propiedades de los fluidos en cercanías del punto crítico, a veces se definen variables de estado reducidas relativas a las propiedades críticas[13] El principio de los estados correspondientes establece que substancias con iguales presiones y temperaturas reducidas tienen iguales volúmenes reducidos.
En otras palabras, es el punto en el que un cambio infinitesimal en alguna variable termodinámica (como temperatura o presión) conduce a la separación de la mezcla en dos fases líquidas distintas, como se muestra en el diagrama de fases polímero-disolvente a la derecha.
Dos tipos de puntos críticos líquido-líquido son la temperatura crítica superior de la solución (UCST), que es el punto más caliente en el que el enfriamiento induce la separación de fases, y la temperatura crítica inferior de la solución (LCST), que es el punto más frío en el que el calentamiento induce la fase.
Por lo tanto, el punto crítico líquido-líquido en un sistema de dos componentes debe satisfacer dos condiciones: la condición de la curva espinodal (la segunda derivada de la energía libre con respecto a la concentración debe ser igual a cero) y la condición del extremo (la tercera derivada de la energía libre con respecto a la concentración también debe ser igual a cero o la derivada de la temperatura espinodal con respecto a la concentración debe ser igual a cero).