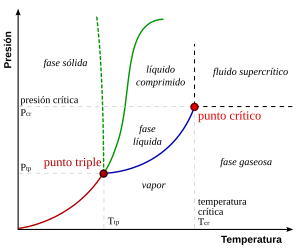
Punto triple
Se define respecto a una temperatura y una presión de vapor.
En esas condiciones, es posible cambiar el estado de toda la masa de agua a hielo, agua líquida o vapor, arbitrariamente, haciendo pequeños cambios en la presión y la temperatura.
El agua tiene un inusual y complejo diagrama de fase (aunque esto no afecta a las consideraciones generales expuestas sobre el punto triple).
A presiones por debajo del punto triple, como las encontradas en el espacio exterior, donde la presión es cercana a cero, el agua líquida no puede existir y, al calentarse, el hielo se convierte directamente en vapor de agua sin pasar por el estado líquido, proceso conocido como sublimación.
Se deben tener en consideración los grados de libertad que nos permite apreciar con mayor facilidad las variables de presión y temperatura, en que momento se pueden modificar y esta dada por la siguiente ecuación:
[1] En esta tabla se incluyen los puntos triples de algunas sustancias comunes.
Estos datos están basados en los proporcionados por la National Bureau of Standards (ahora NIST) de los EE.
En el diagrama U-V, los estados de coexistencia simultánea de las tres fases llenan una región bidimensional, mientras que la presión y la temperatura están aquí degeneradas a un valor constante.
[6] Un ejemplo[6] es un sistema de los siguientes tres componentes: En este sistema, a una temperatura de 22 °C, pueden coexistir las siguientes cinco fases: La única sustancia conocida que no tiene un punto triple sólido-líquido-gas es el helio.