Diagrama de fase
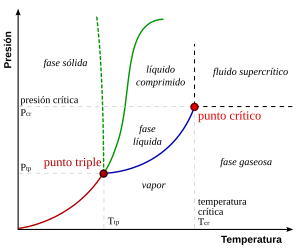
Por ejemplo, el diagrama de fases del agua tiene un punto triple que corresponde a la temperatura y presión únicas a las que el agua sólida, líquida y gaseosa pueden coexistir en un equilibrio estable.
Las curvas del diagrama de fases muestran los puntos en los que la energía libre (y otras propiedades derivadas) se vuelve no analítica: sus derivadas con respecto a las coordenadas (temperatura y presión en este ejemplo) cambian de forma discontinua (abrupta).
En el agua, el punto crítico se produce en torno a Tc = 647,096 Kelvin (373,9 °C), pc = 22,064 MPa (217,8 atm) y ρc = 356 kg/m3.
[4] La existencia del punto crítico líquido-gas revela una ligera ambigüedad en el etiquetado de las regiones monofásicas.
Cuando se pasa de la fase líquida a la gaseosa, normalmente se cruza el límite de fase, pero es posible elegir un camino que nunca cruce el límite yendo a la derecha del punto crítico.
Así, la sustancia requiere una temperatura más alta para que sus moléculas tengan energía suficiente para salir del patrón fijo de la fase sólida y entrar en la fase líquida.
Dos magnitudes termodinámicas cualesquiera pueden representarse en los ejes horizontal y vertical de un diagrama bidimensional.
Cada una de estas líneas iso representa la magnitud termodinámica a un valor constante determinado.
Generalmente, para una presión y temperatura dadas, el cuerpo presenta una única fase excepto en las siguientes zonas: Dos metales (A, B) a temperaturas superiores a sus respectivos puntos de fusión (TA, TB) se encuentran en estado líquido pudiéndose disolver y conformar así una fase única líquida.
Pares (presión, temperatura) de transición de fase entre: Es importante señalar que la curva que separa las fases vapor-líquido se detiene en un punto llamado punto crítico (La densidad del líquido y vapor son iguales).
Modificando la presión y temperatura en valores alrededor del punto crítico se producen reacciones que pueden tener interés industrial, como por ejemplo las utilizadas para obtener café descafeinado.
Un caso particular, el más sencillo, corresponde a los diagramas de fase binarios.
Ahora las variables a tener en cuenta son la temperatura y la concentración, normalmente en masa.
Hay punto y líneas en estos diagramas importantes para su caracterización: En un diagrama binario pueden aparecer las siguientes regiones: Una aleación de cobre-níquel es más resistente que el cobre puro o que el níquel puro debido al endurecimiento por solución sólida.
El níquel puro es endurecido por una solución sólida cuando se le incorpora hasta 33% de Cu.