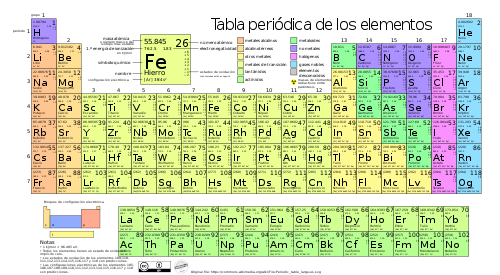
Tabla periódica de los elementos
La historia de la tabla periódica está muy relacionada con varios aspectos del desarrollo de la química y física: Aunque algunos elementos como el oro (Au), plata (Ag), cobre (Cu), plomo (Pb) y mercurio (Hg) ya eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió en el siglo XVII d. C., cuando el alquimista Hennig Brand descubrió el fósforo (P).
Durante los siguientes dos siglos se fue adquiriendo un mayor conocimiento sobre estas propiedades, así como descubriendo muchos elementos nuevos.
Todo ello condujo a diferenciar en primer lugar qué sustancias de las conocidas hasta ese momento eran elementos químicos, cuáles eran sus propiedades y cómo aislarlas.
[14][15] Aunque muy práctica y todavía funcional en la tabla periódica moderna, fue rechazada debido a que había muchas diferencias tanto en las propiedades físicas como en las químicas.
[cita requerida] Los químicos pasaron el siglo siguiente buscando un esquema de clasificación más preciso.
[28] La Chemical Society solamente reconoció la importancia de sus descubrimientos cinco años después de que se le acreditaran a Mendeléyev,[29] y posteriormente fue reconocido por la Royal Society, que le concedió a Newlands su más alta condecoración, la medalla Davy.
La primera fue dejar huecos cuando parecía que el elemento correspondiente todavía no había sido descubierto.
A menudo se afirma que el último elemento natural en ser descubierto fue el francio —designado por Mendeléyev como eka-cesio— en 1939.
[44] Sin embargo, el plutonio, producido sintéticamente en 1940, fue identificado en cantidades ínfimas como un elemento primordial de origen natural en 1971.
[47] En 1928 Merck and Company preparó un folleto con esta tabla, que fue ampliamente difundida en las escuelas estadounidenses.
En las décadas posteriores tuvo que integrar los descubrimientos de los gases nobles, las «tierras raras» y los elementos radioactivos.
Otro problema adicional eran las irregularidades que existían para compaginar el criterio de ordenación por peso atómico creciente y la agrupación por familias con propiedades químicas comunes.
Durante algún tiempo, esta cuestión no pudo resolverse satisfactoriamente hasta que Henry Moseley (1867-1919) realizó un estudio sobre los espectros de rayos X en 1913.
Los colegas de Seaborg le aconsejaron no publicar una teoría tan radical, ya que lo más probable era arruinar su carrera.
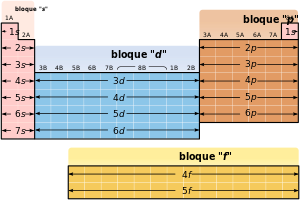
[65] Además, en algunas partes de la tabla periódica como los bloques d y f, las similitudes horizontales pueden ser tan o más pronunciadas que las verticales.
Cada nivel está dividido en distintos subniveles, que conforme aumenta su número atómico se van llenando en este orden: Siguiendo esa norma, cada elemento se coloca según su configuración electrónica y da forma a la tabla periódica.
Los elementos en el mismo período muestran tendencias similares en radio atómico, energía de ionización, afinidad electrónica y electronegatividad.
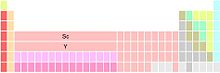
[78] Hay tres variantes principales de la tabla periódica, cada una diferente en cuanto a la constitución del grupo 3.
Las dos posiciones por debajo de itrio contienen los lantánidos y los actínidos (posiblemente por notas al pie).
Por ese motivo diseñó una tabla periódica oval similar a un campo de fútbol que no mostraba saltos ni elementos flotantes.
Por otra parte, la tabla incorpora la familia de los actínidos y los lantánidos al diseño general, ubicándolos en el lugar que les correspondería por número atómico, en lugar de mantenerlos separados en dos grupos flotantes al final como sucede en la tabla estándar.
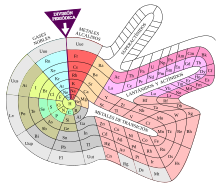
[106] En algún lugar en medio del continuo se ubica la tabla periódica estándar; se considera que expresa las mejores tendencias empíricas en el estado físico, la conductividad eléctrica y térmica, los números de oxidación, y otras propiedades fácilmente inferidas de las técnicas tradicionales del laboratorio químico.
[121] Las propiedades químicas del hidrógeno no son muy cercanas a los de los metales alcalinos, que ocupan el grupo 1, y por eso el hidrógeno a veces se coloca en otra parte: una de las alternativas más comunes es en el grupo 17.
El otro elemento del periodo 1, el helio, a veces se coloca separado de cualquier grupo también.
Según IUPAC un metal de transición es «un elemento cuyo átomo tiene una subcapa d incompleta o que puede dar lugar a cationes».
Existen argumentos físicos y químicos para apoyar esta última disposición,[83][130] pero no todos los autores están convencidos.
Por lo tanto el lantano tiene un electrón diferenciador 5d y esto lo establece «en el grupo 3 como el primer miembro del bloque d para el periodo 6».
[133] En el grupo 3 se ve un conjunto consistente de configuraciones electrónicas: escandio [Ar]3d14s2, itrio [Kr]4d15s2 y lantano.
Aún en el período 6, se le asignó al iterbio una configuración electrónica de [Xe]4f135d16s2 y [Xe]4f145d16s2 para el lutecio, lo que resulta «en un electrón diferenciante 4f para el lutecio y lo establece firmemente como el último miembro del bloque f para el período 6.»[133] Matthias[134] describe la colocación del lantano en virtud del itrio como «un error en el sistema periódico —por desgracia propagado mayoritariamente por la compañía Welch [Sargent-Welch]... y ...todo el mundo la copió».
Esto significaba que iterbio y lutecio tenían 14 electrones f, «resultando en un electrón diferenciante d en lugar de f» para el último, lo que lo hacía un «candidato igualmente válido» para la siguiente posición de la tabla periódica en el grupo 3 debajo del itrio.