Plutonio
El elemento normalmente exhibe seis estados alotrópicos y cuatro de oxidación.
Esos neutrones pueden mantener una reacción nuclear en cadena, dando lugar a aplicaciones en armas y reactores nucleares.
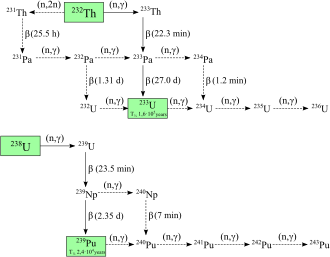
Los isótopos del plutonio son caros y difíciles de separar, por esto suelen fabricarse en reactores especializados.
[4] Fermi llamó al nuevo elemento hesperio y lo mencionó en su discurso del Nobel en 1938.
[9] Un documento científico del descubrimiento fue preparado por el equipo y enviado a la revista Physical Review en marzo de 1941.
La publicación fue retrasada hasta un año después del fin de la Segunda Guerra Mundial, debido a las preocupaciones sobre la seguridad.
[11][nota 1] Seaborg originalmente consideró el nombre «plutio», pero después pensó que no sonaba tan bien como «plutonio».
[14] Este procedimiento permitió a los químicos determinar la masa atómica del nuevo elemento.
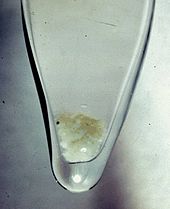
[14] Se produjo suficiente plutonio para que fuera el primer elemento sintético visible a simple vista.
Esos neutrones pueden golpear otros átomos de plutonio-239 y así sucesivamente en una rápida reacción nuclear en cadena.
Durante la guerra fría fueron construidas grandes reservas de plutonio para armas nucleares, tanto por la Unión Soviética como por Estados Unidos.
[27] El plutonio, como la mayoría de los metales, tiene una apariencia plateada brillante al principio, muy parecida a la del níquel, pero se oxida rápidamente a un gris opaco, aunque también se reportan amarillo y verde oliva.
Esta, la forma estructural más común del elemento (alótropo), es casi tan dura y quebradiza como el hierro fundido gris, a menos que se alee con otros metales para hacerlo blando y dúctil.
El calor producido por la deceleración de estas partículas alfa las hace calientes al tacto.
[32] Esta tendencia continúa hasta 100 K, por debajo de la cual la resistividad disminuye rápidamente para las muestras frescas.
[32] Cerca del punto de fusión, el plutonio líquido tiene una viscosidad y tensión superficial muy alta en comparación con otros metales.
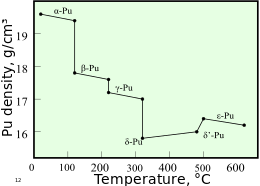
[35] Estos alótropos, que son diferentes modificaciones estructurales o formas de un elemento, tienen energías internas muy similares pero densidades y estructuras cristalinas significativamente variables.
[35] El plutonio en la forma δ (delta) normalmente existe en el rango de 310 °C a 452 °C pero es estable a temperatura ambiente cuando se alea con un pequeño porcentaje de galio, aluminio, o cerio, lo que mejora la trabajabilidad y permite su soldadura.
[37] La fase ε, el alótropo sólido de más alta temperatura, exhibe una autodifusión atómica anómicamente alta en comparación con otros elementos[33] El plutonio es un metal radiactivo actínido cuyo isótopo, plutonio-239, es uno de los tres isótopos primarios fisibles (uranio-233 y uranio-235 son los otros dos); plutonio-241 también es altamente fisible.
[42] El isótopo plutonio-238 no es fisil pero puede sufrir fisión nuclear fácilmente con neutrones rápidos así como también desintegración alfa.
Este elemento también tiene ocho estados meta-estables, aunque todos tienen vida media inferior a un segundo.
[45] Egon Bretscher trabajando en el proyecto británico Tube Alloys predijo esta reacción teóricamente en 1940.
A temperatura ambiente, el plutonio puro es de color plateado pero gana un deslustre al oxidarse.
El metal reacciona con los halógenos, dando lugar a compuestos con la fórmula general PuX3 donde X puede ser F, Cl, Br o I y PuF4 también se ve.
[56] Los crisoles utilizados para contener plutonio necesitan ser capaz de resistir sus fuertes propiedades reductoras.
El isótopo plutonio-239 es un componente clave en las armas nucleares debido a su fácil fisión y su disponibilidad.
[70] Durante el decaimiento del plutonio, son liberados tres tipos de radiación, alfa, beta y gamma.
Aunque solo puede recorrer cortas distancias (pero enormes, a escala celular) y no puede viajar a través de la capa exterior muerta de la piel humana, si llega al pulmón -aún en cantidades ínfimas- puede producir daños muy graves.
La masa crítica del plutonio emite cantidades letales de neutrones y rayos gamma.
Para manipular o almacenar el plutonio en cualquier forma es necesario tomar precauciones especiales; generalmente, se requiere una atmósfera seca de gas inerte.