Nomenclatura química de los compuestos inorgánicos
Los compuestos orgánicos son los que contienen carbono, comúnmente enlazados con hidrógeno, oxígeno, nitrógeno, azufre, boro, fósforo y algunos halógenos.
[cita requerida] A menos que se haya simplificado la fórmula, puede verse en el subíndice del otro elemento (en compuestos binarios y ternarios).
Los números de valencia se colocan como subíndice del átomo (elemento) en una fórmula molecular.
El nombre genérico o general es el que indica a qué grupo de compuestos pertenece la molécula o su función química, por ejemplo si es un óxido metálico/básico, un óxido no metálico/ácido, un peróxido, un hidruro, un hidrácido, un oxácido, una sal haloidea, etc. Y el nombre específico es el que diferencia a las moléculas dentro de un mismo grupo de compuestos.
Por lo general en los tres sistemas de nomenclatura se escribe primero el nombre genérico seguido del específico.
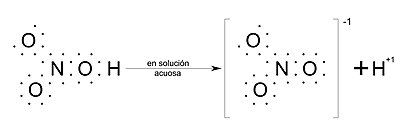
Véase como ejemplo la imagen del "ácido nítrico" al final de la sección oxácidos, del lado derecho de la imagen se encuentran el ion nitrato y el ion hidrógeno con cargas -1 y +1, respectivamente.
Los óxidos son compuestos químicos inorgánicos binarios formados por la unión del oxígeno con otro elemento diferente.
En la nomenclatura tradicional se nombran con los sufijos -oso e -ico dependiendo de la menor o mayor valencia del metal que acompaña al oxígeno.
Y en la nomenclatura sistemática con prefijos se utilizan las reglas generales con la palabra óxido como nombre genérico y los prefijos correspondientes a cada elemento según el número de átomos de este en la fórmula..
La nomenclatura sistemática y la Stock nombran a los compuestos con las mismas reglas que en los óxidos metálicos.
En las nomenclaturas Stock y sistemática se nombran los compuestos con las mismas reglas generales para los óxidos.
Su fórmula general es Metal + H. Para nombrar estos compuestos en el sistema tradicional se utiliza la palabra hidruro y se agrega el nombre del metal con los sufijos -oso o -ico con las reglas generales para esta nomenclatura.
Para las nomenclaturas Stock y sistemática se utilizan las reglas generales con la palabra hidruro como nombre genérico.
Los elementos de estas dos familias que pueden formar hidrácidos e hidruros no metálicos son: S, Se, Te, F, Cl, I y Br, que por lo general trabajan con el menor número de oxidación, -2 para los anfígenos y -1 para los halógenos.
Los hidruros no metálicos son los que se encuentran en estado gaseoso o estado puro y se nombran agregando al no metal el sufijo -uro y la palabra hidrógeno precedido de la sílaba “de”.
Los hidrácidos provienen de disolver en agua a los hidruros no metálicos y por esa misma razón son estos los que se encuentran en estado acuoso.
Estos hidrácidos o hidruros no metálicos son compuestos binarios de hidrógeno y un elemento de la familia (V) (nitrogenoides) que se enlazan siguiendo la fórmula No Metal + H3.
Los boranos son compuestos binarios entre el hidrógeno y el boro que generalmente se enlazan siguiendo la fórmula BnHn+4.
Los silanos son compuestos binarios de hidrógeno y silicio que se enlazan generalmente siguiendo la fórmula SinH2n+2.
Los germanos al igual que los boranos y silanos no tienen un sistema de nomenclatura específico para ser nombrados y utilizan las mismas reglas de nomenclatura que los silanos, con la palabra germano como base.
Ya que para nombrar a los compuestos se necesita saber con qué números de valencia trabajan los elementos, una manera muy fácil para determinar los números, según la fórmula molecular, es sumando los números de valencia del oxígeno y el hidrógeno planteando una ecuación para la valencia del no metal, ya que la suma de cargas o valencias debe ser cero para que la molécula sea neutra (ver la sección reglas generales).
Como la suma de las cargas debe ser igual a cero, entonces el azufre trabajara con la valencia +6.
Como el azufre trabaja con +6 su terminación o sufijo sería –ico y el compuesto se nombraría “ácido sulfúrico”.
Los oxiácidos son compuestos que presentan uniones covalentes, pero cuando se disuelven en agua ceden fácilmente iones H+1 (protones).
Por ejemplo, el ácido nítrico que se disuelve en agua da lugar a un anión nitrato y un catión hidrógeno.
Polibidratados Su fórmula general es: Un óxido no metálico más "n" moléculas de agua (H2O).
Ácido, también es toda sustancia que en solución acuosa se ioniza, liberando cationes de hidrógeno.
Según el número de valencia del no metal en la sal (o del no metal en el oxácido que da origen a la sal) los sufijos son: En el ejemplo anterior, Ca(ClO3)2, como el cloro trabaja con la valencia +5, el compuesto se nombra Clorato de calcio.
Si a la hora de formular pudiera haber confusión con otro oxoácido, se indica el grupo peroxo entre paréntesis.
Si el elemento tiene varios estados de oxidación (valencias) se usan números romanos (Stock) o los afijos hipo- -oso, -oso, -ico, per- -ico (tradicional).