Química inorgánica
[1] Dicha separación no es siempre clara, como por ejemplo en la química organometálica que es una superposición de ambas.
Clases importantes de compuestos inorgánicos son los óxidos, los carbonatos, los sulfatos y los haluros.
La reacción inorgánica más simple es el doble desplazamiento cuando, al mezclar dos sales, los iones se intercambian sin cambiar el estado de oxidación.
El intercambio de electrones también puede ocurrir indirectamente, por ejemplo, en las baterías, un concepto clave en la electroquímica.
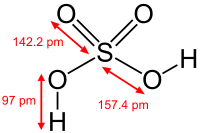
Cuando un reactivo contiene átomos de hidrógeno, puede producirse una reacción al intercambiar protones en la química ácido-base.
Estos campos son áreas activas de investigación en química inorgánica, dirigidas hacia nuevos catalizadores, superconductores y terapias.
En parte, la clasificación se centra en la posición en la tabla periódica del elemento más pesado (el elemento con el mayor peso atómico) del compuesto, en parte agrupando los compuestos por sus similitudes estructurales.
Los experimentos con oxígeno, O2 , de Lavoisier y Priestley no solo identificaron un importante gas diatómico, sino que también abrieron el camino para describir compuestos y reacciones según las relaciones estequiométricas.
Los compuestos de grupo principal también se encuentran en la naturaleza, por ejemplo, el fosfato en el ADN, y por lo tanto pueden clasificarse como bioinorgánicos.
Dado que estos son ligandos están vinculados a la petroquímica en cierto sentido, la química organometálica se ha beneficiado enormemente de su relevancia para la industria.
Por lo tanto, los grandes clústers pueden describirse como una estructura de átomos unidos con carácter intermedio entre una molécula y un sólido.
[9] El campo, que abarca también muchos aspectos de la bioquímica, incluye muchos tipos de compuestos, por ejemplo, los fosfatos en el ADN, y también complejos metálicos que contienen ligandos que van desde macromoléculas biológicas, normalmentepéptidos, hasta especies poco definidas, como el ácido húmico, o el agua (por ejemplo, cuando está coordinada en los complejos de gadolinio empleados para la RMN).
Tradicionalmente, la química bioinorgánica se centraba en la transferencia de electrones y energía en proteínas relevantes para la respiración.
Esta importante área se centra en la estructura,[10] los enlaces y las propiedades físicas de los materiales.
Dentro de la química del estado sólido se encuentran los metales y sus aleaciones o derivados intermetálicos.
Paralelamente a estas descripciones teóricas, se emplean metodologías aproximadas, incluida la teoría del funcional de la densidad.
Las excepciones a las teorías, cualitativas y cuantitativas, son extremadamente importantes en el desarrollo de este campo.
El desacuerdo entre la teoría cualitativa (paramagnética) y la observación (diamagnética) condujo al desarrollo de modelos para el "acoplamiento magnético".
Las aplicaciones más comunes de la simetría en la espectroscopia involucran espectros vibracionales y electrónicos.
Un enfoque cuantitativo alternativo a la química inorgánica se centra en las energías de reacción.
Aunque este enfoque es altamente tradicional y empírico, resulta de gran utilidad.
Los conceptos generales expresados en términos termodinámicos incluyen el potencial redox, la acidez y los cambios de fase.
Los elementos más pesados que C, N, O y F a menudo forman compuestos con más electrones de los que predice la regla del octeto, como se explica en el artículo sobre moléculas hipervalentes.
Estos temas se tratan en artículos sobre química de coordinación y ligandos.
Por ejemplo, la acidez de los ligandos amoniaco en el [Co(NH3)6]3+ es elevada en relación con el NH 3 en sí.
Los metales de transición, casi exclusivamente, reaccionan con moléculas pequeñas como CO, H2 , O2 y C2H4.
[13] Los compuestos inorgánicos solubles se preparan utilizando métodos de síntesis orgánica.
Productos y reactivos se transportan entre las zonas de temperatura para conducir a las reacciones.

A: El Diborano cuenta con un enlace inusual
B: El cloruro de cesio tiene una estructura cristalina arquetípica. C: El Fp 2 es un complejo organometálico. D: Los usos de la silicona van desde implantes mamarios hasta el Silly Putty .
E: El catalizador de Grubbs ganó el Premio Nobel 2005 por su descubridor
F: Las zeolitas encuentran un uso extensivo como tamices moleculares.
G: El acetato de cobre (II) sorprendió a los teóricos con su diamagnetismo