Sulfato
Los sulfatos son las sales o los ésteres provenientes del ácido sulfúrico.
Sales, ácidos derivados y peróxidos de sulfato se usan habitualmente en distintas industrias.
El ion sulfato lleva una carga global de -2 y es la base conjugada del ion bisulfato (o hidrogensulfato), HSO−4, que es a su vez la base conjugada de H2SO4, ácido sulfúrico.
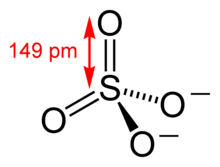
La geometría molecular tetraédrica del ion sulfato es la predicha por la teoría VSEPR.
Las aplicaciones de los sulfatos suelen variar enormemente según el metal al que están unidos.
Si al mismo tiempo hay permanganato presente este puede ser incluido en el precipitado dándole un color ligeramente rosáceo.
Con sodio metálico es reducido al sulfuro (Cuidado: reacción muy violenta) y puede ser determinado como tal.
Los sulfatos orgánicos son ésteres del ácido sulfúrico con la fórmula genérica R–O–SO2–O–R'.
Esta es una prueba de laboratorio común para determinar si los aniones sulfato están presentes.
Los enlaces metal-oxígeno en los complejos de sulfato pueden tener un carácter covalente significativo.
El resultado fue un amplio consenso de que los orbitales d desempeñan un papel, pero no son tan importantes como Pauling había creído.
[6][7] Una descripción ampliamente aceptada que involucra el enlace pπ - dπ fue propuesta inicialmente por Durward William John Cruickshank.
Para el ácido sulfúrico, el análisis computacional (con orbital de enlace natural) confirma una clara carga positiva en el azufre (teóricamente +2,45) y una baja ocupación 3d.
En cambio, en la estructura con un enlace dipolar, la carga se localiza como un par solitario en el oxígeno.
El efecto es muy poco uniforme desde el punto de vista espacial, y es mayor en las grandes zonas industriales.

4

1 solo con los enlaces polares covalentes; 2 con un enlace iónico



