Núcleo atómico
[1] Está formado por protones y neutrones (denominados nucleones) que se mantienen unidos por medio de la interacción nuclear fuerte, y detallada la cual permite que el núcleo sea estable, a pesar de que los protones se repelen entre sí (como los polos iguales de dos imanes).
Los núcleos atómicos no necesariamente tienen el mismo número de neutrones, ya que átomos de un mismo elemento pueden tener masas diferentes, es decir son isótopos del elemento.
Esto parecía indicar que la energía no se conservaba en estos decaimientos.
En 1906 Ernest Rutherford publicó "El retraso de la esfera alfa del radio cuando atraviesa la materia", en Philosophical Magazine (12, p. 134-46).
Hans Geiger amplió este trabajo en una comunicación a la Royal Society (Proc.
A82 p. 495-500) y ampliaron aún más el trabajo en la publicación de 1910 por Geiger (Proc.
En 1911-2 Rutherford explicó ante la Royal Society los experimentos y propuso la nueva teoría del núcleo atómico.
[2] Por esas mismas fechas (1909) Ernest Rutherford realizó un experimento en el que Hans Geiger y Ernest Marsden, bajo su supervisión dispararon partículas alfa (núcleos de helio) en una delgada lámina de oro.
Sin embargo, descubrió que algunas partículas se dispersan a grandes ángulos, e incluso completamente hacia atrás en algunos casos.
[2] Esto fue hasta que los estudios llevados a cabo por Franco Rasetti, en el Institute of Technology de California en 1929.
Rasetti descubierto, sin embargo, que el nitrógeno - 14 tiene un espín total unidad.
Enrico Fermi redenominó en 1931 los neutrones de Pauli como neutrinos (en italiano pequeño neutral) y unos treinta años después se demostró finalmente que un neutrinos realmente se emiten en el decaimiento beta.
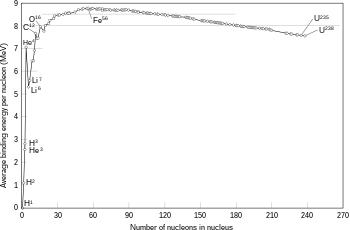
Sin embargo, con el modelo que incluye el neutrón, no había explicación alguna respecto a la forma en que en núcleo se mantiene unido y no explota de inmediato (es decir, ningún elemento debería existir, con la única excepción del hidrógeno).
[6] Utilizando esas ecuaciones, la energía disponible en ese periodo sería de 20 pJ (pico julios, 2 × 10-11 J o 1,25 × 108 eV), lo que equivale a una partícula con una masa de 250 veces la del electrón.
Por supuesto que siendo una partícula que solo existe un breve instante, y utilizando energía no disponible, solo gracias al principio de incertidumbre, sería imposible de detectar, excepto si esa energía fuese proporcionada.
Los rayos cósmicos —partículas que llegan del espacio a enormes velocidades— pueden proporcionar esa energía.
Los núcleos atómicos tienen algún tipo de estructura interna, por ejemplo los neutrones y protones parecen estar orbitando unos alrededor de los otros, hecho que se manifiesta en la existencia del momento magnético nuclear.
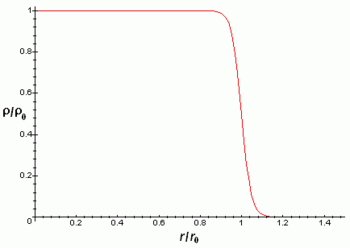
Sin embargo, los experimentos revelan que el núcleo se parece mucho a una esfera o elipsoide compacto de 10-15 m (= 1 fm), en el que la densidad parece prácticamente constante.
La densidad de carga eléctrica del núcleo es aproximadamente constante hasta la distancia
Los núcleos atómicos se comportan como partículas compuestas a energías suficientemente bajas.
Sin embargo, dentro del núcleo atómico la cercanía entre neutrones y protones hace que sean mucho más rápidas, vía interacción fuerte las reacciones: (2)
En 1808 el químico inglés John Dalton propone una nueva teoría sobre la constitución de la materia.
El estudio de esas combinaciones le llevó a poder calcular los pesos atómicos.
Para Dalton la existencia del núcleo atómico era desconocida y se consideraba que no existían partes más pequeñas.
En 1897 Joseph John Thomson fue el primero en proponer un modelo estructural interno del átomo.
Es así como Thomson postuló que el átomo debe ser una esfera compacta positiva en la cual se encontrarían incrustados los electrones en distintos lugares, de manera que la cantidad de carga negativa sea igual a la carga positiva.
Donde: Los resultados del experimento requerían parámetros de impacto muy pequeños, y por tanto que el núcleo estuviera concentrado en la parte central, el núcleo de carga positiva, donde estaría concentrada la masa del átomo.
En 1913 Niels Bohr postula que los electrones giran a grandes velocidades alrededor del núcleo atómico.
Los electrones se disponen en diversas órbitas circulares, las cuales determinan diferentes niveles de energía.
Así dado que los nucleones son fermiones un núcleo atómico tendrá las capas de menor energía llena por lo que los nucleones no pueden caer a capas inferiores ya llenas.