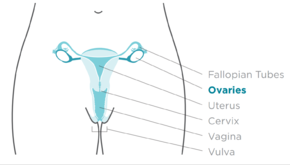
El cáncer de ovario es un tumor canceroso de un ovario . [10] Puede originarse en el propio ovario o, más comúnmente, en estructuras cercanas comunicantes, como las trompas de Falopio o el revestimiento interno del abdomen . [3] [11] El ovario está formado por tres tipos diferentes de células, incluidas las células epiteliales, las células germinales y las células del estroma. [12] Cuando estas células se vuelven anormales, tienen la capacidad de dividirse y formar tumores. Estas células también pueden invadir o propagarse a otras partes del cuerpo. [13] Cuando comienza este proceso, es posible que no haya síntomas o que solo haya síntomas vagos. [1] Los síntomas se vuelven más notorios a medida que progresa el cáncer. [1] [14] Estos síntomas pueden incluir hinchazón , sangrado vaginal, dolor pélvico , hinchazón abdominal , estreñimiento y pérdida de apetito , entre otros. [1] Las áreas comunes a las que se puede propagar el cáncer incluyen el revestimiento del abdomen , los ganglios linfáticos , los pulmones y el hígado . [15]
El riesgo de cáncer de ovario aumenta con la edad. La mayoría de los casos de cáncer de ovario se desarrollan después de la menopausia. [16] También es más común en mujeres que han ovulado más a lo largo de su vida. [17] Esto incluye a aquellas que nunca han tenido hijos , aquellas que comenzaron a ovular a una edad más temprana y aquellas que llegan a la menopausia a una edad más avanzada. [5] Otros factores de riesgo incluyen la terapia hormonal después de la menopausia , la medicación para la fertilidad y la obesidad . [4] [6] Los factores que disminuyen el riesgo incluyen el control de la natalidad hormonal , la ligadura de trompas , el embarazo y la lactancia materna . [6] Alrededor del 10% de los casos están relacionados con el riesgo genético heredado; las mujeres con mutaciones en los genes BRCA1 o BRCA2 tienen alrededor de un 50% de posibilidades de desarrollar la enfermedad. [5] Algunos síndromes de cáncer familiar como el cáncer de colon hereditario no polipósico y el síndrome de Peutz-Jeghers también aumentan el riesgo de desarrollar cáncer de ovario. [16] El carcinoma epitelial de ovario es el tipo más común de cáncer de ovario y comprende más del 95 % de los casos. [5] Existen cinco subtipos principales de carcinoma de ovario, de los cuales el carcinoma seroso de alto grado (HGSC) es el más común. [5] Los tipos menos comunes de cáncer de ovario incluyen tumores de células germinales [18] y tumores del estroma del cordón sexual . [5] El diagnóstico de cáncer de ovario se confirma mediante una biopsia de tejido, generalmente extirpado durante la cirugía. [1]
No se recomienda la detección en mujeres con riesgo promedio, ya que la evidencia no respalda una reducción en la mortalidad y la alta tasa de pruebas con resultados falsos positivos puede llevar a una cirugía innecesaria, que viene acompañada de sus propios riesgos. [19] Aquellas con riesgo muy alto pueden extirparse los ovarios como medida preventiva. [4] Si se detecta y se trata en una etapa temprana, el cáncer de ovario a menudo es curable. [1] El tratamiento generalmente incluye una combinación de cirugía, radioterapia y quimioterapia . [1] Los resultados dependen de la extensión de la enfermedad, el subtipo de cáncer presente y otras condiciones médicas. [5] [20] La tasa general de supervivencia a cinco años en los Estados Unidos es del 49%. [7] Los resultados son peores en el mundo en desarrollo. [5]
En 2020, se produjeron nuevos casos en aproximadamente 313.000 mujeres. [21] En 2019, resultó en 13.445 muertes en los Estados Unidos. [22] La muerte por cáncer de ovario aumentó a nivel mundial entre 1990 y 2017 en un 84,2%. [23] El cáncer de ovario es el segundo cáncer ginecológico más común en los Estados Unidos. Causa más muertes que cualquier otro cáncer del sistema reproductor femenino. [24] Entre las mujeres, ocupa el quinto lugar en muertes relacionadas con el cáncer. [25] La edad típica de diagnóstico es de 63 años . [2] La muerte por cáncer de ovario es más común en América del Norte y Europa que en África y Asia. [5] En los Estados Unidos, es más común en mujeres blancas e hispanas que en mujeres negras o indias americanas. [22]
Los primeros signos y síntomas del cáncer de ovario pueden estar ausentes o ser sutiles. En la mayoría de los casos, los síntomas existen durante varios meses antes de ser reconocidos y diagnosticados . [26] [27] Los síntomas a menudo pueden diagnosticarse erróneamente como síndrome del intestino irritable . [28] Las primeras etapas del cáncer de ovario tienden a ser indoloras, lo que dificulta su detección temprana. Los síntomas pueden variar según el subtipo. [26] Los tumores ováricos limítrofes , también conocidos como tumores ováricos de bajo potencial maligno (LMP), no causan un aumento en los niveles de CA125 y no son identificables con una ecografía. Los síntomas típicos de un tumor LMP pueden incluir distensión abdominal o dolor pélvico. Las masas particularmente grandes tienden a ser benignas o limítrofes. [29] [26]
Los síntomas más típicos del cáncer de ovario incluyen hinchazón , dolor o malestar abdominal o pélvico, dolor de espalda, menstruación irregular o sangrado vaginal posmenopáusico, dolor o sangrado después o durante las relaciones sexuales , pérdida de apetito , fatiga , diarrea , indigestión , acidez estomacal , estreñimiento , náuseas , sensación de saciedad y posiblemente síntomas urinarios (incluyendo micción frecuente y micción urgente ). [27]

Los síntomas posteriores del cáncer de ovario se deben a que la masa en crecimiento causa dolor al presionar otros órganos abdominopélvicos o por metástasis. [26] [30] [31] Debido a la ubicación anatómica de los ovarios en la profundidad de la pelvis, la mayoría de las masas son grandes y avanzadas en el momento del diagnóstico. [14] La masa en crecimiento puede causar dolor si se desarrolla torsión ovárica . Si estos síntomas comienzan a ocurrir con más frecuencia o de manera más severa de lo habitual, especialmente después de que no haya antecedentes significativos de tales síntomas, se considera el cáncer de ovario. [26] [29] Las metástasis pueden causar un nódulo de la Hermana María José . [31] En raras ocasiones, los teratomas pueden causar síndrome de teratoma en crecimiento o gliomatosis peritoneal. [31] Algunas experimentan menometrorragia y sangrado vaginal anormal después de la menopausia en la mayoría de los casos. Otros síntomas comunes incluyen hirsutismo , dolor abdominal, virilización y una masa anexial . [32]
En adolescentes o niños con tumores ováricos, los síntomas pueden incluir dolor abdominal intenso, irritación del peritoneo o sangrado . [33] Los tumores del estroma de los cordones sexuales producen hormonas que pueden conducir al desarrollo prematuro de características sexuales secundarias. Los tumores del estroma de los cordones sexuales en niños prepúberes pueden manifestarse por signos de pubertad temprana ; el dolor abdominal y la distensión también son comunes. Los adolescentes con tumores del estroma de los cordones sexuales pueden experimentar amenorrea . A medida que el cáncer se vuelve más avanzado, puede causar una acumulación de líquido en el abdomen y conducir a distensión. Si la malignidad no ha sido diagnosticada en el momento en que causa ascitis, generalmente se diagnostica poco después. [26] Los cánceres avanzados también pueden causar masas abdominales, masas en los ganglios linfáticos o derrame pleural . [31]
Existen muchos factores de riesgo conocidos que pueden aumentar el riesgo de que una mujer desarrolle cáncer de ovario. El riesgo de desarrollar cáncer de ovario está relacionado con la cantidad de tiempo que una mujer pasa ovulando. [34] Los factores que aumentan el número de ciclos ovulatorios que experimenta una mujer pueden aumentar el riesgo de desarrollar cáncer de ovario. [34] Durante la ovulación, las células son estimuladas a dividirse. Si esta división se regula de manera anormal, pueden formarse tumores que pueden ser malignos. La menarquia temprana y la menopausia tardía aumentan el número de ciclos ovulatorios que una mujer experimenta a lo largo de su vida y, por lo tanto, aumentan el riesgo de desarrollar cáncer de ovario. [29] [34] [35] Dado que la ovulación se suprime durante el embarazo, no tener hijos también aumenta el riesgo de cáncer de ovario. [35] Por lo tanto, las mujeres que no han tenido hijos tienen el doble de riesgo de cáncer de ovario que las que sí los han tenido. [26] Tanto la obesidad como la terapia de reemplazo hormonal también aumentan el riesgo. [26]
El riesgo de desarrollar cáncer de ovario es menor para las mujeres que tienen menos ciclos menstruales, no tienen ciclos menstruales, amamantan , toman anticonceptivos orales, tienen embarazos múltiples y tienen un embarazo a una edad temprana. El riesgo de desarrollar cáncer de ovario se reduce en mujeres que se han sometido a una ligadura de trompas (coloquialmente conocida como "ligadura de las trompas"), a la extirpación de ambos ovarios o a una histerectomía (una operación en la que se extirpa el útero). [27] La edad también es un factor de riesgo. [26] [20] Los factores no genéticos como la diabetes mellitus, el índice de masa corporal alto y el consumo de tabaco también son factores de riesgo para el cáncer de ovario. [23]
El uso de medicamentos para la fertilidad puede contribuir a la formación de tumores ováricos limítrofes , pero el vínculo entre ambos es discutido y difícil de estudiar. [28] Los medicamentos para la fertilidad pueden estar asociados con un mayor riesgo de tumores limítrofes. [31] Las mujeres que han recibido tratamiento para la infertilidad pero siguen siendo nulíparas tienen un mayor riesgo de cáncer epitelial de ovario debido a la exposición hormonal que puede conducir a la proliferación de células. Sin embargo, las mujeres que reciben un tratamiento exitoso para la infertilidad y posteriormente dan a luz no tienen un mayor riesgo. Esto puede deberse al desprendimiento de células precancerosas durante el embarazo, pero la causa sigue sin estar clara. [29] El factor de riesgo puede ser, en cambio, la infertilidad en sí, no el tratamiento. [34]
Las afecciones hormonales como el síndrome de ovario poliquístico y la endometriosis se asocian con el cáncer de ovario, pero el vínculo no está completamente confirmado. [28] La terapia de reemplazo hormonal (TRH) posmenopáusica con estrógeno probablemente aumenta el riesgo de cáncer de ovario. La asociación no se ha confirmado en un estudio a gran escala, [29] [36] pero estudios notables, incluido el Million Women Study, han respaldado este vínculo. La TRH posmenopáusica con estrógeno y progesterona combinados puede aumentar el riesgo contemporáneo si se usa durante más de 5 años, pero este riesgo vuelve a la normalidad después de la interrupción de la terapia. [34] La TRH con estrógeno con o sin progestinas aumenta el riesgo de tumores endometrioides y serosos, pero reduce el riesgo de tumores mucinosos. Las dosis más altas de estrógeno aumentan este riesgo. [31] La endometriosis es otro factor de riesgo para el cáncer de ovario, [34] como lo es el dolor con la menstruación. La endometriosis se asocia con subtipos de células claras y endometrioides, tumores serosos de bajo grado, tumores en estadio I y II, tumores de grado 1 y menor mortalidad. [31]
Antes de la menopausia, la obesidad puede aumentar el riesgo de cáncer de ovario, pero este riesgo no está presente después de la menopausia. Este riesgo también es relevante en aquellas que son obesas y nunca han utilizado terapia de reemplazo hormonal. Una asociación similar con el cáncer de ovario aparece en mujeres más altas. [34]

Los antecedentes familiares de cáncer de ovario son un factor de riesgo de cáncer de ovario. Las mujeres con cáncer de colon hereditario no asociado a poliposis (síndrome de Lynch) y aquellas con anomalías genéticas BRCA-1 y BRCA-2 tienen un mayor riesgo.
El principal factor de riesgo genético para el cáncer de ovario es una mutación en los genes BRCA1 o BRCA2 , o en los genes de reparación de desajustes del ADN , que está presente en el 10% de los casos de cáncer de ovario. Solo se necesita mutar un alelo para que una persona tenga alto riesgo. El gen puede heredarse a través de la línea materna o paterna, pero tiene una penetrancia variable . [26] [29] Aunque las mutaciones en estos genes suelen estar asociadas con un mayor riesgo de cáncer de mama, también conllevan un riesgo de por vida sustancial de cáncer de ovario, un riesgo que alcanza su punto máximo en los 40 y 50 años de una persona. El riesgo más bajo citado es del 30% y el más alto del 60%. [28] [26] [29] Las mutaciones en BRCA1 tienen un riesgo de por vida de desarrollar cáncer de ovario del 15 al 45%. [31] Las mutaciones en BRCA2 son menos riesgosas que las de BRCA1 , con un riesgo de por vida del 10% (riesgo más bajo citado) al 40% (riesgo más alto citado). [26] [31] En promedio, los cánceres asociados a BRCA se desarrollan 15 años antes que sus contrapartes esporádicas porque las personas que heredan las mutaciones en una copia de su gen solo necesitan una mutación para iniciar el proceso de carcinogénesis, mientras que las personas con dos genes normales necesitarían adquirir dos mutaciones. [29]
En los Estados Unidos, cinco de cada 100 mujeres con un familiar de primer grado con cáncer de ovario eventualmente desarrollarán cáncer de ovario, lo que coloca a aquellas con familiares afectados en un riesgo tres veces mayor que las mujeres con familiares no afectados. Siete de cada 100 mujeres con dos o más familiares con cáncer de ovario eventualmente desarrollarán cáncer de ovario. [29] [37] En general, entre el 5 y el 10 % de los casos de cáncer de ovario tienen una causa genética. [29] Las mutaciones BRCA están asociadas con cáncer de ovario epitelial seroso no mucinoso de alto grado. [31]

Una fuerte historia familiar de cáncer de endometrio , cáncer de colon u otros cánceres gastrointestinales puede indicar la presencia de un síndrome conocido como cáncer colorrectal hereditario no polipósico (también conocido como síndrome de Lynch), que confiere un mayor riesgo de desarrollar una serie de cánceres, incluido el cáncer de ovario. El síndrome de Lynch es causado por mutaciones en genes de reparación de desajustes, incluidos MSH2 , MLH1 , MLH6, PMS1 y PMS2 . [26] El riesgo de cáncer de ovario para una persona con síndrome de Lynch es de entre el 10 y el 12 por ciento. [26] [29] Las mujeres de ascendencia islandesa , ascendencia judía europea / ascendencia judía asquenazí y ascendencia húngara tienen un mayor riesgo de cáncer de ovario epitelial. [29] El gen del receptor de estrógeno beta ( ESR2 ) parece ser clave para la patogénesis y la respuesta a la terapia. [38] Otros genes que se han asociado con el cáncer de ovario son BRIP1 , MSH6 , RAD51C y RAD51D . [39] CDH1 , CHEK2 , PALB2 y RAD50 también se han asociado con el cáncer de ovario. [40]
Varios trastornos genéticos raros se asocian con subtipos específicos de cáncer de ovario. El síndrome de Peutz-Jeghers , un trastorno genético raro, también predispone a las mujeres a un tumor de los cordones sexuales con túbulos anulares . [28] [26] La enfermedad de Ollier y el síndrome de Maffucci se asocian con tumores de células de la granulosa en niños y también pueden estar asociados con tumores de Sertoli-Leydig. Los fibromas benignos se asocian con el síndrome de carcinoma basocelular nevoide . [26]
El consumo de alcohol no parece estar relacionado con el cáncer de ovario. [31] [41]
La Sociedad Estadounidense del Cáncer recomienda un patrón de alimentación saludable que incluya muchas frutas, verduras, cereales integrales y una dieta que evite o limite las carnes rojas y procesadas y el azúcar procesado. [42] El consumo elevado de grasas totales, saturadas y trans aumenta el riesgo de cáncer de ovario. [43] Una revisión general de 2021 encontró que la ingesta de café, huevos y grasas aumenta significativamente el riesgo de cáncer de ovario. [44] Existe evidencia mixta de estudios sobre el riesgo de cáncer de ovario y el consumo de productos lácteos . [45] [46]
Los países industrializados, con excepción de Japón, tienen tasas elevadas de cáncer epitelial de ovario, lo que puede deberse a la dieta en esos países. Las mujeres blancas tienen un riesgo entre un 30 y un 40 % mayor de cáncer de ovario en comparación con las mujeres negras y las hispanas, probablemente debido a factores socioeconómicos; las mujeres blancas tienden a tener menos hijos y diferentes tasas de cirugías ginecológicas que afectan el riesgo de cáncer de ovario. [29]
La evidencia provisional sugiere que el talco , los pesticidas y los herbicidas aumentan el riesgo de cáncer de ovario. [47] La Sociedad Estadounidense del Cáncer señala que hasta el momento, ningún estudio ha podido vincular con precisión una sola sustancia química en el medio ambiente o en la dieta humana directamente con las mutaciones que causan cáncer de ovario. [48]
Otros factores que se han investigado, como el tabaquismo , los niveles bajos de vitamina D en la sangre, [49] la presencia de quistes ováricos de inclusión y la infección con el virus del papiloma humano (la causa de algunos casos de cáncer de cuello uterino ), han sido refutados como factores de riesgo para el cáncer de ovario. [28] [31] La carcinogenicidad del talco perineal es controvertida, porque puede actuar como irritante si viaja a través del tracto reproductivo hasta los ovarios. [31] [29] [34] Los estudios de casos y controles han demostrado que el uso de talco perineal aumenta el riesgo de cáncer de ovario, pero usar talco con más frecuencia no crea un riesgo mayor. [31] El uso de talco en otras partes del cuerpo no está relacionado con el cáncer de ovario. [34] Sentarse regularmente durante períodos prolongados se asocia con una mayor mortalidad por cáncer de ovario epitelial. El riesgo no se anula con el ejercicio regular, aunque se reduce. [50]
La edad avanzada (hasta los 70 años) es un factor de riesgo para el cáncer epitelial de ovario porque pueden acumularse más mutaciones en las células y, con el tiempo, causar cáncer. Las personas mayores de 80 años tienen un riesgo ligeramente menor. [29]
Fumar tabaco está asociado con un mayor riesgo de cáncer mucinoso de ovario ; después de dejar de fumar , el riesgo eventualmente vuelve a la normalidad. Los niveles más altos de proteína C reactiva están asociados con un mayor riesgo de desarrollar cáncer de ovario. [31]
La supresión de la ovulación, que de otro modo causaría daño al epitelio ovárico y, en consecuencia, inflamación , es generalmente protectora. Este efecto se puede lograr teniendo hijos , tomando anticonceptivos orales combinados y amamantando , todos los cuales son factores protectores. [26] Un período más largo de lactancia materna se correlaciona con una mayor disminución en el riesgo de cáncer de ovario. [34] Cada nacimiento disminuye más el riesgo de cáncer de ovario, y este efecto se ve con hasta cinco nacimientos. Los anticonceptivos orales combinados reducen el riesgo de cáncer de ovario hasta en un 50%, y el efecto protector de los anticonceptivos orales combinados puede durar 25-30 años después de que se suspenden. [29] [34] El uso regular de aspirina ( estudio MALOVA (MALignant OVArian cancer)) [51] [52] o acetaminofeno (paracetamol) puede estar asociado con un menor riesgo de cáncer de ovario; otros AINE no parecen tener un efecto protector similar. [31]
La ligadura de trompas es protectora porque los carcinógenos no pueden llegar al ovario y las fimbrias a través de la vagina, el útero y las trompas de Falopio. [26] La ligadura de trompas también es protectora en mujeres con la mutación BRCA1, pero no con la mutación BRCA2. [31] La histerectomía reduce el riesgo, y la extirpación de las trompas de Falopio y los ovarios ( salpingooforectomía bilateral ) reduce drásticamente el riesgo no solo de cáncer de ovario sino también de cáncer de mama. [28] Este sigue siendo un tema de investigación, ya que el vínculo entre la histerectomía y un menor riesgo de cáncer de ovario es controvertido. Las razones por las que la histerectomía puede ser protectora no se han dilucidado hasta 2015. [34]
Una dieta que incluya grandes cantidades de caroteno , fibra y vitaminas con bajas cantidades de grasa, específicamente, una dieta con verduras sin almidón (por ejemplo, brócoli y cebollas ), puede ser protectora. [29] La fibra dietética se asocia con un riesgo significativamente reducido de cáncer de ovario. [53] Una revisión de 2021 encontró que la ingesta de verduras de hoja verde, verduras allium, fibra, flavonoides y té verde puede reducir significativamente el riesgo de cáncer de ovario. [54]
El cáncer de ovario se forma cuando se producen errores en el crecimiento normal de las células ováricas . Por lo general, cuando las células envejecen o se dañan, mueren y nuevas células ocupan su lugar. El cáncer comienza cuando se forman nuevas células innecesarias y las células viejas o dañadas no mueren como deberían. La acumulación de células adicionales a menudo forma una masa de tejido llamada tumor o crecimiento ovárico. Estas células cancerosas anormales tienen muchas anomalías genéticas que hacen que crezcan excesivamente. [56] Cuando un ovario libera un óvulo , el folículo del óvulo se abre y se convierte en el cuerpo lúteo . Esta estructura necesita ser reparada mediante la división de células en el ovario. [34] La ovulación continua durante mucho tiempo significa una mayor reparación del ovario mediante la división de células, que pueden adquirir mutaciones en cada división. [29]
En general, las mutaciones genéticas más comunes en el cáncer de ovario ocurren en NF1 , BRCA1, BRCA2 y CDK12 . Los cánceres de ovario tipo I, que tienden a ser menos agresivos, tienden a tener inestabilidad de microsatélites en varios genes, incluidos oncogenes (más notablemente BRAF y KRAS ) y supresores tumorales (más notablemente PTEN ). [28] Las mutaciones más comunes en los cánceres de tipo I son KRAS, BRAF, ERBB2, PTEN, PIK3CA y ARID1A. [31] Los cánceres de tipo II, el tipo más agresivo, tienen diferentes genes mutados, incluidos p53 , BRCA1 y BRCA2 . [28] Los cánceres de bajo grado tienden a tener mutaciones en KRAS, mientras que los cánceres de cualquier grado que se desarrollan a partir de tumores de bajo potencial maligno tienden a tener mutaciones en p53. [29] Los cánceres de tipo I tienden a desarrollarse a partir de lesiones precursoras, mientras que los cánceres de tipo II pueden desarrollarse a partir de un carcinoma intraepitelial tubárico seroso. [31] Los cánceres serosos que tienen mutaciones BRCA también tienen inevitablemente mutaciones p53, lo que indica que la eliminación de ambos genes funcionales es importante para que se desarrolle el cáncer. [29]
En el 50% de los cánceres serosos de alto grado, la reparación del ADN por recombinación homóloga es disfuncional, al igual que las vías de señalización de Notch y FOXM1 . También casi siempre tienen mutaciones de p53. Aparte de esto, las mutaciones en el carcinoma seroso de alto grado son difíciles de caracterizar más allá de su alto grado de inestabilidad genómica . BRCA1 y BRCA2 son esenciales para la reparación del ADN por recombinación homóloga, y las mutaciones de la línea germinal en estos genes se encuentran en aproximadamente el 15% de las mujeres con cáncer de ovario. [28] Las mutaciones más comunes en BRCA1 y BRCA2 son las mutaciones de cambio de marco que se originaron en una pequeña población fundadora de judíos asquenazíes. [29]
Casi el 100% de los carcinomas mucinosos raros tienen mutaciones en KRAS y amplificaciones de ERBB2 (también conocido como Her2/neu ). [28] En general, el 20% de los cánceres de ovario tienen mutaciones en Her2/neu . [26]
Los carcinomas serosos pueden desarrollarse a partir de carcinoma intraepitelial tubárico seroso, en lugar de desarrollarse espontáneamente a partir de tejido ovárico. Otros carcinomas se desarrollan a partir de quistes de inclusión corticales, que son grupos de células ováricas epiteliales dentro del estroma . [29]


El diagnóstico de cáncer de ovario comienza con un examen físico (que incluye un examen pélvico ), un análisis de sangre (para CA-125 y, a veces, otros marcadores) y una ecografía transvaginal . [26] [57] A veces, se utiliza un examen rectovaginal para ayudar a planificar una cirugía. [29] El diagnóstico debe confirmarse con cirugía para inspeccionar la cavidad abdominal , tomar biopsias (muestras de tejido para análisis microscópico ) y buscar células cancerosas en el líquido abdominal. Esto ayuda a determinar si una masa ovárica es benigna o maligna. [26]
Las primeras etapas del cáncer de ovario (I/II) son difíciles de diagnosticar porque la mayoría de los síntomas son inespecíficos y, por lo tanto, de poca utilidad en el diagnóstico; como resultado, rara vez se diagnostica hasta que se propaga y avanza a etapas posteriores (III/IV). [58] Además, los síntomas del cáncer de ovario pueden parecer similares al síndrome del intestino irritable . En mujeres en las que existe la posibilidad de embarazo, se puede medir el nivel de BHCG durante el proceso de diagnóstico. La alfa-fetoproteína sérica , la enolasa neuronal específica y la lactato deshidrogenasa se pueden medir en niñas y adolescentes con sospecha de tumores ováricos , ya que las mujeres más jóvenes con cáncer de ovario tienen más probabilidades de tener tumores malignos de células germinales. [26] [31]
Un examen físico, que incluye un examen pélvico, y una ecografía pélvica (transvaginal o de otro tipo) son esenciales para el diagnóstico: el examen físico puede revelar un aumento de la circunferencia abdominal y/o ascitis (líquido dentro de la cavidad abdominal), mientras que el examen pélvico puede revelar una masa ovárica o abdominal. [28] Una masa anexial es un hallazgo significativo que a menudo indica cáncer de ovario, especialmente si es fija, nodular, irregular, sólida y/o bilateral. Entre el 13 y el 21 % de las masas anexiales son causadas por malignidad; Sin embargo, existen otras causas benignas de masas anexiales, incluyendo quiste folicular ovárico , leiomioma , endometriosis , embarazo ectópico , hidrosálpinx , absceso tuboovárico, torsión ovárica , quiste dermoide , cistoadenoma (seroso o mucinoso), absceso diverticular o apendicular, tumor de la vaina nerviosa , riñón pélvico , divertículo ureteral o vesical , mesotelioma quístico benigno del peritoneo, tuberculosis peritoneal o quiste paraovárico . Los ovarios que se pueden palpar también son un signo de cáncer de ovario en mujeres posmenopáusicas. Otras partes de un examen físico para sospecha de cáncer de ovario pueden incluir un examen de mama y un examen rectal digital . La palpación de los ganglios linfáticos supraclaviculares , axilares e inguinales puede revelar linfadenopatía , que puede ser indicativa de metástasis. Otro indicador puede ser la presencia de un derrame pleural , que puede notarse en la auscultación . [31]
Cuando se incluye una neoplasia maligna de ovario en una lista de posibilidades diagnósticas, se indica un número limitado de pruebas de laboratorio. Por lo general, se obtiene un hemograma completo y una prueba de electrolitos séricos; [59] cuando hay un cáncer de ovario, estas pruebas a menudo muestran un número alto de plaquetas (20-25% de las pacientes) y niveles bajos de sodio en sangre debido a señales químicas secretadas por el tumor. [29] Una prueba positiva de inhibina A e inhibina B puede indicar un tumor de células de la granulosa. [31]
Un análisis de sangre para una molécula marcadora llamada CA-125 es útil en el diagnóstico diferencial y en el seguimiento de la enfermedad, pero por sí solo no ha demostrado ser un método eficaz para detectar el cáncer de ovario en etapa temprana debido a su inaceptable baja sensibilidad y especificidad. [59] Los niveles de CA-125 en mujeres premenopáusicas superiores a 200 U/mL pueden indicar cáncer de ovario, al igual que cualquier elevación de CA-125 por encima de 35 U/mL en mujeres posmenopáusicas. Los niveles de CA-125 no son precisos en el cáncer de ovario en etapa temprana, ya que la mitad de los pacientes con cáncer de ovario en etapa I tienen un nivel normal de CA-125. [31] [29] El CA-125 también puede estar elevado en condiciones benignas (no cancerosas), incluyendo endometriosis , embarazo , fibromas uterinos , menstruación , quistes ováricos , lupus eritematoso sistémico , enfermedad hepática , enfermedad inflamatoria intestinal , enfermedad inflamatoria pélvica y leiomioma . [31] [60] El HE4 es otro candidato para las pruebas de cáncer de ovario, aunque no se ha probado ampliamente. Otros marcadores tumorales para el cáncer de ovario incluyen CA19-9 , CA72-4, CA15-3 , proteína ácida inmunosupresora, haptoglobina-alfa, OVX1, mesotelina , ácido lisofosfatídico , osteopontina y factor de crecimiento de fibroblastos 23. [ 31]
El uso de paneles de análisis de sangre puede ayudar en el diagnóstico. [31] [59] El panel OVA1 incluye CA-125, beta-2 microglobulina , transferrina , apolipoproteína A1 y transtiretina . OVA1 por encima de 5,0 en mujeres premenopáusicas y 4,4 en mujeres posmenopáusicas indica un alto riesgo de cáncer. [29] Se utiliza un conjunto diferente de pruebas de laboratorio para detectar tumores del estroma de los cordones sexuales. Los niveles altos de testosterona o sulfato de dehidroepiandrosterona , combinados con otros síntomas y niveles altos de inhibina A e inhibina B pueden ser indicativos de un SCST de cualquier tipo. [32]
La investigación actual está buscando formas de considerar la proteómica de marcadores tumorales en combinación con otros indicadores de la enfermedad (es decir, radiología y/o síntomas) para mejorar la precisión del diagnóstico. El desafío de este enfoque es que la prevalencia dispar del cáncer de ovario significa que incluso las pruebas con una sensibilidad y especificidad muy altas seguirán dando lugar a una serie de resultados falsos positivos, lo que a su vez puede dar lugar a problemas como la realización de procedimientos quirúrgicos en los que no se detecta cáncer intraoperatoriamente. [ cita requerida ] Todavía no se han desarrollado enfoques genómicos para el cáncer de ovario. [31]
La tomografía computarizada se prefiere para evaluar la extensión del tumor en la cavidad abdominopélvica, aunque también se puede utilizar la resonancia magnética . [28] La tomografía computarizada también puede ser útil para encontrar apelmazamiento omental o diferenciar líquido de tumor sólido en el abdomen, especialmente en tumores de bajo potencial maligno. Sin embargo, puede no detectar tumores más pequeños. A veces, se utiliza una radiografía de tórax para detectar metástasis en el tórax o derrame pleural . Otra prueba para la enfermedad metastásica, aunque se utiliza con poca frecuencia, es un enema de bario , que puede mostrar si el colon rectosigmoide está involucrado en la enfermedad. La tomografía por emisión de positrones , las gammagrafías óseas y la paracentesis son de uso limitado; de hecho, la paracentesis puede causar la formación de metástasis en el sitio de inserción de la aguja y puede no proporcionar resultados útiles. [29] Sin embargo, la paracentesis se puede utilizar en casos en los que no hay masa pélvica y todavía hay ascitis. [29] Un médico que sospecha cáncer de ovario también puede realizar una mamografía o una biopsia endometrial (en caso de sangrado anormal) para evaluar la posibilidad de neoplasias malignas de mama y neoplasias malignas de endometrio, respectivamente. La ecografía vaginal es a menudo el estudio de diagnóstico por imágenes de primera línea que se realiza cuando se encuentra una masa anexial. Varias características de una masa anexial indican neoplasia maligna de ovario; por lo general son sólidas, irregulares, multiloculares y/o grandes; y típicamente tienen características papilares, vasos centrales y/o tabiques internos irregulares. [31] Sin embargo, el SCST no tiene características definitivas en el estudio radiográfico. [32]
Para diagnosticar definitivamente el cáncer de ovario, se requiere un procedimiento quirúrgico para inspeccionar el abdomen. Este puede ser un procedimiento abierto ( laparotomía , incisión a través de la pared abdominal ) o una cirugía de ojo de cerradura ( laparoscopia ). Durante este procedimiento, se extrae tejido sospechoso y se envía para análisis microscópico . Por lo general, esto incluye una salpingooforectomía unilateral , la extirpación de un solo ovario y trompa de Falopio afectados. El líquido de la cavidad abdominal también se puede analizar para detectar células cancerosas . Si se encuentra cáncer, este procedimiento también se puede utilizar para determinar el grado de su propagación (que es una forma de estadificación del tumor ). [26]
La pafolacianina está indicada para su uso en adultos con cáncer de ovario para ayudar a identificar lesiones cancerosas durante la cirugía. [61] Es un agente de diagnóstico que se administra en forma de inyección intravenosa antes de la cirugía. [61]
Un método ampliamente reconocido para estimar el riesgo de cáncer maligno de ovario es el índice de riesgo de malignidad (IRM), calculado en base a una evaluación inicial . [28] [62] Una puntuación RMI de más de 200 o 250 generalmente se considera que indica un alto riesgo de cáncer de ovario. [28] [31]
El RMI se calcula como:
Se pueden utilizar dos métodos para determinar la puntuación ecográfica y la puntuación menopáusica; las puntuaciones resultantes se denominan RMI 1 y RMI 2, respectivamente, dependiendo del método utilizado.
Otro método para cuantificar el riesgo de cáncer de ovario es el algoritmo de riesgo de cáncer de ovario (ROCA), que observa los niveles a lo largo del tiempo y determina si aumentan lo suficientemente rápido como para justificar una ecografía transvaginal. [29] El algoritmo de riesgo de malignidad ovárica utiliza los niveles de CA-125 y los niveles de HE4 para calcular el riesgo de cáncer de ovario; puede ser más eficaz que el RMI. Los modelos IOTA se pueden utilizar para estimar la probabilidad de que un tumor anexial sea maligno. [64] Incluyen el modelo de riesgo LR2, el cálculo de riesgo de reglas simples (SRrisk) y el modelo de evaluación de diferentes neoplasias en los anexos (ADNEX) que se puede utilizar para evaluar el riesgo de malignidad en una masa anexial, en función de sus características y factores de riesgo. El algoritmo QCancer (Ovary) se utiliza para predecir la probabilidad de cáncer de ovario a partir de factores de riesgo. [31]
El Sistema de Información y Datos de Ovario-Anejos (ORADS, por sus siglas en inglés) es un sistema estandarizado desarrollado por el Colegio Americano de Radiología para mejorar el manejo y el diagnóstico de masas ováricas y anexiales. Proporciona un marco consistente para interpretar los hallazgos de las imágenes, en particular de la ecografía, y asigna categorías de estratificación de riesgo que guían la toma de decisiones clínicas. Al utilizar un conjunto claro de criterios y terminología, ORADS tiene como objetivo mejorar la comunicación entre los proveedores de atención médica, aumentar la precisión del diagnóstico y, en última instancia, mejorar los resultados de los pacientes en la evaluación de patologías ováricas y anexiales. Además, hay disponible una calculadora ORADS especializada para facilitar la elaboración de informes, lo que ayuda a los radiólogos y médicos a clasificar los hallazgos de manera rápida y precisa de acuerdo con las pautas del sistema. [65]

Los cánceres de ovario se clasifican según la apariencia microscópica de sus estructuras ( histología o histopatología ). La histología dicta muchos aspectos del tratamiento clínico, el manejo y el pronóstico . La patología macroscópica de los cánceres de ovario es muy similar independientemente del tipo histológico: los tumores de ovario tienen masas sólidas y quísticas. [29] Según SEER , los tipos de cánceres de ovario en mujeres de 20 años o más son: [66]
Los cánceres de ovario se dividen histológica y genéticamente en tipo I o tipo II. Los cánceres de tipo I son de bajo grado histológico e incluyen carcinomas endometrioides, mucinosos y de células claras. Los cánceres de tipo II son de mayor grado histológico e incluyen carcinoma seroso y carcinosarcoma. [28]

El cáncer epitelial de ovario generalmente se presenta en una etapa avanzada y se deriva de la transformación maligna del epitelio de la superficie ovárica, el peritoneo o las trompas de Falopio. [67] Es la causa más común de muerte por cáncer ginecológico. [67] Existen varios tipos de cáncer epitelial de ovario, incluidos el tumor seroso, el tumor endometrioide, el tumor de células claras, el tumor mucinoso y los tumores indiferenciados o no clasificados. [68] Anualmente en todo el mundo, 230.000 mujeres serán diagnosticadas y 150.000 morirán. [69] Tiene una tasa de supervivencia a 5 años del 46% después del diagnóstico debido a la etapa avanzada de la enfermedad en el momento del diagnóstico. [69] Por lo general, alrededor del 75% de los pacientes son diagnosticados con una etapa avanzada de la enfermedad debido a la naturaleza asintomática de su presentación. [69] Existe una predisposición genómica al cáncer de ovario epitelial y se ha descubierto que los genes BRCA1 y BRCA2 son los genes causantes del 65-75% del cáncer de ovario epitelial hereditario. [69]
.jpg/440px-Serous_carcinoma_(3061775966).jpg)
El cáncer de ovario seroso es el tipo más común de cáncer de ovario epitelial y representa aproximadamente dos tercios de los casos de cáncer de ovario epitelial. [28] El carcinoma seroso de bajo grado es menos agresivo que los carcinomas serosos de alto grado, aunque normalmente no responde bien a la quimioterapia ni a los tratamientos hormonales. [28] Se cree que los carcinomas serosos comienzan en las trompas de Falopio . [70] [71] El carcinoma seroso de alto grado representa el 75% de todos los cánceres de ovario epiteliales. [69] Alrededor del 15-20% de los carcinomas serosos de alto grado tienen mutaciones de la línea germinal BRCA1 y BRCA2. [69] Histológicamente, el patrón de crecimiento del carcinoma seroso de alto grado es heterogéneo y tiene algunos patrones de crecimiento papilar o sólido. [69] Las células tumorales son atípicas con núcleos grandes e irregulares. [69] Tiene una alta tasa de proliferación. [69] En el 50% de los casos, los carcinomas serosos son bilaterales y en el 85% de los casos, se han diseminado más allá del ovario en el momento del diagnóstico. [72]
Actualmente se reconoce que el carcinoma intraepitelial tubárico seroso (STIC) es la lesión precursora de la mayoría de los llamados carcinomas serosos de ovario de alto grado. [72] El STIC se caracteriza por

El carcinoma de ovario de células pequeñas es raro y agresivo, con dos subtipos principales: hipercalcémico y pulmonar. [73] Esta rara neoplasia maligna afecta más comúnmente a mujeres jóvenes menores de 40 años con un rango entre 14 meses y 58 años. [73] La edad media de diagnóstico de 24 años. [73] Aproximadamente dos tercios de los pacientes presentarán hipercalcemia paraneoplásica, lo que significa que tienen altos niveles de calcio en sangre por una razón desconocida. [73] [74] El tumor secreta una proteína relacionada con la hormona paratiroidea que actúa de manera similar a la PTH y se une a los receptores de PTH en el hueso y el riñón causando hipercalcemia. [73] Investigaciones recientes han encontrado una mutación germinal y somática inactivante del gen SMARCA4 . [73] [75] El subtipo hipercalcémico es muy agresivo y tiene una tasa de supervivencia general del 16% con una tasa de recurrencia del 65% en pacientes que reciben tratamiento. [73] Los pacientes que han propagado la enfermedad a otras partes del cuerpo tienden a morir 2 años después del diagnóstico. [73] La propagación extraovárica está involucrada en el 50% de los casos y la propagación a los ganglios linfáticos está presente en el 55% de los casos. [74] La presentación inicial más común es una masa pélvica unilateral de rápido crecimiento con un tamaño medio de 15 cm. [73] Histológicamente, se caracteriza por muchas láminas de células pequeñas, redondas y muy compactas con racimos, nidos y cordones. [73] [74] La inmunohistoquímica es típicamente positiva para vimentina, citoqueratina, CD10, p53 y WT-1. [73] [75]
El carcinoma de ovario de células pequeñas del subtipo pulmonar se presenta de manera diferente al subtipo hipercalcémico. [73] Por lo general, el cáncer de ovario de células pequeñas pulmonar suele afectar ambos ovarios de mujeres mayores y se parece al carcinoma de células de avena del pulmón . [29] La edad promedio de aparición de la enfermedad es de 59 años y aproximadamente el 45% de los casos son bilaterales para el subtipo pulmonar. [73] Además, varias hormonas pueden estar elevadas en el subtipo pulmonar, incluidas la serotonina, la somatostatina, la insulina, la gastrina y la calcitonina. [73]
Los carcinomas peritoneales primarios se desarrollan a partir del peritoneo , una membrana que cubre la cavidad abdominal que tiene el mismo origen embrionario que el ovario. A menudo se los analiza y clasifica junto con los cánceres de ovario cuando afectan al ovario. [70] [76] Pueden desarrollarse incluso después de que se hayan extirpado los ovarios y pueden parecer similares al mesotelioma . [29]

El carcinoma de células claras de ovario es un subtipo poco común de cáncer epitelial de ovario. Las personas diagnosticadas con carcinoma de células claras de ovario suelen ser más jóvenes a la edad del diagnóstico y se diagnostican en etapas más tempranas que otros subtipos de cáncer epitelial de ovario. [77] [78] La mayor incidencia de carcinoma de células claras de ovario se ha observado entre mujeres asiáticas jóvenes, especialmente las de ascendencia coreana, taiwanesa y japonesa. [77] [78] La endometriosis se ha relacionado con ser el principal factor de riesgo para el desarrollo de carcinoma de células claras de ovario y se ha encontrado que está presente en el 50% de las mujeres diagnosticadas con carcinoma de células claras de ovario. [77] Se informa que el desarrollo de coágulos en las piernas, como tromboembolia venosa profunda o en los pulmones con embolia pulmonar, es un 40% mayor en pacientes con carcinoma de células claras que otros subtipos de cáncer epitelial de ovario. [78] Se ha descubierto que las mutaciones en vías moleculares como ARID1A, PIK3 y PIK3CA están relacionadas con el carcinoma de células claras. [77] [78] Por lo general, se presentan como una masa grande y unilateral, con un tamaño medio de entre 13 y 15 cm. [77] El 90% de los casos son unilaterales. [77] El carcinoma de células claras de ovario no suele responder bien a la quimioterapia debido a la quimiorresistencia intrínseca, por lo que el tratamiento suele consistir en cirugía citorreductora agresiva y quimioterapia basada en platino. [28] [77]

Los adenocarcinomas de células claras son histopatológicamente similares a otros carcinomas de células claras , con células claras y células en uña . Representan aproximadamente el 5-10% de los cánceres epiteliales de ovario y están asociados con endometriosis en la cavidad pélvica. Por lo general, se encuentran en una etapa temprana y, por lo tanto, son curables mediante cirugía, pero los adenocarcinomas de células claras avanzados (aproximadamente el 20%) tienen un pronóstico malo y a menudo son resistentes a la quimioterapia con platino. [29]
Los adenocarcinomas endometrioides representan aproximadamente el 13-15% de todos los cánceres de ovario. [79] Debido a que son típicamente de bajo grado, los adenocarcinomas endometrioides tienen un buen pronóstico. [79] La edad media de diagnóstico es de alrededor de 53 años. [79] Estos tumores frecuentemente coexisten con endometriosis o cáncer de endometrio. [29] [79] Los niveles de antígeno de cáncer 125 son típicamente elevados y una historia familiar de un pariente de primer grado con cáncer de ovario endometrioide se asocia con un mayor riesgo de desarrollar cáncer de ovario endometrioide. [79] El tamaño promedio del tumor es mayor a 10 cm. [79]
Los tumores müllerianos mixtos representan menos del 1% de los cánceres de ovario. Tienen células epiteliales y mesenquimales visibles y tienden a tener un mal pronóstico. [29]
Los tumores mucinosos incluyen el adenocarcinoma mucinoso y el cistadenocarcinoma mucinoso. [29]
Los adenocarcinomas mucinosos representan entre el 5 y el 10 % de los cánceres epiteliales de ovario. Histológicamente, son similares a los adenocarcinomas intestinales o cervicales y, en realidad, suelen ser metástasis de cánceres de apéndice o de colon . Los adenocarcinomas mucinosos avanzados tienen un pronóstico malo, generalmente peor que los tumores serosos, y suelen ser resistentes a la quimioterapia con platino, aunque son poco frecuentes. [29]

El pseudomixoma peritoneal es una acumulación de moco encapsulado o material gelatinoso en la cavidad abdominopélvica, que muy rara vez es causado por un tumor mucinoso ovárico primario. Más comúnmente, se asocia con metástasis ováricas de cáncer intestinal. [29]
Los cánceres indiferenciados (aquellos en los que no se puede determinar el tipo de célula) representan alrededor del 10% de los cánceres epiteliales de ovario y tienen un pronóstico comparativamente malo. [29] [70] Cuando se examinan bajo el microscopio, estos tumores tienen células muy anormales que están dispuestas en grupos o láminas. Por lo general, hay grupos reconocibles de células serosas dentro del tumor. [29]

Los tumores de Brenner malignos son poco frecuentes. Histológicamente, presentan un estroma fibroso denso con áreas de epitelio transicional y cierta diferenciación escamosa. Para clasificarse como tumor de Brenner maligno, debe tener focos tumorales de Brenner y carcinoma de células transicionales. El componente de carcinoma de células transicionales suele estar poco diferenciado y se asemeja al cáncer del tracto urinario. [29]
Los carcinomas de células transicionales representan menos del 5% de los cánceres de ovario. Histológicamente, parecen similares al carcinoma de vejiga . El pronóstico es intermedio: mejor que la mayoría de los cánceres epiteliales, pero peor que los tumores malignos de Brenner. [29]
Los tumores del estroma de los cordones sexuales , que incluyen el tumor de células de la granulosa productor de estrógenos , el tecoma benigno y el tumor de células de Sertoli-Leydig virilizante o arrenoblastoma , representan el 7 % de los cánceres de ovario. Se presentan con mayor frecuencia en mujeres entre 50 y 69 años de edad, pero pueden presentarse en mujeres de cualquier edad, incluidas las niñas. No suelen ser agresivos y suelen ser unilaterales; [26] por lo tanto, generalmente se tratan solo con cirugía. Los tumores del estroma de los cordones sexuales son los principales tumores ováricos productores de hormonas. [32]
Varias células diferentes del mesénquima pueden dar lugar a tumores de los cordones sexuales o del estroma. Estos incluyen fibroblastos y células endocrinas. Los síntomas de un tumor de los cordones sexuales o del estroma ovárico pueden diferir de otros tipos de cáncer de ovario. Los signos y síntomas comunes incluyen torsión ovárica , hemorragia o ruptura del tumor, una masa abdominal y alteración hormonal. En los niños, la pseudopubertad precoz isosexual puede ocurrir con tumores de células de la granulosa ya que producen estrógeno. Estos tumores causan anomalías en la menstruación ( sangrado excesivo , menstruación infrecuente o ausencia de menstruación ) o sangrado posmenopáusico. Debido a que estos tumores producen estrógeno, pueden causar u ocurrir al mismo tiempo que el cáncer de endometrio o el cáncer de mama . Otros tumores de los cordones sexuales o del estroma presentan síntomas distintos. Los tumores de células de Sertoli-Leydig causan virilización y crecimiento excesivo de vello debido a la producción de testosterona y androstenediona , que también pueden causar síndrome de Cushing en casos raros. También se presentan tumores del estroma de los cordones sexuales que no causan un desequilibrio hormonal, incluidos los fibromas benignos, que causan ascitis e hidrotórax . [26] Dentro de los tumores de células germinales, los tumores del estroma de los cordones sexuales son el cáncer de ovario más común diagnosticado en mujeres menores de 20 años. [32]
Los tumores de células de la granulosa son los tumores del estroma de los cordones sexuales más comunes, representan el 70% de los casos y se dividen en dos subtipos histológicos: tumores de células de la granulosa adultas, que se desarrollan en mujeres mayores de 50 años, y tumores de la granulosa juveniles, que se desarrollan antes de la pubertad o antes de los 30 años. Ambos se desarrollan en el folículo ovárico a partir de una población de células que rodea a las células germinales. [32]
Los tumores de células de la granulosa en adultos se caracterizan por una aparición tardía (más de 30 años, 50 en promedio). Estos tumores producen altos niveles de estrógeno, lo que causa sus síntomas característicos: menometrorragia ; hiperplasia endometrial ; senos sensibles y agrandados ; sangrado posmenopáusico ; y amenorrea secundaria . La masa del tumor puede causar otros síntomas, incluido el dolor y la distensión abdominal, o síntomas similares a un embarazo ectópico si el tumor sangra y se rompe. [32]
Los tumores de Sertoli-Leydig son más comunes en mujeres antes de los 30 años y particularmente comunes antes de la pubertad. [32]
Los tumores estromales esclerosantes suelen aparecer en niñas antes de la pubertad o en mujeres antes de los 30 años. [32]
Los tumores de células germinales del ovario se desarrollan a partir de las células germinales del ovario . [70] Los tumores de células germinales representan alrededor del 30% de los tumores de ovario, pero solo el 5% de los cánceres de ovario, porque la mayoría de los tumores de células germinales son teratomas y la mayoría de los teratomas son benignos. Los teratomas malignos tienden a ocurrir en mujeres mayores, cuando una de las capas germinales del tumor se convierte en un carcinoma de células escamosas . [26] Los tumores de células germinales tienden a ocurrir en mujeres jóvenes (de 20 a 30 años) y niñas, y representan el 70% del cáncer de ovario observado en ese grupo de edad. [33] Los tumores de células germinales pueden incluir disgerminomas, teratomas, tumores del saco vitelino/tumores del seno endodérmico y coriocarcinomas, cuando surgen en el ovario. Algunos tumores de células germinales tienen un isocromosoma 12, en el que se elimina un brazo del cromosoma 12 y se reemplaza por un duplicado del otro. [26] La mayoría de los cánceres de células germinales tienen un mejor pronóstico que otros subtipos y son más sensibles a la quimioterapia. Es más probable que se encuentren en estadio I en el momento del diagnóstico. [32] En general, hacen metástasis con mayor frecuencia que los cánceres epiteliales de ovario. Además, los marcadores de cáncer utilizados varían según el tipo de tumor: los coriocarcinomas se controlan con beta-HCG y los tumores del seno endodérmico con alfa-fetoproteína . [26]
Los tumores de células germinales se descubren típicamente cuando se convierten en masas grandes y palpables. Sin embargo, al igual que los tumores de los cordones sexuales, pueden causar torsión o hemorragia ovárica y, en los niños, pubertad precoz isosexual. Con frecuencia hacen metástasis en los ganglios linfáticos cercanos, especialmente los ganglios linfáticos paraaórticos y pélvicos. [26] El síntoma más común de los tumores de células germinales es el dolor abdominal subagudo causado por el sangrado del tumor, la necrosis o el estiramiento de la cápsula ovárica. Si el tumor se rompe, causa un sangrado significativo o tuerce el ovario, puede causar dolor abdominal agudo , que ocurre en menos del 10% de las personas con tumores de células germinales. También pueden secretar hormonas que cambian el ciclo menstrual . En el 25% de los tumores de células germinales, el cáncer se descubre durante un examen de rutina y no causa síntomas. [32]
El diagnóstico de tumores de células germinales puede ser difícil debido a que el ciclo menstrual normal y la pubertad pueden causar dolor y síntomas pélvicos, y una mujer joven puede incluso creer que estos síntomas son los del embarazo y no buscar tratamiento debido al estigma del embarazo adolescente . Los análisis de sangre para alfa-fetoproteína, cariotipo , gonadotropina coriónica humana y función hepática se utilizan para diagnosticar el tumor de células germinales y la posible disgenesia gonadal coexistente. Un tumor de células germinales puede confundirse inicialmente con un quiste ovárico benigno . [32]

El disgerminoma representa el 35% de los cánceres de ovario en mujeres jóvenes y es el tumor de células germinales con mayor probabilidad de hacer metástasis en los ganglios linfáticos; las metástasis ganglionares ocurren en el 25-30% de los casos. [33] [32] Estos tumores pueden tener mutaciones en el gen KIT , una mutación conocida por su papel en el tumor del estroma gastrointestinal . Las personas con un cariotipo XY y ovarios ( disgenesia gonadal ) o un cariotipo X,0 y ovarios ( síndrome de Turner ) que desarrollan un disgerminoma unilateral tienen riesgo de tener un gonadoblastoma en el otro ovario y, en este caso, generalmente se extirpan ambos ovarios cuando se descubre un disgerminoma unilateral para evitar el riesgo de otro tumor maligno. Los gonadoblastomas en personas con síndrome de Swyer o Turner se vuelven malignos en aproximadamente el 40% de los casos. Sin embargo, en general, los disgerminomas son bilaterales el 10-20% de las veces. [26] [32]

Están compuestos por células que no pueden diferenciarse más y se desarrollan directamente a partir de células germinales o de gonadoblastomas. Los disgerminomas contienen sinciciotrofoblastos en aproximadamente el 5% de los casos y, por lo tanto, pueden causar niveles elevados de hCG. En apariencia macroscópica, los disgerminomas suelen ser de color rosa a tostado, tienen múltiples lóbulos y son sólidos. Microscópicamente, parecen idénticos a los seminomas y muy similares a las células germinales primordiales embrionarias , con células grandes, poliédricas, redondeadas y transparentes . Los núcleos son uniformes y redondos o cuadrados con nucléolos prominentes y el citoplasma tiene altos niveles de glucógeno . La inflamación es otra característica histológica prominente de los disgerminomas. [32]
El coriocarcinoma puede presentarse como un tumor ovárico primario que se desarrolla a partir de una célula germinal, aunque generalmente es una enfermedad gestacional que produce metástasis en el ovario. El coriocarcinoma ovárico primario tiene un pronóstico malo y puede presentarse sin embarazo. Produce niveles altos de hCG y puede causar pubertad temprana en los niños o menometrorragia (menstruación irregular y abundante) después de la menarquia. [32]
.jpg/440px-Mature_Cystic_Teratoma_of_the_Ovary_(5560431170).jpg)
Los teratomas inmaduros o sólidos son el tipo más común de tumor de células germinales de ovario y representan el 40-50% de los casos. Los teratomas se caracterizan por la presencia de tejidos desorganizados que surgen de las tres capas germinales embrionarias : ectodermo , mesodermo y endodermo ; los teratomas inmaduros también tienen células madre indiferenciadas que los hacen más malignos que los teratomas maduros (quistes dermoides). Los diferentes tejidos son visibles en la patología macroscópica y a menudo incluyen hueso, cartílago, cabello, moco o sebo , pero estos tejidos no son visibles desde el exterior, que parece ser una masa sólida con lóbulos y quistes. Histológicamente, tienen grandes cantidades de neuroectodermo organizado en láminas y túbulos junto con glía ; la cantidad de tejido neural determina el grado histológico. Los teratomas inmaduros suelen afectar solo a un ovario (el 10 % coexiste con quistes dermoides) y suelen hacer metástasis en todo el peritoneo. También pueden provocar que los implantes de teratomas maduros crezcan en todo el abdomen en una enfermedad llamada síndrome del teratoma en crecimiento ; estos suelen ser benignos, pero seguirán creciendo durante la quimioterapia y, a menudo, necesitarán más cirugía. A diferencia de los teratomas maduros, los teratomas inmaduros forman muchas adherencias , lo que hace que sea menos probable que provoquen torsión ovárica. No existe un marcador específico para los teratomas inmaduros, pero el antígeno carcinoembrionario (CEA), CA-125, CA19-9 o AFP a veces pueden indicar un teratoma inmaduro. [32]
Los teratomas en estadio I constituyen la mayoría (75%) de los casos y tienen el mejor pronóstico, ya que el 98% de los pacientes sobreviven cinco años; si un tumor en estadio I también es de grado 1, se puede tratar solo con cirugía unilateral. Los tumores en estadio II a IV constituyen el cuarto restante de los casos y tienen un peor pronóstico, ya que entre el 73 y el 88% de los pacientes sobreviven cinco años. [32]
Los teratomas maduros, o quistes dermoides, son tumores raros que consisten principalmente en tejido benigno que se desarrollan después de la menopausia. Los tumores consisten en tejido desorganizado con nódulos de tejido maligno, que pueden ser de varios tipos. La neoplasia maligna más común es el carcinoma de células escamosas , pero el adenocarcinoma , el carcinoma de células basales , el tumor carcinoide , el tumor neuroectodérmico , el melanoma maligno , el sarcoma , el tumor sebáceo y el estruma ovárico también pueden ser parte del quiste dermoide. Se tratan con cirugía y quimioterapia o radiación adyuvante con platino. [32]
Los tumores del saco vitelino , anteriormente llamados tumores del seno endodérmico, representan aproximadamente el 10-20% de las neoplasias malignas de células germinales de ovario y tienen el peor pronóstico de todos los tumores de células germinales de ovario . Se producen tanto antes de la menarquia (en un tercio de los casos) como después de la menarquia (los dos tercios restantes de los casos). La mitad de las personas con tumores del saco vitelino son diagnosticadas en la etapa I. Por lo general, son unilaterales hasta la metástasis, que se produce dentro de la cavidad peritoneal y a través del torrente sanguíneo hasta los pulmones. Los tumores del saco vitelino crecen rápidamente y recurren fácilmente, y no son fácilmente tratables una vez que han recurrido. Los tumores del saco vitelino en etapa I son altamente tratables, con una tasa de supervivencia libre de enfermedad a 5 años del 93%, pero los tumores en etapa II-IV son menos tratables, con tasas de supervivencia del 64-91%. [32]
Su aspecto macroscópico es sólido, friable y amarillento, con áreas necróticas y hemorrágicas. También suelen contener quistes que pueden degenerar o romperse. Histológicamente, los tumores del saco vitelino se caracterizan por la presencia de cuerpos de Schiller-Duval (que son patognomónicos de los tumores del saco vitelino) y un patrón reticular. Los tumores del saco vitelino suelen secretar alfa-fetoproteína y se pueden teñir inmunohistoquímicamente para detectar su presencia; el nivel de alfa-fetoproteína en la sangre es un marcador útil de recurrencia. [32]
Los carcinomas embrionarios, un tipo de tumor poco común que se encuentra generalmente en tumores mixtos, se desarrollan directamente a partir de células germinales pero no están diferenciados terminalmente; en casos raros, pueden desarrollarse en gónadas disgenéticas. Pueden evolucionar a una variedad de otras neoplasias, incluyendo coriocarcinoma, tumor del saco vitelino y teratoma. Se presentan en personas más jóvenes, con una edad promedio en el momento del diagnóstico de 14 años, y secretan alfa-fetoproteína (en el 75% de los casos) y hCG. [32]
Histológicamente, el carcinoma embrionario parece similar al disco embrionario , formado por células epiteliales anaplásicas en láminas desorganizadas, con espacios similares a glándulas y estructuras papilares. [32]
Los poliembriomas, la forma más inmadura de teratoma y tumores ováricos muy raros, se caracterizan histológicamente por tener varios cuerpos similares a embriones con estructuras que se asemejan a un disco germinativo, un saco vitelino y un saco amniótico . Las células gigantes del sinciciotrofoblasto también se encuentran en los poliembriomas. [32]
Los carcinomas escamocelulares primarios de ovario son poco frecuentes y tienen un mal pronóstico cuando están avanzados. Más típicamente, los carcinomas escamocelulares de ovario son metástasis cervicales, áreas de diferenciación en un tumor endometrioide o derivados de un teratoma maduro. [29]
Los tumores mixtos contienen elementos de más de una de las clases de histología tumoral mencionadas anteriormente. Para clasificarse como tumor mixto, el tipo menor debe representar más del 10 % del tumor. [31] Aunque los carcinomas mixtos pueden tener cualquier combinación de tipos de células, los cánceres de ovario mixtos suelen ser serosos/endometrioides o de células claras/endometrioides. [29] Los tumores de células germinales mixtos representan aproximadamente el 25-30 % de todos los cánceres de ovario de células germinales, con combinaciones de disgerminoma, tumor del saco vitelino y/o teratoma inmaduro. El pronóstico y el tratamiento varían según los tipos de células componentes. [32]
El cáncer de ovario también puede ser un cáncer secundario, el resultado de la metástasis de un cáncer primario en otra parte del cuerpo. [26] Alrededor del 5-30% de los cánceres de ovario se deben a metástasis, mientras que el resto son cánceres primarios. [80] Los cánceres primarios comunes son el cáncer de mama , el cáncer de colon , el cáncer de apéndice y el cáncer de estómago (los cánceres gástricos primarios que hacen metástasis en el ovario se denominan tumores de Krukenberg ). [26] Los tumores de Krukenberg tienen células en anillo de sello y células mucinosas. [29] El cáncer de endometrio y los linfomas también pueden hacer metástasis en el ovario. [81]
Los tumores ováricos limítrofes , a veces llamados tumores ováricos de bajo potencial maligno (LMP), tienen algunas características benignas y algunas malignas. [29] Los tumores LMP constituyen aproximadamente el 10-15% de todos los tumores ováricos. [31] [70] Se desarrollan antes que el cáncer ovárico epitelial, alrededor de los 40-49 años. Por lo general, no tienen una invasión extensa; el 10% de los tumores LMP tienen áreas de microinvasión estromal (<3 mm, <5% del tumor). Los tumores LMP tienen otras características anormales, que incluyen aumento de la mitosis, cambios en el tamaño de la célula o el tamaño del núcleo , núcleos anormales , estratificación celular y pequeñas proyecciones en las células (proyecciones papilares). Se pueden ver características serosas y/o mucinosas en el examen histológico, y la histología serosa constituye la abrumadora mayoría de los tumores LMP avanzados. Más del 80% de los tumores LMP están en Estadio I; El 15% se encuentran en estadio II y III y menos del 5% en estadio IV. [29] Los implantes de tumores LMP a menudo no son invasivos. [70]
El cáncer de ovario se estadifica utilizando el sistema de estadificación FIGO y utiliza información obtenida después de la cirugía, que puede incluir una histerectomía abdominal total mediante una laparotomía media , extirpación de (generalmente) ambos ovarios y trompas de Falopio , (generalmente) el epiplón , lavados pélvicos (peritoneales) , evaluación de los ganglios linfáticos retroperitoneales (incluidos los ganglios linfáticos pélvicos y paraaórticos ), apendicectomía en casos sospechosos de tumores mucinosos y biopsias pélvicas/peritoneales para citopatología . [28] [26] [31] [82] Alrededor del 30% de los cánceres de ovario que parecen confinados al ovario han hecho metástasis microscópicamente, por lo que incluso los cánceres en estadio I deben estadificarse por completo. [26] Se observa que el 22% de los cánceres que se presumen en estadio I tienen metástasis linfáticas. [31] El estadio AJCC es el mismo que el estadio FIGO. El sistema de estadificación del AJCC describe la extensión del tumor primario (T), la ausencia o presencia de metástasis en los ganglios linfáticos cercanos (N) y la ausencia o presencia de metástasis a distancia (M). [83] El estadio más común en el momento del diagnóstico es el estadio IIIc, con más del 70 % de los diagnósticos. [26]

El sistema de estadificación AJCC/TNM indica dónde se ha desarrollado el tumor, se ha propagado a los ganglios linfáticos y ha hecho metástasis. [31]
Los estadios AJCC/TNM se pueden correlacionar con los estadios FIGO: [31]
Los tumores de grado 1 tienen células bien diferenciadas (se parecen mucho al tejido normal) y son los que tienen mejor pronóstico. Los tumores de grado 2 también se denominan moderadamente bien diferenciados y están formados por células que se parecen al tejido normal. Los tumores de grado 3 tienen el peor pronóstico y sus células son anormales, denominadas pobremente diferenciadas. [84]
La metástasis en el cáncer de ovario es muy común en el abdomen y ocurre a través de exfoliación, donde las células cancerosas estallan a través de la cápsula ovárica y pueden moverse libremente por toda la cavidad peritoneal. Las metástasis del cáncer de ovario generalmente crecen en la superficie de los órganos en lugar de en el interior; también son comunes en el epiplón y el revestimiento peritoneal. Las células cancerosas también pueden viajar a través del sistema linfático y hacer metástasis en los ganglios linfáticos conectados a los ovarios a través de vasos sanguíneos; es decir, los ganglios linfáticos a lo largo del ligamento infundibulopélvico , el ligamento ancho y el ligamento redondo . Los grupos más comúnmente afectados incluyen los ganglios linfáticos paraaórticos , hipogástricos, ilíacos externos , obturadores e inguinales . Por lo general, el cáncer de ovario no hace metástasis en el hígado, pulmón, cerebro o riñones a menos que sea una enfermedad recurrente; esto diferencia el cáncer de ovario de muchas otras formas de cáncer. [29]
Las mujeres con un alto riesgo genético de cáncer de ovario pueden considerar la extirpación quirúrgica de sus ovarios como medida preventiva. Esto se hace a menudo después de completar los años fértiles. Esto reduce las probabilidades de desarrollar cáncer de mama (en alrededor del 50%) y cáncer de ovario (en aproximadamente el 96%) en mujeres con alto riesgo. Las mujeres con mutaciones del gen BRCA generalmente también se extirpan las trompas de Falopio al mismo tiempo (salpingooforectomía), ya que también tienen un mayor riesgo de cáncer de trompa de Falopio . Sin embargo, estas estadísticas pueden sobreestimar la reducción del riesgo debido a la forma en que se han estudiado. [26] [85]
Debido a que una gran fracción de los cánceres de ovario se originan en las trompas de Falopio, [86] la Ovarian Cancer Research Alliance y la Society of Gynecologic Oncology ahora recomiendan que las mujeres que no planean tener hijos adicionales y que se someten a procedimientos quirúrgicos como la ligadura de trompas (tener las "trompas atadas") se sometan a una salpingooforectomía oportunista, es decir, que se les extirpen simultáneamente las trompas de Falopio. [87] OVCARE, el grupo de investigación de ovarios multiinstitucional y multidisciplinario de BC Cancer , comenzó a recomendar la salpingectomía en el momento de la histerectomía y en lugar de la ligadura de trompas en 2010. [88]
Las mujeres con antecedentes familiares importantes de cáncer de ovario suelen ser derivadas a un asesor genético para ver si sería beneficioso realizar pruebas de detección de mutaciones del gen BRCA. [29] El uso de anticonceptivos orales, la ausencia de "períodos" durante el ciclo menstrual y la ligadura de trompas reducen el riesgo. [89] Puede haber una asociación entre el desarrollo de cáncer de ovario y la estimulación ovárica durante los tratamientos de infertilidad. La endometriosis se ha relacionado con los cánceres de ovario. La infección por el virus del papiloma humano , el tabaquismo y el talco no se han identificado como factores que aumenten el riesgo de desarrollar cáncer de ovario. [28]
No existe una forma sencilla y fiable de detectar el cáncer de ovario en mujeres que no presentan ningún signo o síntoma. No se recomienda realizar pruebas de detección en mujeres con un riesgo promedio, ya que la evidencia no respalda una reducción de la mortalidad y la alta tasa de resultados falsos positivos puede llevar a una cirugía innecesaria, que conlleva sus propios riesgos. [19] Las mujeres con alto riesgo de cáncer de ovario que actualmente se identifican en función de los antecedentes familiares y las pruebas genéticas pueden beneficiarse de las pruebas de detección. [90] La prueba de Papanicolaou no detecta el cáncer de ovario. [27]
El cáncer de ovario suele ser palpable solo en etapas avanzadas. [29] Este grupo de alto riesgo se ha beneficiado de una detección más temprana. [28] [26] [85] No se recomienda la detección mediante mediciones de CA-125 , niveles de HE4 , ecografía o palpación de anexos en mujeres con riesgo promedio. Actualmente no existe un programa nacional de detección en el Reino Unido para el cáncer de ovario. Se pueden utilizar CA125 y ecografía transvaginal, pero hay evidencia mínima que sugiera que esto disminuye la mortalidad. Más recientemente, se ha demostrado que el Algoritmo de Riesgo de Cáncer de Ovario (ROMA) detecta cánceres más tempranos utilizando CA125 y la edad, pero nuevamente no proporciona una medida sólida para disminuir la mortalidad en la actualidad. [91]
El cáncer de ovario tiene una prevalencia baja, incluso en el grupo de alto riesgo de mujeres de 50 a 60 años (aproximadamente una en 2000), y es más probable que el cribado de las mujeres con riesgo medio dé resultados ambiguos que detecte un problema que requiera tratamiento. Dado que los resultados ambiguos son más probables que la detección de un problema tratable, y dado que la respuesta habitual a los resultados ambiguos son las intervenciones invasivas, en las mujeres de riesgo medio, los posibles daños de hacerse un cribado sin una indicación superan los posibles beneficios. El objetivo del cribado es diagnosticar el cáncer de ovario en una etapa temprana, cuando es más probable que se trate con éxito. [26] [85]
En las mujeres con mutaciones BRCA1 o BRCA2, se puede utilizar la ecografía transvaginal , el examen pélvico y la determinación de los niveles de CA-125 en lugar de la cirugía preventiva. Esta estrategia ha demostrado tener cierto éxito. [29]
En un estudio a gran escala realizado en el Reino Unido, se demostró que la detección de CA125, una sustancia química liberada por los tumores ováricos, con seguimiento mediante ultrasonido, no es eficaz para reducir la mortalidad. [92]
Se han realizado algunos ensayos de detección que han utilizado la edad, los antecedentes familiares de cáncer de ovario y el estado de mutación para identificar poblaciones objetivo para la detección. [90]
Una vez que se determina la presencia de cáncer de ovario, de trompa de Falopio o primario de peritoneo, un oncólogo ginecólogo (un médico capacitado para tratar cánceres del sistema reproductivo de la mujer) programa el tratamiento. Los oncólogos ginecológicos pueden realizar cirugías y administrar quimioterapia a mujeres con cáncer de ovario. Se desarrolla un plan de tratamiento. [93]
El tratamiento generalmente implica cirugía y quimioterapia , y algunas veces radioterapia , independientemente del subtipo de cáncer de ovario. [70] [94] El tratamiento quirúrgico puede ser suficiente para tumores malignos bien diferenciados y confinados al ovario. Puede requerirse la adición de quimioterapia para tumores más agresivos confinados al ovario. Para pacientes con enfermedad avanzada, una combinación de reducción quirúrgica con un régimen de quimioterapia combinada es estándar. Desde 1980, los medicamentos basados en platino han tenido un papel importante en el tratamiento del cáncer de ovario. [ cita requerida ] Los tumores limítrofes , incluso después de la propagación fuera del ovario, se manejan bien con cirugía, y la quimioterapia no se considera útil. [95] No se ha demostrado que la cirugía de segunda revisión y la quimioterapia de mantenimiento brinden beneficios. [29]
La cirugía ha sido el estándar de atención durante décadas y puede ser necesaria para obtener una muestra para el diagnóstico . La cirugía depende de la extensión de la invasión cercana de otros tejidos por el cáncer cuando se diagnostica. Esta extensión del cáncer se describe asignándole un estadio, el tipo presunto y el grado de cáncer. El cirujano ginecológico puede extirpar uno (ooforectomía unilateral) o ambos ovarios (ooforectomía bilateral). También se pueden extirpar las trompas de Falopio (salpingectomía), el útero (histerectomía) y el epiplón (omentectomía). Por lo general, se extirpan todos estos órganos. [96]
Para aquellas mujeres que dan positivo en los análisis de los genes BRCA1 o BRCA2, una opción es someterse a una cirugía para reducir el riesgo . Cada vez más mujeres optan por esta opción. Al mismo tiempo, el tiempo de espera promedio para someterse al procedimiento es de dos años, lo que es mucho más largo de lo recomendado. [97] [98]
En el caso de cánceres unilaterales de grado bajo en estadio IA, solo se extirpará el ovario afectado (que no debe estar roto) y la trompa de Falopio. Esto se puede hacer especialmente en mujeres jóvenes que desean preservar su fertilidad. Sin embargo, existe un riesgo de metástasis microscópicas y se debe completar la estadificación. [28] Si se encuentran metástasis, se necesita una segunda cirugía para extirpar el ovario y el útero restantes. [95] Se puede administrar ácido tranexámico antes de la cirugía para reducir la necesidad de transfusiones de sangre debido a la pérdida de sangre durante la cirugía. [31]
Si durante la cirugía se determina que un tumor en una mujer premenopáusica es un tumor de bajo potencial maligno y claramente es un cáncer en estadio I, solo se extirpa el ovario afectado. Para las mujeres posmenopáusicas con tumores de bajo potencial maligno, la histerectomía con salpingooforectomía bilateral sigue siendo la opción preferida. Durante la estadificación, se puede examinar o extirpar el apéndice. Esto es particularmente importante en el caso de los tumores mucinosos. [29] En los niños o adolescentes con cáncer de ovario, los cirujanos generalmente intentan preservar un ovario para permitir la finalización de la pubertad , pero si el cáncer se ha diseminado, esto no siempre es posible. Los disgerminomas, en particular, tienden a afectar ambos ovarios: entre el 8 y el 15 % de los disgerminomas están presentes en ambos ovarios. [33] Las personas con tumores de bajo grado (bien diferenciados) generalmente se tratan solo con cirugía, [26] que a menudo es curativa. [70] En general, los tumores de células germinales pueden tratarse con cirugía unilateral a menos que el cáncer esté muy extendido o la fertilidad no sea un factor. [32] En mujeres con cáncer de ovario epitelial avanzado estadificado quirúrgicamente (estadios III y IV), los estudios sugieren que se deben hacer todos los intentos posibles para alcanzar la citorreducción completa (esfuerzos quirúrgicos para eliminar la mayor parte del tumor). [99]
En los cánceres avanzados, donde la extirpación completa no es una opción, se elimina la mayor cantidad posible de tumor en un procedimiento llamado cirugía de citorreducción . Esta cirugía no siempre es exitosa y es menos probable que tenga éxito en mujeres con metástasis extensas en el peritoneo, enfermedad en estadio IV, cáncer en la fisura transversal del hígado , mesenterio o diafragma y grandes áreas de ascitis. La cirugía de citorreducción generalmente solo se ha realizado una vez [28], pero un estudio reciente ha demostrado una supervivencia general más prolongada en el cáncer de ovario recurrente cuando se realizó cirugía combinada con quimioterapia en comparación con el tratamiento con quimioterapia sola. [100] La tomografía computarizada (TC abdominal) a menudo se usa para evaluar si es posible la cirugía de citorreducción primaria, pero la evidencia de baja certeza también sugiere que la PET/TC con fluorodesoxiglucosa-18 (FDG) y la RMN pueden ser útiles como un complemento para evaluar la citorreducción incompleta macroscópica. [101] Una descitorreducción más completa se asocia con mejores resultados: las mujeres sin evidencia macroscópica de enfermedad después de la descitorreducción tienen una supervivencia media de 39 meses, en comparación con 17 meses con una cirugía menos completa. [26] Al eliminar las metástasis, se eliminan muchas células que son resistentes a la quimioterapia y también se eliminan los grupos de células que han muerto. Esto permite que la quimioterapia llegue mejor a las células cancerosas restantes, que tienen más probabilidades de crecer rápidamente y, por lo tanto, ser quimiosensibles. [29]
La cirugía de reducción de volumen a intervalos es otro protocolo utilizado, en el que se administra quimioterapia neoadyuvante, se realiza la cirugía de reducción de volumen y se finaliza la quimioterapia después de la reducción de volumen. [95] Aunque no se han completado estudios definitivos, se ha demostrado que es aproximadamente equivalente a la cirugía de reducción de volumen primaria en términos de supervivencia y muestra una morbilidad ligeramente menor. [29] Estudios previos han mostrado resultados diferentes de la reducción de volumen primaria frente a la reducción de volumen a intervalos. El estudio TRUST en curso puede aclarar los criterios de selección para cada abordaje quirúrgico. [102]
Existen varios procedimientos quirúrgicos diferentes que se pueden emplear para tratar el cáncer de ovario. Para el cáncer en estadio I y II, se puede utilizar la cirugía laparoscópica (por ojo de cerradura), pero es posible que no se encuentren metástasis. Para el cáncer avanzado, no se utiliza la laparoscopia, ya que la reducción de metástasis requiere acceso a toda la cavidad peritoneal. Dependiendo de la extensión del cáncer, los procedimientos pueden incluir una salpingooforectomía bilateral, biopsias en todo el peritoneo y el sistema linfático abdominal, omentectomía , esplenectomía , resección intestinal , extirpación o resección del diafragma, apendicectomía o incluso una exenteración pélvica posterior . [29]
Para estadificar completamente el cáncer de ovario, se puede incluir la linfadenectomía en la cirugía. Sin embargo, no ha ofrecido beneficios en términos de supervivencia ni en el HGSOC [103] ni en el LGSOC. [104] Esto es particularmente importante en los tumores de células germinales porque con frecuencia hacen metástasis en los ganglios linfáticos cercanos. [26]
Si el cáncer de ovario reaparece, la cirugía secundaria es a veces una opción de tratamiento. Esto depende de la facilidad con la que se pueda extirpar el tumor, de la cantidad de líquido que se haya acumulado en el abdomen y de la salud general. [28] La eficacia de esta cirugía depende de la técnica quirúrgica, de la completitud de la citorreducción y de la extensión de la enfermedad. [105] También puede ser útil en personas que se sometieron a su primera cirugía realizada por un médico generalista y en el cáncer de ovario epitelial. [31] La cirugía secundaria puede ser eficaz en los disgerminomas y los teratomas inmaduros. [32] La evidencia sugiere que la cirugía en el cáncer de ovario epitelial recurrente puede estar asociada con la prolongación de la vida en algunas mujeres con enfermedad sensible al platino. [106]
El principal efecto secundario de la ooforectomía en mujeres jóvenes es la menopausia temprana , que puede causar osteoporosis . Después de la cirugía, se puede considerar la terapia de reemplazo hormonal, especialmente en mujeres jóvenes. Esta terapia puede consistir en una combinación de estrógeno y progesterona, o estrógeno solo. El estrógeno solo es seguro después de la histerectomía; cuando el útero todavía está presente, el estrógeno sin oposición aumenta dramáticamente el riesgo de cáncer de endometrio . [28] La terapia de estrógeno después de la cirugía no cambia las tasas de supervivencia. [31] Las personas que se someten a una cirugía de cáncer de ovario generalmente son hospitalizadas después durante 3 a 4 días y pasan alrededor de un mes recuperándose en casa. [107] Los resultados de la cirugía son mejores en los hospitales que realizan una gran cantidad de cirugías de cáncer de ovario. [29]
No está claro si la laparoscopia o la laparotomía son mejores o peores para el cáncer de ovario en estadio I de la FIGO. [108] Tampoco hay una diferencia aparente entre la histerectomía abdominal total y la histerectomía supracervical para los cánceres avanzados. Aproximadamente el 2,8 % de las personas que se someten a una primera cirugía para el cáncer de ovario avanzado mueren dentro de las dos semanas posteriores a la cirugía ( tasa de mortalidad perioperatoria del 2,8 % ). [31] Las cirugías más agresivas se asocian con mejores resultados en el cáncer de ovario avanzado (estadio III o IV). [29]
La quimioterapia ha sido un estándar general de atención para el cáncer de ovario durante décadas, aunque con protocolos variables. La quimioterapia se utiliza después de la cirugía para tratar cualquier enfermedad residual, si es apropiado. En algunos casos, puede haber una razón para realizar quimioterapia primero, seguida de cirugía. Esto se llama "quimioterapia neoadyuvante", y es común cuando un tumor no se puede extirpar por completo o reducir de manera óptima mediante cirugía. Aunque no se ha demostrado que aumente la supervivencia, puede reducir el riesgo de complicaciones después de la cirugía. Si se realiza una salpingooforectomía unilateral u otra cirugía, se puede administrar quimioterapia adicional, llamada "quimioterapia adyuvante". [28] [31] La quimioterapia adyuvante se utiliza en el cáncer en estadio 1 típicamente si el tumor es de un grado histológico alto (grado 3) o el subestadio más alto (estadio 1c), siempre que el cáncer se haya estadificado de manera óptima durante la cirugía. [31] [95] El bevacizumab se puede utilizar como quimioterapia adyuvante si el tumor no se extirpa por completo durante la cirugía o si el cáncer está en estadio IV; Puede prolongar la supervivencia libre de progresión, pero no se ha demostrado que prolongue la supervivencia general. [31] La quimioterapia es curativa en aproximadamente el 20% de los cánceres de ovario avanzados; [29] es más a menudo curativa con tumores de células germinales malignos que con tumores epiteliales. [32] Se ha descubierto que la quimioterapia adyuvante mejora la supervivencia y reduce el riesgo de recurrencia del cáncer de ovario en comparación con ninguna terapia adyuvante en mujeres con cáncer de ovario epitelial en etapa temprana. [109]
La quimioterapia en el cáncer de ovario generalmente consiste en platinos , un grupo de medicamentos basados en platino , combinados con no platinos. [110] Los medicamentos basados en platino se han utilizado desde 1980. Las terapias comunes pueden incluir paclitaxel , cisplatino , topotecán , doxorrubicina, epirrubicina y gemcitabina . El carboplatino generalmente se administra en combinación con paclitaxel o docetaxel ; la combinación típica es carboplatino con paclitaxel. [28] [31] El carboplatino es superior al cisplatino en que es menos tóxico y tiene menos efectos secundarios, lo que generalmente permite una mejor calidad de vida en comparación, aunque ambos son igualmente efectivos. [31] No se ha encontrado que los regímenes de tres medicamentos sean más efectivos, [28] y los platinos solos o los no platinos solos son menos efectivos que los platinos y no platinos en combinación. [31] La quimioterapia basada en platino tiene un pequeño beneficio en comparación con la terapia sin platino. [111] Las combinaciones de platino pueden ofrecer una mejor supervivencia que la quimioterapia con platino solo. En personas con cáncer de ovario recidivante, la evidencia sugiere que topotecan tiene un efecto similar en la supervivencia general que paclitaxel y topotecan más talidomida, mientras que es superior al treosulfán y no tan eficaz como la doxorrubicina liposomal pegilada en personas sensibles al platino. [112]
La quimioterapia se puede administrar por vía intravenosa o en la cavidad peritoneal . [26] Aunque la quimioterapia intraperitoneal se asocia con una mayor supervivencia sin progresión y una mayor supervivencia general, también causa más efectos secundarios adversos que la quimioterapia intravenosa. [31] Se utiliza principalmente cuando el cáncer se ha reducido de forma óptima. La quimioterapia intraperitoneal puede ser muy eficaz porque el cáncer de ovario se propaga principalmente dentro de la cavidad peritoneal y, de esta manera, dosis más altas de los medicamentos pueden llegar a los tumores. [29]
La quimioterapia puede causar anemia ; se ha descubierto que el hierro intravenoso es más eficaz que los suplementos de hierro orales para reducir la necesidad de transfusiones de sangre . [31] Los ciclos típicos de tratamiento implican un tratamiento cada 3 semanas, repetido durante 6 semanas o más. [113] Menos de 6 semanas (ciclos) de tratamiento es menos eficaz que 6 semanas o más. [31] Las neoplasias malignas de células germinales se tratan de manera diferente a otros cánceres de ovario: se utiliza un régimen de bleomicina , etopósido y cisplatino (BEP) con 5 días de quimioterapia administrada cada 3 semanas durante 3 a 4 ciclos. [26] [32] No se ha demostrado que la quimioterapia para los tumores de células germinales cause amenorrea , infertilidad, defectos de nacimiento o aborto espontáneo . [32] No se ha demostrado que la quimioterapia de mantenimiento sea eficaz. [31]
En personas con mutaciones BRCA , la quimioterapia con platino es más eficaz. [28] Los tumores de células germinales y los tumores malignos del cordón sexual/estromal se tratan con quimioterapia, aunque los disgerminomas y los tumores del cordón sexual no suelen responder muy bien. [26] [33]
Si el cáncer de ovario reaparece, se considera parcialmente sensible al platino o resistente al platino, según el tiempo transcurrido desde la última recurrencia tratada con platino: los cánceres parcialmente sensibles al platino reaparecieron entre 6 y 12 meses después del último tratamiento, y los cánceres resistentes al platino tienen un intervalo de menos de 6 meses. Se puede administrar quimioterapia de segunda línea después de que el cáncer se vuelva sintomático porque no se observa diferencia en la supervivencia entre el tratamiento de recurrencias asintomáticas (CA-125 elevadas) y sintomáticas. [ cita médica necesaria ]
Para los tumores sensibles al platino, los platinos son los fármacos de elección para la quimioterapia de segunda línea, en combinación con otros agentes citotóxicos. Los regímenes incluyen carboplatino combinado con doxorrubicina liposomal pegilada , gemcitabina o paclitaxel . [26] La terapia doble con carboplatino se puede combinar con paclitaxel para aumentar la eficacia en algunos casos. Otra posible terapia adyuvante para las recurrencias sensibles al platino es el olaparib , que puede mejorar la supervivencia libre de progresión , pero no se ha demostrado que mejore la supervivencia general . [31] ( Olaparib , un inhibidor de PARP , fue aprobado por la FDA de EE. UU. para su uso en el cáncer de ovario asociado a BRCA que había sido tratado previamente con quimioterapia. [114] [115] ) Para los tumores de células germinales recurrentes, 4 ciclos adicionales de quimioterapia BEP es el tratamiento de primera línea para aquellos que han sido tratados con cirugía o platinos.
Si se determina que el tumor es resistente al platino, se puede utilizar vincristina , dactinomicina y ciclofosfamida (VAC) o alguna combinación de paclitaxel, gemcitabina y oxaliplatino como terapia de segunda línea. [32]
En el caso de los tumores resistentes al platino, no existen opciones de quimioterapia de alta eficacia. Los regímenes de un solo fármaco (doxorrubicina o topotecán ) no tienen altas tasas de respuesta, [28] pero en algunos casos se utilizan regímenes de un solo fármaco de topotecán, doxorrubicina liposomal pegilada o gemcitabina. [26] [31] El topotecán no se puede utilizar en personas con obstrucción intestinal. El paclitaxel utilizado solo es otro régimen posible, o puede combinarse con doxorrubicina liposomal, gemcitabina, cisplatino, topotecán, etopósido o ciclofosfamida . [113] (Véase también Cuidados paliativos a continuación).
Se están desarrollando nuevos agentes para inhibir el desarrollo de nuevos vasos sanguíneos (angiogénesis) en mujeres con cáncer de ovario que desarrollan resistencia a los fármacos de quimioterapia. A partir de 2023, parecería que estos tratamientos podrían tener un papel, pero debido a la carga adicional que supone el tratamiento y al coste de los tratamientos de mantenimiento, es necesario considerar cuidadosamente los riesgos y los beneficios. [116]
Novocure patrocinó un ensayo de fase 2 que demuestra la eficacia de los campos de tratamiento de tumores en el carcinoma de ovario recurrente resistente al platino, junto con quimioterapia semanal con paclitaxel. [45]
Los disgerminomas se tratan de manera más eficaz con radiación, [33] aunque esta puede causar infertilidad y se está eliminando gradualmente en favor de la quimioterapia. [26] La radioterapia no mejora la supervivencia en personas con tumores bien diferenciados. [26]
En los cánceres en estadio 1c y 2, se utiliza radioterapia después de la cirugía si existe la posibilidad de que quede enfermedad residual en la pelvis pero el abdomen está libre de cáncer. La radioterapia también se puede utilizar en los cuidados paliativos de los cánceres avanzados. Un ciclo típico de radioterapia para el cáncer de ovario es de 5 días a la semana durante 3 a 4 semanas.
Los efectos secundarios comunes de la radioterapia incluyen diarrea, estreñimiento y micción frecuente. [117] Los efectos tardíos de la radioterapia (y las tasas de ocurrencia) incluyen osteonecrosis (8-20%), ulceración de vejiga (<3%), estenosis vaginal (>2,5%) y plexopatía lumbosacra irreversible . [118]
A pesar de que el 60% de los tumores de ovario tienen receptores de estrógeno , el cáncer de ovario rara vez responde a los tratamientos hormonales. Una revisión Cochrane encontró una falta de evidencia sobre los efectos del tamoxifeno en personas con cáncer de ovario recidivante. [119] El estrógeno por sí solo no tiene un efecto sobre el cáncer, y el tamoxifeno y el letrozol rara vez son efectivos. [28] "Algunas mujeres con cáncer de ovario de malignidad limítrofe y cáncer de ovario del estroma pueden recibir terapia hormonal". [96]
La inmunoterapia es un tema de investigación actual en el cáncer de ovario. En algunos casos, el fármaco bevacizumab , aunque todavía es un tema de investigación activa, se utiliza para tratar el cáncer avanzado junto con la quimioterapia. [95] Se ha aprobado para este uso en la Unión Europea. [120]
El seguimiento específico depende, por ejemplo, del tipo y estadio del cáncer de ovario, del tratamiento y de la presencia de síntomas. Por lo general, se programa una cita de control cada 2 o 3 meses al principio, seguida de dos veces al año durante un máximo de 5 años. [121] En el caso de los cánceres de ovario epiteliales, la prueba más común en el seguimiento es el nivel de CA-125. Sin embargo, el tratamiento basado únicamente en niveles elevados de CA-125 y no en síntomas puede aumentar los efectos secundarios sin prolongar la vida, por lo que se puede analizar la implicación del resultado de una prueba de CA-125 antes de realizarla. [122] La recomendación a partir de 2014 es que puede haber cáncer recurrente si el nivel de CA-125 es el doble de lo normal. [28] El tratamiento de una recurrencia detectada por CA-125 no mejora la supervivencia. [31]
En el caso de las mujeres con tumores de células germinales, las pruebas de seguimiento generalmente incluyen alfafetoproteína (AFP) y/o gonadotropina coriónica humana . En el caso de las mujeres con cánceres del estroma , a veces son útiles las pruebas de hormonas como el estrógeno, la testosterona y la inhibina . [122] La inhibina también puede ser útil para controlar el progreso de los tumores de los cordones sexuales, junto con la sustancia inhibidora mülleriana . La AFP también se puede utilizar para controlar los tumores de Sertoli-Leydig. [26] En los disgerminomas, se utilizan la lactato deshidrogenasa y sus dos isoenzimas (LDH-1 y LDH-2) para comprobar la recurrencia. [32]
Las mujeres con cáncer de ovario pueden no necesitar imágenes de vigilancia de rutina para controlar el cáncer a menos que aparezcan nuevos síntomas o los marcadores tumorales comiencen a aumentar. [123] Las imágenes sin estas indicaciones se desaconsejan porque es poco probable que detecten una recurrencia, mejoren la supervivencia y porque tienen sus propios costos y efectos secundarios. [123] Sin embargo, se pueden utilizar imágenes de TC si se desea, aunque esto no es común. [28] Si un tumor se puede visualizar fácilmente, se pueden utilizar imágenes para controlar el progreso del tratamiento. [124]
Los cuidados paliativos se centran en aliviar los síntomas y aumentar o mantener la calidad de vida. El objetivo de este tipo de tratamiento no es curar el cáncer, sino hacer que la mujer se sienta más cómoda viviendo con un cáncer que no se puede curar. Se ha recomendado como parte del plan de tratamiento para cualquier persona con cáncer de ovario avanzado o pacientes con síntomas significativos. [125] En los casos refractarios al platino y resistentes al platino, otra quimioterapia paliativa es el tratamiento principal. [29] [96]
Los cuidados paliativos pueden implicar el tratamiento de los síntomas y complicaciones del cáncer, incluyendo dolor, náuseas, estreñimiento, ascitis, obstrucción intestinal , edema , derrame pleural y mucositis . Especialmente si el cáncer avanza y se vuelve incurable, el tratamiento de los síntomas se convierte en uno de los principales objetivos de la terapia. Los cuidados paliativos también pueden implicar ayudar con la toma de decisiones, como si los cuidados paliativos son apropiados o no, y el lugar preferido para el paciente en los cuidados al final de su vida. [31]
La obstrucción intestinal se puede tratar con cirugía paliativa ( colostomía , ileostomía o bypass interno) o medicamentos, pero se ha demostrado que la cirugía aumenta el tiempo de supervivencia. [28] [31] La cirugía paliativa puede provocar síndrome del intestino corto , fístula enterocutánea o reobstrucción; o puede no ser posible debido a la extensión de la obstrucción. [29] Otros tratamientos de las complicaciones pueden incluir nutrición parenteral total , una dieta baja en residuos , gastrostomía paliativa y control adecuado del dolor. [28] La obstrucción intestinal también se puede tratar con octreotida cuando la cirugía paliativa no es una opción. El cáncer también puede bloquear los uréteres , lo que se puede aliviar con una nefrostomía o un stent ureteral . La ascitis se puede aliviar con paracentesis repetidas o la colocación de un drenaje para aumentar la comodidad. [126] Los derrames pleurales se pueden tratar de manera similar, con toracocentesis repetidas , pleurodesis o colocación de un drenaje. [29]
La radioterapia se puede utilizar como parte de los cuidados paliativos del cáncer de ovario avanzado, ya que puede ayudar a reducir el tamaño de los tumores que están causando síntomas. [96] La radioterapia paliativa suele durar solo unos pocos tratamientos, un curso de terapia mucho más corto que la radioterapia no paliativa. [117] También se utiliza para la paliación de tumores de células germinales resistentes a la quimioterapia. [32]
El cáncer de ovario tiene un efecto significativo en la calidad de vida , la salud psicológica y el bienestar. Existen intervenciones disponibles para ayudar con las necesidades y el apoyo social. Muchas sobrevivientes de cáncer de ovario informan una buena calidad de vida y optimismo . Otras informaron un "cambio espiritual" que las ayudó a encontrar significado durante su experiencia. Otras han descrito su pérdida de fe después de su diagnóstico de cáncer de ovario. Las que han pasado por el tratamiento a veces experimentan aislamiento social , pero se benefician de tener relaciones con otras sobrevivientes. Algunas personas que han expresado su incapacidad para cuidar de su familia han descrito frustración y culpa . [127]
La pérdida de cabello , la extirpación de ovarios y otras estructuras reproductivas y las cicatrices pueden provocar cambios en la autoestima y la imagen corporal . Una vez que el cabello crece, se produce una cierta mejoría. Pueden surgir problemas sexuales. La extirpación de los ovarios provoca una menopausia inducida quirúrgicamente que puede provocar relaciones sexuales dolorosas , sequedad vaginal, pérdida del deseo sexual y cansancio. Aunque el pronóstico es mejor para las supervivientes más jóvenes, el impacto en la sexualidad puede ser considerable. [127]
La ansiedad , la depresión y la angustia están presentes en las sobrevivientes del cáncer de ovario en tasas más altas que en la población general. [127] [128] Los mismos problemas psicosociales pueden desarrollarse en los miembros de la familia. Los efectos emocionales pueden incluir miedo a la muerte , tristeza , problemas de memoria y dificultad para concentrarse. Cuando las personas adoptaron optimismo al comienzo de su tratamiento, tuvieron menos probabilidades de desarrollar angustia. Las personas que tienen miedo de que el cáncer vuelva a aparecer pueden tener dificultad para expresar alegría incluso cuando están libres de enfermedad. Cuantos más tratamientos se someta una mujer, más probable es que se exprese la pérdida de esperanza . Las mujeres a menudo pueden afrontar y reducir los efectos psicosociales negativos mediante una serie de estrategias. Actividades como viajar, pasar más tiempo con la familia y los amigos, ignorar las estadísticas , llevar un diario y aumentar la participación en eventos de base espiritual son adaptativas. [127]
Las mujeres con cáncer de ovario también pueden experimentar dificultades con su dieta y corren el riesgo de sufrir desnutrición. [129]
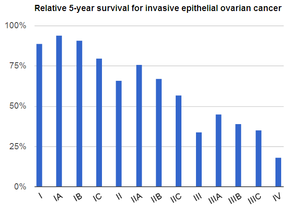
El cáncer de ovario suele tener un pronóstico relativamente malo . Es desproporcionadamente mortal porque no existe una detección temprana clara ni pruebas de detección, lo que significa que la mayoría de los casos no se diagnostican hasta que han alcanzado etapas avanzadas. [123] [28]
El cáncer de ovario hace metástasis en las primeras etapas de su desarrollo, a menudo antes de que se lo haya diagnosticado. Los tumores de alto grado hacen metástasis con mayor facilidad que los de bajo grado. Por lo general, las células tumorales comienzan a hacer metástasis al crecer en la cavidad peritoneal. [26] Más del 60 % de las mujeres que presentan cáncer de ovario tienen cáncer en estadio III o IV, cuando ya se ha propagado más allá de los ovarios. Los cánceres de ovario liberan células en el líquido natural dentro de la cavidad abdominal. Estas células luego pueden implantarse en otras estructuras abdominales (peritoneales), incluido el útero, la vejiga urinaria , el intestino , el revestimiento de la pared intestinal y el epiplón , formando nuevos crecimientos tumorales incluso antes de que se sospeche la presencia de cáncer.
La tasa de supervivencia a cinco años para todas las etapas del cáncer de ovario es del 46%; la tasa de supervivencia a un año es del 72% y la tasa de supervivencia a diez años es del 35%. [131] Para los casos en los que se realiza un diagnóstico temprano en la enfermedad, cuando el cáncer todavía está confinado al sitio primario, la tasa de supervivencia a cinco años es del 92,7%. [132] Alrededor del 70% de las mujeres con enfermedad avanzada responden al tratamiento inicial, la mayoría de las cuales alcanzan la remisión completa, pero la mitad de estas mujeres experimentan una recurrencia entre 1 y 4 años después del tratamiento. [26] La metástasis cerebral es más común en el cáncer en etapa III/IV, pero aún puede ocurrir en cánceres en etapa I/II. Las personas con metástasis cerebrales sobreviven una mediana de 8,2 meses, aunque la cirugía, la quimioterapia y la radioterapia cerebral completa pueden mejorar la supervivencia. [31]
La supervivencia del cáncer de ovario varía significativamente según el subtipo. Los disgerminomas tienen un pronóstico muy favorable. En las primeras etapas, tienen una tasa de supervivencia a cinco años del 96,9%. [33] Alrededor de dos tercios de los disgerminomas se diagnostican en la etapa I. [32] Los disgerminomas en etapa III tienen una supervivencia a cinco años del 61%; cuando se tratan con quimioterapia BEP después de una extirpación quirúrgica incompleta, los disgerminomas tienen una tasa de supervivencia a dos años del 95%. Las neoplasias malignas del estroma de los cordones sexuales también tienen un pronóstico favorable; debido a que crecen lentamente, incluso aquellas con enfermedad metastásica pueden sobrevivir una década o más. [26] Los tumores de bajo potencial maligno generalmente solo tienen un mal pronóstico cuando se encuentran implantes tumorales invasivos en la cavidad peritoneal. [29]
Las complicaciones del cáncer de ovario pueden incluir la propagación del cáncer a otros órganos, la pérdida progresiva de la función de varios órganos, ascitis y obstrucciones intestinales, que pueden ser fatales. Las obstrucciones intestinales en múltiples sitios son la causa inmediata de muerte más común. [28] La obstrucción intestinal en el cáncer de ovario puede ser una obstrucción verdadera, donde el tumor bloquea el lumen intestinal , o una pseudoobstrucción, cuando el tumor impide el peristaltismo normal . [133] La acumulación continua de ascitis se puede tratar colocando un drenaje que pueda autodrenarse. [28]
Existen varios factores pronósticos en el cáncer de ovario. Los factores pronósticos positivos (aquellos que indican mejores posibilidades de supervivencia) incluyen la ausencia de enfermedad residual después de la cirugía (estadio III/IV), la resección macroscópica completa (estadio IV), las mutaciones BRCA2, la edad joven (menos de 45 años), el tipo no seroso, el grado histológico bajo, el estadio temprano, la coocurrencia con cáncer de endometrio y los niveles bajos de CA-125. Hay evidencia contradictoria sobre el BRCA1 como factor pronóstico. Por el contrario, los factores pronósticos negativos (aquellos que indican una peor posibilidad de supervivencia) incluyen la ruptura de la cápsula ovárica durante la cirugía, la edad avanzada (más de 45 años), el tipo mucinoso, el estadio IV, el grado histológico alto, el tipo de células claras, la afectación del abdomen superior, los niveles altos de CA-125, la presencia de células tumorales en la sangre y la elevación de la ciclooxigenasa-2 . [31]
La expresión de varios ARNm también puede ser pronóstica para el cáncer de ovario. Los altos niveles de Drosha y Dicer se asocian con una mejor supervivencia, mientras que los altos niveles de let-7b, HIF1A , EphA1 y poli(ADP-ribosa) polimerasa se asocian con una peor supervivencia. Los cánceres que son positivos para WT1 conllevan un peor pronóstico; los cánceres positivos para el receptor de estrógeno tienen un mejor pronóstico. [31]
A continuación se presentan las tasas generales de supervivencia a cinco años para todos los tipos de cáncer de ovario por estadio y grado histológico: [26]
Las tasas de supervivencia que se indican a continuación corresponden a los diferentes tipos de cáncer de ovario, según la Sociedad Estadounidense del Cáncer . [130] Provienen del Instituto Nacional del Cáncer , SEER , y se basan en pacientes diagnosticadas entre 2004 y 2010.
El cáncer de ovario recurre con frecuencia después del tratamiento. En general, en un período de 5 años, el 20% de los cánceres en estadio I y II recurren. La mayoría de las recurrencias se dan en el abdomen. [29] Si ocurre una recurrencia en una enfermedad avanzada, generalmente ocurre dentro de los 18 meses del tratamiento inicial (18 meses de supervivencia libre de progresión ). Las recurrencias se pueden tratar, pero el intervalo libre de enfermedad tiende a acortarse y la quimiorresistencia aumenta con cada recurrencia. [28] Cuando un disgerminoma recurre, es más probable que recurra dentro de un año del diagnóstico, y otros tumores malignos de células germinales recurren dentro de los 2 años el 90% de las veces. Los tumores de células germinales distintos de los disgerminomas tienen un mal pronóstico cuando recurren, con una tasa de supervivencia a largo plazo del 10%. [32] Los tumores de bajo potencial maligno rara vez recurren, incluso cuando la cirugía para preservar la fertilidad es el tratamiento de elección. El 15% de los tumores LMP recaen después de una cirugía unilateral en el ovario previamente no afectado y, por lo general, se tratan fácilmente con cirugía. Los tumores más avanzados pueden tardar hasta 20 años en recaer, si es que lo hacen, y solo se tratan con cirugía a menos que el tumor haya cambiado sus características histológicas o haya crecido muy rápidamente. En estos casos, y cuando hay ascitis significativa, también se puede utilizar quimioterapia. La recaída generalmente se indica por el aumento de los niveles de CA-125 y luego progresa a una recaída sintomática en un plazo de 2 a 6 meses. [29] Los tumores recurrentes del estroma de los cordones sexuales generalmente no responden al tratamiento, pero no son agresivos. [32]
Es el cáncer ginecológico más mortal. [29]
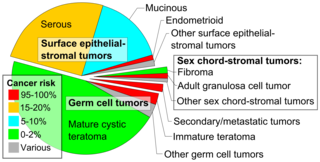
A nivel mundial, en 2018, la incidencia de cáncer de ovario fue de 6,6 por 100 000 y la mortalidad fue de 3,9. [136] A nivel mundial, alrededor de 160 000 personas murieron de cáncer de ovario en 2010. Esto fue un aumento de 113 000 en 1990. [137] El número de casos nuevos por año en Europa es de aproximadamente 5 a 15 por 100 000 mujeres. [31] En Europa, Lituania , Letonia , Irlanda , Eslovaquia y la República Checa tienen las incidencias más altas de cáncer de ovario, mientras que Portugal y Chipre tienen las incidencias más bajas. [31] En 2008, la tasa de supervivencia a cinco años fue del 44%. Esto ha aumentado desde 1977, cuando la tasa de supervivencia fue del 36%. [127]


En 2022, en Estados Unidos, se diagnosticaron aproximadamente 19.880 casos nuevos y 12.810 mujeres murieron por cáncer de ovario. [139] La tasa de supervivencia relativa a 5 años es del 49,7 %. [140] Alrededor del 57 % de los casos han hecho metástasis en el momento del diagnóstico. [140]
En 2014, se realizaron más de 220 000 diagnósticos de cáncer epitelial de ovario al año. [28] El riesgo general de por vida en los EE. UU. es de alrededor del 1,6 % [26] [31] En los EE. UU., el cáncer de ovario afecta al 1,3-1,4 % y es la causa de muerte de aproximadamente el 1 % de las mujeres. [29] [141] En los Estados Unidos, también es el quinto cáncer más común en mujeres, pero la cuarta causa más común de muerte por cáncer. [31] Esta disminución lo convirtió en el noveno cáncer más común en mujeres. [29]
Los riesgos de desarrollar tipos específicos de cáncer de ovario varían. Los tumores de células germinales y los tumores del estroma de los cordones sexuales son menos comunes que los tumores epiteliales. El número de casos nuevos por año en los EE. UU. es de 0,4 por cada 100 000 mujeres y 0,2 por cada 100 000 mujeres, respectivamente. En las mujeres jóvenes, los tumores del estroma de los cordones sexuales y los tumores de células germinales representan el 1 % del cáncer de ovario en general. [32] El cáncer de ovario representa aproximadamente el 4 % de los cánceres diagnosticados en mujeres. [31]
Es el quinto cáncer más común en mujeres del Reino Unido (se diagnosticaron alrededor de 7100 en 2011) y la quinta causa más común de muerte por cáncer en mujeres (alrededor de 4300 murieron en 2012). [142] [31] [34] La tasa de incidencia en toda la población del Reino Unido es de 21,6 por 100 000.
En 2014, en el Reino Unido se diagnosticaron aproximadamente entre 7000 y 7100 casos al año y se produjeron 4200 muertes. [28] [34] Un artículo de The Times de 2022 estimó que en Gran Bretaña se producen 7500 casos nuevos al año. [143] Los primeros síntomas suelen confundirse con afecciones comunes como la cistitis o el síndrome del intestino irritable, y alrededor del 40 por ciento de las mujeres del Reino Unido creen erróneamente que las pruebas de detección del cáncer de cuello uterino detectan el cáncer de ovario, lo que supone un aumento con respecto al 30 por ciento en 2016. [143] Las mujeres judías asquenazíes son portadoras de alelos BRCA mutados cinco veces más a menudo que el resto de la población, lo que les da un mayor riesgo de desarrollar cáncer de ovario. [28]
Las mujeres de raza negra tienen el doble de riesgo de padecer tumores del estroma de los cordones sexuales que las mujeres de otras razas. [32] La prevalencia más alta se observa en mujeres caucásicas e hispanas, seguidas de mujeres afroamericanas y asiáticas. [136] La mortalidad más alta por cáncer de ovario se observa en mujeres afroamericanas. [136]
En los EE. UU., la tasa de incidencia en mujeres mayores de 50 años es de aproximadamente 33 por 100 000. [144] La tasa de cáncer de ovario entre 1993 y 2008 disminuyó en mujeres de la cohorte de edad de 40 a 49 años y en la cohorte de edad de 50 a 64 años. [28] El cáncer de ovario se diagnostica con mayor frecuencia después de la menopausia, [34] entre los 60 y los 64 años. El noventa por ciento del cáncer de ovario se presenta en mujeres mayores de 45 años y el 80 % en mujeres mayores de 50 años . [31] Las mujeres mayores tienen más probabilidades de presentar cáncer de ovario avanzado. [20]
Los tumores de células germinales malignos son el tipo de cáncer de ovario que se presenta con mayor probabilidad durante el embarazo . Por lo general, se diagnostican cuando se encuentra una masa anexial en el examen (en el 1-2% de todos los embarazos), se observa un tumor en la ecografía o el nivel de alfa-fetoproteína de los padres está elevado. Los quistes dermoides y los disgerminomas son los tumores de células germinales más comunes durante el embarazo. Es poco probable que los tumores de células germinales diagnosticados durante el embarazo hayan hecho metástasis y se pueden tratar con cirugía y, en algunos casos, quimioterapia, que conlleva el riesgo de defectos congénitos. Los tumores del saco vitelino y los teratomas inmaduros crecen particularmente rápido y generalmente se tratan con quimioterapia incluso durante el embarazo; sin embargo, los disgerminomas que se han reducido de manera óptima se pueden tratar después del parto. [32]
Se han descrito tumores ováricos en yeguas equinas . Los tipos de tumores descritos incluyen teratoma, [145] [146] cistadenocarcinoma , [147] y, en particular , tumor de células de la granulosa . [148] [149] [150] [151] [152] [ citas excesivas ]
Se está desarrollando un método de detección mediante histeroscopia para obtener muestras de células para examen histológico. Es similar al frotis de Papanicolaou que se utiliza actualmente para detectar el cáncer de cuello uterino. [153] El ensayo colaborativo del Reino Unido sobre detección del cáncer de ovario está probando una técnica de detección que combina análisis de sangre de CA-125 con ecografía transvaginal. [28] Otros estudios sugieren que este procedimiento de detección puede ser eficaz. [120] Aunque los resultados publicados en 2015 no fueron concluyentes, hubo cierta evidencia de que la detección puede salvar vidas a largo plazo. [154] Como resultado, el ensayo se ha ampliado y se publicarán los resultados definitivos a finales de 2019. Un problema importante con la detección es que no se observa una progresión clara de la enfermedad del estadio I (no invasivo) al estadio III (invasivo), y puede que no sea posible encontrar cánceres antes de que alcancen el estadio III. Otro problema es que los métodos de detección tienden a encontrar demasiadas lesiones sospechosas, la mayoría de las cuales no son cáncer, pero la malignidad solo se puede evaluar con cirugía. [28] El método ROCA combinado con la ecografía transvaginal se está investigando en mujeres de alto riesgo para determinar si es un método de detección viable. También se está investigando en mujeres de riesgo normal, ya que ha demostrado ser prometedor en la población en general. [29] También se están realizando estudios para determinar si la detección ayuda a detectar el cáncer de forma más temprana en personas con mutaciones BRCA. [120]
Investigadores de BGI Genomics y la Universidad de Fudan han descubierto hallazgos significativos sobre el cáncer de ovario (VO) en pacientes chinas, revelando una variante única de RAD51D que puede servir como objetivo terapéutico. [12] Publicado en JCO Global Oncology , el estudio identificó una variante enriquecida de RAD51D asociada con la promoción del crecimiento tumoral. En particular, se descubrió que la variante RAD51D K91fs aumenta la sensibilidad a los inhibidores de PARP, como olaparib y niraparib, lo que ofrece nuevas vías de tratamiento.
También se están realizando investigaciones sobre diversos factores de pronóstico del cáncer de ovario. Investigaciones recientes muestran que la trombocitosis predice una menor supervivencia y un cáncer en estadio avanzado. [28] Las investigaciones en curso también están investigando los beneficios de la cirugía para el cáncer de ovario recurrente. [120]
Si bien es un área activa de investigación, a partir de 2018 no hay buena evidencia de que la inmunoterapia sea efectiva para el cáncer de ovario. [155] Sin embargo, los ensayos del anticuerpo e inhibidor de VEGF bevacizumab , que puede retardar el crecimiento de nuevos vasos sanguíneos en el cáncer, han mostrado resultados prometedores, especialmente en combinación con pazopanib , que también retarda el proceso de crecimiento de los vasos sanguíneos. El bevacizumab ha sido particularmente eficaz en estudios preliminares sobre el cáncer en estadio III y IV [28] y se ha citado por tener al menos un 15% de tasa de respuesta. [26] Se está investigando particularmente en cánceres de ovario mucinosos. [120]
Los inhibidores de mTOR fueron un tratamiento potencial muy investigado en los años 2000 y 2010, pero los efectos secundarios de estos fármacos (en particular la hiperglucemia y la hiperlipidemia ) no fueron bien tolerados y el beneficio en la supervivencia no se confirmó. Los inhibidores de la PI3 quinasa han sido de interés, pero tienden a ser altamente tóxicos y causan diarrea . Otro fármaco investigado es el selumetinib , un inhibidor de MAPK . Mejoró la supervivencia, pero no se correlacionó con ninguna mutación encontrada en los tumores. [28]
El bevacizumab también se puede combinar con quimioterapia con platino, una combinación que ha tenido resultados preliminares positivos en la SSP, pero resultados equívocos con respecto a la supervivencia general. Una desventaja de estos tratamientos es el perfil de efectos secundarios, que incluye presión arterial alta y proteinuria . El fármaco también puede exacerbar la enfermedad intestinal, lo que lleva a fístulas o perforación intestinal . Vintafolide , que consiste en un antifolato conjugado con vinblastina , también está en ensayos clínicos; puede resultar beneficioso porque los receptores de folato se sobreexpresan en muchos cánceres de ovario. [28] Otra inmunoterapia potencial es trastuzumab , que es activo contra tumores positivos para mutaciones Her2/neu. [26] También se están investigando otros inhibidores de la angiogénesis como posibles tratamientos del cáncer de ovario. Combretastatina y pazopanib se están investigando en combinación para el cáncer de ovario recurrente. Trebananib y tasquinimod son otros inhibidores de la angiogénesis que se están investigando. El anticuerpo monoclonal farletuzumab se está investigando como adyuvante a la quimioterapia tradicional. Otro tipo de inmunoterapia son las vacunas , incluida TroVax . [120]
Una alternativa a la quimioterapia BEP, un régimen de tres ciclos de carboplatino y etopósido , es un tema actual de investigación para las neoplasias malignas de células germinales. [32]
La quimioterapia intraperitoneal también ha sido objeto de investigación durante los años 2000 y 2010 por su potencial para administrar dosis más altas de agente citotóxico a los tumores. Los ensayos preliminares con cisplatino y paclitaxel han demostrado que no es bien tolerada, pero sí mejora la supervivencia, y se están investigando regímenes más tolerables. [28] Tanto el cisplatino como el paclitaxel se están investigando como agentes de quimioterapia intraperitoneal. También se está investigando un régimen de quimioterapia específico para cánceres de células claras poco frecuentes: irinotecán combinado con cisplatino. [120]
Los inhibidores de PARP también han demostrado ser prometedores en ensayos iniciales, en particular en personas con mutaciones del gen BRCA , ya que la proteína BRCA interactúa con la vía PARP. También se está estudiando en el cáncer de ovario recurrente en general, donde los estudios preliminares han demostrado una mayor supervivencia libre de progresión. En concreto, el olaparib ha demostrado una mayor supervivencia en comparación con la doxorrubicina, aunque este tratamiento todavía se está investigando. Aún no está claro qué biomarcadores predicen la respuesta a los inhibidores de PARP. [28] El rucaparib es otro inhibidor de PARP que se está investigando en el cáncer de ovario avanzado recurrente BRCA positivo y BRCA negativo. El niraparib es un inhibidor de PARP que se está probando en el cáncer de ovario recurrente BRCA positivo. [120]
Los inhibidores de la tirosina quinasa son otra clase de fármacos en investigación que pueden tener aplicaciones en el cáncer de ovario. También se ha demostrado que los inhibidores de la angiogénesis en el grupo de inhibidores de la tirosina quinasa del receptor , incluidos pazopanib , cediranib y nintedanib , aumentan la supervivencia libre de progresión (SLP), pero su beneficio para la supervivencia general no se ha investigado hasta 2015. [28] La investigación preliminar mostró que el cediranib combinado con platinos en el cáncer de ovario recurrente aumentó el tiempo hasta la segunda recurrencia en 3-4 meses y aumentó la supervivencia en 3 meses. [120] MK-1775 es un inhibidor de la tirosina quinasa que se está utilizando en combinación con paclitaxel y carboplatino en cánceres sensibles al platino con mutaciones p53. Se está investigando el nintedanib como una posible terapia en combinación con ciclofosfamida para personas con recurrencias. [120]
Los inhibidores de la histona desacetilasa (HDACi) son otra área de investigación.
Las terapias hormonales son un tema de investigación actual en el cáncer de ovario, en particular, el valor de ciertos medicamentos utilizados para tratar el cáncer de mama. Estos incluyen tamoxifeno , letrozol y anastrozol . Estudios preliminares han demostrado un beneficio del tamoxifeno en un pequeño número de personas con cáncer de ovario avanzado. El letrozol puede ayudar a retardar o detener el crecimiento del cáncer de ovario con receptores de estrógeno positivos. El anastrozol se está investigando en personas posmenopáusicas con cáncer con receptores de estrógeno positivos. [120]
También se están realizando investigaciones para mitigar los efectos secundarios del tratamiento del cáncer de ovario. La fibrosis por radiación, la formación de tejido cicatricial en una zona tratada con radiación, se puede aliviar con terapia de oxígeno hiperbárico , pero no se han completado las investigaciones en esta área. El tratamiento del cáncer de ovario también puede provocar que las personas experimenten dificultades psiquiátricas, incluida la depresión . Se están realizando investigaciones para determinar cómo el asesoramiento y la psicoterapia pueden ayudar a las personas que tienen cáncer de ovario durante el tratamiento. [120]
Existen algunos indicios de que la enfermedad inflamatoria pélvica puede estar asociada con el cáncer de ovario, especialmente en países no occidentales. Puede deberse al proceso inflamatorio presente en la enfermedad inflamatoria pélvica. [156]
Los ensayos clínicos son supervisados y financiados por organizaciones gubernamentales de los EE. UU. para probar las opciones de tratamiento y ver si son seguras y efectivas. Estas incluyen NIH Clinical Research Trials and You ( Institutos Nacionales de Salud ), [157] Learn About Clinical Trials ( Instituto Nacional del Cáncer ), [158] Search for Clinical Trials (Instituto Nacional del Cáncer), [159] ClinicalTrials.gov (Institutos Nacionales de Salud). [160] [93] Los ensayos clínicos también se llevan a cabo en Canadá. [161]
Investigaciones recientes sugieren que la trompa de Falopio distal fimbrial es el origen más probable del HGSC. Esto ha llevado al desarrollo de un plan de prevención para la población general: salpingectomía oportunista, la extirpación de ambas trompas de Falopio. ... La salpingectomía oportunista es prometedora para reducir el riesgo de OC y se puede implementar de manera segura en la mayoría de las prácticas de obstetricia y ginecología. La investigación continua y los estudios de seguimiento a largo plazo son esenciales para comprender completamente su impacto en la incidencia de CO y optimizar su implementación en la práctica clínica.