La metástasis es la propagación de un agente patógeno desde un sitio inicial o primario a un sitio diferente o secundario dentro del cuerpo del huésped; [1] el término se utiliza normalmente cuando se hace referencia a la metástasis de un tumor canceroso . [2] Los nuevos sitios patológicos son, pues, metástasis ( mets ). [3] [4] Generalmente se distingue de la invasión del cáncer , que es la extensión y penetración directa de las células cancerosas en los tejidos vecinos. [5]
El cáncer se produce después de que las células se modifican genéticamente para que proliferen rápida e indefinidamente. Esta proliferación descontrolada por mitosis produce un tumor primario heterogénico . Las células que constituyen el tumor eventualmente sufren metaplasia , seguida de displasia y luego anaplasia , lo que resulta en un fenotipo maligno . Esta neoplasia maligna permite la invasión de la circulación, seguida de la invasión a un segundo sitio para la tumorigénesis .
Algunas células cancerosas conocidas como células tumorales circulantes adquieren la capacidad de penetrar las paredes de los vasos linfáticos o sanguíneos , tras lo cual son capaces de circular por el torrente sanguíneo hacia otros sitios y tejidos del cuerpo. [6] Este proceso se conoce (respectivamente) como diseminación linfática o hematógena . Después de que las células tumorales se detienen en otro sitio, vuelven a penetrar el vaso o las paredes y continúan multiplicándose, formando eventualmente otro tumor clínicamente detectable. [ cita necesaria ] Este nuevo tumor se conoce como tumor metastásico (o secundario ). La metástasis es una de las características distintivas del cáncer , que lo distingue de los tumores benignos . [7] La mayoría de los cánceres pueden metastatizar, aunque en diversos grados. El carcinoma de células basales, por ejemplo, rara vez metastatiza. [7]
Cuando las células tumorales metastatizan, el nuevo tumor se denomina tumor secundario o metastásico , y sus células son similares a las del tumor original o primario . [8] Esto significa que si el cáncer de mama hace metástasis en los pulmones, el tumor secundario está formado por células mamarias anormales, no por células pulmonares anormales. El tumor en el pulmón se llama entonces cáncer de mama metastásico , no cáncer de pulmón . La metástasis es un elemento clave en los sistemas de estadificación del cáncer como el sistema de estadificación TNM , donde representa la "M". En la agrupación por estadios general , la metástasis coloca un cáncer en el estadio IV. Las posibilidades de tratamiento curativo se reducen considerablemente o, a menudo, se eliminan por completo cuando un cáncer ha hecho metástasis.

Inicialmente, los ganglios linfáticos cercanos se atacan temprano. [9] Los pulmones , el hígado , el cerebro y los huesos son los lugares más comunes de metástasis de tumores sólidos. [9]
Aunque el cáncer avanzado puede causar dolor , a menudo no es el primer síntoma.
Algunos pacientes, sin embargo, no presentan ningún síntoma. [9] Cuando el órgano sufre una enfermedad metastásica, comienza a encogerse hasta que sus ganglios linfáticos estallan o sufren lisis .
Los tumores metastásicos son muy comunes en las últimas etapas del cáncer. La propagación de metástasis puede ocurrir a través de la sangre o los linfáticos o por ambas vías. Los sitios más comunes de metástasis son los pulmones , el hígado , el cerebro y los huesos . [10]
Actualmente, se han propuesto tres teorías principales para explicar la vía metastásica del cáncer: la hipótesis de la transición epitelio-mesenquimal (EMT) y la transición mesenquimal-epitelial (MET) (1), la hipótesis de las células madre del cáncer (2) y la hipótesis de los macrófagos. Hipótesis del híbrido de fusión de células cancerosas (3). También se sugirieron algunas hipótesis nuevas, es decir, bajo el efecto de factores estresantes bioquímicos y/o físicos particulares, las células cancerosas pueden sufrir una expulsión nuclear con la subsiguiente absorción y fusión de macrófagos, con la formación de células cancerosas de fusión (CFC). [11] Comprender el enigma de la diseminación de las células cancerosas a sitios distantes, que representa más del 90% de las muertes relacionadas con el cáncer, requiere una investigación exhaustiva. Las preguntas clave pendientes giran en torno a la supervivencia y migración de las células cancerosas, como el núcleo, ya que enfrentan desafíos en el paso a través de válvulas capilares y fuerzas de corte hidrodinámicas en el sistema circulatorio, lo que convierte a las CTC en una fuente poco probable de metástasis. Además, comprender cómo las células cancerosas se adaptan al nicho metastásico y permanecen inactivas (latente del tumor) durante períodos prolongados presenta cuestiones difíciles que requieren más investigación. [12]
La metástasis implica una serie compleja de pasos en los que las células cancerosas abandonan el sitio del tumor original y migran a otras partes del cuerpo a través del torrente sanguíneo, el sistema linfático o por extensión directa. Para hacerlo, las células malignas se desprenden del tumor primario y se adhieren y degradan las proteínas que forman la matriz extracelular (MEC) circundante, que separa el tumor de los tejidos adyacentes. Al degradar estas proteínas, las células cancerosas pueden romper la MEC y escapar. La ubicación de las metástasis no siempre es aleatoria, ya que los diferentes tipos de cáncer tienden a extenderse a órganos y tejidos concretos a un ritmo mayor de lo esperado sólo por el azar estadístico. [13] El cáncer de mama, por ejemplo, tiende a metastatizar en los huesos y los pulmones. Esta especificidad parece estar mediada por moléculas señal solubles, como las quimiocinas [14] y el factor de crecimiento transformante beta . [15] El cuerpo resiste la metástasis mediante una variedad de mecanismos a través de las acciones de una clase de proteínas conocidas como supresores de metástasis , de las cuales se conocen alrededor de una docena. [dieciséis]
Las células humanas exhiben diferentes tipos de movimiento: motilidad colectiva , movimiento de tipo mesenquimatoso y movimiento ameboide . Las células cancerosas a menudo cambian de manera oportunista entre diferentes tipos de movimiento. Algunos investigadores del cáncer esperan encontrar tratamientos que puedan detener o al menos ralentizar la propagación del cáncer bloqueando de alguna manera algún paso necesario en uno o más tipos de movimiento. [17] [18]
Todos los pasos de la cascada metastásica implican una serie de procesos físicos. La migración celular requiere la generación de fuerzas, y cuando las células cancerosas transmigran a través de la vasculatura, esto requiere que se formen espacios físicos en los vasos sanguíneos. [19] Además de las fuerzas, la regulación de varios tipos de adherencias entre células y entre células y matrices es crucial durante la metástasis.
Los pasos metastásicos están regulados de manera crítica por varios tipos de células, incluidas las células de los vasos sanguíneos (células endoteliales), las células inmunes o las células estromales. El crecimiento de una nueva red de vasos sanguíneos, llamada angiogénesis tumoral , [20] es una característica crucial del cáncer. Por tanto, se ha sugerido que los inhibidores de la angiogénesis impedirían el crecimiento de metástasis. [7] Se ha demostrado que las células progenitoras endoteliales tienen una fuerte influencia en la metástasis y la angiogénesis. [21] [22] Las células progenitoras endoteliales son importantes en el crecimiento tumoral, la angiogénesis y la metástasis, y pueden marcarse utilizando el inhibidor de unión al ADN 1 (ID1). Este nuevo hallazgo significó que los investigadores obtuvieron la capacidad de rastrear células progenitoras endoteliales desde la médula ósea hasta la sangre y el estroma del tumor e incluso incorporarlas en la vasculatura del tumor. Las células progenitoras endoteliales incorporadas en la vasculatura tumoral sugieren que este tipo de células en el desarrollo de los vasos sanguíneos es importante en el entorno tumoral y en la metástasis. Además, la ablación de las células progenitoras endoteliales de la médula ósea puede provocar una disminución significativa del crecimiento tumoral y del desarrollo de la vasculatura. Por tanto, las células progenitoras endoteliales son importantes en la biología tumoral y presentan nuevas dianas terapéuticas. [23] El sistema inmunológico generalmente está desregulado en el cáncer y afecta muchas etapas de la progresión del tumor, incluida la metástasis.
La regulación epigenética también juega un papel importante en el crecimiento metastásico de células tumorales diseminadas. Las metástasis muestran alteraciones en las modificaciones de las histonas, como la metilación H3K4 y la metilación H3K9, en comparación con tumores primarios compatibles. [24] Estas modificaciones epigenéticas en las metástasis pueden permitir la proliferación y supervivencia de células tumorales diseminadas en órganos distantes. [25]
Un estudio reciente muestra que PKC-iota promueve la invasión de células de melanoma activando Vimentin durante la EMT. La inhibición o eliminación de PKC-iota dio como resultado un aumento en los niveles de E-cadherina y RhoA al tiempo que disminuyó la vimentina total, la vimentina fosforilada (S39) y Par6 en las células de melanoma metastásico. Estos resultados sugirieron que PKC-ι está involucrada en vías de señalización que regulan positivamente la EMT en el melanoma, por lo que estimula directamente la metástasis. [26]
Recientemente, una serie de experimentos de alto perfil sugiere que la cooptación de la comunicación cruzada intercelular mediada por vesículas de exosomas es un factor crítico involucrado en todos los pasos de la cascada de invasión-metástasis. [27]
La metástasis se produce por las siguientes cuatro rutas:
La propagación de una neoplasia maligna a las cavidades corporales puede ocurrir mediante la penetración de la superficie de los espacios peritoneal , pleural , pericárdico o subaracnoideo. Por ejemplo, los tumores de ovario pueden diseminarse por vía transperitoneal hasta la superficie del hígado.
La diseminación linfática permite el transporte de células tumorales a los ganglios linfáticos regionales cercanos al tumor primario y, en última instancia, a otras partes del cuerpo. Esto se llama afectación ganglionar, ganglios positivos o enfermedad regional. "Ganglios positivos" es un término que utilizarían los especialistas médicos para describir los ganglios linfáticos regionales que dieron positivo en pruebas de malignidad. Es una práctica médica común examinar mediante biopsia al menos un ganglio linfático cerca del sitio del tumor cuando se realiza una cirugía para examinar o extirpar un tumor. Este ganglio linfático se denomina entonces ganglio linfático centinela . La diseminación linfática es la ruta más común de metástasis inicial de los carcinomas . [7] Por el contrario, es poco común que un sarcoma metastatice a través de esta ruta. La diseminación localizada a los ganglios linfáticos regionales cerca del tumor primario normalmente no se cuenta como metástasis, aunque es un signo de un peor resultado . El sistema linfático eventualmente drena desde el conducto torácico y el conducto linfático derecho hacia el sistema venoso sistémico en el ángulo venoso y hacia las venas braquiocefálicas y, por lo tanto, estas células metastásicas también pueden eventualmente diseminarse a través de la ruta hematógena.

Esta es la ruta típica de metástasis de los sarcomas, pero también es la ruta preferida para ciertos tipos de carcinoma, como el carcinoma de células renales que se origina en el riñón y los carcinomas foliculares de la tiroides. Debido a sus paredes más delgadas, las venas son invadidas con mayor frecuencia que las arterias y las metástasis tienden a seguir el patrón del flujo venoso . Es decir, la diseminación hematógena a menudo sigue patrones distintos según la ubicación del tumor primario. Por ejemplo, el cáncer colorrectal se propaga principalmente a través de la vena porta hasta el hígado.
Algunos tumores, especialmente los carcinomas , pueden metastatizar a lo largo de los espacios canaliculares anatómicos. Estos espacios incluyen por ejemplo los conductos biliares, el sistema urinario, las vías respiratorias y el espacio subaracnoideo . El proceso es similar al de la propagación transcelómica. Sin embargo, a menudo no está claro si los tumores diagnosticados simultáneamente de un sistema canalicular son un proceso metastásico o en realidad tumores independientes causados por el mismo agente ( cancerización de campo ).
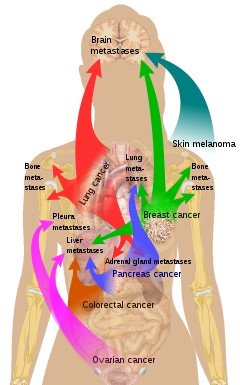
Existe una propensión a que ciertos tumores se desarrollen en órganos concretos. Esto fue discutido por primera vez como la teoría de la "semilla y el suelo" por Stephen Paget en 1889. [29] La propensión de una célula metastásica a propagarse a un órgano en particular se denomina "organotropismo". Por ejemplo, el cáncer de próstata suele metastatizar en los huesos. De manera similar, el cáncer de colon tiene tendencia a metastatizar en el hígado. El cáncer de estómago a menudo hace metástasis en el ovario en las mujeres, lo que se denomina tumor de Krukenberg .
Según la teoría de la "semilla y el suelo", a las células cancerosas les resulta difícil sobrevivir fuera de su región de origen, por lo que para poder metastatizar deben encontrar un lugar con características similares. [30] Por ejemplo, las células tumorales de mama, que recogen iones de calcio de la leche materna, hacen metástasis en el tejido óseo, donde pueden recoger iones de calcio del hueso. El melanoma maligno se propaga al cerebro, presumiblemente porque el tejido neural y los melanocitos surgen de la misma línea celular en el embrión . [31]
En 1928, James Ewing cuestionó la teoría de la "semilla y el suelo" y propuso que la metástasis ocurre puramente por rutas anatómicas y mecánicas. Esta hipótesis se ha utilizado recientemente para sugerir varias hipótesis sobre el ciclo de vida de las células tumorales circulantes (CTC) y postular que los patrones de propagación podrían comprenderse mejor a través de una perspectiva de "filtro y flujo". [32] Sin embargo, las evidencias contemporáneas indican que el tumor primario puede dictar metástasis organotrópicas al inducir la formación de nichos premetastásicos en sitios distantes, donde las células metastásicas entrantes pueden injertarse y colonizar. [27] Específicamente, se ha demostrado que las vesículas exosomáticas secretadas por los tumores albergan sitios premetastásicos, donde activan procesos prometastásicos como la angiogénesis y modifican la contextura inmune, a fin de fomentar un microambiente favorable para el crecimiento del tumor secundario. [27]
Se teoriza que la metástasis siempre coincide con un cáncer primario y, como tal, es un tumor que se originó a partir de una célula o células cancerosas de otra parte del cuerpo. Sin embargo, más del 10% de los pacientes que acuden a las unidades de oncología tendrán metástasis sin que se encuentre un tumor primario. En estos casos, los médicos se refieren al tumor primario como "desconocido" u "oculto" y se dice que el paciente tiene cáncer de origen primario desconocido (CUP) o tumores primarios desconocidos (UPT). [33] Se estima que el 3% de todos los cánceres son de origen primario desconocido. [34] Los estudios han demostrado que, si un simple interrogatorio no revela el origen del cáncer (toser sangre, "probablemente pulmón ", orinar sangre, "probablemente vejiga "), las imágenes complejas tampoco lo harán. [34] En algunos de estos casos, un tumor primario puede aparecer más tarde.
El uso de la inmunohistoquímica ha permitido a los patólogos dar identidad a muchas de estas metástasis. Sin embargo, las imágenes del área indicada sólo ocasionalmente revelan un tumor primario. En casos raros (p. ej., de melanoma ), no se encuentra ningún tumor primario, ni siquiera en la autopsia . Por lo tanto, se cree que algunos tumores primarios pueden retroceder por completo, pero dejan atrás sus metástasis. En otros casos, el tumor podría ser demasiado pequeño o estar en una ubicación inusual para ser diagnosticado.

Las células de un tumor metastásico se parecen a las del tumor primario. Una vez que se examina el tejido canceroso bajo un microscopio para determinar el tipo de célula, el médico generalmente puede determinar si ese tipo de célula se encuentra normalmente en la parte del cuerpo de la que se tomó la muestra de tejido.
Por ejemplo, las células del cáncer de mama tienen el mismo aspecto tanto si se encuentran en la mama como si se han diseminado a otra parte del cuerpo. Entonces, si una muestra de tejido tomada de un tumor en el pulmón contiene células que parecen células mamarias, el médico determina que el tumor de pulmón es un tumor secundario. Aún así, la determinación del tumor primario a menudo puede resultar muy difícil y es posible que el patólogo tenga que utilizar varias técnicas adyuvantes, como la inmunohistoquímica , FISH ( hibridación fluorescente in situ ) y otras. A pesar del uso de técnicas, en algunos casos el tumor primario permanece sin identificar.
Los cánceres metastásicos pueden detectarse al mismo tiempo que el tumor primario, o meses o años después. Cuando se encuentra un segundo tumor en un paciente que ha sido tratado por cáncer en el pasado, es más frecuente que se trate de una metástasis que de otro tumor primario.
Anteriormente se pensaba que la mayoría de las células cancerosas tienen un potencial metastásico bajo y que hay células raras que desarrollan la capacidad de metastatizar mediante el desarrollo de mutaciones somáticas. [35] Según esta teoría, el diagnóstico de cánceres metastásicos sólo es posible después del evento de metástasis. Los medios tradicionales de diagnóstico del cáncer (por ejemplo, una biopsia ) solo investigarían una subpoblación de células cancerosas y muy probablemente no tomarían muestras de la subpoblación con potencial metastásico. [36]
La teoría de la mutación somática sobre el desarrollo de metástasis no ha sido fundamentada en cánceres humanos. Más bien, parece que el estado genético del tumor primario refleja la capacidad de ese cáncer para metastatizar. [36] La investigación que comparó la expresión genética entre adenocarcinomas primarios y metastásicos identificó un subconjunto de genes cuya expresión podría distinguir los tumores primarios de los tumores metastásicos, denominado "firma metastásica". [36] Los genes regulados positivamente en la firma incluyen: SNRPF , HNRPAB , DHPS y securin . La regulación negativa de actina , miosina y MHC clase II también se asoció con la firma. Además, la expresión de estos genes asociada a metástasis también se observó en algunos tumores primarios, lo que indica que las células con potencial de metastatizar podrían identificarse al mismo tiempo que el diagnóstico del tumor primario. [37] Un trabajo reciente identificó una forma de inestabilidad genética en el cáncer llamada inestabilidad cromosómica (CIN) como un factor impulsor de la metástasis. [38] En las células cancerosas agresivas, fragmentos de ADN sueltos de cromosomas inestables se derraman en el citosol, lo que provoca la activación crónica de vías inmunes innatas, que son secuestradas por las células cancerosas para propagarse a órganos distantes.
La expresión de esta firma metastásica se ha correlacionado con un mal pronóstico y se ha demostrado que es consistente en varios tipos de cáncer. Se demostró que el pronóstico era peor para los individuos cuyos tumores primarios expresaban la firma metastásica. [36] Además, se demostró que la expresión de estos genes asociados a metástasis se aplica a otros tipos de cáncer además del adenocarcinoma . Las metástasis de cáncer de mama , meduloblastoma y cáncer de próstata tenían patrones de expresión similares de estos genes asociados a metástasis. [36]
La identificación de esta firma asociada a metástasis es prometedora para identificar células con potencial metastásico dentro del tumor primario y esperanza para mejorar el pronóstico de estos cánceres asociados a metástasis. Además, identificar los genes cuya expresión cambia en la metástasis ofrece objetivos potenciales para inhibir la metástasis. [36]
El tratamiento y la supervivencia están determinados, en gran medida, por si el cáncer permanece localizado o se propaga a otras partes del cuerpo. Si el cáncer hace metástasis en otros tejidos u órganos, generalmente aumenta drásticamente la probabilidad de muerte del paciente. Algunos cánceres, como algunas formas de leucemia , un cáncer de la sangre o enfermedades malignas en el cerebro , pueden matar sin propagarse en absoluto.
Una vez que un cáncer ha hecho metástasis, todavía se puede tratar con radiocirugía , quimioterapia , radioterapia , terapia biológica , terapia hormonal , cirugía o una combinación de estas intervenciones ("terapia multimodal"). La elección del tratamiento depende de muchos factores, incluido el tipo de cáncer primario, el tamaño y la ubicación de las metástasis, la edad y la salud general del paciente y los tipos de tratamientos utilizados anteriormente. En pacientes diagnosticados con CUP, a menudo todavía es posible tratar la enfermedad incluso cuando no se puede localizar el tumor primario.
Los tratamientos actuales rara vez pueden curar el cáncer metastásico, aunque algunos tumores, como el cáncer testicular y el cáncer de tiroides , suelen ser curables.
Los cuidados paliativos , cuidados destinados a mejorar la calidad de vida de las personas con enfermedades graves, se han recomendado como parte de los programas de manejo de metástasis. [39] Los resultados de una revisión sistemática de la literatura sobre radioterapia para metástasis cerebrales encontraron que hay poca evidencia para informar la efectividad comparativa y los resultados centrados en el paciente sobre la calidad de vida, el estado funcional y los efectos cognitivos. [40]
Aunque se acepta ampliamente que la metástasis es el resultado de la migración de las células tumorales, existe la hipótesis de que algunas metástasis son el resultado de procesos inflamatorios provocados por células inmunitarias anormales. [41] La existencia de cánceres metastásicos en ausencia de tumores primarios también sugiere que la metástasis no siempre es causada por células malignas que abandonan los tumores primarios. [42]
La investigación realizada por el equipo de Sarna demostró que las células de melanoma muy pigmentadas tienen un módulo de Young de aproximadamente 4,93, mientras que en las no pigmentadas es sólo de 0,98. [43] En otro experimento descubrieron que la elasticidad de las células del melanoma es importante para su metástasis y crecimiento: los tumores no pigmentados eran más grandes que los pigmentados y les resultaba mucho más fácil propagarse. Demostraron que en los tumores de melanoma hay células pigmentadas y no pigmentadas , por lo que pueden ser resistentes a los medicamentos y metastásicos. [43]
El primer médico que informó sobre la posibilidad de metástasis local desde una fuente cancerosa primaria a los tejidos cercanos fue Ibn Sina . Describió un caso de cáncer de mama y condición metastásica en The Canon of Medicine . Su hipótesis se basó en el curso clínico del paciente. [44] [45]
En marzo de 2014, los investigadores descubrieron el ejemplo completo más antiguo de un ser humano con cáncer metastásico. Los tumores se habían desarrollado en un esqueleto de 3.000 años de antigüedad encontrado en 2013 en una tumba en Sudán que data del año 1200 a.C. El esqueleto fue analizado mediante radiografía y microscopio electrónico de barrido. Estos hallazgos fueron publicados en la revista Public Library of Science . [46] [47] [48]
Metástasis es una palabra griega que significa "desplazamiento", de μετά, meta , "siguiente" y στάσις, estasis , "colocación".