El cáncer de próstata es el crecimiento descontrolado de células en la próstata , una glándula del sistema reproductor masculino debajo de la vejiga . El cáncer de próstata temprano no causa síntomas. La mayoría de los casos se detectan después de que las pruebas de detección (generalmente análisis de sangre para determinar los niveles del antígeno prostático específico (PSA)) indiquen un crecimiento inusual del tejido prostático. El diagnóstico requiere una biopsia de la próstata. Si hay cáncer, el patólogo asigna una puntuación de Gleason , donde una puntuación más alta representa un tumor más peligroso. Se realizan imágenes médicas para buscar cáncer que se haya diseminado fuera de la próstata. Según la puntuación de Gleason, los niveles de PSA y los resultados de las imágenes, a un caso de cáncer se le asigna una etapa 1 a 4. Una etapa más alta significa una enfermedad más avanzada y más peligrosa.
La mayoría de los tumores de próstata siguen siendo pequeños y no causan problemas de salud. Estos se manejan con vigilancia activa , monitorizando el tumor con pruebas periódicas para asegurar que no ha crecido. Los tumores que tienen más probabilidades de ser peligrosos pueden destruirse con radioterapia o extirparse quirúrgicamente mediante prostatectomía radical . Aquellos cuyo cáncer se propaga más allá de la próstata son tratados con terapia hormonal que reduce los niveles de andrógenos (hormonas sexuales masculinas) que las células de la próstata necesitan para sobrevivir. Con el tiempo, las células cancerosas se vuelven resistentes a este tratamiento. Esta etapa más avanzada de la enfermedad, llamada cáncer de próstata resistente a la castración, se trata con terapia hormonal continua junto con el fármaco de quimioterapia docetaxel . Algunos tumores se diseminan a otras áreas del cuerpo, particularmente a los huesos y los ganglios linfáticos . Allí, los tumores causan dolor intenso en los huesos , debilidad o parálisis en las piernas y, finalmente, la muerte.
El pronóstico del cáncer de próstata depende de qué tan lejos se haya propagado el cáncer en el momento del diagnóstico. A la mayoría de los hombres se les diagnostican tumores confinados a la próstata; El 99% de ellos sobrevive más de 10 años desde su diagnóstico. Los tumores que han hecho metástasis a sitios distantes del cuerpo son los más peligrosos, con tasas de supervivencia a cinco años de 30 a 40%.
El riesgo de desarrollar cáncer de próstata aumenta con la edad; la edad promedio de diagnóstico es 67 años. Las personas con antecedentes familiares de cáncer de próstata tienen más probabilidades de tener cáncer de próstata. Cada año se diagnostican 1,2 millones de casos de cáncer de próstata y 350.000 mueren a causa de la enfermedad, [2] lo que la convierte en la segunda causa de cáncer y de muerte por cáncer en los hombres. Uno de cada ocho hombres es diagnosticado con cáncer de próstata a lo largo de su vida y uno de cada cuarenta muere a causa de la enfermedad. [3] Inicialmente se pensó que los tumores de próstata eran raros y un informe de 1893 describió solo 50 casos en la literatura médica. A medida que la cirugía se volvió más común, se encontraron tumores de próstata en muestras quirúrgicas de próstatas agrandadas. Los tratamientos quirúrgicos y de radiación se desarrollaron a lo largo del siglo XX. Un importante trabajo que describe la necesidad de hormonas sexuales masculinas de los tumores de próstata y el posterior desarrollo de terapias hormonales para el cáncer de próstata le valieron a Charles B. Huggins el Premio Nobel de Fisiología o Medicina de 1966 y a Andrzej W. Schally el Premio Nobel de Fisiología o Medicina de 1977. .
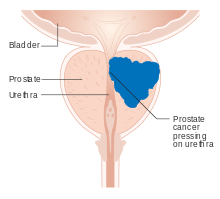
El cáncer de próstata en sus primeras etapas generalmente no causa síntomas. A medida que un tumor crece más allá de la próstata, puede dañar los órganos cercanos y provocar disfunción eréctil , sangre en la orina o el semen , o dificultad para orinar (a menudo, micción frecuente y un chorro de orina lento o débil). [4] Más de la mitad de los hombres mayores de 50 años experimentan algún tipo de problema al orinar, [5] generalmente debido a problemas distintos al cáncer de próstata, como la hiperplasia prostática benigna (agrandamiento no canceroso de la próstata). [4]
Los tumores de próstata avanzados a menudo metastatizan a los huesos cercanos de la pelvis y la espalda; allí pueden provocar fatiga , pérdida de peso inexplicable y dolor de espalda o de huesos que no mejora con el reposo. [6] Las metástasis pueden dañar los huesos que las rodean, y alrededor de una cuarta parte de las personas con cáncer de próstata metastásico desarrollan una fractura ósea . [7] Las metástasis en crecimiento también pueden comprimir la médula espinal causando debilidad en las piernas y los pies, o parálisis de las extremidades. [8] [9]
La mayoría de los casos de cáncer de próstata se diagnostican mediante pruebas de detección, cuando los tumores son demasiado pequeños para causar síntomas. [4] Esto se hace mediante análisis de sangre para medir los niveles de la proteína del antígeno prostático específico (PSA), que están elevados en personas con próstata agrandada, ya sea debido a cáncer de próstata o hiperplasia prostática benigna . [10] [11] La sangre de un hombre promedio tiene alrededor de 1 nanogramo (ng) de PSA por mililitro (mL) de sangre analizada. [12] Es muy poco probable que aquellos con niveles de PSA por debajo del promedio desarrollen un cáncer de próstata peligroso en los próximos 8 a 10 años. [12] Los hombres con niveles de PSA superiores a 4 ng/ml tienen un mayor riesgo (alrededor de 1 de cada 4 desarrollará cáncer de próstata) y, a menudo, son remitidos a una biopsia de próstata. [13] [14] Los niveles de PSA superiores a 10 ng/ml indican un riesgo aún mayor; más de la mitad de los hombres de este grupo desarrollan cáncer de próstata. [13] A los hombres con niveles altos de PSA a menudo se les recomienda repetir el análisis de sangre de cuatro a seis semanas después, ya que los niveles de PSA pueden fluctuar sin relación con el cáncer de próstata. [15]
Las personas con PSA elevado pueden someterse a análisis de sangre de detección secundarios que miden subtipos de PSA y otras moléculas para predecir mejor la probabilidad de que una persona desarrolle un cáncer de próstata agresivo. En particular, muchos miden el "PSA libre": alrededor del 10% al 30% del PSA no unido a otras proteínas sanguíneas. Los hombres que tienen un porcentaje menor de PSA libre tienen más probabilidades de tener cáncer de próstata. [16] Varias pruebas comunes detectan con mayor precisión los casos de cáncer de próstata al medir también los subtipos de PSA libre, incluido el índice de salud de la próstata (mide un fragmento llamado -2proPSA) y la puntuación 4K (mide el PSA libre intacto). [17] [18] Otras pruebas miden los niveles en sangre de proteínas adicionales relacionadas con la próstata, como la calicreína-2 (también medida mediante puntuación 4K), o los niveles en orina de moléculas de ARNm comunes a los tumores de próstata como PCA3 y TMPRSS2 fusionados a ERG . [19]
Varios estudios importantes han encontrado que los hombres sometidos a pruebas de detección de cáncer de próstata tienen un riesgo reducido de morir a causa de la enfermedad; [20] sin embargo, la detección de casos de cáncer que de otro modo no habrían afectado la salud puede causar ansiedad y dar lugar a biopsias y tratamientos innecesarios. [10] Las principales organizaciones nacionales de salud ofrecen diferentes recomendaciones, intentando equilibrar los beneficios del diagnóstico temprano con los daños potenciales del tratamiento de personas cuyos tumores es poco probable que afecten la salud. [10] La mayoría de las pautas médicas recomiendan que los hombres con buena salud y con alto riesgo de cáncer de próstata (debido a la edad, antecedentes familiares, origen étnico o evidencia previa de niveles altos de PSA en sangre) reciban asesoramiento sobre los riesgos y beneficios de las pruebas de PSA, y se les ofrecerá acceso a pruebas de detección. [10] La aceptación de los exámenes de detección varía según la geografía: más del 80 % de los hombres se someten a exámenes de detección en los EE. UU. y Europa occidental, el 20 % de los hombres en Japón, y los exámenes de detección son poco comunes en regiones con un índice de desarrollo humano bajo . [20]

Los hombres con sospecha de cáncer de próstata pueden someterse a varias pruebas para ayudar a evaluar la próstata. Un procedimiento común es el tacto rectal , en el que un médico inserta un dedo lubricado en el recto para palpar la próstata cercana. [21] [22] Los tumores se sienten como bultos rígidos y de forma irregular contra el resto de la próstata. El endurecimiento de la próstata también puede deberse a una hiperplasia prostática benigna ; alrededor del 20 al 25% de las personas con resultados anormales en el examen rectal tienen cáncer de próstata. [23]
Un diagnóstico de cáncer de próstata requiere una biopsia de la próstata. Las biopsias de próstata generalmente se toman con una aguja que pasa a través del recto o el perineo , guiadas por imágenes de ultrasonido transrectal , imágenes por resonancia magnética (MRI) o una combinación de ambas. [24] [22] Se toman de diez a doce muestras de varias regiones de la próstata para mejorar las posibilidades de encontrar tumores. [22] Las biopsias son examinadas bajo un microscopio por un patólogo , quien determina el tipo y la extensión de las células cancerosas presentes. Los cánceres se clasifican primero según su apariencia al microscopio. Más del 95% de los cánceres de próstata se clasifican como adenocarcinomas (que se asemejan al tejido glandular ), y el resto son principalmente carcinomas de células escamosas (que se asemejan a las células escamosas , un tipo de célula epitelial ) y carcinomas de células de transición (que se asemejan a las células de transición ). [25]

Las siguientes muestras de tumores se clasifican según la diferencia entre el tejido tumoral y el tejido prostático normal; cuanto más diferente parezca el tumor, más rápido crecerá. El sistema de clasificación de Gleason se usa comúnmente, donde el patólogo asigna un número del 1 (más similar al tejido prostático sano) al 5 (menos similar) para el patrón más común observado bajo el microscopio, luego hace lo mismo para el segundo patrón más común. patrón. La suma de estos dos números es la puntuación de Gleason. [25] Las puntuaciones totales de 2 a 5 ya no se utilizan habitualmente en la práctica, lo que hace que la puntuación más baja sea 6 y la puntuación más alta, 10. Las puntuaciones se agrupan habitualmente en grupos de grados de Gleason: una puntuación de 6 o menos es el grupo de grados de Gleason 1. ; una puntuación de 7 con el primer número (del patrón más común) 3 y el segundo número 4 es el grupo de grado 2; el reverso – primer número 4, segundo número 3 – es el grupo de grado 3; una puntuación de 8 es el grupo de grado 4; una puntuación de 9 o 10 es el grupo de grado 5. [25] Las puntuaciones de Gleason más altas y los grupos de grado más alto representan casos de cáncer que probablemente sean más agresivos y tengan un peor pronóstico. [25]
El alcance de la propagación del cáncer se evalúa mediante resonancia magnética o exploración PSMA , una técnica de imágenes por tomografía por emisión de positrones (PET) en la que se utiliza un marcador radiactivo que se une a la proteína prostática y al antígeno de membrana específico de la próstata para detectar metástasis distantes de la próstata. [26] [22] También se pueden utilizar tomografías computarizadas , pero son menos capaces de detectar la diseminación fuera de la próstata que la resonancia magnética. La gammagrafía ósea se utiliza para detectar la propagación del cáncer a los huesos. [26]

Después del diagnóstico, se clasifica el tumor para determinar el grado de crecimiento y diseminación. El cáncer de próstata generalmente se clasifica mediante el sistema TNM de tres componentes del Comité Conjunto Estadounidense sobre el Cáncer (AJCC), con puntuaciones asignadas según la extensión del tumor (T), la diseminación a cualquier ganglio linfático (N) y la presencia de metástasis . (METRO). [27] Las puntuaciones de T1 y T2 representan tumores que permanecen dentro de la próstata: T1 es para tumores no detectables mediante imágenes o examen rectal digital; T2 es para tumores detectables mediante imágenes o examen rectal, pero aún confinados dentro de la próstata. [28] T3 es para tumores que crecen más allá de la próstata – T3a para tumores con cualquier extensión fuera de la próstata; T3b para tumores que invaden las vesículas seminales adyacentes . T4 es para tumores que han crecido hacia órganos más allá de las vesículas seminales. [28] Las puntuaciones N y M son binarias (sí o no). N1 representa cualquier diseminación a los ganglios linfáticos cercanos. M1 representa cualquier metástasis a otros sitios del cuerpo. [28]
Luego, el AJCC combina las puntuaciones TNM, el grupo de grado de Gleason y los resultados del análisis de sangre PSA para clasificar los casos de cáncer en una de cuatro etapas y sus subdivisiones. Los casos de cáncer con tumores localizados (T1 o T2), sin diseminación (N0 y M0), grado de Gleason grupo 1 y PSA menor a 10 ng/mL se denominan estadio I. Aquellos con tumores localizados y PSA entre 10 y 20 ng/mL se denominan etapa II, subdivididas en IIA para el grupo de grado 1 de Gleason, IIB para el grupo de grado 2 y IIC para el grupo de grado 3 o 4. La etapa III es la designación de cualquiera de los tres factores de riesgo más altos: IIIA es para un nivel de PSA de alrededor de 20 ng/ml; IIIB es para tumores T3 o T4; IIIC es para un grupo de grado 5 de Gleason. El estadio IV es para cánceres que se han diseminado a los ganglios linfáticos (N1, estadio IVA) u otros órganos (M1, estadio IVB). [27]
El Instituto Nacional para la Excelencia en Salud y Atención Médica del Reino Unido recomienda un sistema de cinco etapas basado en el pronóstico de la enfermedad llamado Cambridge Prognostic Group, con grupos de pronóstico CPG 1 a CPG 5. [29] El CPG 1 es el mismo que el estadio I del AJCC. los tumores localizados (T1 o T2) y el grupo 2 de grado Gleason o niveles de PSA superiores (10 a 20 ng/ml) se denominan GPC 2. La GPC 3 representa el grupo 3 de grado Gleason o la combinación de los criterios de la GPC 2. CPG 4 es similar al estadio 3 del AJCC: cualquiera del grupo 4 de grado Gleason, niveles de PSA superiores a 20 ng/ml o un tumor que ha crecido más allá de la próstata (T3). La GPC 5 es para los casos de mayor riesgo: ya sea un tumor T4, grupo 5 de grado Gleason o dos criterios cualesquiera de la GPC 4. [30]
Las agencias reguladoras no han aprobado ningún medicamento o vacuna para la prevención del cáncer de próstata. Varios estudios han demostrado que los inhibidores de la 5α-reductasa reducen la incidencia total de cáncer de próstata; sin embargo, aún no está claro si reducen los casos de enfermedades peligrosas. [31]
El tratamiento del cáncer de próstata varía según el grado de avance del cáncer, el riesgo de que se propague y la salud y las preferencias personales de la persona afectada. [32] Aquellos con una enfermedad localizada con bajo riesgo de propagación a menudo tienen más probabilidades de resultar perjudicados por los efectos secundarios del tratamiento que por la enfermedad misma, por lo que son monitoreados periódicamente mediante pruebas repetidas para detectar un empeoramiento de su enfermedad. [33] Aquellos con mayor riesgo pueden recibir tratamiento para eliminar el tumor, generalmente prostatectomía (cirugía para extirpar la próstata) o radioterapia , a veces junto con terapia hormonal . [34] Las personas con enfermedad metastásica reciben tratamiento adicional con quimioterapia , así como radiación adicional u otros agentes para aliviar los síntomas de los tumores metastásicos. [34] Durante todo el tratamiento, se controlan los niveles de PSA en sangre para evaluar la eficacia de los tratamientos y si la enfermedad está avanzando. [35]
Los hombres diagnosticados con casos de cáncer de próstata de bajo riesgo a menudo posponen el tratamiento y son monitoreados periódicamente para detectar la progresión del cáncer mediante vigilancia activa , que implica monitorear el crecimiento del tumor a intervalos fijos mediante pruebas de PSA (aproximadamente cada seis meses), examen rectal digital (anualmente) y resonancia magnética o biopsias repetidas (cada uno a tres años). [33] Este programa continúa hasta que los aumentos en los niveles de PSA, el grado de Gleason o el tamaño del tumor indiquen un tumor de mayor riesgo que puede requerir intervención. [36] Al menos la mitad de los hombres permanecen bajo vigilancia activa y nunca requieren un tratamiento más directo para sus tumores de próstata. [37]

Quienes eligen recibir terapia generalmente reciben radioterapia o prostatectomía . [38] La radiación se puede administrar mediante radioterapia de intensidad modulada (IMRT), que permite administrar dosis altas (superiores a 80 Gy ) a la próstata con relativamente poca radiación a otros órganos, o mediante braquiterapia , en la que se utiliza una fuente radiactiva. Se coloca quirúrgicamente junto a la próstata. [39] [40] La IMRT se administra en varias sesiones y los tratamientos se repiten cinco días por semana durante varias semanas. La braquiterapia generalmente se realiza en una sola sesión, con la fuente radiactiva implantada permanentemente en la próstata, donde gasta su radiactividad en los próximos meses. [41] Con cualquiera de las técnicas, el daño por radiación a los órganos cercanos puede aumentar el riesgo de cáncer de vejiga posterior y causar disfunción eréctil , infertilidad y problemas gastrointestinales: diarrea , heces con sangre , incontinencia fecal y dolor. [42]

La prostatectomía radical tiene como objetivo extirpar quirúrgicamente la parte cancerosa de la próstata, junto con las vesículas seminales y partes de los conductos deferentes . [43] Esto generalmente se hace mediante cirugía asistida por robot , donde herramientas robóticas insertadas a través de pequeños orificios en el abdomen permiten al cirujano realizar movimientos pequeños y exactos durante la cirugía. [44] Este método produce estancias hospitalarias más cortas, menos pérdida de sangre y menos complicaciones que la cirugía abierta tradicional. [44] En lugares donde la cirugía asistida por robot no está disponible, la prostatectomía se puede realizar por vía laparoscópica (usando una cámara y herramientas manuales a través de pequeños orificios en el abdomen) o mediante cirugía abierta tradicional con una incisión por encima del pene (abordaje retropúbico) o por debajo. el escroto (abordaje perineal). [45] [44] Los cuatro enfoques dan como resultado tasas similares de control del cáncer. [45] El daño al tejido cercano durante la cirugía puede provocar disfunción eréctil e incontinencia urinaria . La disfunción eréctil es más probable en personas mayores o que han tenido problemas de erección previos. [45] La incontinencia es más común en personas mayores y con uretras más cortas . [45] Tanto para los resultados de la progresión del cáncer como para los efectos secundarios de la cirugía, la habilidad y la experiencia del cirujano individual que realiza el procedimiento se encuentran entre los mayores determinantes del éxito. [45]
La radioterapia y la cirugía producen resultados similares con respecto a la función intestinal, eréctil y urinaria después de cinco años. [46] Después de la prostatectomía, los niveles de PSA caen rápidamente, alcanzando niveles muy bajos o indetectables en dos meses. La radioterapia también reduce sustancialmente los niveles de PSA, pero de forma más lenta y menos completa, y los niveles de PSA alcanzan su punto más bajo dos años después de la radioterapia. [47] Después de cualquiera de los tratamientos, los niveles de PSA se controlan periódicamente. Hasta la mitad de los tratados eventualmente tendrán un aumento en los niveles de PSA, lo que sugiere que el tumor o las pequeñas metástasis están creciendo nuevamente. [48] A las personas con niveles de PSA altos o en aumento a menudo se les ofrece otra ronda de radioterapia dirigida al sitio del tumor anterior. Esto reduce el riesgo de una mayor progresión en un 75%. [49] Las personas sospechosas de metástasis pueden someterse a una exploración por TEP con radiotrazadores sensibles colina C-11, fluciclovina F-18 y F-18 o Ga-68 unidos a un fármaco dirigido a PSMA, cada uno de los cuales es capaz de detectar metástasis pequeñas con mayor precisión. sensibilidad que los métodos de imagen alternativos. [50] [49]

Para quienes padecen enfermedad metastásica, el estándar de atención es la terapia de privación de andrógenos , medicamentos que reducen los niveles de andrógenos (hormonas sexuales masculinas) que las células de la próstata necesitan para crecer. [51] Se utilizan varios fármacos para reducir los niveles de andrógenos bloqueando la síntesis o acción de la testosterona , el andrógeno primario. La primera línea de tratamiento suele ser agonistas de GnRH como leuprolida , goserelina o triptorelina mediante inyección mensual o con menos frecuencia si es necesario. [52] [51] Los agonistas de GnRH provocan un breve aumento en los niveles de testosterona al inicio del tratamiento, lo que puede empeorar la enfermedad en personas con síntomas significativos de metástasis. [53] En estas personas, se administran antagonistas de GnRH como degarelix o relugolix , que también pueden reducir rápidamente los niveles de testosterona. [53] La terapia hormonal detiene el crecimiento del tumor en más del 95% de los tratados, [54] y los niveles de PSA vuelven a la normalidad hasta en un 70%. [55]
A pesar de los niveles reducidos de testosterona, los tumores de próstata metastásicos eventualmente continúan creciendo, lo que se manifiesta por un aumento de los niveles de PSA en sangre y metástasis en los huesos cercanos. [56] [57] Esta es la etapa más avanzada de la enfermedad, llamada cáncer de próstata resistente a la castración (CRPC). Los tumores CRPC desarrollan continuamente resistencia a los tratamientos, lo que requiere varias líneas de terapia, cada una de las cuales se utiliza en secuencia para extender la supervivencia. El tratamiento estándar es la quimioterapia con docetaxel junto con fármacos antiandrógenos , concretamente los antagonistas de los receptores de andrógenos enzalutamida , apalutamida y darolutamida , así como el inhibidor de la producción de testosterona acetato de abiraterona . [58] [56] [59] Una alternativa es el procedimiento de terapia celular Sipuleucel-T , donde se eliminan las células inmunitarias de la persona afectada, se tratan para atacar más eficazmente las células del cáncer de próstata y se reinyectan en la misma persona. [56] Los tumores que desarrollan resistencia al docetaxel pueden recibir el fármaco taxano cabazitaxel de segunda generación . [56]
Algunos tratamientos de CRPC se usan sólo en hombres cuyos tumores tienen ciertas características que hacen que la terapia tenga más probabilidades de ser efectiva. Los hombres cuyos tumores expresan la proteína PSMA pueden recibir el radiofármaco Lu-177 PSMA , que se une a las células positivas para PSMA y las destruye. [60] [56] Aquellos cuyos tumores tienen una reparación defectuosa del daño del ADN se benefician del tratamiento con el fármaco inhibidor del punto de control inmunitario pembrolizumab y/o inhibidores de PARP , a saber, olaparib , rucaparib o niraparib . [56]
Las metástasis óseas, presentes en alrededor del 85% de las personas con cáncer de próstata metastásico, son la principal causa de síntomas y muerte por cáncer de próstata metastásico. [61] [62] A las personas con dolor constante se les recetan medicamentos antiinflamatorios no esteroides . [63] Sin embargo, las personas con metástasis óseas a menudo experimentan "dolor irruptivo", ráfagas repentinas de dolor intenso que se resuelven en unos 15 minutos, antes de que los analgésicos puedan surtir efecto. [63] Los sitios únicos de dolor se pueden tratar con radioterapia de haz externo para reducir los tumores cercanos. [64] El dolor óseo más disperso se puede tratar con compuestos radiactivos que se acumulan desproporcionadamente en el hueso, como el radio-223 y el samario-153-EDTMP , que ayudan a reducir el tamaño de los tumores óseos. De manera similar, los quimioterapéuticos sistémicos utilizados para el cáncer de próstata metastásico pueden reducir el dolor a medida que reducen los tumores. [64] Otros agentes modificadores de los huesos, como el ácido zoledrónico y el denosumab , pueden reducir el dolor óseo del cáncer de próstata, aunque tienen poco efecto sobre el tamaño del tumor. [64] Las metástasis comprimen la médula espinal en hasta un 12% de las personas con cáncer de próstata metastásico, causando dolor, debilidad, entumecimiento y parálisis. [65] [66] La inflamación de la columna se puede tratar con altas dosis de esteroides, así como con cirugía y radioterapia para reducir los tumores de la columna y aliviar la presión sobre la médula espinal. [65] [66]
Las personas con cáncer de próstata avanzado suelen sufrir fatiga, letargo y debilidad generalizada. Esto se debe en parte a problemas gastrointestinales, siendo comunes la pérdida de apetito , pérdida de peso, náuseas y estreñimiento . Por lo general, estos se tratan con medicamentos que aumentan el apetito ( acetato de megestrol o corticosteroides), antieméticos o tratamientos que se centran en problemas gastrointestinales subyacentes. [67] La debilidad general también puede ser causada por anemia , que a su vez es causada por una combinación de la propia enfermedad, la mala nutrición y el daño a la médula ósea debido a tratamientos contra el cáncer o metástasis óseas. [68] La anemia se puede tratar de varias maneras dependiendo de la causa, o se puede abordar directamente con transfusiones de sangre . [68] El daño a los órganos y las metástasis en los ganglios linfáticos pueden provocar una acumulación incómoda de líquido (llamada linfedema ) en los genitales o las extremidades inferiores. Estas hinchazones pueden ser extremadamente dolorosas y limitar la capacidad de la persona afectada para orinar, tener relaciones sexuales o caminar normalmente. El linfedema se puede tratar aplicando presión para ayudar al drenaje, drenando quirúrgicamente el líquido acumulado y limpiando y tratando la piel dañada cercana. [69]
Las personas con cáncer de próstata tienen aproximadamente el doble de probabilidades de experimentar ansiedad o depresión en comparación con las que no tienen cáncer. [70] Cuando se agregan a los tratamientos normales para el cáncer de próstata, las intervenciones psicológicas como la psicoeducación y la terapia cognitivo-conductual pueden ayudar a reducir la ansiedad, la depresión y la angustia general. [71]
A medida que los enfermos graves de cáncer de próstata metastásico se acercan al final de sus vidas, la mayoría experimenta confusión y puede tener alucinaciones o tener problemas para reconocer a sus seres queridos. [72] [73] La confusión es causada por diversas afecciones, incluida la insuficiencia renal , la sepsis , la deshidratación y como efecto secundario de varios medicamentos, especialmente los opioides . [72] La mayoría de las personas duermen durante períodos prolongados y algunas se sienten somnolientas cuando están despiertas. [73] La inquietud también es común, a veces causada por malestar físico por estreñimiento o retención urinaria , a veces causada por ansiedad. [73] En los últimos días, la respiración de los hombres afectados puede volverse superficial y lenta, con largas pausas entre respiraciones. La respiración puede ir acompañada de un ruido como si el líquido permaneciera en la garganta, pero esto no resulta incómodo para la persona afectada. [73] [74] Sus manos y pies pueden enfriarse al tacto y la piel se vuelve azul o con manchas debido a una circulación sanguínea más débil. Muchos dejan de comer y beber, lo que provoca una sensación de sequedad en la boca, que puede aliviarse humedeciendo la boca y los labios. [73] La persona responde cada vez menos y, finalmente, el corazón y la respiración se detienen. [74]
El pronóstico del cáncer de próstata diagnosticado varía ampliamente según el grado y el estadio del cáncer en el momento del diagnóstico; aquellos con enfermedad en etapa más baja tienen pronósticos enormemente mejorados. Alrededor del 80% de los diagnósticos de cáncer de próstata se producen en hombres cuyo cáncer todavía se limita a la próstata. Estos hombres a menudo sobreviven mucho después del diagnóstico, y hasta el 99% siguen vivos 10 años después del diagnóstico. [75] Los hombres cuyo cáncer ha hecho metástasis en una parte cercana del cuerpo (alrededor del 15 % de los diagnósticos) tienen peores pronósticos, con tasas de supervivencia a cinco años del 60 al 80 %. [76] Aquellos con metástasis en sitios distantes del cuerpo (alrededor del 5 % de los diagnósticos) tienen pronósticos relativamente malos, con tasas de supervivencia a cinco años del 30 al 40 %. [76]
Aquellos que tienen niveles bajos de PSA en sangre en el momento del diagnóstico y cuyos tumores tienen un grado de Gleason bajo y un estadio clínico menos avanzado tienden a tener mejores pronósticos. [77] Después de la prostatectomía o la radioterapia, aquellos que tienen un corto tiempo entre el tratamiento y un aumento posterior en los niveles de PSA, o una tasa rápida de aumentos en los niveles de PSA, tienen más probabilidades de morir a causa de sus cánceres. [48] El cáncer de próstata metastásico resistente a la castración es incurable, [78] y mata a la mayoría de aquellos cuya enfermedad alcanza esta etapa. [56]
El cáncer de próstata es causado por la acumulación de mutaciones genéticas en el ADN de las células de la próstata. Estas mutaciones afectan a genes implicados en el crecimiento celular, la replicación, la muerte celular y la reparación de daños en el ADN . [79] Los cambios en estos genes pueden hacer que las células de la próstata crezcan sin control, lo que resulta en un tumor. [80] Con el tiempo, el tumor puede crecer lo suficiente como para invadir órganos cercanos, como las vesículas seminales o la vejiga . [81] Con el tiempo, las células tumorales desarrollan la capacidad de viajar a través del sistema linfático hasta los ganglios linfáticos cercanos , o a través del torrente sanguíneo hasta la médula ósea y (más raramente) otras partes del cuerpo. [82] En estos nuevos sitios, las células cancerosas alteran la función normal del cuerpo y continúan creciendo. Las metástasis causan la mayor parte de las molestias asociadas con el cáncer de próstata y, eventualmente, pueden matar a la persona afectada. [82]
La mayoría de los tumores de próstata comienzan en la zona periférica, la parte más externa de la próstata. [83] A medida que las células comienzan a crecer sin control, forman un pequeño grupo de células desreguladas llamado neoplasia intraepitelial prostática (PIN). [84] Algunos PIN continúan creciendo, formando capas de tejido que dejan de expresar genes comunes a su ubicación tisular original ( p63 , citoqueratina 5 y citoqueratina 14 ) y comienzan a expresar genes comunes a las células que componen el revestimiento más interno del conducto pancreático. citoqueratina 8 y citoqueratina 18 . [83] Estos PIN de múltiples capas también suelen sobreexpresar el gen AMACR , que está asociado con la progresión del cáncer de próstata. [83]
Los PIN particularmente grandes pueden eventualmente convertirse en tumores. Esto suele ir acompañado de cambios a gran escala en el genoma , con secuencias cromosómicas que se reorganizan o copian repetidamente. Algunas alteraciones genómicas son particularmente comunes en el cáncer de próstata temprano, a saber, la fusión genética entre TMPRSS2 y el oncogén ERG (hasta el 60% de los tumores de próstata), mutaciones que desactivan SPOP (hasta el 15% de los tumores) y mutaciones que hiperactivan FOXA1 (hasta el 15% de los tumores de próstata). hasta el 5% de los tumores). [83]
El cáncer de próstata metastásico tiende a tener más mutaciones genéticas que la enfermedad localizada. [85] Muchas de estas mutaciones se encuentran en genes que protegen del daño al ADN, como p53 (mutado en el 8% de los tumores localizados, más del 27% de los metastásicos) y RB1 (1% de los tumores localizados, más del 5% de los metastásicos). [85] De manera similar, las mutaciones en los genes BRCA2 y ATM relacionados con la reparación del ADN son raras en la enfermedad localizada, pero se encuentran en al menos el 7 % y el 5 % de los casos de enfermedad metastásica, respectivamente. [85]
La transición de un cáncer de próstata sensible a la castración a un cáncer de próstata resistente a la castración también va acompañada de la adquisición de diversas mutaciones genéticas. En la enfermedad resistente a la castración, más del 70% de los tumores tienen mutaciones en la vía de señalización del receptor de andrógenos : amplificaciones y mutaciones de ganancia de función en el propio gen del receptor, amplificación de sus activadores (p. ej., FOXA1) o mutaciones inactivadoras en su gen negativo. reguladores (por ejemplo, ZBTB16 y NCOR1 ). [85] Estas alteraciones del receptor de andrógenos solo se encuentran en hasta el 6% de las biopsias de enfermedad metastásica sensible a la castración. [85] De manera similar, las eliminaciones del supresor de tumores PTEN se encuentran en 12 a 17 % de los tumores sensibles a la castración, pero en más del 40 % de los tumores resistentes a la castración. [85] Con menos frecuencia, los tumores tienen una activación aberrante de la vía de señalización Wnt mediante la alteración de los miembros APC (9 % de los tumores) o CTNNB1 (4 % de los tumores); o desregulación de la vía PI3K a través de mutaciones PI3KCA/PI3KCB (6% de los tumores) o AKT1 (2% de los tumores). [85]

El cáncer de próstata es el segundo cáncer más frecuentemente diagnosticado en los hombres y la segunda causa más frecuente de muerte por cáncer en los hombres (después del cáncer de pulmón ). [2] [3] Cada año se diagnostican alrededor de 1,2 millones de nuevos casos de cáncer de próstata y 350.000 hombres mueren a causa de la enfermedad. [2] A uno de cada ocho hombres se le diagnostica cáncer de próstata a lo largo de su vida, y alrededor de uno de cada cuarenta muere a causa de la enfermedad. [3] Las tasas de cáncer de próstata aumentan con la edad. Debido a esto, las tasas de cáncer de próstata son generalmente más altas en partes del mundo con mayor esperanza de vida, que también tienden a ser áreas con mayor producto interno bruto y mayor índice de desarrollo humano . [2] Australia, Europa, América del Norte, Nueva Zelanda y partes de América del Sur tienen la mayor incidencia. Asia meridional, Asia central y África subsahariana tienen la incidencia más baja de cáncer de próstata; aunque la incidencia está aumentando en estas regiones a un ritmo que se encuentra entre los más rápidos del mundo. [2] El cáncer de próstata es el cáncer más diagnosticado en hombres en más de la mitad de los países del mundo, y la principal causa de muerte por cáncer en hombres en alrededor de una cuarta parte de los países. [86]
El cáncer de próstata es poco común en personas menores de 40 años, [87] y la mayoría de los casos ocurren en personas mayores de 60 años, [2] con una persona promedio diagnosticada a los 67 años. [88] La persona promedio que muere de cáncer de próstata tiene 77 años. [ 88] Sólo una minoría de los casos de cáncer de próstata se diagnostica. Las autopsias de hombres que murieron a distintas edades han demostrado cáncer de próstata en más del 40% de los hombres mayores de 50 años. La incidencia aumenta con la edad, y casi el 70% de los hombres a los que se les realizó una autopsia entre 80 y 89 años tenían cáncer de próstata. [89]
El cáncer de próstata es más común en algunas familias. Los hombres con un familiar de primer grado afectado (padre o hermano) tienen más del doble de riesgo de desarrollar cáncer de próstata, y aquellos con dos familiares de primer grado tienen un riesgo cinco veces mayor en comparación con los hombres sin antecedentes familiares. [90] También existe un mayor riesgo en algunos grupos étnicos, siendo los hombres de ascendencia africana y afrocaribeña los que corren un riesgo particularmente alto: tienen tasas más altas de cáncer de próstata y cánceres de próstata más agresivos que se desarrollan a edades más tempranas. [91] Grandes estudios de asociación de todo el genoma han identificado más de 100 variantes genéticas asociadas con un mayor riesgo de cáncer de próstata. [92] El mayor aumento de riesgo se asocia con variaciones en BRCA2 (hasta ocho veces mayor riesgo) y HOXB13 (tres veces mayor riesgo), los cuales están involucrados en la reparación del daño del ADN . [92] Las variantes de otros genes implicados en la reparación del daño del ADN también se han asociado con un mayor riesgo de desarrollar cáncer de próstata, en particular cáncer de próstata de aparición temprana, incluidos BRCA1 , ATM , NBS1 , MSH2 , MSH6 , PMS2 , CHEK2 , RAD51D y PALB2 . [92] Además, las variantes en el genoma cerca del oncogén MYC se asocian con un mayor riesgo. [92] Al igual que los polimorfismos de un solo nucleótido en el receptor de vitamina D , comunes en los afroamericanos, y en el receptor de andrógenos , CYP3A4 y CYP17, implicados en la síntesis y señalización de testosterona . [90] Se estima que las variantes genéticas conocidas en conjunto causan alrededor del 25 % de los casos de cáncer de próstata, incluido el 40 % de los cánceres de próstata de aparición temprana. [90]
Los hombres más altos tienen un riesgo ligeramente mayor de desarrollar cáncer de próstata, al igual que los hombres obesos . [93] Los niveles altos de colesterol en la sangre también se asocian con un mayor riesgo de cáncer de próstata; en consecuencia, quienes toman medicamentos para reducir el colesterol, estatinas , tienen un riesgo reducido de cáncer de próstata avanzado. [94] La inflamación crónica puede causar varios tipos de cáncer. Se han estudiado posibles vínculos entre la infección (u otras fuentes de inflamación) y el cáncer de próstata, pero no se ha encontrado ninguno de manera definitiva, y un gran estudio no encontró ningún vínculo entre el cáncer de próstata y antecedentes de gonorrea , sífilis , clamidia o infección por varios virus del papiloma humano . [95]
El ejercicio vigoroso y regular puede reducir las posibilidades de desarrollar cáncer de próstata avanzado, al igual que varias intervenciones dietéticas. [96] Aquellos con una dieta rica en vegetales crucíferos , pescado , genisteína o licopeno (que se encuentra en los tomates) tienen un riesgo reducido de cáncer de próstata sintomático. [90] [97] Por el contrario, aquellos que consumen altos niveles de grasas dietéticas, hidrocarburos aromáticos policíclicos (provenientes de cocinar carnes rojas) o calcio pueden tener un mayor riesgo de desarrollar cáncer de próstata avanzado. [90] [98] Se han estudiado varios suplementos dietéticos y se ha descubierto que no afectan el riesgo de cáncer de próstata, incluidos el selenio , la vitamina C , la vitamina D y la vitamina E. [31] [98]
Un tumor en la próstata fue descrito por primera vez en 1817 por el cirujano inglés George Langstaff, tras la autopsia de un hombre que había muerto a los 68 años con dolor en la parte inferior del cuerpo y problemas urinarios. [99] [100] En 1853, el cirujano del Hospital de Londres , John Adams, describió otro tumor de próstata de un hombre que había muerto con problemas urinarios; Adams hizo que un patólogo examinara el tumor, lo que proporcionó el primer caso histológicamente confirmado de un tumor canceroso en la próstata. [99] [101] Inicialmente se pensó que la enfermedad era poco común ya que rara vez se distinguía de otras causas de obstrucción urinaria. [102] Un informe de 1893 encontró sólo 50 casos descritos en la literatura médica. [103] A principios del siglo XIX, la cirugía de próstata para aliviar la obstrucción urinaria se volvió más común, lo que permitió a los cirujanos y patólogos examinar el tejido prostático extirpado. Dos estudios de esa época encontraron cáncer en hasta el 10% de las muestras quirúrgicas, lo que sugiere que el cáncer de próstata era una causa bastante común de agrandamiento de la próstata. [103]
Durante gran parte del siglo XX, la terapia principal para el cáncer de próstata fue la cirugía para extirpar la próstata. La prostatectomía perineal fue realizada por primera vez en 1904 por Hugh H. Young en el Hospital Johns Hopkins . [104] [105] El método de Young se convirtió en el estándar generalizado, inicialmente realizado principalmente para aliviar los síntomas de obstrucción urinaria. [104] En 1931 estuvo disponible un nuevo método quirúrgico, la resección transuretral de la próstata , que reemplazó a la prostatectomía perineal para el alivio sintomático de la obstrucción. [103] En 1945, Terence Millin describió un enfoque de prostatectomía retropúbica, que proporcionaba un acceso más fácil a los ganglios linfáticos pélvicos para ayudar a estadificar la extensión de la enfermedad y era más fácil de aprender para los cirujanos. [104] Esto fue mejorado por la descripción de Patrick C. Walsh en 1983 de un enfoque de prostatectomía retropúbica que evitaba el daño a los nervios cercanos a la próstata, preservando la función eréctil. [104] [106]
La radioterapia para el cáncer de próstata se utilizó ocasionalmente a principios del siglo XX, implantándose radio en la uretra o el recto para reducir el tamaño del tumor y los síntomas asociados. [107] En la década de 1950, la llegada de máquinas de radiación más potentes permitió que la radioterapia de haz externo llegara a la próstata. En la década de 1960, esto se combinaba a menudo con terapia hormonal para mejorar la potencia de la terapia. [107] En la década de 1970, Willet Whitmore fue pionero en una técnica de cirugía abierta en la que se colocaban agujas de yodo-125 directamente en la próstata. Esto fue mejorado por Henrik H. Holm en 1983 mediante el uso de ultrasonido transcrectal para guiar la implantación de material radiactivo. [107]
La observación de que los testículos (y las hormonas que secretan) influyen en el tamaño de la próstata se hizo ya a finales del siglo XVIII mediante experimentos de castración en animales. Sin embargo, la experimentación ocasional durante el siglo siguiente arrojó resultados mixtos, probablemente debido a la incapacidad de separar los tumores de próstata de las próstatas agrandadas debido a la hiperplasia prostática benigna. En 1941, Charles B. Huggins y Clarence V. Hodges publicaron dos estudios que utilizaban la castración quirúrgica o el estrógeno oral para reducir los niveles de andrógenos y mejorar los síntomas del cáncer de próstata. Huggins recibió el Premio Nobel de Fisiología o Medicina en 1966 por este descubrimiento, la primera terapia sistémica para el cáncer de próstata. [108] [109] En la década de 1960, grandes estudios demostraron que la terapia con estrógenos era tan eficaz como la castración quirúrgica en el tratamiento del cáncer de próstata, pero que quienes recibían terapia con estrógenos tenían un mayor riesgo de sufrir coágulos sanguíneos . [108] Durante la década de 1980, los estudios de Andrzej W. Schally sobre la GnRH condujeron al desarrollo de agonistas de la GnRH, que resultaron ser tan eficaces como el estrógeno sin aumentar el riesgo de coagulación. [108] [110] Schally recibió el Premio Nobel de Fisiología o Medicina en 1977 por su trabajo sobre la GnRH y el cáncer de próstata. [108]
La quimioterapia sistémica para el cáncer de próstata se ha estudiado desde la década de 1950, pero los ensayos clínicos no lograron mostrar beneficios en la mayoría de las personas que reciben los medicamentos. [111] En 1996, la Administración de Alimentos y Medicamentos de EE. UU. aprobó la quimioterapia sistémica mitoxantrona para aquellos con cáncer de próstata resistente a la castración basándose en ensayos que mostraban que mejoraba los síntomas aunque no lograba mejorar la supervivencia. [112] En 2004, se aprobó docetaxel como la primera quimioterapia para aumentar la supervivencia en personas con cáncer de próstata resistente a la castración. [112] Después de ensayos adicionales en 2015, el uso de docetaxel se extendió a personas con cáncer de próstata sensible a la castración. [113]
La detección y la concientización sobre el cáncer de próstata se han promovido ampliamente desde principios de la década de 2000 mediante el Mes de Concientización sobre el Cáncer de Próstata en septiembre y Movember en noviembre. [114] Los análisis de búsquedas en Internet y publicaciones en redes sociales sugieren que ninguno de los eventos cambia el nivel de interés o discusión sobre el cáncer de próstata, en contraste con el Mes de Concientización sobre el Cáncer de Mama, más establecido . [114] [115] Se utiliza una cinta azul claro para promover la concientización sobre el cáncer de próstata.
El cáncer de próstata es un tema importante de investigación en curso: el Instituto Nacional del Cáncer de EE. UU. (NCI, el mayor financiador de investigaciones sobre el cáncer del mundo) gastó 209 millones de dólares en investigación sobre el cáncer de próstata en 2020, la sexta cifra más alta entre los tipos de cáncer. [116] A pesar del alto gasto bruto, la financiación para la investigación del cáncer de próstata es relativamente baja para el número de muertes que causa. El NCI gasta alrededor de 5.700 dólares por muerte por cáncer de próstata, considerablemente menos que por el cáncer de cerebro (21.000 dólares por muerte), el cáncer de mama (13.000 dólares por muerte) o el cáncer en su conjunto (11.000 dólares por muerte). [117] Una tendencia similar se aplica a las organizaciones privadas sin fines de lucro . Los ingresos anuales de las organizaciones sin fines de lucro centradas en el cáncer de próstata ocupan el sexto lugar entre los tipos de cáncer, pero las organizaciones sin fines de lucro contra el cáncer de próstata tienen ingresos más bajos de lo que se esperaría por la cantidad de casos, muertes y años potenciales de vida perdidos. [118]
La investigación sobre el cáncer de próstata se basa en varios modelos de laboratorio para probar aspectos de la enfermedad. Varias líneas celulares inmortalizadas de próstata se utilizan ampliamente, a saber, las líneas clásicas DU145 , PC-3 y LNCaP , así como líneas celulares más recientes 22Rv1, LAPC-4 , VCaP y MDA-PCa-2a y −2b. [119] La investigación que requiere modelos más complejos de la próstata utiliza organoides : grupos de células de la próstata que pueden cultivarse a partir de tumores de próstata humanos o células madre. [120] Modelar el crecimiento tumoral y la metástasis requiere un organismo modelo , generalmente un ratón. Los investigadores pueden implantar quirúrgicamente tumores de próstata humanos en ratones inmunocomprometidos (una técnica llamada xenoinjerto derivado del paciente ) [121] o pueden inducir tumores de próstata en ratones mediante exposición química o ingeniería genética . [122] Estos modelos de ratón genéticamente modificados suelen utilizar un sistema de recombinasa Cre para alterar los supresores de tumores o activar oncogenes específicamente en las células de la próstata. [123]