La quimioterapia (a menudo abreviada como quimio , a veces como CTX y CTx ) es el tipo de tratamiento contra el cáncer que utiliza uno o más medicamentos contra el cáncer ( agentes quimioterapéuticos o agentes alquilantes ) en un régimen estándar . La quimioterapia puede administrarse con una intención curativa (que casi siempre implica combinaciones de medicamentos) o puede apuntar solo a prolongar la vida o reducir los síntomas ( quimioterapia paliativa ). La quimioterapia es una de las principales categorías de la disciplina médica dedicada específicamente a la farmacoterapia para el cáncer , que se llama oncología médica . [1] [2]
El término quimioterapia ahora significa el uso no específico de venenos intracelulares para inhibir la mitosis (división celular) o para inducir daño al ADN (para que la reparación del ADN pueda aumentar la quimioterapia). [3] Este significado excluye los agentes más selectivos que bloquean las señales extracelulares ( transducción de señales ). Las terapias con objetivos moleculares o genéticos específicos, que inhiben las señales promotoras del crecimiento de las hormonas endocrinas clásicas (principalmente estrógenos para el cáncer de mama y andrógenos para el cáncer de próstata), ahora se denominan terapias hormonales . Otras inhibiciones de las señales de crecimiento, como las asociadas con las tirosina quinasas receptoras , son terapias dirigidas .
El uso de medicamentos (ya sea quimioterapia, terapia hormonal o terapia dirigida) es una terapia sistémica para el cáncer: se introducen en el torrente sanguíneo (el sistema) y, por lo tanto, pueden tratar el cáncer en cualquier parte del cuerpo. La terapia sistémica se utiliza a menudo con otras terapias locales (tratamientos que funcionan solo donde se aplican), como la radiación , la cirugía y la hipertermia .
Los agentes quimioterapéuticos tradicionales son citotóxicos al interferir con la división celular (mitosis), pero las células cancerosas varían ampliamente en su susceptibilidad a estos agentes. En gran medida, la quimioterapia puede considerarse como una forma de dañar o estresar las células, lo que puede conducir a la muerte celular si se inicia la apoptosis . Muchos de los efectos secundarios de la quimioterapia se pueden atribuir al daño a las células normales que se dividen rápidamente y, por lo tanto, son sensibles a los medicamentos antimitóticos: células de la médula ósea , el tracto digestivo y los folículos pilosos . Esto da como resultado los efectos secundarios más comunes de la quimioterapia: mielosupresión (disminución de la producción de células sanguíneas, por lo tanto también inmunosupresión ), mucositis (inflamación del revestimiento del tracto digestivo) y alopecia (pérdida de cabello). Debido al efecto sobre las células inmunes (especialmente los linfocitos), los medicamentos de quimioterapia a menudo se utilizan en una serie de enfermedades que resultan de la hiperactividad dañina del sistema inmunológico contra sí mismo (la llamada autoinmunidad ). Estas incluyen la artritis reumatoide , el lupus eritematoso sistémico , la esclerosis múltiple , la vasculitis y muchas otras.
En la actualidad, se utilizan diversas estrategias para la administración de fármacos quimioterapéuticos. La quimioterapia puede administrarse con fines curativos o puede tener como objetivo prolongar la vida o paliar los síntomas .
Todos los regímenes de quimioterapia requieren que el receptor sea capaz de someterse al tratamiento. El estado funcional se utiliza a menudo como una medida para determinar si una persona puede recibir quimioterapia o si es necesario reducir la dosis. Debido a que solo una fracción de las células de un tumor mueren con cada tratamiento ( muerte fraccionada ), se deben administrar dosis repetidas para continuar reduciendo el tamaño del tumor. [10] Los regímenes de quimioterapia actuales aplican el tratamiento farmacológico en ciclos, con la frecuencia y la duración de los tratamientos limitadas por la toxicidad. [11]
La eficacia de la quimioterapia depende del tipo de cáncer y de su estadio. La eficacia general varía desde la curación de algunos tipos de cáncer, como algunas leucemias , [12] [13] hasta la ineficacia, como en el caso de algunos tumores cerebrales , [14] o la inutilidad en otros, como la mayoría de los cánceres de piel no melanoma . [15]

La dosificación de la quimioterapia puede ser difícil: si la dosis es demasiado baja, será ineficaz contra el tumor, mientras que, en dosis excesivas, la toxicidad ( efectos secundarios ) será intolerable para la persona que la recibe. [4] El método estándar para determinar la dosis de quimioterapia se basa en el área de superficie corporal calculada (BSA). El BSA generalmente se calcula con una fórmula matemática o un nomograma , utilizando el peso y la altura del receptor, en lugar de mediante la medición directa del área corporal. Esta fórmula se derivó originalmente en un estudio de 1916 e intentó traducir las dosis medicinales establecidas con animales de laboratorio a dosis equivalentes para humanos. [16] El estudio solo incluyó nueve sujetos humanos. [17] Cuando se introdujo la quimioterapia en la década de 1950, la fórmula de BSA se adoptó como el estándar oficial para la dosificación de quimioterapia por falta de una mejor opción. [18] [19]
La validez de este método para calcular dosis uniformes ha sido cuestionada porque la fórmula solo tiene en cuenta el peso y la altura del individuo. La absorción y la depuración de los fármacos están influenciadas por múltiples factores, entre ellos la edad, el sexo, el metabolismo, el estado de la enfermedad, la función orgánica, las interacciones entre fármacos, la genética y la obesidad, que tienen un impacto importante en la concentración real del fármaco en el torrente sanguíneo de la persona. [18] [20] [21] Como resultado, existe una alta variabilidad en la concentración sistémica del fármaco de quimioterapia en personas dosificadas según el ASC, y se ha demostrado que esta variabilidad es más de diez veces mayor para muchos fármacos. [17] [22] En otras palabras, si dos personas reciben la misma dosis de un fármaco determinado según el ASC, la concentración de ese fármaco en el torrente sanguíneo de una persona puede ser 10 veces mayor o menor en comparación con la de la otra persona. [22] Esta variabilidad es típica de muchos fármacos de quimioterapia dosificados según el ASC y, como se muestra a continuación, se demostró en un estudio de 14 fármacos de quimioterapia comunes. [17]

El resultado de esta variabilidad farmacocinética entre las personas es que muchas de ellas no reciben la dosis adecuada para lograr una eficacia óptima del tratamiento con efectos secundarios tóxicos mínimos. Algunas personas reciben una sobredosis, mientras que otras reciben una dosis insuficiente. [18] [20] [21] [23] [24] [25] [26] Por ejemplo, en un ensayo clínico aleatorizado, los investigadores descubrieron que el 85 % de los pacientes con cáncer colorrectal metastásico tratados con 5-fluorouracilo (5-FU) no recibieron la dosis terapéutica óptima cuando se les administró según el estándar de la superficie corporal: el 68 % recibió una dosis insuficiente y el 17 % una sobredosis. [23]
Ha habido controversia sobre el uso del ASC para calcular las dosis de quimioterapia para personas obesas . [27] Debido a que su ASC es más alto, los médicos a menudo reducen arbitrariamente la dosis prescrita por la fórmula de ASC por temor a una sobredosis . [27] En muchos casos, esto puede resultar en un tratamiento subóptimo. [27]
Varios estudios clínicos han demostrado que cuando la dosis de quimioterapia se individualiza para lograr una exposición sistémica óptima al fármaco, los resultados del tratamiento mejoran y los efectos secundarios tóxicos se reducen. [23] [25] En el estudio clínico de 5-FU citado anteriormente, las personas cuya dosis se ajustó para lograr una exposición objetivo predeterminada experimentaron una mejora del 84% en la tasa de respuesta al tratamiento y una mejora de seis meses en la supervivencia general (SG) en comparación con las personas dosificadas según BSA. [23]
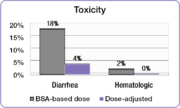
En el mismo estudio, los investigadores compararon la incidencia de toxicidades comunes de grado 3/4 asociadas con 5-FU entre las personas con dosis ajustadas y las personas dosificadas por ASA. [23] La incidencia de grados debilitantes de diarrea se redujo del 18% en el grupo dosificado por ASA al 4% en el grupo de dosis ajustada y se eliminaron los efectos secundarios hematológicos graves. [23] Debido a la toxicidad reducida, los pacientes con dosis ajustadas pudieron ser tratados durante períodos de tiempo más largos. [23] Las personas dosificadas por ASA fueron tratadas durante un total de 680 meses, mientras que las personas del grupo de dosis ajustada fueron tratadas durante un total de 791 meses. [23] Completar el curso del tratamiento es un factor importante para lograr mejores resultados del tratamiento.
Se obtuvieron resultados similares en un estudio en el que participaron personas con cáncer colorrectal que habían sido tratadas con el popular régimen FOLFOX . [25] La incidencia de diarrea grave se redujo del 12% en el grupo de pacientes que recibieron dosis de BSA al 1,7% en el grupo con dosis ajustada, y la incidencia de mucositis grave se redujo del 15% al 0,8%. [25]
El estudio FOLFOX también demostró una mejora en los resultados del tratamiento. [25] La respuesta positiva aumentó del 46 % en el grupo que recibió la dosis de ASC al 70 % en el grupo que recibió la dosis ajustada. La supervivencia libre de progresión (SLP) media y la supervivencia general (SG) mejoraron a los seis meses en el grupo que recibió la dosis ajustada. [25]
Un método que puede ayudar a los médicos a individualizar la dosificación de la quimioterapia es medir los niveles del fármaco en el plasma sanguíneo a lo largo del tiempo y ajustar la dosis según una fórmula o algoritmo para lograr una exposición óptima. Con una exposición objetivo establecida para una eficacia optimizada del tratamiento con toxicidades minimizadas, la dosificación se puede personalizar para lograr la exposición objetivo y resultados óptimos para cada persona. Este algoritmo se utilizó en los ensayos clínicos citados anteriormente y dio como resultado resultados de tratamiento significativamente mejorados. [28]
Los oncólogos ya están individualizando la dosificación de algunos fármacos contra el cáncer en función de la exposición. La dosificación de carboplatino [29] : 4 y busulfán [30] [31] se basa en los resultados de los análisis de sangre para calcular la dosis óptima para cada persona. También existen análisis de sangre sencillos para optimizar la dosis de metotrexato [32] , 5-FU, paclitaxel y docetaxel [33] [34 ]
El nivel de albúmina sérica inmediatamente antes de la administración de quimioterapia es un predictor pronóstico independiente de supervivencia en varios tipos de cáncer. [35]

Los agentes alquilantes son el grupo más antiguo de quimioterapéuticos en uso hoy en día. Originalmente derivados del gas mostaza utilizado en la Primera Guerra Mundial , ahora hay muchos tipos de agentes alquilantes en uso. [4] Se llaman así por su capacidad de alquilar muchas moléculas, incluidas las proteínas , el ARN y el ADN . Esta capacidad de unirse covalentemente al ADN a través de su grupo alquilo es la causa principal de sus efectos anticancerígenos. [37] El ADN está hecho de dos hebras y las moléculas pueden unirse dos veces a una hebra de ADN (enlace cruzado intrahebra) o pueden unirse una vez a ambas hebras (enlace cruzado interhebra). Si la célula intenta replicar el ADN reticulado durante la división celular , o intenta repararlo, las hebras de ADN pueden romperse. Esto conduce a una forma de muerte celular programada llamada apoptosis . [36] [38] Los agentes alquilantes funcionarán en cualquier punto del ciclo celular y, por lo tanto, se conocen como medicamentos independientes del ciclo celular. Por esta razón, el efecto sobre la célula depende de la dosis; La fracción de células que mueren es directamente proporcional a la dosis del fármaco. [39]
Los subtipos de agentes alquilantes son las mostazas nitrogenadas , nitrosoureas , tetrazinas , aziridinas , [40] cisplatinos y derivados, y agentes alquilantes no clásicos. Las mostazas nitrogenadas incluyen mecloretamina , ciclofosfamida , melfalán , clorambucilo , ifosfamida y busulfán . Las nitrosoureas incluyen N-nitroso-N-metilurea (MNU), carmustina (BCNU), lomustina (CCNU) y semustina (MeCCNU), fotemustina y estreptozotocina . Las tetrazinas incluyen dacarbazina , mitozolomida y temozolomida . Las aziridinas incluyen tiotepa , mitomicina y diaziquona (AZQ). El cisplatino y sus derivados incluyen cisplatino , carboplatino y oxaliplatino . [37] [38] Perjudican la función celular al formar enlaces covalentes con los grupos amino , carboxilo , sulfhidrilo y fosfato en moléculas biológicamente importantes. [41] Los agentes alquilantes no clásicos incluyen procarbazina y hexametilmelamina. [37] [38]

Los antimetabolitos son un grupo de moléculas que impiden la síntesis de ADN y ARN. Muchos de ellos tienen una estructura similar a los bloques de construcción del ADN y ARN. Los bloques de construcción son nucleótidos ; una molécula que comprende una nucleobase , un azúcar y un grupo fosfato . Las nucleobases se dividen en purinas ( guanina y adenina ) y pirimidinas ( citosina , timina y uracilo ). Los antimetabolitos se parecen a las nucleobases o nucleósidos (un nucleótido sin el grupo fosfato), pero tienen grupos químicos alterados . [42] Estos fármacos ejercen su efecto bloqueando las enzimas necesarias para la síntesis de ADN o incorporándose al ADN o ARN. Al inhibir las enzimas involucradas en la síntesis de ADN, previenen la mitosis porque el ADN no puede duplicarse a sí mismo. Además, después de la incorporación incorrecta de las moléculas al ADN, puede ocurrir daño al ADN y se induce la muerte celular programada ( apoptosis ). A diferencia de los agentes alquilantes, los antimetabolitos dependen del ciclo celular. Esto significa que sólo actúan durante una parte específica del ciclo celular, en este caso la fase S (la fase de síntesis del ADN). Por este motivo, a una dosis determinada, el efecto se estabiliza y, proporcionalmente, no se produce más muerte celular con dosis mayores. Los subtipos de antimetabolitos son los antifolatos , las fluoropirimidinas, los análogos de desoxinucleósidos y las tiopurinas . [37] [42]
Los antifolatos incluyen metotrexato y pemetrexed . El metotrexato inhibe la dihidrofolato reductasa (DHFR), una enzima que regenera tetrahidrofolato a partir de dihidrofolato . Cuando la enzima es inhibida por metotrexato, los niveles celulares de coenzimas de folato disminuyen. Estas son necesarias para la producción de timidilato y purina, que son esenciales para la síntesis de ADN y la división celular. [6] : 55–59 [7] : 11 El pemetrexed es otro antimetabolito que afecta la producción de purina y pirimidina y, por lo tanto, también inhibe la síntesis de ADN. Inhibe principalmente la enzima timidilato sintasa , pero también tiene efectos sobre DHFR, aminoimidazol carboxamida ribonucleótido formiltransferasa y glicinamida ribonucleótido formiltransferasa . [43] Las fluoropirimidinas incluyen fluorouracilo y capecitabina . El fluorouracilo es un análogo de nucleobase que se metaboliza en las células para formar al menos dos productos activos; 5-fluorouridina monofosfato (FUMP) y 5-fluoro-2'-desoxiuridina 5'-fosfato (fdUMP). FUMP se incorpora al ARN y fdUMP inhibe la enzima timidilato sintasa; ambos conducen a la muerte celular. [7] : 11 La capecitabina es un profármaco de 5-fluorouracilo que se descompone en las células para producir el fármaco activo. [44] Los análogos de desoxinucleósidos incluyen citarabina , gemcitabina , decitabina , azacitidina , fludarabina , nelarabina , cladribina , clofarabina y pentostatina . Las tiopurinas incluyen tioguanina y mercaptopurina . [37] [42]

Los agentes antimicrotúbulos son sustancias químicas derivadas de plantas que bloquean la división celular al impedir la función de los microtúbulos . Los microtúbulos son una estructura celular importante compuesta por dos proteínas, α-tubulina y β-tubulina . Son estructuras huecas, en forma de varilla, que son necesarias para la división celular, entre otras funciones celulares. [45] Los microtúbulos son estructuras dinámicas, lo que significa que están permanentemente en un estado de ensamblaje y desensamblaje. Los alcaloides de la vinca y los taxanos son los dos grupos principales de agentes antimicrotúbulos, y aunque ambos grupos de fármacos causan disfunción de los microtúbulos, sus mecanismos de acción son completamente opuestos: los alcaloides de la vinca impiden el ensamblaje de los microtúbulos, mientras que los taxanos impiden su desensamblaje. Al hacerlo, pueden inducir una catástrofe mitótica en las células cancerosas. [46] Después de esto, se produce la detención del ciclo celular, lo que induce la muerte celular programada ( apoptosis ). [37] [47] Estos medicamentos también pueden afectar el crecimiento de los vasos sanguíneos , un proceso esencial que los tumores utilizan para crecer y hacer metástasis. [47]
Los alcaloides de la vinca se derivan de la vincapervinca de Madagascar , Catharanthus roseus , [48] [49] anteriormente conocida como Vinca rosea . Se unen a sitios específicos de la tubulina, inhibiendo el ensamblaje de la tubulina en microtúbulos. Los alcaloides de la vinca originales son productos naturales que incluyen vincristina y vinblastina . [50] [51] [52] [53] Tras el éxito de estos fármacos, se produjeron alcaloides de la vinca semisintéticos : vinorelbina (utilizada en el tratamiento del cáncer de pulmón de células no pequeñas [52] [54] [55] ), vindesina y vinflunina . [47] Estos fármacos son específicos del ciclo celular . Se unen a las moléculas de tubulina en la fase S y previenen la formación adecuada de microtúbulos necesaria para la fase M. [39]
Los taxanos son fármacos naturales y semisintéticos. El primer fármaco de su clase, el paclitaxel , se extrajo originalmente del Taxus brevifolia , el tejo del Pacífico. Ahora, este fármaco y otro de esta clase, el docetaxel , se producen de forma semisintética a partir de una sustancia química que se encuentra en la corteza de otro tejo, el Taxus baccata . [56]
La podofilotoxina es un lignano antineoplásico obtenido principalmente de la mandrágora americana ( Podophyllum peltatum ) y de la mandrágora del Himalaya ( Sinopodophyllum hexandrum ). Tiene actividad antimicrotúbulos y su mecanismo es similar al de los alcaloides de la vinca en el sentido de que se unen a la tubulina, inhibiendo la formación de microtúbulos. La podofilotoxina se utiliza para producir otros dos fármacos con diferentes mecanismos de acción: etopósido y tenipósido . [57] [58]

Los inhibidores de la topoisomerasa son fármacos que afectan a la actividad de dos enzimas: la topoisomerasa I y la topoisomerasa II . Cuando se desenrolla la doble hélice del ADN, durante la replicación o transcripción del ADN , por ejemplo, el ADN adyacente sin abrir se enrolla más apretado (superenrollado), como si se abriera la mitad de una cuerda retorcida. El estrés causado por este efecto se ve ayudado en parte por las enzimas topoisomerasas. Producen roturas de cadena simple o doble en el ADN, reduciendo la tensión en la cadena de ADN. Esto permite que se produzca el desenrollado normal del ADN durante la replicación o transcripción. La inhibición de la topoisomerasa I o II interfiere con ambos procesos. [59] [60]
Dos inhibidores de la topoisomerasa I, el irinotecán y el topotecán , son derivados semisintéticamente de la camptotecina , que se obtiene del árbol ornamental chino Camptotheca acuminata . [39] Los fármacos que tienen como objetivo la topoisomerasa II se pueden dividir en dos grupos. Los venenos de la topoisomerasa II provocan un aumento de los niveles de enzimas unidas al ADN. Esto impide la replicación y transcripción del ADN, provoca roturas de la cadena de ADN y conduce a la muerte celular programada ( apoptosis ). Estos agentes incluyen etopósido , doxorrubicina , mitoxantrona y tenipósido . El segundo grupo, los inhibidores catalíticos, son fármacos que bloquean la actividad de la topoisomerasa II y, por lo tanto, impiden la síntesis y traducción del ADN porque el ADN no puede desenrollarse correctamente. Este grupo incluye novobiocina , merbarona y aclarubicina , que también tienen otros mecanismos de acción importantes. [61]
Los antibióticos citotóxicos son un grupo variado de fármacos que tienen diversos mecanismos de acción. El tema común que comparten en su indicación quimioterapéutica es que interrumpen la división celular . El subgrupo más importante son las antraciclinas y las bleomicinas ; otros ejemplos destacados incluyen la mitomicina C y la actinomicina . [62]
Entre las antraciclinas, la doxorrubicina y la daunorrubicina fueron las primeras, y se obtuvieron de la bacteria Streptomyces peucetius . [63] Los derivados de estos compuestos incluyen la epirrubicina y la idarrubicina . Otros fármacos utilizados clínicamente en el grupo de las antraciclinas son la pirarrubicina , la aclarrubicina y la mitoxantrona . [64] Los mecanismos de las antraciclinas incluyen la intercalación del ADN (las moléculas se insertan entre las dos hebras de ADN), la generación de radicales libres altamente reactivos que dañan las moléculas intercelulares y la inhibición de la topoisomerasa. [65]
La actinomicina es una molécula compleja que se intercala en el ADN y evita la síntesis de ARN . [66]
La bleomicina, un glucopéptido aislado de Streptomyces verticillus , también se intercala en el ADN, pero produce radicales libres que dañan el ADN. Esto ocurre cuando la bleomicina se une a un ion metálico , se reduce químicamente y reacciona con el oxígeno . [67] [6] : 87
La mitomicina es un antibiótico citotóxico con la capacidad de alquilar el ADN. [68]

La mayor parte de la quimioterapia se administra por vía intravenosa , aunque varios agentes pueden administrarse por vía oral (p. ej., melfalán , busulfán , capecitabina ). Según una revisión sistemática reciente (2016), las terapias orales presentan desafíos adicionales para los pacientes y los equipos de atención para mantener y apoyar la adherencia a los planes de tratamiento. [69]
Existen muchos métodos intravenosos de administración de fármacos, conocidos como dispositivos de acceso vascular. Entre ellos se incluyen el dispositivo de infusión con alas , el catéter venoso periférico , el catéter de línea media, el catéter central de inserción periférica (PICC), el catéter venoso central y el puerto implantable . Los dispositivos tienen diferentes aplicaciones en cuanto a la duración del tratamiento de quimioterapia, el método de administración y los tipos de agente quimioterapéutico. [7] : 94–95
Dependiendo de la persona, el cáncer, el estadio del cáncer, el tipo de quimioterapia y la dosis, la quimioterapia intravenosa puede administrarse de forma ambulatoria o hospitalaria . Para la administración continua, frecuente o prolongada de quimioterapia intravenosa, se pueden insertar quirúrgicamente varios sistemas en la vasculatura para mantener el acceso. [7] : 113–118 Los sistemas más utilizados son la vía Hickman , la Port-a-Cath y la vía PICC . Estas tienen un menor riesgo de infección, son mucho menos propensas a la flebitis o la extravasación y eliminan la necesidad de la inserción repetida de cánulas periféricas. [70]
La perfusión aislada de las extremidades (que se utiliza a menudo en el melanoma ) [71] o la infusión aislada de quimioterapia en el hígado [72] o en el pulmón se han utilizado para tratar algunos tumores. El objetivo principal de estos enfoques es administrar una dosis muy alta de quimioterapia en los sitios del tumor sin causar un daño sistémico abrumador. [73] Estos enfoques pueden ayudar a controlar las metástasis solitarias o limitadas, pero por definición no son sistémicos y, por lo tanto, no tratan las metástasis distribuidas o las micrometástasis . [ cita requerida ]
Las quimioterapias tópicas, como el 5-fluorouracilo , se utilizan para tratar algunos casos de cáncer de piel no melanoma . [74]
Si el cáncer afecta el sistema nervioso central o hay enfermedad meníngea, se puede administrar quimioterapia intratecal . [4]
Las técnicas quimioterapéuticas tienen una variedad de efectos secundarios que dependen del tipo de medicamento utilizado. Los medicamentos más comunes afectan principalmente a las células del cuerpo que se dividen rápidamente , como las células sanguíneas y las células que recubren la boca, el estómago y los intestinos. Las toxicidades relacionadas con la quimioterapia pueden ocurrir de manera aguda después de la administración, en cuestión de horas o días, o de manera crónica, de semanas a años. [6] : 265
Prácticamente todos los regímenes quimioterapéuticos pueden causar depresión del sistema inmunológico , a menudo paralizando la médula ósea y provocando una disminución de los glóbulos blancos , los glóbulos rojos y las plaquetas . La anemia y la trombocitopenia pueden requerir transfusión sanguínea . La neutropenia (una disminución del recuento de granulocitos neutrófilos por debajo de 0,5 x 10 9 / litro ) se puede mejorar con G-CSF sintético ( factor estimulante de colonias de granulocitos , p. ej., filgrastim , lenograstim , efbemalenograstim alfa ). [75]
En casos de mielosupresión muy grave , que se produce en algunos regímenes, se destruyen casi todas las células madre de la médula ósea (células que producen glóbulos blancos y rojos), lo que significa que son necesarios trasplantes alogénicos o autólogos de células de médula ósea . (En los trasplantes autólogos de médula ósea, las células se extraen de la persona antes del tratamiento, se multiplican y luego se vuelven a inyectar después; en los trasplantes alogénicos de médula ósea, la fuente es un donante). Sin embargo, algunas personas aún desarrollan enfermedades debido a esta interferencia con la médula ósea. [76]
Aunque se anima a las personas que reciben quimioterapia a lavarse las manos, evitar a las personas enfermas y tomar otras medidas para reducir las infecciones, alrededor del 85% de las infecciones se deben a microorganismos que se producen de forma natural en el tracto gastrointestinal de la propia persona (incluida la cavidad oral ) y la piel. [77] : 130 Esto puede manifestarse como infecciones sistémicas, como sepsis , o como brotes localizados, como herpes simple , herpes zóster u otros miembros de Herpesviridea . [78] El riesgo de enfermedad y muerte se puede reducir tomando antibióticos comunes como quinolonas o trimetoprima/sulfametoxazol antes de que aparezca cualquier fiebre o signo de infección. [79] Las quinolonas muestran una profilaxis eficaz principalmente con cáncer hematológico. [79] Sin embargo, en general, por cada cinco personas inmunodeprimidas después de la quimioterapia que toman un antibiótico, se puede prevenir una fiebre; por cada 34 que toman un antibiótico, se puede prevenir una muerte. [79] A veces, los tratamientos de quimioterapia se posponen porque el sistema inmunológico está suprimido a un nivel críticamente bajo. [ cita requerida ]
En Japón , el gobierno ha aprobado el uso de algunos hongos medicinales como Trametes versicolor , para contrarrestar la depresión del sistema inmunológico en personas sometidas a quimioterapia. [80]
El trilaciclib es un inhibidor de la cinasa dependiente de ciclina 4/6 aprobado para la prevención de la mielosupresión causada por la quimioterapia. El fármaco se administra antes de la quimioterapia para proteger la función de la médula ósea. [81]
Debido a la supresión del sistema inmunológico, la enterocolitis neutropénica (tiflitis) es una "complicación gastrointestinal potencialmente mortal de la quimioterapia". [82] La tiflitis es una infección intestinal que puede manifestarse a través de síntomas que incluyen náuseas , vómitos , diarrea , abdomen distendido , fiebre , escalofríos o dolor y sensibilidad abdominal . [83]
La tiflitis es una emergencia médica . Tiene un pronóstico muy malo y suele ser mortal a menos que se la reconozca rápidamente y se la trate de manera agresiva. [84] El éxito del tratamiento depende del diagnóstico temprano proporcionado por un alto índice de sospecha y el uso de tomografía computarizada, el tratamiento no quirúrgico para los casos sin complicaciones y, a veces, la hemicolectomía derecha electiva para prevenir la recurrencia. [84]
Náuseas , vómitos , anorexia , diarrea , calambres abdominales y estreñimiento son efectos secundarios comunes de los medicamentos quimioterapéuticos que matan las células que se dividen rápidamente. [85] La desnutrición y la deshidratación pueden resultar cuando el receptor no come o bebe lo suficiente, o cuando la persona vomita con frecuencia, debido al daño gastrointestinal. Esto puede resultar en una rápida pérdida de peso, o en ocasiones en un aumento de peso, si la persona come demasiado en un esfuerzo por aliviar las náuseas o la acidez estomacal. El aumento de peso también puede ser causado por algunos medicamentos esteroides. Estos efectos secundarios con frecuencia se pueden reducir o eliminar con medicamentos antieméticos . La evidencia de baja certeza también sugiere que los probióticos pueden tener un efecto preventivo y de tratamiento de la diarrea relacionada con la quimioterapia sola y con la radioterapia. [86] Sin embargo, es apropiado un alto índice de sospecha, ya que la diarrea y la hinchazón también son síntomas de tiflitis , una emergencia médica muy grave y potencialmente mortal que requiere tratamiento inmediato. [87]
La anemia puede ser un resultado combinado causado por la quimioterapia mielosupresora y posibles causas relacionadas con el cáncer, como sangrado , destrucción de células sanguíneas ( hemólisis ), enfermedad hereditaria, disfunción renal, deficiencias nutricionales o anemia por enfermedad crónica . Los tratamientos para mitigar la anemia incluyen hormonas para estimular la producción de sangre ( eritropoyetina ), suplementos de hierro y transfusiones de sangre . [88] [89] [90] La terapia mielosupresora puede causar una tendencia a sangrar fácilmente, lo que lleva a la anemia. Los medicamentos que matan células que se dividen rápidamente o células sanguíneas pueden reducir la cantidad de plaquetas en la sangre, lo que puede provocar hematomas y sangrado . Los recuentos de plaquetas extremadamente bajos pueden aumentarse temporalmente a través de transfusiones de plaquetas y se están desarrollando nuevos medicamentos para aumentar los recuentos de plaquetas durante la quimioterapia. [91] [92] [93] [94] A veces, los tratamientos de quimioterapia se posponen para permitir que se recuperen los recuentos de plaquetas.
La fatiga puede ser consecuencia del cáncer o de su tratamiento y puede durar meses o años después del tratamiento. Una causa fisiológica de la fatiga es la anemia, que puede ser causada por quimioterapia, cirugía , radioterapia , enfermedad primaria y metastásica o agotamiento nutricional. [95] [96] Se ha descubierto que el ejercicio aeróbico es beneficioso para reducir la fatiga en personas con tumores sólidos . [97]
Las náuseas y los vómitos son dos de los efectos secundarios relacionados con el tratamiento del cáncer más temidos por las personas con cáncer y sus familias. En 1983, Coates et al. descubrieron que las personas que recibían quimioterapia clasificaban las náuseas y los vómitos como el primer y segundo efecto secundario más grave, respectivamente. [98] Hasta el 20% de las personas que recibían agentes altamente emetogénicos en esta era posponían, o incluso rechazaban, tratamientos potencialmente curativos. [99] Las náuseas y los vómitos inducidos por la quimioterapia (NVIQ) son comunes con muchos tratamientos y algunas formas de cáncer. Desde la década de 1990, se han desarrollado y comercializado varias clases nuevas de antieméticos , que se han convertido en un estándar casi universal en los regímenes de quimioterapia y ayudan a controlar con éxito estos síntomas en muchas personas. La mediación eficaz de estos síntomas desagradables y a veces debilitantes da como resultado una mayor calidad de vida para el receptor y ciclos de tratamiento más eficientes, debido a una menor interrupción del tratamiento debido a una mejor tolerancia y una mejor salud general. [100]

La pérdida de cabello (alopecia) puede ser causada por la quimioterapia que mata las células que se dividen rápidamente; otros medicamentos pueden hacer que el cabello se vuelva más fino. Estos son efectos más a menudo temporales: el cabello generalmente comienza a crecer nuevamente unas semanas después del último tratamiento, pero a veces con un cambio de color, textura, grosor o estilo. A veces el cabello tiene una tendencia a rizarse después del recrecimiento, lo que resulta en "rizos de quimioterapia". La pérdida grave del cabello ocurre con mayor frecuencia con medicamentos como doxorrubicina , daunorrubicina , paclitaxel , docetaxel , ciclofosfamida , ifosfamida y etopósido . El adelgazamiento permanente o la pérdida del cabello pueden ser resultado de algunos regímenes de quimioterapia estándar. [101]
La pérdida de cabello inducida por quimioterapia ocurre por un mecanismo no androgénico y puede manifestarse como alopecia total , efluvio telógeno o, con menor frecuencia, alopecia areata . [102] Generalmente se asocia con un tratamiento sistémico debido a la alta tasa mitótica de los folículos pilosos y es más reversible que la pérdida de cabello androgénica, [103] [104] aunque pueden ocurrir casos permanentes. [105] La quimioterapia induce la pérdida de cabello en las mujeres con más frecuencia que en los hombres. [106]
El enfriamiento del cuero cabelludo ofrece un medio para prevenir la pérdida de cabello tanto permanente como temporal; sin embargo, se han planteado preocupaciones sobre este método. [107] [108]
Puede desarrollarse una neoplasia secundaria después de un tratamiento exitoso de quimioterapia o radioterapia. La neoplasia secundaria más común es la leucemia mieloide aguda secundaria, que se desarrolla principalmente después del tratamiento con agentes alquilantes o inhibidores de la topoisomerasa. [109] Los sobrevivientes de cáncer infantil tienen más de 13 veces más probabilidades de desarrollar una neoplasia secundaria durante los 30 años posteriores al tratamiento que la población general. [110] No todo este aumento puede atribuirse a la quimioterapia.
Algunos tipos de quimioterapia son gonadotóxicos y pueden causar infertilidad . [111] Las quimioterapias con alto riesgo incluyen procarbazina y otros fármacos alquilantes como ciclofosfamida, ifosfamida, busulfán, melfalán, clorambucilo y clormetina. [111] Los fármacos con riesgo medio incluyen doxorrubicina y análogos de platino como cisplatino y carboplatino. [111] Por otro lado, las terapias con bajo riesgo de gonadotoxicidad incluyen derivados de plantas como vincristina y vinblastina, antibióticos como bleomicina y dactinomicina, y antimetabolitos como metotrexato, mercaptopurina y 5-fluorouracilo. [111]
La infertilidad femenina por quimioterapia parece ser secundaria a una falla ovárica prematura por pérdida de folículos primordiales . [112] Esta pérdida no es necesariamente un efecto directo de los agentes quimioterapéuticos, sino que podría deberse a una mayor tasa de inicio del crecimiento para reemplazar los folículos en desarrollo dañados. [112]
Las personas pueden elegir entre varios métodos de preservación de la fertilidad antes de la quimioterapia, incluida la criopreservación de semen, tejido ovárico, ovocitos o embriones. [113] Como más de la mitad de los pacientes con cáncer son ancianos, este efecto adverso solo es relevante para una minoría de pacientes. Un estudio realizado en Francia entre 1999 y 2011 llegó al resultado de que la congelación de embriones antes de la administración de agentes gonadotóxicos a mujeres causó un retraso del tratamiento en el 34% de los casos y un nacimiento vivo en el 27% de los casos supervivientes que querían quedarse embarazadas, con un tiempo de seguimiento que variaba entre 1 y 13 años. [114]
Los agentes protectores o atenuantes potenciales incluyen análogos de GnRH , donde varios estudios han demostrado un efecto protector in vivo en humanos, pero algunos estudios no muestran tal efecto. La esfingosina-1-fosfato (S1P) ha mostrado un efecto similar, pero su mecanismo de inhibición de la vía apoptótica de la esfingomielina también puede interferir con la acción apoptótica de los fármacos de quimioterapia. [115]
En la quimioterapia como régimen de acondicionamiento en el trasplante de células madre hematopoyéticas, un estudio de personas acondicionadas con ciclofosfamida sola para anemia aplásica grave llegó al resultado de que la recuperación ovárica ocurrió en todas las mujeres menores de 26 años al momento del trasplante, pero solo en cinco de 16 mujeres mayores de 26 años. [116]
La quimioterapia es teratogénica durante el embarazo , especialmente durante el primer trimestre , hasta el punto de que generalmente se recomienda el aborto si se detecta un embarazo en este período durante la quimioterapia. [117] La exposición en el segundo y tercer trimestre generalmente no aumenta el riesgo teratogénico ni los efectos adversos sobre el desarrollo cognitivo, pero puede aumentar el riesgo de diversas complicaciones del embarazo y mielosupresión fetal. [117]
Las pacientes femeninas con potencial reproductivo deben utilizar un método anticonceptivo eficaz durante la quimioterapia y durante algunos meses después de la última dosis (por ejemplo, 6 meses para la doxorrubicina [118] ).
En los varones que se han sometido previamente a quimioterapia o radioterapia, no parece haber un aumento de defectos genéticos o malformaciones congénitas en sus hijos concebidos después de la terapia. [117] El uso de tecnologías de reproducción asistida y técnicas de micromanipulación podría aumentar este riesgo. [117] En las mujeres que se han sometido previamente a quimioterapia, el aborto espontáneo y las malformaciones congénitas no aumentan en las concepciones posteriores. [117] Sin embargo, cuando se practica la fertilización in vitro y la criopreservación de embriones entre o poco después del tratamiento, existen posibles riesgos genéticos para los ovocitos en crecimiento y, por lo tanto, se ha recomendado que los bebés sean examinados. [117]
Entre el 30 y el 40 por ciento de las personas que se someten a quimioterapia experimentan neuropatía periférica inducida por quimioterapia (CIPN), una afección progresiva, duradera y a menudo irreversible, que causa dolor, hormigueo, entumecimiento y sensibilidad al frío, que comienza en las manos y los pies y, a veces, progresa a los brazos y las piernas. [119] Los medicamentos de quimioterapia asociados con CIPN incluyen talidomida , epotilonas , alcaloides de la vinca , taxanos, inhibidores del proteasoma y los medicamentos basados en platino. [119] [120] Si surge CIPN, y en qué grado, está determinado por la elección del medicamento, la duración del uso, la cantidad total consumida y si la persona ya tiene neuropatía periférica . Aunque los síntomas son principalmente sensoriales, en algunos casos se ven afectados los nervios motores y el sistema nervioso autónomo . [121] La CIPN a menudo sigue a la primera dosis de quimioterapia y aumenta en gravedad a medida que continúa el tratamiento, pero esta progresión generalmente se estabiliza al finalizar el tratamiento. Los medicamentos basados en platino son la excepción; Con estos medicamentos, la sensibilidad puede continuar deteriorándose durante varios meses después de finalizar el tratamiento. [122] Algunas CIPN parecen ser irreversibles. [122] El dolor a menudo se puede controlar con medicamentos u otros tratamientos, pero el entumecimiento suele ser resistente al tratamiento. [123]
Algunas personas que reciben quimioterapia informan fatiga o problemas neurocognitivos no específicos, como incapacidad para concentrarse; esto a veces se denomina deterioro cognitivo posterior a la quimioterapia , y se lo conoce como "cerebro de quimioterapia" en los medios sociales y populares. [124]
En tumores particularmente grandes y cánceres con recuentos altos de glóbulos blancos , como linfomas , teratomas y algunas leucemias , algunas personas desarrollan síndrome de lisis tumoral . La rápida descomposición de las células cancerosas provoca la liberación de sustancias químicas desde el interior de las células. Después de esto, se encuentran altos niveles de ácido úrico , potasio y fosfato en la sangre. Los altos niveles de fosfato inducen hipoparatiroidismo secundario, lo que resulta en niveles bajos de calcio en la sangre. [125] Esto causa daño renal y los altos niveles de potasio pueden causar arritmia cardíaca . Aunque la profilaxis está disponible y a menudo se inicia en personas con tumores grandes, este es un efecto secundario peligroso que puede provocar la muerte si no se trata. [7] : 202
La cardiotoxicidad (daño cardíaco) es especialmente prominente con el uso de fármacos antraciclínicos ( doxorrubicina , epirrubicina , idarrubicina y doxorrubicina liposomal ). La causa de esto se debe muy probablemente a la producción de radicales libres en la célula y al daño subsiguiente del ADN . Otros agentes quimioterapéuticos que causan cardiotoxicidad, pero con una incidencia menor, son la ciclofosfamida , el docetaxel y la clofarabina . [126]
La hepatotoxicidad (daño hepático) puede ser causada por muchos fármacos citotóxicos. La susceptibilidad de un individuo al daño hepático puede verse alterada por otros factores como el propio cáncer, la hepatitis viral , la inmunosupresión y la deficiencia nutricional . El daño hepático puede consistir en daño a las células hepáticas, síndrome sinusoidal hepático (obstrucción de las venas del hígado), colestasis (donde la bilis no fluye desde el hígado al intestino) y fibrosis hepática . [127] [128]
La nefrotoxicidad (daño renal) puede ser causada por el síndrome de lisis tumoral y también por efectos directos de la depuración de fármacos por los riñones. Diferentes fármacos afectarán distintas partes del riñón y la toxicidad puede ser asintomática (solo se observa en análisis de sangre u orina) o puede causar lesión renal aguda . [129] [130]
La ototoxicidad (daño al oído interno) es un efecto secundario común de los medicamentos a base de platino que puede producir síntomas como mareos y vértigo . [131] [132] Se ha descubierto que los niños tratados con análogos del platino corren el riesgo de desarrollar pérdida auditiva. [133] [134] [135]
Los efectos secundarios menos comunes incluyen enrojecimiento de la piel ( eritema ), piel seca, uñas dañadas, boca seca ( xerostomía ), retención de líquidos e impotencia sexual . Algunos medicamentos pueden provocar reacciones alérgicas o pseudoalérgicas .
Los agentes quimioterapéuticos específicos están asociados con toxicidades específicas de órganos, incluyendo enfermedad cardiovascular (p. ej., doxorrubicina ), enfermedad pulmonar intersticial (p. ej., bleomicina ) y ocasionalmente neoplasia secundaria (p. ej., terapia MOPP para la enfermedad de Hodgkin). [136]
El síndrome mano-pie es otro efecto secundario de la quimioterapia citotóxica. [137]
Los problemas nutricionales también se observan con frecuencia en pacientes con cáncer en el momento del diagnóstico y durante el tratamiento de quimioterapia. Las investigaciones sugieren que en niños y jóvenes sometidos a tratamiento contra el cáncer, la nutrición parenteral puede ayudar con esto, lo que conduce a un aumento de peso y una mayor ingesta de calorías y proteínas, en comparación con la nutrición enteral. [138]
La quimioterapia no siempre funciona y, aun cuando sea útil, puede que no destruya por completo el cáncer. Con frecuencia, la gente no comprende sus limitaciones. En un estudio de personas a las que se les había diagnosticado recientemente un cáncer incurable en etapa 4 , más de dos tercios de las personas con cáncer de pulmón y más de cuatro quintos de las personas con cáncer colorrectal todavía creían que era probable que la quimioterapia curara su cáncer. [139]
La barrera hematoencefálica supone un obstáculo para la administración de quimioterapia al cerebro . Esto se debe a que el cerebro cuenta con un amplio sistema para protegerlo de sustancias químicas nocivas. Los transportadores de fármacos pueden bombear fármacos desde el cerebro y las células de los vasos sanguíneos cerebrales hacia el líquido cefalorraquídeo y la circulación sanguínea. Estos transportadores bombean la mayoría de los fármacos de quimioterapia, lo que reduce su eficacia para el tratamiento de tumores cerebrales. Solo los pequeños agentes alquilantes lipofílicos , como la lomustina o la temozolomida, pueden atravesar esta barrera hematoencefálica. [140] [141] [142]
Los vasos sanguíneos de los tumores son muy diferentes de los que se observan en los tejidos normales. A medida que un tumor crece, las células tumorales más alejadas de los vasos sanguíneos se vuelven pobres en oxígeno ( hipóxicas ). Para contrarrestar esto, envían señales para que crezcan nuevos vasos sanguíneos. La vasculatura tumoral recién formada está mal formada y no proporciona un suministro de sangre adecuado a todas las áreas del tumor. Esto genera problemas con la administración de medicamentos porque muchos de ellos se administrarán al tumor a través del sistema circulatorio . [143]
La resistencia es una de las principales causas del fracaso del tratamiento de los fármacos quimioterapéuticos. Hay algunas posibles causas de resistencia en el cáncer, una de las cuales es la presencia de pequeñas bombas en la superficie de las células cancerosas que mueven activamente la quimioterapia desde el interior de la célula al exterior. Las células cancerosas producen grandes cantidades de estas bombas, conocidas como p-glicoproteína , para protegerse de los quimioterapéuticos. La investigación sobre la p-glicoproteína y otras bombas de eflujo de quimioterapia similares está actualmente en curso. Se están investigando medicamentos para inhibir la función de la p-glicoproteína, pero debido a las toxicidades e interacciones con los medicamentos contra el cáncer, su desarrollo ha sido difícil. [144] [145] Otro mecanismo de resistencia es la amplificación genética , un proceso en el que las células cancerosas producen múltiples copias de un gen. Esto supera el efecto de los medicamentos que reducen la expresión de los genes involucrados en la replicación. Con más copias del gen, el medicamento no puede prevenir toda la expresión del gen y, por lo tanto, la célula puede restaurar su capacidad proliferativa. Las células cancerosas también pueden causar defectos en las vías celulares de apoptosis (muerte celular programada). Como la mayoría de los medicamentos de quimioterapia matan a las células cancerosas de esta manera, la apoptosis defectuosa permite la supervivencia de estas células, haciéndolas resistentes. Muchos medicamentos de quimioterapia también causan daño al ADN, que puede ser reparado por enzimas en la célula que llevan a cabo la reparación del ADN . La regulación positiva de estos genes puede superar el daño al ADN y prevenir la inducción de la apoptosis. Pueden ocurrir mutaciones en genes que producen proteínas diana de medicamentos, como la tubulina , que impiden que los medicamentos se unan a la proteína, lo que lleva a la resistencia a este tipo de medicamentos. [146] Los medicamentos utilizados en quimioterapia pueden inducir estrés celular, que puede matar una célula cancerosa; sin embargo, bajo ciertas condiciones, el estrés celular puede inducir cambios en la expresión genética que permiten la resistencia a varios tipos de medicamentos. [147] En el cáncer de pulmón , se cree que el factor de transcripción NFκB juega un papel en la resistencia a la quimioterapia, a través de vías inflamatorias. [148] [149] [150]
Las terapias dirigidas son una clase relativamente nueva de medicamentos contra el cáncer que pueden superar muchos de los problemas observados con el uso de citotóxicos. Se dividen en dos grupos: moléculas pequeñas y anticuerpos. La toxicidad masiva observada con el uso de citotóxicos se debe a la falta de especificidad celular de los medicamentos. Matan cualquier célula que se divida rápidamente, tumoral o normal. Las terapias dirigidas están diseñadas para afectar las proteínas celulares o los procesos que utilizan las células cancerosas. [151] Esto permite una dosis alta para los tejidos cancerosos con una dosis relativamente baja para otros tejidos. Aunque los efectos secundarios son a menudo menos graves que los observados con los quimioterapéuticos citotóxicos, pueden ocurrir efectos potencialmente mortales. Inicialmente, se suponía que las terapias dirigidas eran únicamente selectivas para una proteína. Ahora está claro que a menudo hay una variedad de objetivos proteicos a los que el medicamento puede unirse. Un ejemplo de objetivo para la terapia dirigida es la proteína BCR-ABL1 producida a partir del cromosoma Filadelfia , una lesión genética que se encuentra comúnmente en la leucemia mieloide crónica y en algunos pacientes con leucemia linfoblástica aguda . Esta proteína de fusión tiene una actividad enzimática que puede ser inhibida por imatinib , un fármaco de molécula pequeña . [152] [153] [154] [155]

El cáncer es el crecimiento descontrolado de células acompañado de un comportamiento maligno : invasión y metástasis (entre otras características). [156] Es causado por la interacción entre la susceptibilidad genética y factores ambientales. [157] [158] Estos factores conducen a acumulaciones de mutaciones genéticas en oncogenes (genes que controlan la tasa de crecimiento de las células) y genes supresores de tumores (genes que ayudan a prevenir el cáncer), lo que da a las células cancerosas sus características malignas, como el crecimiento descontrolado. [159] : 93–94
En sentido amplio, la mayoría de los fármacos quimioterapéuticos actúan alterando la mitosis ( división celular ), y se dirigen de manera efectiva a las células que se dividen rápidamente . Como estos fármacos causan daño a las células, se los denomina citotóxicos . Previenen la mitosis mediante diversos mecanismos, entre ellos el daño al ADN y la inhibición de la maquinaria celular involucrada en la división celular. [39] [160] Una teoría sobre por qué estos fármacos matan a las células cancerosas es que inducen una forma programada de muerte celular conocida como apoptosis . [161]
Como la quimioterapia afecta la división celular, los tumores con altas tasas de crecimiento (como la leucemia mieloide aguda y los linfomas agresivos , incluida la enfermedad de Hodgkin ) son más sensibles a la quimioterapia, ya que una mayor proporción de las células diana están experimentando división celular en cualquier momento. Las neoplasias malignas con tasas de crecimiento más lentas, como los linfomas indolentes, tienden a responder a la quimioterapia de manera mucho más modesta. [4] Los tumores heterogéneos también pueden mostrar sensibilidades variables a los agentes de quimioterapia, dependiendo de las poblaciones subclonales dentro del tumor. [162]
Las células del sistema inmunológico también contribuyen de manera crucial a los efectos antitumorales de la quimioterapia. [163] Por ejemplo, los fármacos quimioterapéuticos oxaliplatino y ciclofosfamida pueden provocar que las células tumorales mueran de una manera detectable por el sistema inmunológico (llamada muerte celular inmunogénica ), que moviliza células inmunes con funciones antitumorales. [164] Los fármacos quimioterapéuticos que provocan la muerte inmunogénica de las células tumorales del cáncer pueden hacer que los tumores que no responden sean sensibles a la terapia de puntos de control inmunológico . [165]
Algunos fármacos de quimioterapia se utilizan en enfermedades distintas del cáncer, como en trastornos autoinmunes, [166] y discrasia de células plasmáticas no cancerosas . En algunos casos se suelen utilizar en dosis más bajas, lo que significa que los efectos secundarios se minimizan, [166] mientras que en otros casos se utilizan dosis similares a las utilizadas para tratar el cáncer. El metotrexato se utiliza en el tratamiento de la artritis reumatoide (AR), [167] psoriasis , [168] espondilitis anquilosante [169] y esclerosis múltiple . [170] [171] Se cree que la respuesta antiinflamatoria observada en la AR se debe a aumentos de adenosina , que causa inmunosupresión ; efectos sobre las vías de la enzima ciclooxigenasa -2 inmunorreguladora ; reducción de las citocinas proinflamatorias ; y propiedades antiproliferativas. [167] Aunque el metotrexato se utiliza para tratar tanto la esclerosis múltiple como la espondilitis anquilosante, su eficacia en estas enfermedades aún es incierta. [169] [170] [171] La ciclofosfamida se utiliza a veces para tratar la nefritis lúpica , un síntoma común del lupus eritematoso sistémico . [172] La dexametasona junto con bortezomib o melfalán se utiliza comúnmente como tratamiento para la amiloidosis AL . Recientemente, el bortezomid en combinación con ciclofosfamida y dexametasona también ha demostrado ser prometedor como tratamiento para la amiloidosis AL. Otros medicamentos utilizados para tratar el mieloma, como la lenalidomida, han demostrado ser prometedores en el tratamiento de la amiloidosis AL. [173]
Los medicamentos quimioterapéuticos también se utilizan en regímenes de acondicionamiento previos al trasplante de médula ósea ( trasplante de células madre hematopoyéticas ). Los regímenes de acondicionamiento se utilizan para suprimir el sistema inmunológico del receptor con el fin de permitir que se injerte un trasplante. La ciclofosfamida es un fármaco citotóxico común utilizado de esta manera y a menudo se utiliza junto con la irradiación corporal total . Los medicamentos quimioterapéuticos se pueden utilizar en dosis altas para eliminar permanentemente las células de la médula ósea del receptor (acondicionamiento mieloablativo) o en dosis más bajas que evitarán la pérdida permanente de médula ósea (acondicionamiento no mieloablativo y de intensidad reducida). [174] Cuando se utiliza en un entorno no oncológico, el tratamiento todavía se llama "quimioterapia" y a menudo se realiza en los mismos centros de tratamiento que se utilizan para las personas con cáncer.
En la década de 1970, los fármacos antineoplásicos (quimioterapéuticos) fueron identificados como peligrosos, y desde entonces la Sociedad Estadounidense de Farmacéuticos de Sistemas de Salud (ASHP) ha introducido el concepto de fármacos peligrosos después de publicar una recomendación en 1983 sobre el manejo de fármacos peligrosos. La adaptación de las regulaciones federales se produjo cuando la Administración de Seguridad y Salud Ocupacional de los Estados Unidos (OSHA) publicó por primera vez sus directrices en 1986 y luego las actualizó en 1996, 1999 y, más recientemente, en 2006. [175]
Desde entonces, el Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH) ha estado realizando una evaluación en el lugar de trabajo con respecto a estos medicamentos. La exposición ocupacional a medicamentos antineoplásicos se ha relacionado con múltiples efectos sobre la salud, incluida la infertilidad y posibles efectos cancerígenos. El informe de alerta del NIOSH ha informado de algunos casos, como uno en el que se diagnosticó carcinoma papilar de células transicionales a una farmacéutica. Doce años antes de que se le diagnosticara la enfermedad, la farmacéutica había trabajado durante 20 meses en un hospital donde era responsable de preparar múltiples medicamentos antineoplásicos. [176] La farmacéutica no tenía ningún otro factor de riesgo de cáncer y, por lo tanto, su cáncer se atribuyó a la exposición a los medicamentos antineoplásicos, aunque no se ha establecido una relación de causa y efecto en la literatura. Otro caso ocurrió cuando se cree que un mal funcionamiento de un gabinete de bioseguridad expuso al personal de enfermería a medicamentos antineoplásicos. Las investigaciones revelaron evidencia de biomarcadores genotóxicos dos y nueve meses después de esa exposición.
Los fármacos antineoplásicos se administran habitualmente por vía intravenosa , intramuscular , intratecal o subcutánea . En la mayoría de los casos, antes de administrar el medicamento al paciente, es necesario que varios trabajadores lo preparen y manipulen. Cualquier trabajador que esté involucrado en la manipulación, preparación o administración de los fármacos, o en la limpieza de objetos que hayan estado en contacto con los fármacos antineoplásicos, está potencialmente expuesto a fármacos peligrosos. [177] Los trabajadores de la salud están expuestos a los fármacos en diferentes circunstancias, como cuando los farmacéuticos y los técnicos de farmacia preparan y manipulan los fármacos antineoplásicos y cuando las enfermeras y los médicos administran los fármacos a los pacientes. Además, quienes son responsables de desechar los fármacos antineoplásicos en los centros de atención médica también corren el riesgo de exposición. [178]
Se cree que la exposición dérmica es la principal vía de exposición debido al hecho de que se han encontrado cantidades significativas de los agentes antineoplásicos en los guantes que usan los trabajadores de la salud que preparan, manipulan y administran los agentes. Otra vía de exposición notable es la inhalación de los vapores de los medicamentos. Múltiples estudios han investigado la inhalación como una vía de exposición, y aunque el muestreo de aire no ha mostrado niveles peligrosos, sigue siendo una vía de exposición potencial. La ingestión de la mano a la boca es una vía de exposición que es menos probable en comparación con otras debido al estándar de higiene impuesto en las instituciones de salud. Sin embargo, sigue siendo una vía potencial, especialmente en el lugar de trabajo, fuera de un instituto de salud. Uno también puede estar expuesto a estos medicamentos peligrosos a través de inyecciones con agujas . La investigación realizada en esta área ha establecido que la exposición ocupacional ocurre al examinar la evidencia en múltiples muestras de orina de trabajadores de la salud. [179]
Los medicamentos peligrosos exponen a los trabajadores de la salud a graves riesgos para la salud. Muchos estudios muestran que los medicamentos antineoplásicos pueden tener muchos efectos secundarios en el sistema reproductivo, como pérdida fetal, malformaciones congénitas e infertilidad. Los trabajadores de la salud que están expuestos a medicamentos antineoplásicos en muchas ocasiones tienen resultados reproductivos adversos, como abortos espontáneos, muerte fetal y malformaciones congénitas. Además, los estudios han demostrado que la exposición a estos medicamentos conduce a irregularidades en el ciclo menstrual. Los medicamentos antineoplásicos también pueden aumentar el riesgo de discapacidades de aprendizaje entre los hijos de los trabajadores de la salud expuestos a estas sustancias peligrosas. [180]
Además, estos fármacos tienen efectos cancerígenos . En las últimas cinco décadas, múltiples estudios han demostrado los efectos cancerígenos de la exposición a fármacos antineoplásicos. De manera similar, ha habido estudios de investigación que vincularon los agentes alquilantes con el desarrollo de leucemias en humanos. Los estudios han informado de un riesgo elevado de cáncer de mama, cáncer de piel no melanoma y cáncer de recto entre las enfermeras expuestas a estos fármacos. Otras investigaciones revelaron que existe un posible efecto genotóxico de los fármacos antineoplásicos para los trabajadores de los entornos sanitarios. [176]
A partir de 2018, no se establecieron límites de exposición ocupacional para medicamentos antineoplásicos, es decir, la OSHA o la Conferencia Americana de Higienistas Industriales Gubernamentales (ACGIH) no han establecido pautas de seguridad en el lugar de trabajo. [181]
El NIOSH recomienda utilizar un gabinete ventilado diseñado para disminuir la exposición de los trabajadores. Además, recomienda la capacitación de todo el personal, el uso de gabinetes, la implementación de una evaluación inicial de la técnica del programa de seguridad y el uso de guantes y batas de protección al abrir envases de medicamentos, manipular viales o etiquetar. Al usar equipo de protección personal , se deben inspeccionar los guantes para detectar defectos físicos antes de usarlos y siempre usar guantes dobles y batas de protección. Los trabajadores de la salud también deben lavarse las manos con agua y jabón antes y después de trabajar con medicamentos antineoplásicos, cambiarse los guantes cada 30 minutos o cuando se perforen y desecharlos inmediatamente en un contenedor de desechos de quimioterapia. [182]
Las batas que se utilicen deben ser desechables y estar hechas de polipropileno recubierto de polietileno. Al utilizarlas, las personas deben asegurarse de que estén cerradas y tengan mangas largas. Una vez realizada la preparación, el producto final debe estar completamente sellado en una bolsa de plástico. [183]
El personal sanitario también debe limpiar todos los recipientes de desechos dentro del armario ventilado antes de sacarlos del mismo. Por último, los trabajadores deben quitarse todo el equipo de protección y colocarlo en una bolsa para su eliminación dentro del armario ventilado. [178]
Los medicamentos sólo deben administrarse utilizando dispositivos médicos de protección, como listas de agujas y sistemas cerrados, y técnicas como la preparación de los tubos intravenosos por parte del personal de la farmacia dentro de un armario ventilado. Los trabajadores siempre deben usar equipo de protección personal, como guantes dobles, gafas protectoras y batas protectoras, al abrir la bolsa exterior y ensamblar el sistema de administración para administrar el medicamento al paciente, y al desechar todo el material utilizado en la administración de los medicamentos. [181]
Los trabajadores del hospital nunca deben retirar los tubos de una bolsa de suero que contenga un medicamento antineoplásico y, al desconectar los tubos del sistema, deben asegurarse de que se hayan enjuagado completamente. Después de retirar la bolsa de suero, los trabajadores deben colocarla junto con otros elementos desechables directamente en el contenedor amarillo de desechos de quimioterapia con la tapa cerrada. Se debe retirar el equipo de protección y colocarlo en un contenedor de desechos de quimioterapia desechable. Después de que se haya hecho esto, se deben colocar los desechos de quimioterapia en una bolsa doble antes o después de quitarse los guantes internos. Además, siempre se deben lavar las manos con agua y jabón antes de abandonar el lugar de administración del medicamento. [184]
Todos los empleados que trabajan en centros de atención de salud que los exponen a medicamentos peligrosos deben recibir capacitación. La capacitación debe incluir al personal de envío y recepción, a las amas de llaves, a los farmacéuticos, a los asistentes y a todas las personas involucradas en el transporte y almacenamiento de medicamentos antineoplásicos. Estas personas deben recibir información y capacitación para informarles sobre los peligros de los medicamentos presentes en sus áreas de trabajo. Deben ser informados y capacitados sobre las operaciones y procedimientos en sus áreas de trabajo donde pueden encontrar peligros, los diferentes métodos utilizados para detectar la presencia de medicamentos peligrosos y cómo se liberan los peligros, y los peligros físicos y para la salud de los medicamentos, incluido su potencial de riesgo reproductivo y carcinógeno. Además, deben ser informados y capacitados sobre las medidas que deben tomar para evitar y protegerse de estos peligros. Esta información debe proporcionarse cuando los trabajadores de atención de salud entren en contacto con los medicamentos, es decir, realicen la tarea inicial en un área de trabajo con medicamentos peligrosos. Además, también debe proporcionarse capacitación cuando surjan nuevos peligros, así como cuando se introduzcan nuevos medicamentos, procedimientos o equipos. [181]
Al realizar la limpieza y descontaminación del área de trabajo donde se utilizan medicamentos antineoplásicos, se debe asegurar que haya suficiente ventilación para evitar la acumulación de concentraciones de medicamentos en el aire. Al limpiar la superficie de trabajo, los trabajadores del hospital deben usar agentes de desactivación y limpieza antes y después de cada actividad, así como al final de sus turnos. La limpieza siempre debe realizarse utilizando guantes de doble protección y batas desechables. Una vez que los empleados terminan de limpiar, deben desechar los elementos utilizados en la actividad en un contenedor amarillo para desechos de quimioterapia mientras aún usan guantes protectores. Después de quitarse los guantes, deben lavarse bien las manos con agua y jabón. Todo lo que entre en contacto o tenga un rastro de los medicamentos antineoplásicos, como agujas, viales vacíos, jeringas, batas y guantes, debe colocarse en el contenedor de desechos de quimioterapia. [185]
Es necesario contar con una política escrita en caso de derrame de productos antineoplásicos. La política debe abordar la posibilidad de derrames de distintos tamaños, así como el procedimiento y el equipo de protección personal necesario para cada tamaño. Un trabajador capacitado debe manipular un derrame grande y siempre desechar todos los materiales de limpieza en el contenedor de desechos químicos de acuerdo con las regulaciones de la EPA, no en un contenedor amarillo para desechos de quimioterapia. [186]
Se debe establecer un programa de vigilancia médica . En caso de exposición, los profesionales de la salud ocupacional deben solicitar una historia clínica detallada y realizar un examen físico completo. Deben analizar la orina del trabajador potencialmente expuesto mediante una tira reactiva o un examen microscópico, buscando principalmente sangre, ya que se sabe que varios medicamentos antineoplásicos causan daño a la vejiga. [176]
La mutagenicidad urinaria es un marcador de exposición a fármacos antineoplásicos que Falck y sus colegas utilizaron por primera vez en 1979 y que utiliza ensayos de mutagenicidad bacteriana. Además de ser inespecífica, la prueba puede verse influida por factores externos como la ingesta dietética y el tabaquismo, por lo que se utiliza con moderación. Sin embargo, la prueba desempeñó un papel importante en el cambio del uso de cabinas de flujo horizontal a cabinas de seguridad biológica de flujo vertical durante la preparación de fármacos antineoplásicos, ya que las primeras exponían a los trabajadores de la salud a altos niveles de fármacos. Esto cambió la manipulación de los fármacos y redujo eficazmente la exposición de los trabajadores a los fármacos antineoplásicos. [176]
Los biomarcadores de exposición a fármacos antineoplásicos incluyen comúnmente platino urinario , metotrexato , ciclofosfamida urinaria e ifosfamida , y metabolito urinario de 5-fluorouracilo . Además de esto, hay otros fármacos que se utilizan para medir los fármacos directamente en la orina, aunque rara vez se utilizan. Una medición de estos fármacos directamente en la orina es un signo de altos niveles de exposición y de que se está produciendo una absorción de los fármacos ya sea por inhalación o por vía dérmica. [176]
Existe una extensa lista de agentes antineoplásicos . Se han utilizado varios esquemas de clasificación para subdividir los medicamentos utilizados para el cáncer en varios tipos diferentes. [187] [188]


El primer uso de fármacos de moléculas pequeñas para tratar el cáncer fue a principios del siglo XX, aunque los productos químicos específicos utilizados al principio no estaban destinados originalmente a ese propósito. El gas mostaza se utilizó como agente de guerra química durante la Primera Guerra Mundial y se descubrió que era un potente supresor de la hematopoyesis (producción de sangre). [189] Una familia similar de compuestos conocidos como mostazas nitrogenadas se estudió más a fondo durante la Segunda Guerra Mundial en la Facultad de Medicina de Yale . [190] Se razonó que un agente que dañara los glóbulos blancos de rápido crecimiento podría tener un efecto similar sobre el cáncer. [190] Por lo tanto, en diciembre de 1942, a varias personas con linfomas avanzados (cánceres del sistema linfático y los ganglios linfáticos) se les administró el fármaco por vía intravenosa, en lugar de respirar el gas irritante. [190] Su mejoría, aunque temporal, fue notable. [191] Al mismo tiempo, durante una operación militar en la Segunda Guerra Mundial, tras un ataque aéreo alemán al puerto italiano de Bari , varios cientos de personas fueron expuestas accidentalmente al gas mostaza, que había sido transportado allí por las fuerzas aliadas para prepararse para una posible represalia en caso de que Alemania utilizara una guerra química. Más tarde se descubrió que los supervivientes tenían recuentos de glóbulos blancos muy bajos. [192] Una vez finalizada la Segunda Guerra Mundial y desclasificados los informes, las experiencias convergieron y llevaron a los investigadores a buscar otras sustancias que pudieran tener efectos similares contra el cáncer. El primer fármaco de quimioterapia que se desarrolló a partir de esta línea de investigación fue la mustina . Desde entonces, se han desarrollado muchos otros fármacos para tratar el cáncer, y el desarrollo de fármacos se ha convertido en una industria multimillonaria, aunque los principios y limitaciones de la quimioterapia descubiertos por los primeros investigadores todavía se aplican. [193]
La palabra quimioterapia sin un modificador generalmente se refiere al tratamiento del cáncer, pero su significado histórico era más amplio. El término fue acuñado a principios de la década de 1900 por Paul Ehrlich para significar cualquier uso de productos químicos para tratar cualquier enfermedad ( quimio- + -terapia ), como el uso de antibióticos ( quimioterapia antibacteriana ). [194] Ehrlich no era optimista de que se encontrarían medicamentos de quimioterapia efectivos para el tratamiento del cáncer. [194] El primer agente quimioterapéutico moderno fue la arsfenamina , un compuesto de arsénico descubierto en 1907 y utilizado para tratar la sífilis . [195] A esto le siguieron más tarde las sulfonamidas (sulfamidas) y la penicilina . En el uso actual , el sentido de "cualquier tratamiento de la enfermedad con medicamentos" a menudo se expresa con la palabra farmacoterapia .

Los vehículos de administración especialmente dirigidos tienen como objetivo aumentar los niveles efectivos de quimioterapia para las células tumorales y reducir los niveles efectivos para otras células. Esto debería dar como resultado una mayor destrucción del tumor o una menor toxicidad, o ambas cosas. [196]
Los conjugados anticuerpo-fármaco (ADC) comprenden un anticuerpo , un fármaco y un ligador entre ellos. El anticuerpo se dirigirá a una proteína expresada preferentemente en las células tumorales (conocida como antígeno tumoral ) o en células que el tumor puede utilizar, como las células endoteliales de los vasos sanguíneos . Se unen al antígeno tumoral y se internalizan, donde el ligador libera el fármaco en la célula. Estos vehículos de administración especialmente dirigidos varían en su estabilidad, selectividad y elección del objetivo, pero, en esencia, todos tienen como objetivo aumentar la dosis efectiva máxima que se puede administrar a las células tumorales. [197] La toxicidad sistémica reducida significa que también se pueden usar en personas que están más enfermas y que pueden transportar nuevos agentes quimioterapéuticos que habrían sido demasiado tóxicos para administrarse a través de enfoques sistémicos tradicionales. [198]
El primer fármaco aprobado de este tipo fue gemtuzumab ozogamicina (Mylotarg), comercializado por Wyeth (ahora Pfizer ). El fármaco fue aprobado para tratar la leucemia mieloide aguda . [199] Otros dos fármacos, trastuzumab emtansina y brentuximab vedotina , se encuentran en ensayos clínicos avanzados, y al último se le ha concedido la aprobación acelerada para el tratamiento del linfoma de Hodgkin refractario y el linfoma anaplásico de células grandes sistémico . [197]
Las nanopartículas son partículas de tamaño de 1 a 1000 nanómetros (nm) que pueden promover la selectividad tumoral y ayudar a administrar medicamentos de baja solubilidad . Las nanopartículas pueden ser dirigidas de forma pasiva o activa. La orientación pasiva explota la diferencia entre los vasos sanguíneos tumorales y los vasos sanguíneos normales. Los vasos sanguíneos en los tumores son "permeables" porque tienen espacios de 200 a 2000 nm, que permiten que las nanopartículas escapen al tumor. La orientación activa utiliza moléculas biológicas ( anticuerpos , proteínas , ADN y ligandos de receptores ) para dirigir preferentemente las nanopartículas a las células tumorales. Hay muchos tipos de sistemas de administración de nanopartículas, como sílice , polímeros , liposomas [200] y partículas magnéticas. Las nanopartículas hechas de material magnético también se pueden utilizar para concentrar agentes en sitios tumorales utilizando un campo magnético aplicado externamente. [196] Han surgido como un vehículo útil en la administración magnética de fármacos para agentes poco solubles como el paclitaxel . [201]
La electroquimioterapia es un tratamiento combinado en el que la inyección de un fármaco quimioterapéutico se acompaña de la aplicación local de pulsos eléctricos de alto voltaje en el tumor. El tratamiento permite que los fármacos quimioterapéuticos, que de otro modo no pueden o apenas pueden atravesar la membrana de las células (como la bleomicina y el cisplatino), entren en las células cancerosas. De este modo, se consigue una mayor eficacia del tratamiento antitumoral. [202]
La electroquimioterapia clínica se ha utilizado con éxito para el tratamiento de tumores cutáneos y subcutáneos independientemente de su origen histológico. [203] [204] El método se ha descrito como seguro, sencillo y muy eficaz en todos los informes sobre el uso clínico de la electroquimioterapia. Según el proyecto ESOPE (European Standard Operating Procedures of Electrochemotherapy), se prepararon los procedimientos operativos estándar (SOP) para la electroquimioterapia, basándose en la experiencia de los principales centros oncológicos europeos en electroquimioterapia. [205] [206] Recientemente, se han desarrollado nuevas modalidades de electroquimioterapia para el tratamiento de tumores internos mediante procedimientos quirúrgicos, vías endoscópicas o abordajes percutáneos para acceder al área de tratamiento. [207] [208]
La terapia de hipertermia es un tratamiento térmico para el cáncer que puede ser una herramienta poderosa cuando se utiliza en combinación con quimioterapia (termoquimioterapia) o radiación para el control de una variedad de cánceres. El calor se puede aplicar localmente en el sitio del tumor, lo que dilatará los vasos sanguíneos del tumor, lo que permitirá que más medicamento quimioterapéutico ingrese al tumor. Además, la membrana de la célula tumoral se volverá más porosa, lo que permitirá que más medicamento quimioterapéutico ingrese a la célula tumoral.
También se ha demostrado que la hipertermia ayuda a prevenir o revertir la "quimiorresistencia". La resistencia a la quimioterapia a veces se desarrolla con el tiempo a medida que los tumores se adaptan y pueden superar la toxicidad de la medicación quimioterapéutica. "La superación de la quimiorresistencia se ha estudiado ampliamente en el pasado, especialmente utilizando células resistentes al CDDP. Con respecto al beneficio potencial de que las células resistentes a los fármacos se puedan reclutar para una terapia eficaz mediante la combinación de quimioterapia con hipertermia, era importante demostrar que la quimiorresistencia contra varios fármacos contra el cáncer (por ejemplo, mitomicina C, antraciclinas, BCNU, melfalán), incluido el CDDP, se podía revertir al menos parcialmente mediante la adición de calor. [209]
La quimioterapia se utiliza en medicina veterinaria de forma similar a como se utiliza en medicina humana. [210]
Las náuseas y los vómitos son dos de los efectos secundarios relacionados con el tratamiento del cáncer más temidos por los pacientes con cáncer y sus familias.