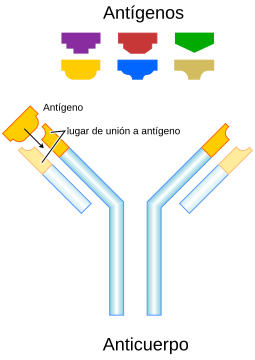
Anticuerpo
El reconocimiento de un antígeno por un anticuerpo lo marca para ser atacado por otras partes del sistema inmunitario.
Los anticuerpos también pueden neutralizar sus objetivos directamente, mediante, por ejemplo, la unión a una porción de un patógeno necesaria para que este provoque una infección.
Esto posibilita que un solo anticuerpo pueda ser usado por las diferentes partes del sistema inmune.
[22] Los anticuerpos son, por tanto, un producto esencial del sistema inmunitario adaptativo que aprenden y recuerdan las respuestas a patógenos invasores.
Los anticuerpos solubles son secretados por un linfocito B activado (en su forma de célula plasmática) para unirse a sustancias extrañas y señalizarlas para su destrucción por el resto del sistema inmune.
En mamíferos placentados existen cinco isotipos de anticuerpos conocidos como IgA, IgD, IgE, IgG e IgM.
En otras palabras, es el paratopo, o la región cercana de una inmunoglobulina puede ser reconocido como un epitopo por ciertos linfocitos (Staff, 2003).
Hay cinco tipos de Ig en mamíferos que se nombran por letras griegas: α, δ, ε, γ y μ.
Solo un tipo de cadena ligera, κ o λ, está presente dentro del mismo anticuerpo en mamíferos.
[3] Mediante la unión a proteínas específicas la región Fc se asegura que cada anticuerpo genera una respuesta inmune apropiada para un antígeno dado.
Revistiendo al patógeno, los anticuerpos estimulan las funciones efectoras contra este en las células que reconocen la región Fc.
La región variable de cada inmunoglobulina pesada está codificada por varias partes, que se conocen como segmentos.
[2] Tras la producción de una inmunoglobulina funcional por un linfocito B durante la recombinación V(D)J no podrá expresar ninguna región variable diferente (a este proceso se le conoce como exclusión alélica).
Cada isotipo está adaptado para una función distinta y, por tanto, tras la activación, se necesita un anticuerpo con un efector IgG, IgA o IgE para la eliminación eficaz del antígeno.
[51][52] El exón del dominio variable se vuelve a empalmar mediante un proceso llamado unión de extremos no homóloga ("non-homologous end joining" o NHEJ) a la región constante elegida (γ, α o ε).
Posteriormente, estos segmentos cambian somáticamente la única región V, pudiendo también estar sometidas a hipermutación.
Este ARN abandona el núcleo, dirigiéndose a los ribosomas del retículo endoplásmico rugoso, donde comienza su traducción.
Sus patrones operativos se mezclan en ocasiones para combinar sus propiedades, aunque existen pocas moléculas que contengan los tres, como es el caso del gen de la enfermedad poliquística renal (PKD1).
[60] Las proteínas con dominios Ig son comunes en eucariotas unicelulares, y hasta cierto punto su estructura es un rasgo conservado.
[62] Sin embargo, es en los grupos de animales pluricelulares más primitivos, los parazoa, donde los científicos intentan hallar respuestas al origen del sistema inmunitario adaptativo.
Se han realizado múltiples estudios en el anfioxo Branchiostoma floridae, encontrando unas curiosas proteínas, llamadas VCBP (por Proteínas tipo V que contienen dominios que se unen a quitina) con grandes homologías con las regiones V (variables) de las inmunoglobulinas, ciertamente implicadas en la respuesta inmunitaria, pero carentes de su variabilidad.
Esto sugiere una evolución de este tipo celular en los vertebrados más basales, y posiblemente en un protocordado.
[94] Algunas inmunodeficiencias, como la agammaglobulinemia ligada al cromosoma X y la hipogammaglobulinemia consisten en una carencia parcial o completa de anticuerpos.
[97] De estos anticuerpos anti-RhD se conocen varias marcas comerciales, como RhoGAM, BayRHo-D, Gamulin Rh, HypRho-D, y WinRho SDF.
Durante nacimiento normal, la sangre fetal puede pasar a la madre por traumas en el parto o complicaciones del embarazo.
[98] Los anti-RhD se administran como parte del tratamiento prenatal para prevenir la sensibilización que pudiera tener lugar para evitarlo.
También se pueden inyectar antígenos en gallinas y recoger en la yema de huevo los anticuerpos policlonales IgY producidos.
Estos son excepcionales en el reino animal, dado su reducido tamaño, debido a que están compuestos únicamente por dos cadenas pesadas.
[112] Tales peculiaridades les permitirían acceder a localizaciones celulares y antígenos inaccesibles para los anticuerpos normales, además de ser posible su administración oral.
Estos procedimientos producían un gran número de reacciones alérgicas, como anafilaxias o la enfermedad del suero.
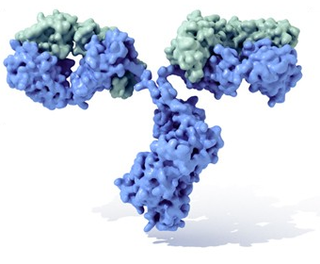




2. Región Fc
3. Cadena pesada con un dominio variable (V H ) seguido por un dominio constante (C H 1), una región bisagra, y dos más constantes, los dominios (C H 2 y C H 3).
4. Cadena ligera con un dominio variable (V L ) y uno constante (C L )
5. Lugar de unión al antígeno (paratopo)
6. Regiones bisagra.

Región Fc: fragmento de unión a la célula inmunitaria.