Anticuerpo de cadena sencilla
Éste está formado habitualmente por residuos de glicina (para aportarle flexibilidad) y de serina o treonina para darle solubilidad.
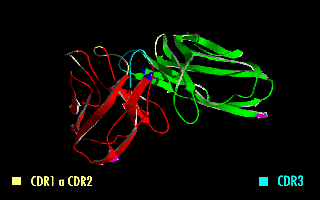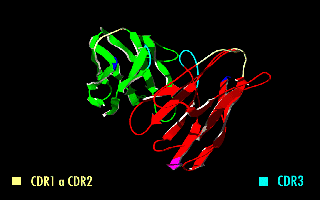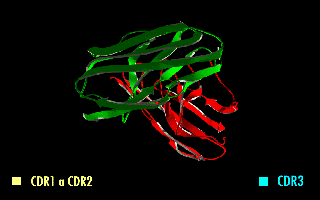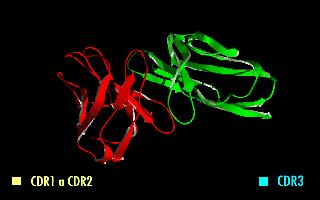
La imagen de la derecha muestra cómo estas modificaciones dejan inalterada la estructura de la región del anticuerpo que reconoce el antígeno.
Estas moléculas se crearon originalmente para facilitar la confección de bibliotecas de expresión en fago (phage display) donde es muy conveniente expresar el dominio de unión al antígeno como un único péptido.
Por otra parte, los scFv se pueden crear directamente a partir de cadenas ligeras y pesadas subclonadas, derivadas de un hibridoma.
Estos fragmentos pueden purificarse o inmovilizarse empleando Proteína L, ya que ésta interacciona con la región variable de las cadenas ligeras kappa.