Constante de disociación ácida
El equilibrio puede escribirse simbólicamente como: donde HA es un ácido genérico que se disocia dividiéndose en A-, conocida como base conjugada del ácido, y el ion hidrógeno o protón, H+, que, en el caso de soluciones acuosas, existe como un ion hidronio solvatado.
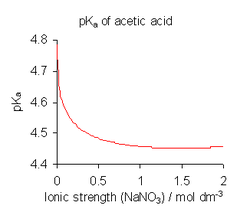
En el ejemplo que se muestra en la figura, HA representa el ácido acético, y A- el ion acetato.
Las especies químicas HA, A- y H+ se dice que están en equilibrio cuando sus concentraciones no cambian con el paso del tiempo.
Estos cálculos tienen aplicación en diferentes áreas de la química, la biología, la medicina y la geología.
La definición de Brønsted-Lowry se aplica a otros disolventes, como el dimetilsulfóxido: el solvente S actúa como una base, aceptando un protón y formando el ácido conjugado SH+.
Los ácidos y las bases se consideran así simplemente como donadores o aceptores de protones, respectivamente.
El agua es una sustancia anfiprótica, ya que puede reaccionar tanto como un ácido o como una base.
Para el equilibrio específico entre un ácido monoprótico, HA y su base conjugada A- en agua: la constante de equilibrio termodinámica, K puede definirse por:[9] donde {A} es la actividad de la especie química A, etc. K es adimensional ya que la actividad no tiene dimensiones .
Sin embargo, no es inusual, sobre todo en textos relativos a equilibrios bioquímicos, ver un valor citado con una dimensión como, por ejemplo, "Ka = 300 M".
Asimismo, todas las bases con un valor de pKa mayor que el límite superior están desprotonadas en más del 99 % para todos los valores posibles de pH y se clasifican como bases fuertes.
Dado que el protón tiene una carga positiva se necesita un trabajo extra para arrancarlo; esta es la causa de la tendencia señalada anteriormente.
Cuando se encuentra una excepción a la regla indica que está ocurriendo un cambio importante en la estructura.
El agua es una sustancia anfiprótica, es decir, tiene propiedades tanto ácidas como básicas, pudiendo reaccionar consigo misma.
Un disolvente es más probable que promueva la ionización de una molécula ácida disuelta en las siguientes circunstancias.
Algunos valores de pKa a 25 o C para el acetonitrilo (ACN)[22][23][24] y el dimetilsulfóxido (DMSO)[25] se muestran en las siguientes tablas.
[28] En disolventes apróticos, se pueden formar oligómeros por enlace de hidrógeno, como el conocido dímero del ácido acético.
[29] En soluciones acuosas, la homoconjugation no se produce, porque el agua forma enlaces de hidrógeno más fuertes a la base conjugada que al ácido.
La razón de esto es que cuando el disolvente está en su estado estándar su actividad se “define” como la unidad.
Por ejemplo, el estado estándar del agua:dioxano 9:1 es precisamente la mezcla disolvente, sin solutos añadidos.
Estos hechos quedan ocultados por la omisión del disolvente en la expresión que se utiliza normalmente para definir el pKa pero los valores de pKa obtenidos en una determinada mezcla de disolventes dada se puede comparar con cualquier otra, dando las fuerzas ácidas relativas.
Lo mismo es cierto para los valores de pKa obtenidos en un disolvente no acuoso particular tal como el DMSO.
La razón de esta gran diferencia es que cuando se retira un electrón del isómero cis- (ácido maleico) se forma un fuerte enlace de hidrógeno intramolecular con el cercano grupo carboxilo restante.
En el isómero trans, los dos grupos carboxilos están siempre muy alejados, por lo que no se observa el enlace de hidrógeno.
Por lo tanto, metilaminas se estabilizan casi en la misma medida por hidratación, independientemente del número de grupos metilo.
En marcado contraste, los cationes metilamonio correspondientes siempre utilizar 'todos' los protones disponibles para los donantes NH-OH 2 enlaces.
La solución se valora entonces con una base fuerte hasta que todos los protones han sido arrancados.
No pueden determinarse directamente mediante medidas de pH, absorbancia, fluorescencia o RMN.
Esto permite una técnica llamada Isoelectroenfoque,[56] que se utiliza para la separación de proteínas por Electroforesis en gel bidimensional.
La ingestión de cianuro por vía oral, es potencialmente fatal, independiente del pH, debido a la reacción con la citocromo c oxidasa.
[66] Existen múltiples técnicas para determinar el pK, una de una sustancia química, dando lugar a algunas discrepancias entre distintas fuentes.