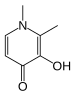
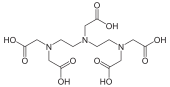
Constantes de estabilidad de complejos
[1] Las razones por las que esto ocurrió en una fecha tan tardía, casi 50 años después de que Alfred Werner propusiera las estructuras correctas para los complejos de coordinación , han sido resumidas por Beck y Nagypál.
Bjerrum pasó a determinar las constantes de estabilidad para sistemas en los que se pueden formar muchos complejos.
Esto permitió el examen de sistemas demasiado complicados para ser evaluados mediante cálculos manuales.
Por ejemplo, en soluciones acuosas, los iones metálicos estarán presentes como aquiones, por lo que la reacción para la formación del primer complejo podría escribirse como La constante de equilibrio para esta reacción está dada por [L] debe leerse como "la concentración de L" y de la misma manera para los otros términos entre corchetes.
La expresión se puede simplificar enormemente eliminando aquellos términos que son constantes.
El efecto del quelato, a continuación, se explica mejor en términos de termodinámica.
Otro ejemplo es el hierro (III) que forma complejos débiles con haluros y otros aniones, pero no con iones perclorato .
Cuando las constantes publicadas se refieren a una fuerza iónica diferente a la requerida para una aplicación particular, pueden ajustarse por medio de la teoría de los iones específicos (SIT) y otras teorías.
El enfoque termodinámico para explicar el efecto del quelato considera la constante de equilibrio para la reacción: cuanto mayor sea la constante de equilibrio, mayor será la concentración del complejo.
Otras explicaciones, incluida la de Schwarzenbach,[20] se discuten en Greenwood y Earnshaw.
El EDTA (ácido etilendiaminotetracético) tiene seis átomos donantes, por lo que forma complejos muy fuertes con cinco anillos de quelatos.
Los ligandos como DTPA, que tienen ocho átomos donadores, se usan para formar complejos con grandes iones metálicos, como los iones lantánidos o actínidos , que generalmente forman complejos de 8 o 9 coordenadas.
Por lo tanto, la ionización de grupos alifáticos-OH ocurre en solución acuosa solo en circunstancias especiales.
El efecto de quelato suministra la energía extra necesaria para romper el enlace –OH.
Sin embargo, estudios posteriores sugirieron que tanto la entalpía como los factores de entropía estaban involucrados.
[22] Una diferencia importante entre los ligandos macrocíclicos y los ligandos de cadena abierta (quelantes) es que tienen selectividad para los iones metálicos, según el tamaño de la cavidad en la que se inserta el ion metálico cuando se forma un complejo.
El ejemplo clásico es la formación del complejo diamminesilver (I) [Ag(NH3)2]+ en solución acuosa.
En el segundo paso, los ligandos aqua se pierden para formar un producto lineal de dos coordenadas [H 3 N – Ag – NH 3 ] + .
Ahrland, Chatt y Davies propusieron que los iones metálicos podrían describirse como de clase A si formaran complejos más fuertes con ligandos cuyos átomos donadores son nitrógeno , oxígeno o flúor que con los ligandos cuyos átomos donadores son fósforo , azufre o cloro y clase B si ocurre lo contrario.
Un ejemplo de este efecto está dado por el hecho de que el Fe 2+ tiende a formar complejos más fuertes con los ligandos N- donantes que con los ligandos O- donantes, pero lo contrario es cierto para el Fe 3+ .
El DTPA también se usa como agente complejante para el gadolinio en la mejora del contraste de MRI.
El EDTA forma complejos tan fuertes con la mayoría de los cationes divalentes que encuentra muchos usos.
Por ejemplo, existen electrodos selectivos de potasio que utilizan el antibiótico macrocíclico natural valinomicina .
Los complejos supramoleculares se mantienen unidos por enlaces de hidrógeno, fuerzas hidrófobas, fuerzas de van der Waals, interacciones π-π y efectos electrostáticos, todos los cuales pueden describirse como enlaces no covalentes .
Las aplicaciones incluyen reconocimiento molecular , química huésped-huésped y sensores de aniones.
[32] El estudio se llevó a cabo utilizando un disolvente no acuoso y mediciones de desplazamiento químico por RMN .
Por ejemplo, los aniones de dicarboxilato podrían encapsularse en la cavidad elipsoidal en una gran estructura macrocíclica que contiene dos iones metálicos.
Estas estimaciones son necesarias porque el cálculo utiliza un algoritmo de mínimos cuadrados no lineal.
Todas estas revisiones son publicadas por IUPAC y el texto completo está disponible, sin cargo, en formato pdf.
Complex formation of cadmium with sugar residues, nucleobases, phosphates, nucleotides and nucleic acids».