El cáncer de ovario es un tumor canceroso de un ovario . [10] Puede originarse en el propio ovario o, más comúnmente, en la comunicación de estructuras cercanas, como las trompas de Falopio o el revestimiento interno del abdomen . [3] [11] El ovario se compone de tres tipos de células diferentes, incluidas las células epiteliales, las células germinales y las células estromales. [12] Cuando estas células se vuelven anormales, tienen la capacidad de dividirse y formar tumores. Estas células también pueden invadir o diseminarse a otras partes del cuerpo. [13] Cuando comienza este proceso, es posible que no haya síntomas o que solo haya síntomas vagos. [1] Los síntomas se vuelven más notorios a medida que avanza el cáncer. [1] [14] Estos síntomas pueden incluir hinchazón , sangrado vaginal, dolor pélvico , hinchazón abdominal , estreñimiento y pérdida de apetito , entre otros. [1] Las áreas comunes a las que el cáncer puede propagarse incluyen el revestimiento del abdomen , los ganglios linfáticos , los pulmones y el hígado . [15]
El riesgo de cáncer de ovario aumenta con la edad. La mayoría de los casos de cáncer de ovario se desarrollan después de la menopausia. [16] También es más común en mujeres que han ovulado más a lo largo de su vida. [17] Esto incluye a aquellas que nunca han tenido hijos , aquellas que comenzaron a ovular a una edad más temprana y aquellas que llegan a la menopausia a una edad mayor. [5] Otros factores de riesgo incluyen la terapia hormonal después de la menopausia , los medicamentos para la fertilidad y la obesidad . [4] [6] Los factores que disminuyen el riesgo incluyen anticonceptivos hormonales , ligadura de trompas , embarazo y lactancia . [6] Alrededor del 10% de los casos están relacionados con el riesgo genético hereditario; Las mujeres con mutaciones en los genes BRCA1 o BRCA2 tienen aproximadamente un 50% de posibilidades de desarrollar la enfermedad. [5] Algunos síndromes de cáncer familiar, como el cáncer de colon hereditario sin poliposis y el síndrome de Peutz-Jeghers, también aumentan el riesgo de desarrollar cáncer de ovario. [16] El carcinoma epitelial de ovario es el tipo más común de cáncer de ovario y comprende más del 95% de los casos. [5] Hay cinco subtipos principales de carcinoma de ovario, de los cuales el carcinoma seroso de alto grado (HGSC) es el más común. [5] Los tipos menos comunes de cáncer de ovario incluyen tumores de células germinales [18] y tumores del estroma de los cordones sexuales . [5] El diagnóstico de cáncer de ovario se confirma mediante una biopsia de tejido, generalmente extirpado durante la cirugía. [1]
No se recomiendan las pruebas de detección en mujeres con un riesgo promedio, ya que la evidencia no respalda una reducción de la mortalidad y la alta tasa de pruebas falsas positivas puede llevar a una cirugía innecesaria, que va acompañada de sus propios riesgos. [19] A las personas con un riesgo muy alto se les pueden extirpar los ovarios como medida preventiva. [4] Si se detecta y se trata en una etapa temprana, el cáncer de ovario suele ser curable. [1] El tratamiento generalmente incluye alguna combinación de cirugía, radioterapia y quimioterapia . [1] Los resultados dependen de la extensión de la enfermedad, el subtipo de cáncer presente y otras afecciones médicas. [5] [20] La tasa general de supervivencia a cinco años en los Estados Unidos es del 49%. [7] Los resultados son peores en el mundo en desarrollo. [5]
En 2020, se produjeron nuevos casos en aproximadamente 313.000 mujeres. [21] En 2019 provocó 13.445 muertes en los Estados Unidos. [22] La muerte por cáncer de ovario aumentó a nivel mundial entre 1990 y 2017 en un 84,2%. [23] El cáncer de ovario es el segundo cáncer ginecológico más común en los Estados Unidos. Causa más muertes que cualquier otro cáncer del sistema reproductivo femenino. [24] Entre las mujeres ocupa el quinto lugar en muertes relacionadas con el cáncer. [25] La edad típica de diagnóstico es 63 años. [2] La muerte por cáncer de ovario es más común en América del Norte y Europa que en África y Asia. [5] En los Estados Unidos, es más común en mujeres blancas e hispanas que en mujeres negras o indias americanas. [22]

Los primeros signos y síntomas del cáncer de ovario pueden estar ausentes o ser sutiles. En la mayoría de los casos, los síntomas persisten durante varios meses antes de ser reconocidos y diagnosticados . [26] [27] Los síntomas a menudo pueden diagnosticarse erróneamente como síndrome del intestino irritable . [28] Las primeras etapas del cáncer de ovario tienden a ser indoloras, lo que dificulta su detección temprana. Los síntomas pueden variar según el subtipo. [26] Los tumores limítrofes de ovario , también conocidos como tumores de ovario de bajo potencial maligno (LMP), no causan un aumento en los niveles de CA125 y no son identificables con una ecografía. Los síntomas típicos de un tumor FUM pueden incluir distensión abdominal o dolor pélvico. Las masas particularmente grandes tienden a ser benignas o dudosas. [29] [26]
Los síntomas más típicos del cáncer de ovario incluyen hinchazón , dolor o malestar abdominal o pélvico, dolor de espalda, menstruación irregular o sangrado vaginal posmenopáusico, dolor o sangrado después o durante las relaciones sexuales , pérdida de apetito , fatiga , diarrea , indigestión , acidez de estómago , estreñimiento , náuseas , sensación de saciedad y posiblemente síntomas urinarios (incluyendo micción frecuente y micción urgente ). [27]

Los síntomas posteriores del cáncer de ovario se deben a la masa creciente que causa dolor al presionar otros órganos abdominopélvicos o por metástasis. [26] [30] [31] Debido a la ubicación anatómica de los ovarios en lo profundo de la pelvis, la mayoría de las masas son grandes y avanzadas en el momento del diagnóstico. [32] La masa en crecimiento puede causar dolor si se desarrolla una torsión ovárica . Si estos síntomas comienzan a ocurrir con más frecuencia o gravedad de lo habitual, especialmente sin antecedentes significativos de dichos síntomas, se considera cáncer de ovario. [26] [29] Las metástasis pueden causar un nódulo de la hermana Mary Joseph . [31] En raras ocasiones, los teratomas pueden causar síndrome de teratoma en crecimiento o gliomatosis peritoneal. [31] Algunas experimentan menometrorragia y sangrado vaginal anormal después de la menopausia en la mayoría de los casos. Otros síntomas comunes incluyen hirsutismo , dolor abdominal, virilización y una masa anexial . [33]
En adolescentes o niños con tumores de ovario, los síntomas pueden incluir dolor abdominal intenso, irritación del peritoneo o sangrado . [34] Los tumores del estroma del cordón sexual producen hormonas que pueden conducir al desarrollo prematuro de características sexuales secundarias. Los tumores del estroma del cordón sexual en niños prepúberes pueden manifestarse por signos de pubertad temprana ; El dolor abdominal y la distensión también son comunes. Los adolescentes con tumores del estroma del cordón sexual pueden experimentar amenorrea . A medida que el cáncer avanza, puede provocar una acumulación de líquido en el abdomen y provocar distensión. Si la enfermedad maligna no se ha diagnosticado en el momento en que causa la ascitis, generalmente se diagnostica poco después. [26] Los cánceres avanzados también pueden causar masas abdominales, masas en los ganglios linfáticos o derrame pleural . [31]
Hay muchos factores de riesgo conocidos que pueden aumentar el riesgo de que una mujer desarrolle cáncer de ovario. El riesgo de desarrollar cáncer de ovario está relacionado con la cantidad de tiempo que una mujer pasa ovulando. [35] Los factores que aumentan el número de ciclos ovulatorios que experimenta una mujer pueden aumentar el riesgo de desarrollar cáncer de ovario. [35] Durante la ovulación, las células son estimuladas para dividirse. Si esta división está anormalmente regulada se pueden formar tumores que pueden ser malignos. La menarquia temprana y la menopausia tardía aumentan el número de ciclos ovulatorios que sufre una mujer a lo largo de su vida y, por tanto, aumentan el riesgo de desarrollar cáncer de ovario. [29] [35] [36] Dado que la ovulación se suprime durante el embarazo, no tener hijos también aumenta el riesgo de cáncer de ovario. [36] Por lo tanto, las mujeres que no han tenido hijos tienen el doble de riesgo de sufrir cáncer de ovario que aquellas que sí los han tenido. [26] Tanto la obesidad como la terapia de reemplazo hormonal también aumentan el riesgo. [26]
El riesgo de desarrollar cáncer de ovario es menor para las mujeres que tienen menos ciclos menstruales, ningún ciclo menstrual, amamantan , toman anticonceptivos orales, tienen embarazos múltiples y tienen un embarazo a una edad temprana. El riesgo de desarrollar cáncer de ovario se reduce en mujeres a las que se les ha realizado una ligadura de trompas (conocida coloquialmente como "ligadura de trompas"), extirpación de ambos ovarios o histerectomía (una operación en la que se extirpa el útero). [27] La edad también es un factor de riesgo. [26] [20] Los factores no genéticos como la diabetes mellitus, el índice de masa corporal alto, el consumo de tabaco y alcohol también son factores de riesgo para el cáncer de ovario. [23]
El uso de medicamentos para la fertilidad puede contribuir a la formación de tumores limítrofes de ovario , pero el vínculo entre ambos es controvertido y difícil de estudiar. [28] Los medicamentos para la fertilidad pueden estar asociados con un mayor riesgo de tumores límite. [31] Aquellos que han sido tratados por infertilidad pero siguen siendo nulíparas tienen un mayor riesgo de cáncer de ovario epitelial debido a la exposición hormonal que puede conducir a la proliferación de células. Sin embargo, aquellas que reciben un tratamiento exitoso para la infertilidad y posteriormente dan a luz no corren mayor riesgo. Esto puede deberse a la eliminación de células precancerosas durante el embarazo, pero la causa aún no está clara. [29] En cambio, el factor de riesgo puede ser la infertilidad en sí, no el tratamiento. [35]
Las afecciones hormonales como el síndrome de ovario poliquístico y la endometriosis están asociadas con el cáncer de ovario, pero el vínculo no está completamente confirmado. [28] La terapia de reemplazo hormonal (TRH) posmenopáusica con estrógeno probablemente aumenta el riesgo de cáncer de ovario. La asociación no ha sido confirmada en un estudio a gran escala, [29] [37] pero estudios notables, incluido el Million Women Study , han respaldado este vínculo. La TRH posmenopáusica con estrógeno y progesterona combinados puede aumentar el riesgo contemporáneo si se usa durante más de cinco años, pero este riesgo vuelve a la normalidad después de suspender el tratamiento. [35] La TRH con estrógenos con o sin progestágenos aumenta el riesgo de tumores endometrioides y serosos, pero reduce el riesgo de tumores mucinosos. Dosis más altas de estrógeno aumentan este riesgo. [31] La endometriosis es otro factor de riesgo de cáncer de ovario, [35] al igual que el dolor durante la menstruación. La endometriosis se asocia con subtipos de células claras y endometrioides, tumores serosos de bajo grado, tumores en estadio I y II, tumores de grado 1 y una menor mortalidad. [31]
Antes de la menopausia, la obesidad puede aumentar el riesgo de que una persona padezca cáncer de ovario, pero este riesgo no está presente después de la menopausia. Este riesgo también es relevante en aquellos que son obesos y que nunca han usado TRH. Una asociación similar con el cáncer de ovario aparece en mujeres más altas. [35]
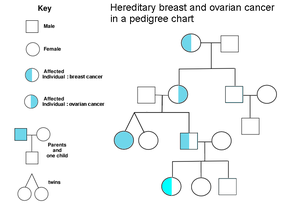
Los antecedentes familiares de cáncer de ovario son un factor de riesgo de cáncer de ovario. Las mujeres con cáncer de colon hereditario sin poliposis (síndrome de Lynch) y aquellas con anomalías genéticas BRCA-1 y BRCA-2 tienen un mayor riesgo.
El principal factor de riesgo genético del cáncer de ovario es una mutación en los genes BRCA1 o BRCA2 , o en los genes reparadores de discrepancias del ADN , que está presente en el 10% de los casos de cáncer de ovario. Sólo es necesario mutar un alelo para poner a una persona en alto riesgo. El gen se puede heredar a través de la línea materna o paterna, pero tiene penetrancia variable . [26] [29] Aunque las mutaciones en estos genes generalmente se asocian con un mayor riesgo de cáncer de mama, también conllevan un riesgo sustancial de cáncer de ovario durante toda la vida, un riesgo que alcanza su punto máximo entre los 40 y 50 años de una persona. El riesgo más bajo citado es del 30% y el más alto del 60%. [28] [26] [29] Las mutaciones en BRCA1 tienen un riesgo de por vida de desarrollar cáncer de ovario de 15 a 45 %. [31] Las mutaciones en BRCA2 son menos riesgosas que aquellas con BRCA1 , con un riesgo de por vida del 10% (el riesgo más bajo citado) al 40% (el riesgo más alto citado). [26] [31] En promedio, los cánceres asociados a BRCA se desarrollan 15 años antes que sus contrapartes esporádicas porque las personas que heredan las mutaciones en una copia de su gen solo necesitan una mutación para iniciar el proceso de carcinogénesis, mientras que las personas con dos genes normales necesitarían Necesita adquirir dos mutaciones. [29]
En los Estados Unidos, cinco de cada 100 mujeres con un familiar de primer grado con cáncer de ovario eventualmente contraerán cáncer de ovario, lo que coloca a aquellas con familiares afectados en un riesgo tres veces mayor que el de las mujeres con familiares no afectados. Siete de cada 100 mujeres con dos o más familiares con cáncer de ovario eventualmente desarrollarán cáncer de ovario. [29] [38] En general, entre el 5% y el 10% de los casos de cáncer de ovario tienen una causa genética. [29] Las mutaciones de BRCA se asocian con cáncer de ovario epitelial seroso no mucinoso de alto grado. [31]

Un fuerte historial familiar de cáncer de endometrio , cáncer de colon u otros cánceres gastrointestinales puede indicar la presencia de un síndrome conocido como cáncer colorrectal hereditario sin poliposis (también conocido como síndrome de Lynch), que confiere un mayor riesgo de desarrollar una serie de cánceres, incluido el de ovario. cáncer. El síndrome de Lynch es causado por mutaciones en genes reparadores de discordancias, incluidos MSH2 , MLH1 , MLH6, PMS1 y PMS2 . [26] El riesgo de cáncer de ovario para una persona con síndrome de Lynch es de entre 10 y 12 por ciento. [26] [29] Las mujeres de ascendencia islandesa , ascendencia judía europea / ascendencia judía asquenazí y ascendencia húngara tienen un mayor riesgo de cáncer de ovario epitelial. [29] El gen beta del receptor de estrógeno ( ESR2 ) parece ser clave para la patogénesis y la respuesta a la terapia. [39] Otros genes que se han asociado con el cáncer de ovario son BRIP1 , MSH6 , RAD51C y RAD51D . [40] CDH1 , CHEK2 , PALB2 y RAD50 también se han asociado con el cáncer de ovario. [41]
Varios trastornos genéticos raros están asociados con subtipos específicos de cáncer de ovario. El síndrome de Peutz-Jeghers , un trastorno genético poco común, también predispone a las mujeres a sufrir un tumor de los cordones sexuales con túbulos anulares . [28] [26] La enfermedad de Ollier y el síndrome de Maffucci se asocian con tumores de células de la granulosa en niños y también pueden estar asociados con tumores de Sertoli-Leydig. Los fibromas benignos están asociados con el síndrome del carcinoma nevoide de células basales . [26]
El consumo de alcohol no parece estar relacionado con el cáncer de ovario. [31] [42]
La Sociedad Estadounidense del Cáncer recomienda un patrón de alimentación saludable que incluya muchas frutas, verduras, cereales integrales y una dieta que evite o limite las carnes rojas y procesadas y el azúcar procesado. [43] El alto consumo de grasas totales, saturadas y trans aumenta el riesgo de cáncer de ovario. [44] Una revisión general de 2021 encontró que la ingesta de café, huevos y grasas aumenta significativamente el riesgo de cáncer de ovario. [45] Existe evidencia mixta de estudios sobre el riesgo de cáncer de ovario y el consumo de productos lácteos . [46] [47]
Los países industrializados, con excepción de Japón, tienen altas tasas de cáncer epitelial de ovario, lo que puede deberse a la dieta de esos países. Las mujeres blancas tienen entre un 30% y un 40% más de riesgo de sufrir cáncer de ovario en comparación con las mujeres negras y las hispanas, probablemente debido a factores socioeconómicos; Las mujeres blancas tienden a tener menos hijos y diferentes tasas de cirugías ginecológicas que afectan el riesgo de cáncer de ovario. [29]
La evidencia provisional sugiere que el talco , los pesticidas y los herbicidas aumentan el riesgo de cáncer de ovario. [48] La Sociedad Estadounidense del Cáncer señala que, hasta el momento, ningún estudio ha podido vincular con precisión ninguna sustancia química en el medio ambiente o en la dieta humana directamente con las mutaciones que causan el cáncer de ovario. [49]
Otros factores que han sido investigados, como el tabaquismo , los bajos niveles de vitamina D en la sangre, [50] la presencia de quistes ováricos de inclusión y la infección por el virus del papiloma humano (la causa de algunos casos de cáncer de cuello uterino ), han sido refutados como Factores de riesgo para el cáncer de ovario. [28] [31] La carcinogenicidad del talco perineal es controvertida, porque puede actuar como irritante si viaja a través del tracto reproductivo hasta los ovarios. [31] [29] [35] Los estudios de casos y controles han demostrado que el uso de talco perineal aumenta el riesgo de cáncer de ovario, pero el uso de talco con más frecuencia no crea un riesgo mayor. [31] El uso de talco en otras partes del cuerpo no está relacionado con el cáncer de ovario. [35] Sentarse regularmente durante períodos prolongados se asocia con una mayor mortalidad por cáncer epitelial de ovario. El riesgo no se anula con el ejercicio regular, aunque sí se reduce. [51]
La edad avanzada (hasta los 70 años) es un factor de riesgo de cáncer de ovario epitelial porque se pueden acumular más mutaciones en las células y eventualmente causar cáncer. Los mayores de 80 años tienen un riesgo ligeramente menor. [29]
Fumar tabaco se asocia con un mayor riesgo de cáncer de ovario mucinoso ; Después de dejar de fumar , el riesgo finalmente vuelve a la normalidad. Los niveles más altos de proteína C reactiva se asocian con un mayor riesgo de desarrollar cáncer de ovario. [31]
La supresión de la ovulación, que de otro modo causaría daño al epitelio ovárico y, en consecuencia, inflamación , es generalmente protectora. Este efecto se puede conseguir teniendo hijos , tomando anticonceptivos orales combinados y amamantando , todos ellos factores protectores. [26] Un período más prolongado de lactancia materna se correlaciona con una mayor disminución en el riesgo de cáncer de ovario. [35] Cada nacimiento disminuye más el riesgo de cáncer de ovario, y este efecto se observa hasta en cinco nacimientos. Los anticonceptivos orales combinados reducen el riesgo de cáncer de ovario hasta en un 50% y el efecto protector de los anticonceptivos orales combinados puede durar entre 25 y 30 años después de suspenderlos. [29] [35] El uso regular de aspirina o paracetamol (paracetamol) puede estar asociado con un menor riesgo de cáncer de ovario; Otros AINE no parecen tener un efecto protector similar. [31]
La ligadura de trompas tiene un efecto protector porque los carcinógenos no pueden llegar al ovario y las fimbrias a través de la vagina, el útero y las trompas de Falopio. [26] La ligadura de trompas también tiene un efecto protector en mujeres con la mutación BRCA1, pero no con la mutación BRCA2. [31] La histerectomía reduce el riesgo, y la extirpación de las trompas de Falopio y los ovarios ( salpingooforectomía bilateral ) reduce drásticamente el riesgo no solo de cáncer de ovario sino también de cáncer de mama. [28] Este sigue siendo un tema de investigación, ya que el vínculo entre la histerectomía y un menor riesgo de cáncer de ovario es controvertido. Las razones por las que la histerectomía puede tener un efecto protector no se han aclarado hasta 2015. [35]
Una dieta que incluya grandes cantidades de caroteno , fibra y vitaminas con bajas cantidades de grasa; específicamente, una dieta con vegetales sin almidón (por ejemplo, brócoli y cebolla ) puede tener un efecto protector. [29] La fibra dietética se asocia con una reducción significativa del riesgo de cáncer de ovario. [52] Una revisión de 2021 encontró que la ingesta de vegetales de hojas verdes, vegetales allium, fibra, flavonoides y té verde puede reducir significativamente el riesgo de cáncer de ovario. [53]
El cáncer de ovario se forma cuando ocurren errores en el crecimiento normal de las células ováricas . Por lo general, cuando las células envejecen o se dañan, mueren y otras nuevas ocupan su lugar. El cáncer comienza cuando se forman nuevas células innecesarias y las células viejas o dañadas no mueren como deberían. La acumulación de células adicionales a menudo forma una masa de tejido llamada tumor o crecimiento ovárico . Estas células cancerosas anormales tienen muchas anomalías genéticas que hacen que crezcan excesivamente. [55] Cuando un ovario libera un óvulo , el folículo del óvulo se abre de golpe y se convierte en el cuerpo lúteo . Esta estructura debe repararse mediante la división de las células del ovario. [35] La ovulación continua durante mucho tiempo significa una mayor reparación del ovario mediante la división de las células, que pueden adquirir mutaciones en cada división. [29]
En general, las mutaciones genéticas más comunes en el cáncer de ovario ocurren en NF1 , BRCA1, BRCA2 y CDK12 . Los cánceres de ovario tipo I, que tienden a ser menos agresivos, tienden a tener inestabilidad de microsatélites en varios genes, incluidos los oncogenes (más notablemente BRAF y KRAS ) y supresores de tumores (más notablemente PTEN ). [28] Las mutaciones más comunes en los cánceres de tipo I son KRAS, BRAF, ERBB2, PTEN, PIK3CA y ARID1A. [31] Los cánceres de tipo II, el tipo más agresivo, tienen diferentes genes mutados, incluidos p53 , BRCA1 y BRCA2 . [28] Los cánceres de bajo grado tienden a tener mutaciones en KRAS, mientras que los cánceres de cualquier grado que se desarrollan a partir de tumores de bajo potencial maligno tienden a tener mutaciones en p53. [29] Los cánceres de tipo I tienden a desarrollarse a partir de lesiones precursoras, mientras que los cánceres de tipo II pueden desarrollarse a partir de un carcinoma intraepitelial tubárico seroso. [31] Los cánceres serosos que tienen mutaciones en BRCA también inevitablemente tienen mutaciones en p53, lo que indica que la eliminación de ambos genes funcionales es importante para que se desarrolle el cáncer. [29]
En el 50% de los cánceres serosos de alto grado, la reparación del ADN por recombinación homóloga es disfuncional, al igual que las vías de señalización notch y FOXM1 . También casi siempre tienen mutaciones en p53. Aparte de esto, las mutaciones en el carcinoma seroso de alto grado son difíciles de caracterizar más allá de su alto grado de inestabilidad genómica . BRCA1 y BRCA2 son esenciales para la reparación del ADN por recombinación homóloga, y las mutaciones de la línea germinal en estos genes se encuentran en aproximadamente el 15% de las mujeres con cáncer de ovario. [28] Las mutaciones más comunes en BRCA1 y BRCA2 son las mutaciones de cambio de marco que se originaron en una pequeña población fundadora de judíos asquenazíes. [29]
Casi el 100% de los carcinomas mucinosos raros tienen mutaciones en KRAS y amplificaciones de ERBB2 (también conocido como Her2/neu ). [28] En general, el 20% de los cánceres de ovario tienen mutaciones en Her2/neu . [26]
Los carcinomas serosos pueden desarrollarse a partir de un carcinoma intraepitelial tubárico seroso, en lugar de desarrollarse espontáneamente a partir de tejido ovárico. Otros carcinomas se desarrollan a partir de quistes de inclusión cortical, que son grupos de células epiteliales del ovario dentro del estroma . [29]


El diagnóstico de cáncer de ovario comienza con un examen físico (incluido un examen pélvico ), un análisis de sangre (para CA-125 y, a veces, otros marcadores) y una ecografía transvaginal . [26] [56] A veces se utiliza un examen rectovaginal para ayudar a planificar una cirugía. [29] El diagnóstico debe confirmarse con cirugía para inspeccionar la cavidad abdominal , tomar biopsias (muestras de tejido para análisis microscópico ) y buscar células cancerosas en el líquido abdominal. Esto ayuda a determinar si una masa ovárica es benigna o maligna. [26]
Las primeras etapas (I/II) del cáncer de ovario son difíciles de diagnosticar porque la mayoría de los síntomas son inespecíficos y, por tanto, de poca utilidad en el diagnóstico; como resultado, rara vez se diagnostica hasta que se propaga y avanza a etapas posteriores (III/IV). [57] Además, los síntomas del cáncer de ovario pueden parecer similares a los del síndrome del intestino irritable . En mujeres en las que existe la posibilidad de quedar embarazada, el nivel de BHCG se puede medir durante el proceso de diagnóstico. La alfafetoproteína sérica , la enolasa neuronal específica y la lactato deshidrogenasa se pueden medir en niñas y adolescentes con sospecha de tumores de ovario , ya que las mujeres más jóvenes con cáncer de ovario tienen más probabilidades de tener tumores malignos de células germinales. [26] [31]
Un examen físico, incluido un examen pélvico, y una ecografía pélvica (transvaginal o de otro tipo) son esenciales para el diagnóstico: el examen físico puede revelar un aumento del perímetro abdominal y/o ascitis (líquido dentro de la cavidad abdominal), mientras que el examen pélvico puede revelar un ovario. o masa abdominal. [28] Una masa anexial es un hallazgo importante que a menudo indica cáncer de ovario, especialmente si es fija, nodular, irregular, sólida y/o bilateral. 13 a 21% de las masas anexiales son causadas por malignidad; sin embargo, existen otras causas benignas de masas anexiales, incluyendo quiste folicular ovárico , leiomioma , endometriosis , embarazo ectópico , hidrosálpinx , absceso tuboovárico, torsión ovárica , quiste dermoide , cistadenoma (seroso o mucinoso), absceso diverticular o apendicular, tumor de la vaina nerviosa , riñón pélvico , divertículo ureteral o vesical , mesotelioma quístico benigno del peritoneo, tuberculosis peritoneal o quiste paraovárico . Los ovarios que se pueden palpar también son un signo de cáncer de ovario en mujeres posmenopáusicas. Otras partes de un examen físico en caso de sospecha de cáncer de ovario pueden incluir un examen de los senos y un examen rectal digital . La palpación de los ganglios linfáticos supraclaviculares , axilares e inguinales puede revelar linfadenopatía , que puede ser indicativa de metástasis. Otro indicador puede ser la presencia de un derrame pleural , que puede notarse en la auscultación . [31]
Cuando se incluye una neoplasia maligna de ovario en una lista de posibilidades diagnósticas, está indicado un número limitado de pruebas de laboratorio. Generalmente se obtiene un hemograma completo y una prueba de electrolitos séricos; [58] Cuando hay cáncer de ovario, estas pruebas a menudo muestran una cantidad elevada de plaquetas (20 a 25 % de los pacientes) y niveles bajos de sodio en la sangre debido a señales químicas secretadas por el tumor. [29] Una prueba positiva para inhibina A e inhibina B puede indicar un tumor de células de la granulosa. [31]
Un análisis de sangre para una molécula marcadora llamada CA-125 es útil en el diagnóstico diferencial y en el seguimiento de la enfermedad, pero por sí solo no ha demostrado ser un método eficaz para detectar el cáncer de ovario en etapa temprana debido a su inaceptable bajo nivel. sensibilidad y especificidad. [58] Los niveles de CA-125 en mujeres premenopáusicas superiores a 200 U/ml pueden indicar cáncer de ovario, al igual que cualquier elevación de CA-125 por encima de 35 U/ml en mujeres posmenopáusicas. Los niveles de CA-125 no son precisos en el cáncer de ovario en etapa temprana, ya que la mitad de las pacientes con cáncer de ovario en etapa I tienen un nivel normal de CA-125. [31] [ 29] El CA-125 también puede estar elevado en condiciones benignas (no cancerosas), incluyendo endometriosis , embarazo , fibromas uterinos , menstruación , quistes ováricos , lupus eritematoso sistémico , enfermedad hepática , enfermedad inflamatoria intestinal , enfermedad inflamatoria pélvica , y leiomioma . [31] [59] HE4 es otro candidato para las pruebas de cáncer de ovario, aunque no se ha probado exhaustivamente. Otros marcadores tumorales para el cáncer de ovario incluyen CA19-9 , CA72-4, CA15-3 , proteína ácida inmunosupresora, haptoglobina alfa, OVX1, mesotelina , ácido lisofosfatídico , osteopontina y factor de crecimiento de fibroblastos 23 . [31]
El uso de paneles de análisis de sangre puede ayudar en el diagnóstico. [31] [58] El panel OVA1 incluye CA-125, microglobulina beta-2 , transferrina , apolipoproteína A1 y transtiretina . OVA1 por encima de 5,0 en mujeres premenopáusicas y 4,4 en mujeres posmenopáusicas indica un alto riesgo de cáncer. [29] Se utiliza un conjunto diferente de pruebas de laboratorio para detectar tumores del estroma del cordón sexual. Los niveles altos de testosterona o sulfato de dehidroepiandrosterona , combinados con otros síntomas y niveles altos de inhibina A e inhibina B, pueden ser indicativos de un SCST de cualquier tipo. [33]
La investigación actual está buscando formas de considerar la proteómica de los marcadores tumorales en combinación con otros indicadores de enfermedad (es decir, radiología y/o síntomas) para mejorar la precisión del diagnóstico. El desafío de este enfoque es que la prevalencia dispar del cáncer de ovario significa que incluso las pruebas con muy alta sensibilidad y especificidad conducirán a una serie de resultados falsos positivos, lo que a su vez puede generar problemas como la realización de procedimientos quirúrgicos en los que el cáncer no se encuentra intraoperatoriamente. [ cita necesaria ] Aún no se han desarrollado enfoques genómicos para el cáncer de ovario. [31]
Se prefiere la tomografía computarizada para evaluar la extensión del tumor en la cavidad abdominopélvica, aunque también se pueden utilizar imágenes por resonancia magnética . [28] La tomografía computarizada también puede ser útil para encontrar apelmazamiento omental o diferenciar líquido de un tumor sólido en el abdomen, especialmente en tumores de bajo potencial maligno. Sin embargo, es posible que no detecte tumores más pequeños. En ocasiones, se utiliza una radiografía de tórax para detectar metástasis en el tórax o derrame pleural . Otra prueba para detectar la enfermedad metastásica, aunque se utiliza con poca frecuencia, es un enema de bario , que puede mostrar si el colon rectosigmoide está involucrado en la enfermedad. La tomografía por emisión de positrones , las gammagrafías óseas y la paracentesis son de uso limitado; de hecho, la paracentesis puede provocar la formación de metástasis en el lugar de inserción de la aguja y es posible que no proporcione resultados útiles. [29] Sin embargo, la paracentesis se puede utilizar en casos en los que no hay masa pélvica y todavía hay ascitis. [29] Un médico que sospecha cáncer de ovario también puede realizar una mamografía o una biopsia de endometrio (en el caso de sangrado anormal) para evaluar la posibilidad de neoplasias malignas de mama y de endometrio, respectivamente. La ecografía vaginal suele ser el estudio de imagen de primera línea que se realiza cuando se encuentra una masa anexial. Varias características de una masa anexial indican malignidad ovárica; suelen ser sólidos, irregulares, multiloculares y/o grandes; y típicamente tienen características papilares, vasos centrales y/o tabiques internos irregulares. [31] Sin embargo, SCST no tiene características definitivas en el estudio radiográfico. [33]
Para diagnosticar definitivamente el cáncer de ovario se requiere un procedimiento quirúrgico para inspeccionar el abdomen. Puede ser un procedimiento abierto ( laparotomía , incisión a través de la pared abdominal ) o una cirugía mínimamente invasiva ( laparoscopia ). Durante este procedimiento, se extrae el tejido sospechoso y se envía para análisis microscópico . Por lo general, esto incluye una salpingooforectomía unilateral , la extirpación de un solo ovario afectado y la trompa de Falopio. El líquido de la cavidad abdominal también se puede analizar en busca de células cancerosas . Si se encuentra cáncer, este procedimiento también se puede utilizar para determinar el alcance de su diseminación (que es una forma de estadificación del tumor ). [26]
La pafolacianina está indicada para su uso en adultos con cáncer de ovario para ayudar a identificar lesiones cancerosas durante la cirugía. [60] Es un agente de diagnóstico que se administra en forma de inyección intravenosa antes de la cirugía. [60]
Un método ampliamente reconocido para estimar el riesgo de cáncer de ovario maligno es el índice de riesgo de malignidad (RMI), calculado en base a un estudio inicial . [28] [61] Generalmente se considera que una puntuación RMI superior a 200 o 250 indica un alto riesgo de cáncer de ovario. [28] [31]
El RMI se calcula como:
Se pueden utilizar dos métodos para determinar la puntuación ecográfica y la puntuación menopáusica; las puntuaciones resultantes se denominan RMI 1 y RMI 2, respectivamente, según el método que se utilice.
Otro método para cuantificar el riesgo de cáncer de ovario es el algoritmo de riesgo de cáncer de ovario (ROCA), que observa los niveles a lo largo del tiempo y determina si aumentan lo suficientemente rápido como para justificar una ecografía transvaginal. [29] El algoritmo de riesgo de cáncer de ovario utiliza niveles de CA-125 y niveles de HE4 para calcular el riesgo de cáncer de ovario; puede ser más eficaz que RMI. Los modelos IOTA se pueden utilizar para estimar la probabilidad de que un tumor anexial sea maligno. [63] Incluyen el modelo de riesgo LR2, el cálculo de riesgo de reglas simples (SRrisk) y el modelo de evaluación de diferentes neoplasias en los anexos (ADNEX) que se pueden utilizar para evaluar el riesgo de malignidad en una masa anexial, en función de sus características y factores de riesgo. . El algoritmo QCancer (Ovary) se utiliza para predecir la probabilidad de cáncer de ovario a partir de factores de riesgo. [31]

Los cánceres de ovario se clasifican según el aspecto microscópico de sus estructuras ( histología o histopatología ). La histología dicta muchos aspectos del tratamiento clínico, manejo y pronóstico . La patología macroscópica de los cánceres de ovario es muy similar independientemente del tipo histológico: los tumores de ovario tienen masas sólidas y quísticas. [29] Según SEER , los tipos de cáncer de ovario en mujeres de 20 años o más son: [64]
Los cánceres de ovario se dividen histológica y genéticamente en tipo I o tipo II. Los cánceres de tipo I son de grado histológico bajo e incluyen carcinomas endometrioides, mucinosos y de células claras. Los cánceres de tipo II son de grado histológico superior e incluyen carcinoma seroso y carcinosarcoma. [28]

El cáncer epitelial de ovario típicamente se presenta en un estadio avanzado y se deriva de la transformación maligna del epitelio de la superficie del ovario, peritoneo o trompa de Falopio. [65] Es la causa más común de muerte por cáncer ginecológico. [65] Existen varios tipos de cáncer de ovario epitelial, incluido el tumor seroso, el tumor endometrioide, el tumor de células claras, el tumor mucinoso y los tumores indiferenciados o no clasificados. [66] Anualmente en todo el mundo, 230.000 mujeres serán diagnosticadas y 150.000 morirán. [67] Tiene una tasa de supervivencia de 46% a 5 años después del diagnóstico debido a la etapa avanzada de la enfermedad en el momento del diagnóstico. [67] Por lo general, alrededor del 75% de los pacientes son diagnosticados con una etapa avanzada de la enfermedad debido a la naturaleza asintomática de su presentación. [67] Existe una predisposición genómica al cáncer de ovario epitelial y se ha descubierto que los genes BRCA1 y BRCA2 son los genes causantes en 65-75% del cáncer de ovario epitelial hereditario. [67]
.jpg/440px-Serous_carcinoma_(3061775966).jpg)
El cáncer de ovario seroso es el tipo más común de cáncer de ovario epitelial y representa aproximadamente dos tercios de los casos de cáncer de ovario epitelial. [28] El carcinoma seroso de bajo grado es menos agresivo que los carcinomas serosos de alto grado, aunque generalmente no responde bien a la quimioterapia ni a los tratamientos hormonales. [28] Se cree que los carcinomas serosos comienzan en las trompas de Falopio . [68] [69] El carcinoma seroso de alto grado representa el 75 % de todos los cánceres epiteliales de ovario. [67] Alrededor de 15 a 20 % de los carcinomas serosos de alto grado tienen mutaciones de la línea germinal en BRCA1 y BRCA2. [67] Histológicamente, el patrón de crecimiento del carcinoma seroso de alto grado es heterogéneo y tiene algunos patrones de crecimiento papilar o sólido. [67] Las células tumorales son atípicas con núcleos grandes e irregulares. [67] Tiene una alta tasa de proliferación. [67] 50 % de las veces, los carcinomas serosos son bilaterales y, en 85 % de los casos, se han diseminado más allá del ovario en el momento del diagnóstico. [70]
Actualmente se reconoce que el carcinoma intraepitelial de trompas serosas (STIC) es la lesión precursora de la mayoría de los llamados carcinomas serosos de ovario de alto grado. [70] STIC se caracteriza por

El carcinoma de ovario de células pequeñas es raro y agresivo, con dos subtipos principales: hipercalcémico y pulmonar. [71] Esta rara malignidad afecta con mayor frecuencia a mujeres jóvenes menores de 40 años con un rango entre 14 meses y 58 años. [71] La edad media de diagnóstico es 24 años. [71] Aproximadamente dos tercios de los pacientes presentarán hipercalcemia paraneoplásica, lo que significa que tienen niveles altos de calcio en sangre por una razón desconocida. [71] [72] El tumor secreta una proteína relacionada con la hormona paratiroidea que actúa de manera similar a la PTH y se une a los receptores de PTH en el hueso y el riñón, causando hipercalcemia. [71] Investigaciones recientes han encontrado una línea germinal inactivante y una mutación somática del gen SMARCA4 . [71] [73] El subtipo hipercalcémico es muy agresivo y tiene una tasa de supervivencia general de 16 % con una tasa de recurrencia de 65 % en pacientes que reciben tratamiento. [71] Los pacientes que se han diseminado de la enfermedad a otras partes del cuerpo tienden a morir 2 años después del diagnóstico. [71] La diseminación extraovárica está involucrada en el 50% de los casos y la diseminación a los ganglios linfáticos está presente en el 55% de los casos. [72] La presentación inicial más común es una masa pélvica unilateral de rápido crecimiento con un tamaño medio de 15 cm. [71] Histológicamente, se caracteriza por muchas láminas de células pequeñas, redondas y muy compactas con racimos, nidos y cordones. [71] [72] La inmunohistoquímica suele ser positiva para vimentina, citoqueratina, CD10, p53 y WT-1. [71] [73]
El carcinoma de ovario de células pequeñas del subtipo pulmonar se presenta de manera diferente al subtipo hipercalcémico. [71] Por lo general, el cáncer de ovario pulmonar de células pequeñas suele afectar a ambos ovarios de mujeres mayores y se parece al carcinoma de pulmón de células de avena . [29] La edad promedio de aparición de la enfermedad es 59 años y aproximadamente el 45% de los casos son bilaterales para el subtipo pulmonar. [71] Además, varias hormonas pueden estar elevadas en el subtipo pulmonar, incluidas la serotonina, la somatostatina, la insulina, la gastrina y la calcitonina. [71]
Los carcinomas peritoneales primarios se desarrollan a partir del peritoneo , una membrana que recubre la cavidad abdominal y que tiene el mismo origen embrionario que el ovario. A menudo se comentan y clasifican con los cánceres de ovario cuando afectan al ovario. [68] [74] Pueden desarrollarse incluso después de que se hayan extirpado los ovarios y pueden parecer similares al mesotelioma . [29]

El carcinoma de células claras de ovario es un subtipo poco común de cáncer de ovario epitelial. Las personas diagnosticadas con carcinoma de células claras de ovario suelen ser más jóvenes a la edad del diagnóstico y se les diagnostica en etapas más tempranas que otros subtipos de cáncer de ovario epitelial. [75] [76] La mayor incidencia de carcinoma de células claras de ovario se ha observado entre mujeres jóvenes asiáticas, especialmente aquellas de origen coreano, taiwanés y japonés. [75] [76] La endometriosis se ha relacionado con ser el principal factor de riesgo para el desarrollo de carcinoma de células claras de ovario y se ha encontrado que está presente en el 50% de las mujeres diagnosticadas con carcinoma de células claras de ovario. [75] Se informa que el desarrollo de coágulos en las piernas, como en el caso del tromboembolismo venoso profundo, o en los pulmones con embolismo pulmonar, es un 40% mayor en pacientes con carcinoma de células claras que en otros subtipos de cáncer epitelial de ovario. [76] Se ha descubierto que las mutaciones en vías moleculares como ARID1A, PIK3 y PIK3CA están relacionadas con el carcinoma de células claras. [75] [76] Por lo general, se presentan como una masa grande y unilateral, con un tamaño medio de entre 13 y 15 cm. [75] El 90% de los casos son unilaterales. [75] El carcinoma de células claras de ovario no suele responder bien a la quimioterapia debido a la quimiorresistencia intrínseca; por lo tanto, el tratamiento suele consistir en cirugía citorreductora agresiva y quimioterapia a base de platino. [28] [75]

Los adenocarcinomas de células claras son histopatológicamente similares a otros carcinomas de células claras , con células claras y células en forma de clavo . Representan aproximadamente del 5 al 10% de los cánceres epiteliales de ovario y se asocian con endometriosis en la cavidad pélvica. Por lo general, se encuentran en una etapa temprana y, por lo tanto, se pueden curar mediante cirugía, pero los adenocarcinomas de células claras avanzados (aproximadamente 20%) tienen un pronóstico precario y a menudo son resistentes a la quimioterapia con platino. [29]
Los adenocarcinomas endometrioides representan aproximadamente entre el 13 y el 15 % de todos los cánceres de ovario. [77] Debido a que típicamente son de bajo grado, los adenocarcinomas endometrioides tienen un buen pronóstico. [77] La edad media de diagnóstico es de alrededor de 53 años. [77] Estos tumores frecuentemente coexisten con la endometriosis o el cáncer de endometrio. [29] [77] Los niveles del antígeno canceroso 125 generalmente están elevados y los antecedentes familiares de un pariente de primer grado con cáncer de ovario endometrioide se asocian con un mayor riesgo de desarrollar cáncer de ovario endometrioide. [77] El tamaño promedio del tumor es mayor de 10 cm. [77]
Los tumores müllerianos mixtos representan menos del 1% del cáncer de ovario. Tienen células epiteliales y mesenquimales visibles y suelen tener mal pronóstico. [29]
Los tumores mucinosos incluyen el adenocarcinoma mucinoso y el cistoadenocarcinoma mucinoso. [29]
Los adenocarcinomas mucinosos representan entre el 5 y el 10% de los cánceres epiteliales de ovario. Histológicamente, son similares a los adenocarcinomas intestinales o cervicales y, a menudo, en realidad son metástasis de cánceres de apéndice o colon . Los adenocarcinomas mucinosos avanzados tienen un mal pronóstico, generalmente peor que los tumores serosos y, a menudo, son resistentes a la quimioterapia con platino, aunque son raros. [29]

El pseudomixoma peritoneal se refiere a una colección de material mucoso o gelatinoso encapsulado en la cavidad abdominopélvica, que muy raramente es causada por un tumor de ovario mucinoso primario. Más comúnmente, se asocia con metástasis ováricas de cáncer intestinal. [29]
Los cánceres indiferenciados (aquellos en los que no se puede determinar el tipo de célula) representan alrededor del 10% de los cánceres de ovario epiteliales y tienen un pronóstico comparativamente malo. [29] [68] Cuando se examinan bajo el microscopio, estos tumores tienen células muy anormales que están dispuestas en grupos o láminas. Por lo general, hay grupos reconocibles de células serosas dentro del tumor. [29]

Los tumores malignos de Brenner son raros. Histológicamente tienen un estroma fibroso denso con áreas de epitelio de transición y cierta diferenciación escamosa. Para ser clasificado como tumor de Brenner maligno, debe tener focos de tumor de Brenner y carcinoma de células transicionales. El componente del carcinoma de células transicionales suele estar poco diferenciado y se asemeja al cáncer del tracto urinario. [29]
Los carcinomas de células transicionales representan menos del 5% de los cánceres de ovario. Histológicamente, parecen similares al carcinoma de vejiga . El pronóstico es intermedio: mejor que el de la mayoría de los cánceres epiteliales, pero peor que el de los tumores malignos de Brenner. [29]
El tumor del estroma del cordón sexual , incluido el tumor de células de la granulosa productor de estrógenos , el tecoma benigno y el tumor virilizante de células de Sertoli-Leydig o arrenoblastoma , representa el 7% de los cánceres de ovario. Ocurren con mayor frecuencia en mujeres entre 50 y 69 años, pero pueden ocurrir en mujeres de cualquier edad, incluidas las niñas. No suelen ser agresivos y suelen ser unilaterales; [26] por lo tanto, generalmente se tratan solo con cirugía. Los tumores del estroma del cordón sexual son los principales tumores de ovario productores de hormonas. [33]
Varias células diferentes del mesénquima pueden dar lugar a tumores del estroma o de los cordones sexuales. Estos incluyen fibroblastos y células endocrinas. Los síntomas de un tumor de ovario del cordón sexual o del estroma pueden diferir de otros tipos de cáncer de ovario. Los signos y síntomas comunes incluyen torsión ovárica , hemorragia o ruptura del tumor, una masa abdominal y alteración hormonal. En los niños, la pseudopubertad precoz isosexual puede ocurrir con tumores de células de la granulosa, ya que producen estrógeno. Estos tumores causan anomalías en la menstruación ( sangrado excesivo , menstruación poco frecuente o ausencia de menstruación ) o sangrado posmenopáusico. Debido a que estos tumores producen estrógeno, pueden causar o ocurrir al mismo tiempo que el cáncer de endometrio o el cáncer de mama . Otros tumores del cordón sexual/estroma se presentan con síntomas distintos. Los tumores de células de Sertoli-Leydig provocan virilización y crecimiento excesivo de cabello debido a la producción de testosterona y androstenediona , que también pueden provocar el síndrome de Cushing en casos raros. Además, se producen tumores del estroma de los cordones sexuales que no provocan un desequilibrio hormonal, incluidos los fibromas benignos, que provocan ascitis e hidrotórax . [26] Junto con los tumores de células germinales, los tumores del estroma del cordón sexual son el cáncer de ovario más común diagnosticado en mujeres menores de 20 años. [33]
Los tumores de células de la granulosa son los tumores del estroma de los cordones sexuales más comunes, representan el 70% de los casos, y se dividen en dos subtipos histológicos: tumores de células de la granulosa adultas, que se desarrollan en mujeres mayores de 50 años, y tumores de la granulosa juveniles, que se desarrollan antes de la pubertad o antes de los 30 años. Ambos se desarrollan en el folículo ovárico a partir de una población de células que rodea a las células germinales. [33]
Los tumores de células de la granulosa en adultos se caracterizan por un inicio tardío (más de 30 años, 50 en promedio). Estos tumores producen niveles elevados de estrógeno, lo que provoca sus síntomas característicos: menometrorragia ; hiperplasia endometrial ; senos sensibles y agrandados ; sangrado posmenopáusico ; y amenorrea secundaria . La masa del tumor puede causar otros síntomas, como dolor y distensión abdominal, o síntomas similares a los de un embarazo ectópico si el tumor sangra y se rompe. [33]
Los tumores de Sertoli-Leydig son más comunes en mujeres antes de los 30 años y particularmente comunes antes de la pubertad. [33]
Los tumores estromales esclerosantes suelen aparecer en niñas antes de la pubertad o en mujeres antes de los 30 años. [33]
Los tumores de células germinales del ovario se desarrollan a partir de las células germinales del ovario . [68] Los tumores de células germinales representan aproximadamente el 30 % de los tumores de ovario, pero solo el 5 % de los cánceres de ovario, porque la mayoría de los tumores de células germinales son teratomas y la mayoría de los teratomas son benignos. Los teratomas malignos tienden a ocurrir en mujeres mayores, cuando una de las capas germinales del tumor se convierte en un carcinoma de células escamosas . [26] Los tumores de células germinales tienden a ocurrir en mujeres jóvenes (entre 20 y 30 años) y niñas, y representan el 70% del cáncer de ovario observado en ese grupo de edad. [34] Los tumores de células germinales pueden incluir disgerminomas, teratomas, tumores del saco vitelino/tumores del seno endodérmico y coriocarcinomas, cuando surgen en el ovario. Algunos tumores de células germinales tienen un isocromosoma 12, donde un brazo del cromosoma 12 se elimina y se reemplaza con un duplicado del otro. [26] La mayoría de los cánceres de células germinales tienen un mejor pronóstico que otros subtipos y son más sensibles a la quimioterapia. Es más probable que estén en etapa I en el momento del diagnóstico. [33] En general, metastatizan con más frecuencia que los cánceres de ovario epiteliales. Además, los marcadores de cáncer utilizados varían según el tipo de tumor: los coriocarcinomas se controlan con beta-HCG y los tumores de los senos endodérmicos con alfafetoproteína . [26]
Los tumores de células germinales generalmente se descubren cuando se convierten en masas grandes y palpables. Sin embargo, al igual que los tumores de los cordones sexuales, pueden causar torsión o hemorragia ovárica y, en los niños, pubertad precoz isosexual. Con frecuencia metastatizan a los ganglios linfáticos cercanos, especialmente a los ganglios linfáticos paraaórticos y pélvicos. [26] El síntoma más común de los tumores de células germinales es el dolor abdominal subagudo causado por el sangrado del tumor, la necrosis o el estiramiento de la cápsula ovárica. Si el tumor se rompe, causa un sangrado significativo o desgarra el ovario, puede causar dolor abdominal agudo , que ocurre en menos del 10% de las personas con tumores de células germinales. También pueden secretar hormonas que cambian el ciclo menstrual . En el 25% de los tumores de células germinales, el cáncer se descubre durante un examen de rutina y no causa síntomas. [33]
Diagnosticar tumores de células germinales puede ser difícil porque el ciclo menstrual normal y la pubertad pueden causar dolor y síntomas pélvicos, y una mujer joven puede incluso creer que estos síntomas son los del embarazo y no buscar tratamiento debido al estigma del embarazo en la adolescencia . Los análisis de sangre para alfafetoproteína, cariotipo , gonadotropina coriónica humana y función hepática se utilizan para diagnosticar tumores de células germinales y una posible disgenesia gonadal concurrente. Inicialmente, un tumor de células germinales puede confundirse con un quiste ovárico benigno . [33]

El disgerminoma representa 35% de los cánceres de ovario en mujeres jóvenes y es el tumor de células germinales con mayor probabilidad de metastatizarse en los ganglios linfáticos; las metástasis ganglionares ocurren en 25 a 30% de los casos. [34] [33] Estos tumores pueden tener mutaciones en el gen KIT , una mutación conocida por su función en el tumor del estroma gastrointestinal . Las personas con un cariotipo XY y ovarios ( disgenesia gonadal ) o un cariotipo X,0 y ovarios ( síndrome de Turner ) que desarrollan un disgerminoma unilateral tienen riesgo de sufrir un gonadoblastoma en el otro ovario y, en este caso, generalmente se extirpan ambos ovarios cuando Se descubre un disgerminoma unilateral para evitar el riesgo de otro tumor maligno. Los gonadoblastomas en personas con síndrome de Swyer o Turner se vuelven malignos en aproximadamente el 40% de los casos. Sin embargo, en general, los disgerminomas son bilaterales entre 10 y 20% de las veces. [26] [33]

Están compuestos por células que no pueden diferenciarse más y se desarrollan directamente a partir de células germinales o de gonadoblastomas. Los disgerminomas contienen sincitiotrofoblastos en aproximadamente el 5% de los casos y, por lo tanto, pueden causar niveles elevados de hCG. A simple vista, los disgerminomas suelen ser de color rosado a tostado, tienen múltiples lóbulos y son sólidos. Microscópicamente, parecen idénticos a los seminomas y muy cercanos a las células germinales primordiales embrionarias , ya que tienen células claras grandes, poliédricas y redondeadas . Los núcleos son uniformes y redondos o cuadrados con nucléolos prominentes y el citoplasma tiene niveles elevados de glucógeno . La inflamación es otra característica histológica destacada de los disgerminomas. [33]
El coriocarcinoma puede ocurrir como un tumor ovárico primario que se desarrolla a partir de una célula germinal, aunque generalmente es una enfermedad gestacional que metastatiza en el ovario. El coriocarcinoma de ovario primario tiene un mal pronóstico y puede ocurrir sin embarazo. Producen altos niveles de hCG y pueden causar pubertad temprana en niños o menometrorragia (menstruación irregular y abundante) después de la menarquia. [33]
.jpg/440px-Mature_Cystic_Teratoma_of_the_Ovary_(5560431170).jpg)
Los teratomas inmaduros o sólidos son el tipo más común de tumor de células germinales de ovario y representan entre el 40 y el 50% de los casos. Los teratomas se caracterizan por la presencia de tejidos desorganizados que surgen de las tres capas germinales embrionarias : ectodermo , mesodermo y endodermo ; Los teratomas inmaduros también tienen células madre indiferenciadas que los hacen más malignos que los teratomas maduros (quistes dermoides). Los diferentes tejidos son visibles a simple vista y a menudo incluyen hueso, cartílago, cabello, moco o sebo , pero estos tejidos no son visibles desde el exterior, que parece ser una masa sólida con lóbulos y quistes. Histológicamente presentan grandes cantidades de neuroectodermo organizado en láminas y túbulos junto con la glía ; la cantidad de tejido neural determina el grado histológico. Los teratomas inmaduros generalmente afectan solo a un ovario (10% coexisten con quistes dermoides) y generalmente metastatizan en todo el peritoneo. También pueden hacer que los implantes de teratoma maduro crezcan por todo el abdomen en una enfermedad llamada síndrome de teratoma en crecimiento ; Estos suelen ser benignos, pero seguirán creciendo durante la quimioterapia y, a menudo, requieren más cirugía. A diferencia de los teratomas maduros, los teratomas inmaduros forman muchas adherencias , lo que los hace menos propensos a causar torsión ovárica. No existe un marcador específico para los teratomas inmaduros, pero el antígeno carcinoembrionario (CEA), CA-125, CA19-9 o AFP a veces pueden indicar un teratoma inmaduro. [33]
Los teratomas en estadio I constituyen la mayoría (75%) de los casos y tienen el mejor pronóstico, ya que el 98% de los pacientes sobrevive cinco años; Si un tumor en etapa I también es de grado 1, se puede tratar únicamente con cirugía unilateral. Los tumores en estadio II a IV constituyen la cuarta parte restante de los casos y tienen un peor pronóstico, ya que entre el 73 y el 88 % de los pacientes sobreviven cinco años. [33]
Los teratomas maduros, o quistes dermoides, son tumores raros que consisten principalmente en tejido benigno que se desarrollan después de la menopausia. Los tumores consisten en tejido desorganizado con nódulos de tejido maligno, que pueden ser de varios tipos. La neoplasia maligna más común es el carcinoma de células escamosas , pero el adenocarcinoma , el carcinoma de células basales , el tumor carcinoide , el tumor neuroectodérmico , el melanoma maligno , el sarcoma , el tumor sebáceo y el estruma ovárico también pueden formar parte del quiste dermoide. Se tratan con cirugía y quimioterapia o radiación adyuvante con platino. [33]
Los tumores del saco vitelino , anteriormente llamados tumores del seno endodérmico, representan aproximadamente del 10 al 20% de las neoplasias malignas de células germinales del ovario y tienen el peor pronóstico de todos los tumores de células germinales del ovario . Ocurren tanto antes de la menarquia (en un tercio de los casos) como después de la menarquia (los dos tercios restantes de los casos). La mitad de las personas con tumores del saco vitelino son diagnosticadas en el estadio I. Por lo general, son unilaterales hasta la metástasis, que ocurre dentro de la cavidad peritoneal y a través del torrente sanguíneo hasta los pulmones. Los tumores del saco vitelino crecen rápidamente y reaparecen fácilmente, y no son fácilmente tratables una vez que han reaparecido. Los tumores del saco vitelino en estadio I son altamente tratables, con una tasa de supervivencia libre de enfermedad a 5 años del 93 %, pero los tumores en estadio II-IV son menos tratables, con tasas de supervivencia del 64 al 91 %. [33]
Su apariencia macroscópica es sólida, friable y amarilla, con áreas necróticas y hemorrágicas. También suelen contener quistes que pueden degenerar o romperse. Histológicamente, los tumores del saco vitelino se caracterizan por la presencia de cuerpos de Schiller-Duval (que son patognomónicos de los tumores del saco vitelino) y un patrón reticular. Los tumores del saco vitelino comúnmente secretan alfafetoproteína y pueden teñirse inmunohistoquímicamente para detectar su presencia; el nivel de alfafetoproteína en sangre es un marcador útil de recurrencia. [33]
Los carcinomas embrionarios, un tipo de tumor poco común que generalmente se encuentra en tumores mixtos, se desarrollan directamente a partir de células germinales pero no se diferencian terminalmente; en casos raros, pueden desarrollarse en gónadas disgenéticas. Pueden desarrollarse aún más y convertirse en una variedad de otras neoplasias, incluido el coriocarcinoma, el tumor del saco vitelino y el teratoma. Ocurren en personas más jóvenes, con una edad promedio en el momento del diagnóstico de 14 años, y secretan tanto alfafetoproteína (en el 75% de los casos) como hCG. [33]
Histológicamente, el carcinoma embrionario tiene un aspecto similar al disco embrionario , formado por células epiteliales, anaplásicas, en láminas desorganizadas, con espacios glandulares y estructuras papilares. [33]
Los poliembriomas, la forma más inmadura de teratoma y tumores ováricos muy raros, se caracterizan histológicamente por tener varios cuerpos parecidos a embriones con estructuras que se asemejan a un disco germinal, un saco vitelino y un saco amniótico . Las células gigantes de sincitiotrofoblasto también se encuentran en los poliembriomas. [33]
Artículo principal : Carcinoma de células escamosas de ovario
Los carcinomas primarios de células escamosas de ovario son raros y tienen un mal pronóstico cuando están avanzados. Más típicamente, los carcinomas de células escamosas de ovario son metástasis cervicales, áreas de diferenciación en un tumor endometrioide o derivados de un teratoma maduro. [29]
Los tumores mixtos contienen elementos de más de una de las clases anteriores de histología tumoral. Para ser clasificado como tumor mixto, el tipo menor debe representar más del 10% del tumor. [31] Aunque los carcinomas mixtos pueden tener cualquier combinación de tipos de células, los cánceres de ovario mixtos suelen ser serosos/endometrioides o de células claras/endometrioides. [29] Los tumores mixtos de células germinales representan aproximadamente entre el 25 y el 30 % de todos los cánceres de ovario de células germinales, con combinaciones de disgerminoma, tumor del saco vitelino y/o teratoma inmaduro. El pronóstico y el tratamiento varían según los tipos de células que lo componen. [33]
El cáncer de ovario también puede ser un cáncer secundario, el resultado de la metástasis de un cáncer primario en otra parte del cuerpo. [26] Alrededor del 5% al 30% de los cánceres de ovario se deben a metástasis, mientras que el resto son cánceres primarios. [78] Los cánceres primarios comunes son el cáncer de mama , el cáncer de colon , el cáncer de apéndice y el cáncer de estómago (los cánceres gástricos primarios que hacen metástasis en el ovario se denominan tumores de Krukenberg ). [26] Los tumores de Krukenberg tienen células en anillo de sello y células mucinosas. [29] El cáncer de endometrio y los linfomas también pueden metastatizarse en el ovario. [79]
Los tumores limítrofes de ovario , a veces llamados tumores de ovario de bajo potencial maligno (LMP), tienen algunas características benignas y otras malignas. [29] Los tumores FUM representan aproximadamente entre el 10 % y el 15 % de todos los tumores de ovario. [31] [68] Se desarrollan antes que el cáncer de ovario epitelial, alrededor de los 40 a 49 años. Por lo general, no tienen una invasión extensa; El 10 % de los tumores FUM tienen áreas de microinvasión estromal (<3 mm, <5 % del tumor). Los tumores FUM tienen otras características anormales, que incluyen aumento de la mitosis, cambios en el tamaño de las células o del núcleo , núcleos anormales , estratificación celular y pequeñas proyecciones sobre las células (proyecciones papilares). Las características serosas y/o mucinosas se pueden observar en el examen histológico, y la histología serosa constituye la inmensa mayoría de los tumores FUM avanzados. Más del 80% de los tumores FUM están en estadio I; El 15% están en estadio II y III y menos del 5% están en estadio IV. [29] Los implantes de tumores FUM a menudo no son invasivos. [68]
El cáncer de ovario se clasifica utilizando el sistema de estadificación FIGO y utiliza información obtenida después de la cirugía, que puede incluir una histerectomía abdominal total mediante laparotomía de la línea media , extirpación (generalmente) de ambos ovarios y trompas de Falopio , (generalmente) el epiplón , lavados pélvicos (peritoneales) , evaluación de los ganglios linfáticos retroperitoneales (incluidos los ganglios linfáticos pélvicos y paraaórticos ), apendicectomía en casos sospechosos de tumores mucinosos y biopsias pélvicas/peritoneales para citopatología . [28] [26] [31] [80] Alrededor del 30% de los cánceres de ovario que parecen confinados al ovario han metastatizado microscópicamente, razón por la cual incluso los cánceres en etapa I deben estadificarse por completo. [26] Se observa que el 22% de los cánceres que se presume están en etapa I tienen metástasis linfáticas. [31] La etapa AJCC es la misma que la etapa FIGO. El sistema de estadificación del AJCC describe la extensión del tumor primario (T), la ausencia o presencia de metástasis a los ganglios linfáticos cercanos (N) y la ausencia o presencia de metástasis a distancia (M). [81] La etapa más común en el momento del diagnóstico es la etapa IIIc, con más del 70% de los diagnósticos. [26]

El sistema de estadificación AJCC/TNM indica dónde se desarrolló el tumor, dónde se diseminó a los ganglios linfáticos y dónde se produjo la metástasis. [31]
Las etapas AJCC/TNM se pueden correlacionar con las etapas FIGO: [31]
Los tumores de grado 1 tienen células bien diferenciadas (se ven muy similares al tejido normal) y son los que tienen mejor pronóstico. Los tumores de grado 2 también se denominan moderadamente bien diferenciados y están formados por células que se asemejan al tejido normal. Los tumores de grado 3 tienen el peor pronóstico y sus células son anormales, lo que se conoce como poco diferenciadas. [82]
La metástasis en el cáncer de ovario es muy común en el abdomen y se produce mediante exfoliación, donde las células cancerosas atraviesan la cápsula ovárica y pueden moverse libremente por la cavidad peritoneal. Las metástasis del cáncer de ovario generalmente crecen en la superficie de los órganos en lugar de en el interior; también son comunes en el epiplón y el revestimiento peritoneal. Las células cancerosas también pueden viajar a través del sistema linfático y metastatizarse en los ganglios linfáticos conectados a los ovarios a través de los vasos sanguíneos; es decir, los ganglios linfáticos a lo largo del ligamento infundibulopélvico , el ligamento ancho y el ligamento redondo . Los grupos más comúnmente afectados incluyen los ganglios linfáticos paraaórticos , hipogástricos, ilíacos externos , obturadores e inguinales . Por lo general, el cáncer de ovario no hace metástasis en el hígado, los pulmones, el cerebro o los riñones a menos que sea una enfermedad recurrente; esto diferencia el cáncer de ovario de muchas otras formas de cáncer. [29]
Las mujeres con un fuerte riesgo genético de padecer cáncer de ovario pueden considerar la extirpación quirúrgica de sus ovarios como medida preventiva. Esto se hace a menudo después de completar los años fértiles. Esto reduce las posibilidades de desarrollar cáncer de mama (alrededor del 50%) y cáncer de ovario (alrededor del 96%) en mujeres con alto riesgo. A las mujeres con mutaciones en el gen BRCA generalmente también se les extirpan las trompas de Falopio al mismo tiempo (salpingooforectomía), ya que también tienen un mayor riesgo de cáncer de trompas de Falopio . Sin embargo, estas estadísticas pueden sobrestimar la reducción del riesgo debido a la forma en que se han estudiado. [26] [83]
Las mujeres con antecedentes familiares importantes de cáncer de ovario a menudo son remitidas a un asesor genético para ver si las pruebas de mutaciones BRCA serían beneficiosas. [29] El uso de anticonceptivos orales, la ausencia de "períodos" durante el ciclo menstrual y la ligadura de trompas reducen el riesgo. [84] Puede haber una asociación entre el desarrollo de cáncer de ovario y la estimulación ovárica durante los tratamientos de infertilidad. La endometriosis se ha relacionado con el cáncer de ovario. No se ha identificado que la infección por el virus del papiloma humano , el tabaquismo y el talco aumenten el riesgo de desarrollar cáncer de ovario. [28]
No existe una forma sencilla y confiable de realizar pruebas de cáncer de ovario en mujeres que no presentan ningún signo o síntoma. No se recomiendan las pruebas de detección en mujeres con un riesgo promedio, ya que la evidencia no respalda una reducción de la mortalidad y la alta tasa de pruebas falsas positivas puede llevar a una cirugía innecesaria, que va acompañada de sus propios riesgos. [19] Las mujeres con alto riesgo de cáncer de ovario que actualmente se identifican según los antecedentes familiares y las pruebas genéticas pueden beneficiarse de las pruebas de detección. [85] La prueba de Papanicolaou no detecta el cáncer de ovario. [27]
El cáncer de ovario generalmente sólo es palpable en etapas avanzadas. [29] Este grupo de alto riesgo se ha beneficiado de una detección más temprana. [28] [26] [83] No se recomienda la detección mediante mediciones de CA-125 , niveles de HE4 , ultrasonido o palpación de anexos en mujeres que tienen un riesgo promedio. Actualmente no existe ningún programa nacional de detección del cáncer de ovario en el Reino Unido. Se pueden utilizar CA125 y ecografía transvaginal, pero hay evidencia mínima que sugiere que esto disminuye la mortalidad. Más recientemente, se ha demostrado que el algoritmo de riesgo de cáncer de ovario (ROMA) detecta cánceres más tempranos utilizando CA125 y la edad, pero nuevamente no proporciona una medida sólida para disminuir la mortalidad en la actualidad. [86]
El cáncer de ovario tiene una baja prevalencia, incluso en el grupo de alto riesgo de mujeres de 50 a 60 años (aproximadamente una en 2000), y es más probable que la detección en mujeres con riesgo promedio dé resultados ambiguos que detecte un problema que requiere tratamiento. . Debido a que los resultados ambiguos son más probables que la detección de un problema tratable, y debido a que la respuesta habitual a los resultados ambiguos son las intervenciones invasivas, en mujeres de riesgo promedio, los daños potenciales de realizarse exámenes de detección sin una indicación superan los beneficios potenciales. El propósito de la detección es diagnosticar el cáncer de ovario en una etapa temprana, cuando es más probable que se trate con éxito. [26] [83]
Se pueden utilizar pruebas de detección con ecografía transvaginal , examen pélvico y niveles de CA-125 en lugar de cirugía preventiva en mujeres que tienen mutaciones en BRCA1 o BRCA2. Esta estrategia ha mostrado cierto éxito. [29]
En un estudio a gran escala en el Reino Unido, se demostró que la detección de CA125, una sustancia química liberada por los tumores de ovario, con seguimiento mediante ultrasonido, no fue efectiva para reducir la mortalidad. [87]
Ha habido algunos ensayos de detección que han utilizado la edad, los antecedentes familiares de cáncer de ovario y el estado de mutación para identificar las poblaciones objetivo de la detección. [85]
Una vez que se determina que hay cáncer de ovario, de trompas de Falopio o peritoneal primario, el tratamiento lo programa un oncólogo ginecológico (un médico capacitado para tratar los cánceres del sistema reproductivo de la mujer). Los oncólogos ginecólogos pueden realizar cirugías y administrar quimioterapia a mujeres con cáncer de ovario. Se desarrolla un plan de tratamiento. [88]
El tratamiento suele incluir cirugía y quimioterapia y, en ocasiones , radioterapia , independientemente del subtipo de cáncer de ovario. [68] [89] El tratamiento quirúrgico puede ser suficiente para tumores malignos bien diferenciados y confinados al ovario. Es posible que se requiera la adición de quimioterapia para tumores más agresivos confinados al ovario. Para pacientes con enfermedad avanzada, lo estándar es una combinación de reducción quirúrgica con un régimen de quimioterapia combinado. Desde 1980, los medicamentos a base de platino han tenido un papel importante en el tratamiento del cáncer de ovario. [ cita necesaria ] Los tumores límite , incluso después de diseminarse fuera del ovario, se tratan bien con cirugía y la quimioterapia no se considera útil. [90] No se ha demostrado que la cirugía de revisión y la quimioterapia de mantenimiento proporcionen beneficios. [29]
La cirugía ha sido el estándar de atención durante décadas y puede ser necesaria para obtener una muestra para el diagnóstico . La cirugía depende del grado de invasión del cáncer a otros tejidos cercanos cuando se diagnostica. Esta extensión del cáncer se describe asignándole una etapa, el tipo presunto y el grado del cáncer. El cirujano ginecológico puede extirpar uno (ooforectomía unilateral) o ambos ovarios (ooforectomía bilateral). También se pueden extirpar las trompas de Falopio (salpingectomía), el útero (histerectomía) y el epiplón (omentectomía). Por lo general, se extirpan todos estos órganos. [91]
Para aquellos que dan positivo en los genes BRCA1 o BRCA2 defectuosos, someterse a una cirugía para reducir el riesgo es una opción. Un número cada vez mayor de mujeres eligen esto. Al mismo tiempo, el tiempo medio de espera para someterse al procedimiento es de dos años, mucho más de lo recomendado. [92] [93]
Para los cánceres unilaterales de bajo grado en etapa IA, solo se extirparán el ovario afectado (que no debe estar roto) y la trompa de Falopio. Esto se puede hacer especialmente en personas jóvenes que desean preservar su fertilidad. Sin embargo, existe riesgo de metástasis microscópicas y se debe completar la estadificación. [28] Si se encuentra alguna metástasis, se necesita una segunda cirugía para extirpar el ovario y el útero restantes. [90] El ácido tranexámico se puede administrar antes de la cirugía para reducir la necesidad de transfusiones de sangre debido a la pérdida de sangre durante la cirugía. [31]
Si durante la cirugía se determina que un tumor en una mujer premenopáusica es un tumor de bajo potencial maligno, y es claramente cáncer en etapa I, solo se extirpa el ovario afectado. Para las mujeres posmenopáusicas con tumores de bajo potencial maligno, la histerectomía con salpingooforectomía bilateral sigue siendo la opción preferida. Durante la estadificación, se puede examinar o extirpar el apéndice. Esto es particularmente importante en el caso de los tumores mucinosos. [29] En niños o adolescentes con cáncer de ovario, los cirujanos generalmente intentan preservar un ovario para permitir la finalización de la pubertad , pero si el cáncer se ha diseminado, esto no siempre es posible. Los disgerminomas, en particular, tienden a afectar ambos ovarios: entre 8 y 15% de los disgerminomas están presentes en ambos ovarios. [34] Las personas con tumores de bajo grado (bien diferenciados) generalmente reciben tratamiento sólo con cirugía, [26] que a menudo es curativa. [68] En general, los tumores de células germinales se pueden tratar con cirugía unilateral a menos que el cáncer esté muy extendido o la fertilidad no sea un factor. [33] En mujeres con cáncer de ovario epitelial avanzado estadificado quirúrgicamente (estadios III y IV), los estudios sugieren que se deben hacer todos los intentos para alcanzar la citorreducción completa (esfuerzos quirúrgicos para extirpar la mayor parte del tumor). [94]
En los cánceres avanzados, donde la extirpación completa no es una opción, se extirpa la mayor cantidad de tumor posible mediante un procedimiento llamado cirugía citorreductora . Esta cirugía no siempre tiene éxito y es menos probable que lo sea en mujeres con metástasis extensas en el peritoneo, enfermedad en estadio IV, cáncer en la fisura transversal del hígado , mesenterio o diafragma y grandes áreas de ascitis. La cirugía citorreductora generalmente solo se ha realizado una vez [28] , pero un estudio reciente ha demostrado una supervivencia general más larga en el cáncer de ovario recurrente cuando se realiza la cirugía combinada con quimioterapia en comparación con el tratamiento con quimioterapia sola. [95] La tomografía computarizada (TC abdominal) se utiliza a menudo para evaluar si la cirugía de citorreducción primaria es posible, pero la evidencia de certeza baja también sugiere que la PET/TC con fluorodesoxiglucosa-18 (FDG) y la resonancia magnética pueden ser útiles como complemento para evaluar la citorreducción macroscópica incompleta. [96] Una citorreducción más completa se asocia con mejores resultados: las mujeres sin evidencia macroscópica de enfermedad después de una citorreducción tienen una mediana de supervivencia de 39 meses, en comparación con 17 meses con una cirugía menos completa. [26] Al eliminar las metástasis, se eliminan muchas células que son resistentes a la quimioterapia y también se eliminan los grupos de células que han muerto. Esto permite que la quimioterapia llegue mejor a las células cancerosas restantes, que tienen más probabilidades de crecer rápidamente y, por lo tanto, son quimiosensibles. [29]
La cirugía de reducción de volumen a intervalos es otro protocolo utilizado, en el que se administra quimioterapia neoadyuvante, se realiza una cirugía de reducción de volumen y se finaliza la quimioterapia después de la reducción de volumen. [90] Aunque no se han completado estudios definitivos, se ha demostrado que es aproximadamente equivalente a la cirugía citorreductora primaria en términos de supervivencia y muestra una morbilidad ligeramente menor. [29] Estudios anteriores han mostrado resultados diferentes entre la reducción primaria y la reducción de intervalos. El estudio TRUST en curso puede aclarar los criterios de selección para cada abordaje quirúrgico. [97]
Existen varios procedimientos quirúrgicos diferentes que se pueden emplear para tratar el cáncer de ovario. Para el cáncer en estadio I y II, se puede utilizar la cirugía laparoscópica (ojo de cerradura), pero es posible que no se encuentren metástasis. Para el cáncer avanzado, no se utiliza la laparoscopia, ya que las metástasis citorreductoras requieren acceso a toda la cavidad peritoneal. Dependiendo de la extensión del cáncer, los procedimientos pueden incluir una salpingooforectomía bilateral, biopsias de todo el peritoneo y el sistema linfático abdominal, omentectomía , esplenectomía , resección intestinal , extracción o resección del diafragma, apendicectomía o incluso una exenteración pélvica posterior . [29]
Para estadificar completamente el cáncer de ovario, se puede incluir la linfadenectomía en el procedimiento quirúrgico. Sin embargo, no ha ofrecido beneficios en términos de supervivencia ni en HGSOC [98] ni en LGSOC [99] . Esto es particularmente importante en los tumores de células germinales porque con frecuencia metastatizan en ganglios linfáticos cercanos. [26]
Si el cáncer de ovario reaparece, la cirugía secundaria a veces es una opción de tratamiento. Esto depende de la facilidad con la que se pueda extirpar el tumor, de la cantidad de líquido que se haya acumulado en el abdomen y de la salud general. [28] La eficacia de esta cirugía depende de la técnica quirúrgica, la integridad de la citorreducción y la extensión de la enfermedad. [100] También puede ser útil en personas cuya primera cirugía fue realizada por un generalista y en el cáncer de ovario epitelial. [31] La cirugía secundaria puede ser efectiva en disgerminomas y teratomas inmaduros. [33] La evidencia sugiere que la cirugía en el cáncer de ovario epitelial recurrente puede estar asociada con la prolongación de la vida en algunas mujeres con enfermedad sensible al platino. [101]
El principal efecto secundario de la ooforectomía en mujeres más jóvenes es la menopausia precoz , que puede causar osteoporosis . Después de la cirugía, se puede considerar la terapia de reemplazo hormonal, especialmente en mujeres más jóvenes. Esta terapia puede consistir en una combinación de estrógeno y progesterona, o estrógeno solo. El estrógeno solo es seguro después de la histerectomía; cuando el útero todavía está presente, el estrógeno sin oposición aumenta dramáticamente el riesgo de cáncer de endometrio . [28] La terapia con estrógenos después de la cirugía no cambia las tasas de supervivencia. [31] Las personas que se someten a una cirugía de cáncer de ovario generalmente son hospitalizadas durante 3 a 4 días y pasan alrededor de un mes recuperándose en casa. [102] Los resultados de la cirugía son mejores en los hospitales que realizan una gran cantidad de cirugías de cáncer de ovario. [29]
No está claro si la laparoscopia o la laparotomía son mejores o peores para el cáncer de ovario en estadio I de FIGO. [103] Tampoco existe una diferencia aparente entre la histerectomía abdominal total y la histerectomía supracervical para cánceres avanzados. Aproximadamente el 2,8% de las personas que se someten a una primera cirugía por cáncer de ovario avanzado mueren dentro de las dos semanas posteriores a la cirugía ( tasa de mortalidad perioperatoria del 2,8% ). [31] Las cirugías más agresivas se asocian con mejores resultados en el cáncer de ovario avanzado (estadio III o IV). [29]
La quimioterapia ha sido un estándar general de atención para el cáncer de ovario durante décadas, aunque con protocolos variables. La quimioterapia se utiliza después de la cirugía para tratar cualquier enfermedad residual, si corresponde. En algunos casos, puede haber motivos para realizar primero la quimioterapia y luego la cirugía. Esto se llama "quimioterapia neoadyuvante" y es común cuando un tumor no se puede extirpar por completo ni reducir de manera óptima mediante cirugía. Aunque no se ha demostrado que aumente la supervivencia, puede reducir el riesgo de complicaciones después de la cirugía. Si se realiza una salpingooforectomía unilateral u otra cirugía, se puede administrar quimioterapia adicional, llamada "quimioterapia adyuvante". [28] [31] La quimioterapia adyuvante se usa en el cáncer en etapa 1 generalmente si el tumor es de un grado histológico alto (grado 3) o del subestadio más alto (etapa 1c), siempre que el cáncer se haya estadificado de manera óptima durante la cirugía. [31] [90] Bevacizumab se puede usar como quimioterapia adyuvante si el tumor no se extirpa por completo durante la cirugía o si el cáncer está en estadio IV; puede prolongar la supervivencia libre de progresión, pero no se ha demostrado que prolongue la supervivencia general. [31] La quimioterapia es curativa en aproximadamente el 20% de los cánceres de ovario avanzados; [29] es más a menudo curativo en tumores malignos de células germinales que en tumores epiteliales. [33] Se ha descubierto que la quimioterapia adyuvante mejora la supervivencia y reduce el riesgo de recurrencia del cáncer de ovario en comparación con ninguna terapia adyuvante en mujeres con cáncer de ovario epitelial en etapa temprana. [104]
La quimioterapia en el cáncer de ovario generalmente consiste en platinos , un grupo de medicamentos a base de platino , combinados con medicamentos sin platino. [105] Los medicamentos a base de platino se han utilizado desde 1980. Las terapias comunes pueden incluir paclitaxel , cisplatino , topotecán , doxorrubicina, epirrubicina y gemcitabina . El carboplatino normalmente se administra en combinación con paclitaxel o docetaxel ; la combinación típica es carboplatino con paclitaxel. [28] [31] El carboplatino es superior al cisplatino porque es menos tóxico y tiene menos efectos secundarios, lo que generalmente permite una mejor calidad de vida en comparación, aunque ambos son igualmente efectivos. [31] No se ha encontrado que los regímenes de tres medicamentos sean más efectivos, [28] y los platinos solos o los no platinos solos son menos efectivos que los platinos y los no platinos en combinación. [31] Existe un pequeño beneficio en la quimioterapia basada en platino en comparación con la terapia sin platino. [106] Las combinaciones de platino pueden ofrecer una mejor supervivencia que el platino único. En personas con cáncer de ovario recidivante, la evidencia sugiere que el topotecán tiene un efecto similar en la supervivencia general al de paclitaxel y topotecán más talidomida, mientras que es superior al treosulfán y no tan efectivo como la doxorrubicina liposomal pegilada en personas sensibles al platino. [107]
La quimioterapia se puede administrar por vía intravenosa o en la cavidad peritoneal . [26] Aunque la quimioterapia intraperitoneal se asocia con una supervivencia libre de progresión y una supervivencia general más prolongadas, también causa más efectos secundarios adversos que la quimioterapia intravenosa. [31] Se utiliza principalmente cuando el cáncer se ha reducido de manera óptima. La quimioterapia intraperitoneal puede ser muy eficaz porque el cáncer de ovario se propaga principalmente dentro de la cavidad peritoneal y dosis más altas de los medicamentos pueden llegar a los tumores de esta manera. [29]
La quimioterapia puede causar anemia ; Se ha descubierto que el hierro intravenoso es más eficaz que los suplementos de hierro oral para reducir la necesidad de transfusiones de sangre . [31] Los ciclos típicos de tratamiento implican un tratamiento cada 3 semanas, repetido durante 6 semanas o más. [108] Menos de 6 semanas (ciclos) de tratamiento son menos efectivos que 6 semanas o más. [31] Las neoplasias malignas de células germinales se tratan de manera diferente a otros cánceres de ovario: se utiliza un régimen de bleomicina , etopósido y cisplatino (BEP) con 5 días de quimioterapia administrada cada 3 semanas durante 3 a 4 ciclos. [26] [33] No se ha demostrado que la quimioterapia para los tumores de células germinales cause amenorrea , infertilidad, defectos de nacimiento o abortos espontáneos . [33] No se ha demostrado que la quimioterapia de mantenimiento sea eficaz. [31]
En personas con mutaciones BRCA , la quimioterapia con platino es más eficaz. [28] Los tumores de células germinales y los tumores malignos de los cordones sexuales/estromas se tratan con quimioterapia, aunque los disgerminomas y los tumores de los cordones sexuales no suelen responder muy bien. [26] [34]
Si el cáncer de ovario reaparece, se considera parcialmente sensible al platino o resistente al platino, según el tiempo transcurrido desde la última recurrencia tratada con platinos: los cánceres parcialmente sensibles al platino reaparecieron entre 6 y 12 meses después del último tratamiento, y los cánceres resistentes al platino tienen una Intervalo inferior a 6 meses. La quimioterapia de segunda línea se puede administrar después de que el cáncer se vuelve sintomático porque no se observa ninguna diferencia en la supervivencia entre el tratamiento de recurrencias asintomáticas (CA-125 elevado) y sintomáticas. [ cita médica necesaria ]
Para los tumores sensibles al platino, los platinos son los fármacos de elección para la quimioterapia de segunda línea, en combinación con otros agentes citotóxicos. Los regímenes incluyen carboplatino combinado con doxorrubicina liposomal pegilada , gemcitabina o paclitaxel . [26] La terapia con doblete de carboplatino se puede combinar con paclitaxel para aumentar la eficacia en algunos casos. Otra posible terapia adyuvante para las recurrencias sensibles al platino es olaparib , que puede mejorar la supervivencia libre de progresión pero no se ha demostrado que mejore la supervivencia general . [31] ( Olaparib , un inhibidor de PARP , fue aprobado por la FDA de EE. UU. para su uso en el cáncer de ovario asociado a BRCA que había sido tratado previamente con quimioterapia. [109] [110] ) Para tumores de células germinales recurrentes, se requieren 4 ciclos adicionales de La quimioterapia BEP es el tratamiento de primera línea para quienes han sido tratados con cirugía o platinos.
Si se determina que el tumor es resistente al platino, se puede utilizar vincristina , dactinomicina y ciclofosfamida (VAC) o alguna combinación de paclitaxel, gemcitabina y oxaliplatino como tratamiento de segunda línea. [33]
Para los tumores resistentes al platino, no existen opciones de quimioterapia de alta eficacia. Los regímenes de un solo fármaco (doxorrubicina o topotecán ) no tienen tasas de respuesta altas, [28] pero en algunos casos se utilizan regímenes de un solo fármaco como topotecán, doxorrubicina liposomal pegilada o gemcitabina. [26] [31] El topotecán no se puede utilizar en personas con una obstrucción intestinal. Paclitaxel usado solo es otro régimen posible, o puede combinarse con doxorrubicina liposomal, gemcitabina, cisplatino, topotecán, etopósido o ciclofosfamida . [108] (Ver también Cuidados paliativos a continuación.)
Se están desarrollando nuevos agentes para inhibir el desarrollo de nuevos vasos sanguíneos (angiogénesis) en mujeres con cáncer de ovario que desarrollan resistencia a los fármacos de quimioterapia. A partir de 2023, estos tratamientos parecerían tener una función, pero debido a la carga adicional del tratamiento y al costo de los tratamientos de mantenimiento, el riesgo versus los beneficios requieren una consideración cuidadosa. [111]
Novocure patrocinó un ensayo de fase 2 que demuestra la eficacia de los campos de tratamiento de tumores en el carcinoma de ovario recurrente resistente al platino, junto con quimioterapia semanal con paclitaxel. [46]
Los disgerminomas se tratan más eficazmente con radiación, [34] aunque esto puede causar infertilidad y se está eliminando gradualmente en favor de la quimioterapia. [26] La radioterapia no mejora la supervivencia en personas con tumores bien diferenciados. [26]
En los cánceres en etapa 1c y 2, la radioterapia se usa después de la cirugía si existe la posibilidad de enfermedad residual en la pelvis pero el abdomen está libre de cáncer. La radioterapia también se puede utilizar en cuidados paliativos de cánceres avanzados. Un ciclo típico de radioterapia para el cáncer de ovario es de 5 días a la semana durante 3 a 4 semanas. Los efectos secundarios comunes de la radioterapia incluyen diarrea, estreñimiento y micción frecuente. [112]
A pesar de que el 60% de los tumores de ovario tienen receptores de estrógenos , el cáncer de ovario rara vez responde a los tratamientos hormonales. Una revisión Cochrane encontró una falta de evidencia sobre los efectos del tamoxifeno en personas con cáncer de ovario recurrente. [113] El estrógeno por sí solo no tiene ningún efecto sobre el cáncer, y el tamoxifeno y el letrozol rara vez son eficaces. [28] "Algunas mujeres con cáncer de ovario en el límite de malignidad y cáncer de ovario estromal pueden recibir terapia hormonal". [91]
La inmunoterapia es un tema de investigación actual en el cáncer de ovario. En algunos casos, el fármaco anticuerpo bevacizumab , aunque todavía es un tema de investigación activa, se utiliza para tratar el cáncer avanzado junto con quimioterapia. [90] Ha sido aprobado para este uso en la Unión Europea. [114]
El seguimiento específico depende, por ejemplo, del tipo y estadio del cáncer de ovario, el tratamiento y la presencia de cualquier síntoma. Por lo general, inicialmente se programa una cita de control cada 2 o 3 meses, seguida de dos veces al año durante un máximo de 5 años. [115] Para los cánceres de ovario epiteliales, la prueba más común durante el seguimiento es el nivel de CA-125. Sin embargo, el tratamiento basado únicamente en niveles elevados de CA-125 y sin ningún síntoma puede aumentar los efectos secundarios sin prolongar la vida, por lo que se puede discutir la implicación del resultado de una prueba de CA-125 antes de realizarla. [116] La recomendación a partir de 2014 es que puede haber cáncer recurrente si el nivel de CA-125 es dos veces lo normal. [28] El tratamiento de una recurrencia detectada por CA-125 no mejora la supervivencia. [31]
Para las mujeres con tumores de células germinales, las pruebas de seguimiento generalmente incluyen alfafetoproteína (AFP) y/o gonadotropina coriónica humana . Para las mujeres con cánceres del estroma , a veces son útiles las pruebas de hormonas como el estrógeno, la testosterona y la inhibina . [116] La inhibina también puede ser útil para controlar el progreso de los tumores de los cordones sexuales, junto con la sustancia inhibidora mülleriana . La AFP también se puede utilizar para controlar los tumores de Sertoli-Leydig. [26] En los disgerminomas, la lactato deshidrogenasa y sus dos isoenzimas (LDH-1 y LDH-2) se utilizan para evaluar la recurrencia. [33]
Es posible que las mujeres con cáncer de ovario no necesiten imágenes de vigilancia de rutina para controlar el cáncer a menos que aparezcan nuevos síntomas o los marcadores tumorales comiencen a aumentar. [117] Se desaconsejan las imágenes sin estas indicaciones porque es poco probable que detecten una recurrencia, mejoren la supervivencia y porque tienen sus propios costos y efectos secundarios. [117] Sin embargo, si se desea, se pueden utilizar imágenes por TC, aunque esto no es común. [28] Si es fácil obtener imágenes de un tumor, se pueden utilizar imágenes para monitorear el progreso del tratamiento. [118]
Los cuidados paliativos se centran en aliviar los síntomas y aumentar o mantener la calidad de vida. El propósito de este tipo de tratamiento no es curar el cáncer sino hacer que la mujer se sienta más cómoda mientras vive con un cáncer que no se puede curar. Se ha recomendado como parte del plan de tratamiento para cualquier persona con cáncer de ovario avanzado o pacientes con síntomas importantes. [119] En los casos refractarios y resistentes al platino, el tratamiento principal es otra quimioterapia paliativa. [29] [91]
Los cuidados paliativos pueden implicar el tratamiento de los síntomas y complicaciones del cáncer, incluidos dolor, náuseas, estreñimiento, ascitis, obstrucción intestinal , edema , derrame pleural y mucositis . Especialmente si el cáncer avanza y se vuelve incurable, el tratamiento de los síntomas se convierte en uno de los principales objetivos de la terapia. Los cuidados paliativos también pueden implicar ayudar en la toma de decisiones, como si los cuidados paliativos son apropiados y cuándo, y el lugar preferido para el paciente en los cuidados al final de su vida. [31]
La obstrucción intestinal se puede tratar con cirugía paliativa ( colostomía , ileostomía o derivación interna) o medicamentos, pero se ha demostrado que la cirugía aumenta el tiempo de supervivencia. [28] [31] La cirugía paliativa puede provocar síndrome del intestino corto , fístula enterocutánea o reobstrucción; o puede que no sea posible debido al alcance de la obstrucción. [29] Otros tratamientos de las complicaciones pueden incluir nutrición parenteral total , una dieta baja en residuos , gastrostomía paliativa y un control adecuado del dolor. [28] La obstrucción intestinal también se puede tratar con octreotida cuando la cirugía paliativa no es una opción. El cáncer también puede bloquear los uréteres , lo que puede aliviarse mediante una nefrostomía o un stent ureteral . La ascitis se puede aliviar mediante paracentesis repetidas o la colocación de un drenaje para aumentar la comodidad. [120] Los derrames pleurales se pueden tratar de manera similar, con toracentesis repetida , pleurodesis o colocación de un drenaje. [29]
La radioterapia se puede utilizar como parte de los cuidados paliativos del cáncer de ovario avanzado, ya que puede ayudar a reducir los tumores que causan síntomas. [91] La radioterapia paliativa generalmente dura solo unos pocos tratamientos, un ciclo de terapia mucho más corto que la radioterapia no paliativa. [112] También se utiliza para la paliación de tumores de células germinales resistentes a la quimioterapia. [33]
El cáncer de ovario tiene un efecto significativo en la calidad de vida , la salud psicológica y el bienestar. Hay intervenciones disponibles para ayudar con las necesidades y el apoyo social. Muchas sobrevivientes de cáncer de ovario reportan una buena calidad de vida y optimismo . Otros informaron de un "cambio espiritual" que les ayudó a encontrar significado durante su experiencia. Otras han descrito su pérdida de fe tras el diagnóstico de cáncer de ovario. Quienes han pasado por tratamiento a veces experimentan aislamiento social , pero se benefician de tener relaciones con otros sobrevivientes. Algunos han descrito la frustración y la culpa y han expresado su incapacidad para cuidar de su familia. [121]
Los cambios en la autoestima y la imagen corporal pueden ocurrir debido a la caída del cabello , la extirpación de ovarios y otras estructuras reproductivas y las cicatrices . Hay cierta mejora después de que crece el cabello. Pueden desarrollarse problemas sexuales. La extirpación de los ovarios da como resultado la menopausia inducida quirúrgicamente que puede provocar relaciones sexuales dolorosas , sequedad vaginal, pérdida del deseo sexual y cansancio. Aunque el pronóstico es mejor para los supervivientes más jóvenes, el impacto en la sexualidad aún puede ser sustancial. [121]
La ansiedad , la depresión y la angustia están presentes en quienes sobreviven al cáncer de ovario en tasas más altas que en la población general. [121] [122] Los mismos problemas psicosociales pueden desarrollarse en miembros de la familia. Los efectos emocionales pueden incluir miedo a la muerte , tristeza , problemas de memoria y dificultad para concentrarse. Cuando los pacientes adoptaron el optimismo al comienzo del tratamiento, tuvieron menos probabilidades de desarrollar angustia. Aquellos que temen que el cáncer vuelva a aparecer pueden tener dificultades para expresar alegría incluso cuando no tienen la enfermedad. Cuantos más tratamientos se somete una mujer, más probable es que exprese la pérdida de esperanza . Las mujeres a menudo pueden afrontar y reducir los efectos psicosociales negativos mediante una serie de estrategias. Actividades como viajar, pasar más tiempo con familiares y amigos, ignorar las estadísticas , llevar un diario y aumentar la participación en eventos de base espiritual son adaptativas. [121]
Las mujeres con cáncer de ovario también pueden experimentar dificultades con su dieta y corren riesgo de desnutrición. [123]

El cáncer de ovario suele tener un pronóstico relativamente malo . Es desproporcionadamente mortal porque carece de una detección temprana o prueba de detección clara, lo que significa que la mayoría de los casos no se diagnostican hasta que alcanzan etapas avanzadas. [117] [28]
El cáncer de ovario metastatiza en una etapa temprana de su desarrollo, a menudo antes de ser diagnosticado. Los tumores de alto grado metastatizan más fácilmente que los tumores de bajo grado. Normalmente, las células tumorales comienzan a metastatizar creciendo en la cavidad peritoneal. [26] Más del 60% de las mujeres que presentan cáncer de ovario tienen cáncer en estadio III o IV, cuando ya se ha extendido más allá de los ovarios. Los cánceres de ovario arrojan células al líquido natural dentro de la cavidad abdominal. Luego, estas células pueden implantarse en otras estructuras abdominales (peritoneales), incluido el útero, la vejiga urinaria , el intestino , el revestimiento de la pared intestinal y el epiplón , formando nuevos crecimientos tumorales incluso antes de que se sospeche de cáncer.
La tasa de supervivencia a cinco años para todas las etapas del cáncer de ovario es del 46%; la tasa de supervivencia a un año es del 72% y la tasa de supervivencia a diez años es del 35%. [125] En los casos en los que se realiza un diagnóstico temprano en la enfermedad, cuando el cáncer todavía está confinado al sitio primario, la tasa de supervivencia a cinco años es del 92,7 %. [126] Alrededor del 70 % de las mujeres con enfermedad avanzada responden al tratamiento inicial, la mayoría de las cuales logran una remisión completa, pero la mitad de estas mujeres experimentan una recurrencia entre 1 y 4 años después del tratamiento. [26] La metástasis cerebral es más común en el cáncer en estadio III/IV, pero aún puede ocurrir en cánceres en estadio I/II. Las personas con metástasis cerebrales sobreviven una media de 8,2 meses, aunque la cirugía, la quimioterapia y la radioterapia total del cerebro pueden mejorar la supervivencia. [31]
La supervivencia del cáncer de ovario varía significativamente según el subtipo. Los disgerminomas tienen un pronóstico muy favorable. En etapas tempranas, tienen una tasa de supervivencia a cinco años del 96,9%. [34] Alrededor de dos tercios de los disgerminomas se diagnostican en la etapa I. [33] Los disgerminomas en etapa III tienen una supervivencia a cinco años de 61 %; cuando se tratan con quimioterapia BEP después de una extirpación quirúrgica incompleta, los disgerminomas tienen una tasa de supervivencia a dos años del 95%. Las neoplasias malignas del estroma del cordón sexual también tienen un pronóstico favorable; debido a que crecen lentamente, incluso aquellos con enfermedad metastásica pueden sobrevivir una década o más. [26] Los tumores de bajo potencial maligno generalmente solo tienen un mal pronóstico cuando se encuentran implantes tumorales invasivos en la cavidad peritoneal. [29]
Las complicaciones del cáncer de ovario pueden incluir diseminación del cáncer a otros órganos, pérdida progresiva de la función de varios órganos, ascitis y obstrucciones intestinales, que pueden ser fatales. Las obstrucciones intestinales en múltiples sitios son la causa inmediata de muerte más común. [28] La obstrucción intestinal en el cáncer de ovario puede ser una obstrucción verdadera, donde el tumor bloquea la luz intestinal , o una pseudoobstrucción, cuando el tumor impide la peristalsis normal . [127] La acumulación continua de ascitis se puede tratar colocando un drenaje que pueda drenarse por sí solo. [28]
Hay una serie de factores pronósticos en el cáncer de ovario. Los factores de pronóstico positivo (aquellos que indican mejores posibilidades de supervivencia) incluyen ausencia de enfermedad residual después de la cirugía (estadio III/IV), resección macroscópica completa (estadio IV), mutaciones en BRCA2, edad joven (menos de 45 años), tipo no seroso, grado histológico bajo, etapa temprana, coexistencia con cáncer de endometrio y niveles bajos de CA-125. Existe evidencia contradictoria sobre el BRCA1 como factor pronóstico. Por el contrario, los factores de pronóstico negativo –aquellos que indican una peor probabilidad de supervivencia– incluyen la rotura de la cápsula ovárica durante la cirugía, edad avanzada (más de 45 años), tipo mucinoso, estadio IV, grado histológico alto, tipo de células claras, afectación abdominal superior. , niveles elevados de CA-125, presencia de células tumorales en la sangre y ciclooxigenasa-2 elevada . [31]
La expresión de varios ARNm también puede ser un pronóstico para el cáncer de ovario. Los niveles altos de Drosha y Dicer se asocian con una mejor supervivencia, mientras que los niveles altos de let-7b, HIF1A , EphA1 y poli(ADP-ribosa) polimerasa se asocian con una peor supervivencia. Los cánceres que son positivos para WT1 tienen un peor pronóstico; Los cánceres con receptores de estrógeno positivos tienen un mejor pronóstico. [31]
A continuación se presentan las tasas generales de supervivencia a cinco años para todos los tipos de cáncer de ovario por estadio y grado histológico: [26]
Las tasas de supervivencia que se indican a continuación corresponden a los diferentes tipos de cáncer de ovario, según la Sociedad Estadounidense del Cáncer . [124] Provienen del Instituto Nacional del Cáncer , SEER, y se basan en pacientes diagnosticados entre 2004 y 2010.
El cáncer de ovario frecuentemente reaparece después del tratamiento. En general, en un período de cinco años, el 20% de los cánceres en estadio I y II recurren. La mayoría de las recurrencias ocurren en el abdomen. [29] Si se produce una recurrencia en una enfermedad avanzada, generalmente ocurre dentro de los 18 meses posteriores al tratamiento inicial (18 meses de supervivencia libre de progresión ). Las recurrencias pueden tratarse, pero el intervalo libre de enfermedad tiende a acortarse y la quimiorresistencia aumenta con cada recurrencia. [28] Cuando un disgerminoma reaparece, es más probable que reaparezca dentro del año posterior al diagnóstico, y otros tumores malignos de células germinales reaparecen dentro de los 2 años el 90 % de las veces. Los tumores de células germinales distintos de los disgerminomas tienen un mal pronóstico cuando recaen, con una tasa de supervivencia a largo plazo del 10%. [33] Los tumores de bajo potencial maligno rara vez recaen, incluso cuando la cirugía para preservar la fertilidad es el tratamiento de elección. El 15% de los tumores FUM recaen después de una cirugía unilateral en el ovario previamente no afectado y, por lo general, se tratan fácilmente con cirugía. Los tumores más avanzados pueden tardar hasta 20 años en recaer, si es que recaen, y sólo se tratan con cirugía a menos que el tumor haya cambiado sus características histológicas o haya crecido muy rápidamente. En estos casos, y cuando hay ascitis importante, también se puede recurrir a la quimioterapia. La recaída suele estar indicada por un aumento de los niveles de CA-125 y luego progresa a una recaída sintomática en 2 a 6 meses. [29] Los tumores recurrentes del estroma del cordón sexual generalmente no responden al tratamiento, pero no son agresivos. [33]
Es el cáncer ginecológico más mortal. [29]
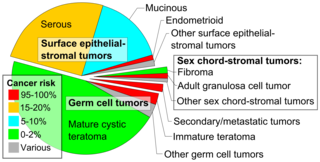
A nivel mundial, en 2018, la incidencia de cáncer de ovario fue de 6,6 por 100.000 y la mortalidad de 3,9. [130] A nivel mundial, alrededor de 160.000 personas murieron de cáncer de ovario en 2010. Esto representó un aumento con respecto a 113.000 en 1990. [131] El número de casos nuevos por año en Europa es aproximadamente de 5 a 15 por 100.000 mujeres. [31] En Europa, Lituania , Letonia , Irlanda , Eslovaquia y la República Checa tienen las incidencias más altas de cáncer de ovario, mientras que Portugal y Chipre tienen las incidencias más bajas. [31] En 2008, la tasa de supervivencia a cinco años fue del 44%. Esto ha aumentado desde 1977, cuando la tasa de supervivencia era del 36%. [121]


En 2022, en Estados Unidos, se estima que se diagnosticaron 19.880 nuevos casos y 12.810 mujeres murieron de cáncer de ovario. [133] La tasa de supervivencia relativa a 5 años es del 49,7%. [134] Alrededor del 57% de los casos han metastatizado en el momento del diagnóstico. [134]
En 2014, se realizaron más de 220.000 diagnósticos de cáncer epitelial de ovario al año. [28] El riesgo general de por vida en los EE. UU. es de alrededor del 1,6 % [26] [31] En los EE. UU., el cáncer de ovario afecta entre el 1,3 y el 1,4 % y es la causa de muerte de aproximadamente el 1 % de las mujeres. [29] [135] En los Estados Unidos, también es el quinto cáncer más común en las mujeres, pero la cuarta causa más común de muerte por cáncer. [31] Esta disminución lo convirtió en el noveno cáncer más común en las mujeres. [29]
Los riesgos de desarrollar tipos específicos de cáncer de ovario varían. Los tumores de células germinales y los tumores del estroma de los cordones sexuales son menos comunes que los tumores epiteliales. El número de casos nuevos al año en Estados Unidos es de 0,4 por 100.000 mujeres y 0,2 por 100.000 mujeres, respectivamente. En las personas jóvenes, los tumores del estroma de los cordones sexuales y los tumores de células germinales suman el 1% del cáncer de ovario general. [33] El cáncer de ovario representa aproximadamente el 4% de los cánceres diagnosticados en mujeres. [31]
Es el quinto cáncer más común en las mujeres del Reino Unido (alrededor de 7100 fueron diagnosticados en 2011) y la quinta causa más común de muerte por cáncer en mujeres (alrededor de 4300 murieron en 2012). [136] [31] [35] La tasa de incidencia en toda la población del Reino Unido es de 21,6 por 100.000.
En 2014, el Reino Unido registró aproximadamente entre 7000 y 7100 diagnósticos anuales con 4200 muertes. [28] [35] Un artículo de 2022 de The Times cifra la estimación en 7.500 casos nuevos al año en Gran Bretaña. [137] Los primeros síntomas a menudo se confunden con afecciones comunes como la cistitis o el síndrome del intestino irritable, y alrededor del 40 por ciento de las mujeres del Reino Unido creen erróneamente que el examen cervical detecta el cáncer de ovario, un aumento del 30 por ciento en 2016. [137] Judía asquenazí Las mujeres portan alelos BRCA mutados cinco veces más a menudo que el resto de la población, lo que les da un mayor riesgo de desarrollar cáncer de ovario. [28]
Las mujeres negras tienen el doble de riesgo de sufrir tumores del estroma del cordón sexual en comparación con las mujeres no negras. [33] La prevalencia más alta se da en mujeres caucásicas e hispanas, seguidas por mujeres afroamericanas y asiáticas. [130] La mayor mortalidad por cáncer de ovario se da entre las mujeres afroamericanas. [130]
En Estados Unidos, la tasa de incidencia en mujeres mayores de 50 años es de aproximadamente 33 por 100.000. [138] La tasa de cáncer de ovario entre 1993 y 2008 disminuyó en mujeres de la cohorte de 40 a 49 años y en la cohorte de 50 a 64 años. [28] El cáncer de ovario se diagnostica con mayor frecuencia después de la menopausia, [35] entre las edades de 60 y 64 años. El noventa por ciento del cáncer de ovario ocurre en mujeres mayores de 45 años y el 80% en mujeres mayores de 50 años. [31] Las mujeres mayores son más probabilidades de presentar cáncer de ovario avanzado. [20]
Los tumores malignos de células germinales son el tipo de cáncer de ovario con mayor probabilidad de ocurrir durante el embarazo . Por lo general, se diagnostican cuando se encuentra una masa anexial en el examen (en 1 a 2% de todos los embarazos), se observa un tumor en la ecografía o el nivel de alfafetoproteína de los padres está elevado. Los quistes dermoides y los disgerminomas son los tumores de células germinales más comunes durante el embarazo. Es poco probable que los tumores de células germinales diagnosticados durante el embarazo hayan hecho metástasis y pueden tratarse mediante cirugía y, en algunos casos, quimioterapia, lo que conlleva el riesgo de defectos congénitos. Los tumores del saco vitelino y los teratomas inmaduros crecen particularmente rápido y generalmente se tratan con quimioterapia incluso durante el embarazo; sin embargo, los disgerminomas que han sido citorreducidos de manera óptima pueden tratarse después del parto. [33]
Se han informado tumores de ovario en yeguas equinas . Los tipos de tumores informados incluyen teratoma, [139] [140] cistadenocarcinoma , [141] y particularmente tumor de células de la granulosa . [142] [143] [ 144] [ 145] [146] [ citas excesivas ]
Se está desarrollando el cribado mediante histeroscopia para obtener muestras de células obtenidas para examen histológico. Esto es similar a la prueba de Papanicolaou actual que se utiliza para detectar el cáncer de cuello uterino. [147] El ensayo colaborativo del Reino Unido sobre detección del cáncer de ovario está probando una técnica de detección que combina análisis de sangre CA-125 con ecografía transvaginal. [28] Otros estudios sugieren que este procedimiento de detección puede ser eficaz. [114] Aunque los resultados publicados en 2015 no fueron concluyentes, hubo cierta evidencia de que las pruebas de detección pueden salvar vidas a largo plazo. [148] Como resultado, el ensayo se extendió y publicará los resultados definitivos a fines de 2019. Un problema importante con la detección es que no se observa una progresión clara de la enfermedad desde la etapa I (no invasiva) a la etapa III (invasiva). y puede que no sea posible encontrar cánceres antes de que alcancen la etapa III. Otro problema es que los métodos de detección tienden a encontrar demasiadas lesiones sospechosas, la mayoría de las cuales no son cáncer, pero la malignidad sólo puede evaluarse mediante cirugía. [28] El método ROCA combinado con ecografía transvaginal se está investigando en mujeres de alto riesgo para determinar si es un método de detección viable. También se está investigando en mujeres con riesgo normal, ya que se ha mostrado prometedor en la población en general. [29] También se están realizando estudios para determinar si las pruebas de detección ayudan a detectar el cáncer antes en personas con mutaciones BRCA. [114]
También se están realizando investigaciones sobre diversos factores pronósticos del cáncer de ovario. Investigaciones recientes muestran que la trombocitosis predice una menor supervivencia y un cáncer en estadio más alto. [28] Las investigaciones en curso también están investigando los beneficios de la cirugía para el cáncer de ovario recurrente. [114]
Si bien es un área de investigación activa, en 2018 no hay pruebas convincentes de que la inmunoterapia sea eficaz para el cáncer de ovario. [149] Sin embargo, los ensayos del anticuerpo y del inhibidor de VEGF bevacizumab , que puede retardar el crecimiento de nuevos vasos sanguíneos en el cáncer, han mostrado resultados prometedores, especialmente en combinación con pazopanib , que también retarda el proceso de crecimiento de los vasos sanguíneos. Bevacizumab ha sido particularmente eficaz en estudios preliminares sobre cáncer en estadio III y IV [28] y se ha citado que tiene una tasa de respuesta de al menos el 15 %. [26] Se está investigando particularmente en cánceres de ovario mucinosos. [114]
Los inhibidores de mTOR fueron un tratamiento potencial muy investigado en las décadas de 2000 y 2010, pero los efectos secundarios de estos fármacos (particularmente hiperglucemia e hiperlipidemia ) no fueron bien tolerados y no se confirmó el beneficio de supervivencia. Los inhibidores de la quinasa PI3 han sido de interés, pero tienden a ser altamente tóxicos y causar diarrea . Otro fármaco investigado es el selumetinib , un inhibidor de MAPK . Mejoró la supervivencia, pero no se correlacionó con ninguna mutación encontrada en los tumores. [28]
Bevacizumab también se puede combinar con quimioterapia con platino, una combinación que ha tenido resultados preliminares positivos en la SSP, pero resultados equívocos con respecto a la supervivencia general. Una desventaja de estos tratamientos es el perfil de efectos secundarios, que incluye presión arterial alta y proteinuria . El fármaco también puede exacerbar la enfermedad intestinal y provocar fístulas o perforación intestinal . La vintafolida , que consiste en un antifolato conjugado con vinblastina , también se encuentra en ensayos clínicos; puede resultar beneficioso porque los receptores de folato están sobreexpresados en muchos cánceres de ovario. [28] Otra posible inmunoterapia es el trastuzumab , que es activo contra tumores positivos para mutaciones Her2/neu. [26] También se están investigando otros inhibidores de la angiogénesis como posibles tratamientos para el cáncer de ovario. Se están investigando la combinación de combretastatina y pazopanib para el cáncer de ovario recurrente. Trebananib y tasquinimod son otros inhibidores de la angiogénesis que se están investigando. Se está investigando el anticuerpo monoclonal farletuzumab como adyuvante de la quimioterapia tradicional. Otro tipo de inmunoterapia implica vacunas , incluida TroVax . [114]
Una alternativa a la quimioterapia BEP, un régimen de 3 ciclos de carboplatino y etopósido , es un tema actual de investigación para las neoplasias malignas de células germinales. [33]
La quimioterapia intraperitoneal también ha sido objeto de investigación durante las décadas de 2000 y 2010 por su potencial para administrar dosis más altas de agente citotóxico a los tumores. Los ensayos preliminares con cisplatino y paclitaxel han demostrado que no se tolera bien, pero mejora la supervivencia y se están investigando regímenes más tolerables. [28] Se están investigando tanto el cisplatino como el paclitaxel como agentes de quimioterapia intraperitoneal. También se está investigando un régimen de quimioterapia específico para cánceres de células claras poco comunes: irinotecán combinado con cisplatino. [114]
Los inhibidores de PARP también se han mostrado prometedores en los primeros ensayos, particularmente en personas con mutaciones del gen BRCA , ya que la proteína BRCA interactúa con la vía PARP. También se está estudiando en el cáncer de ovario recurrente en general, donde los estudios preliminares han demostrado una SSP más prolongada. En concreto, olaparib ha demostrado una mayor supervivencia que la doxorrubicina, aunque este tratamiento aún está en investigación. Aún no está claro qué biomarcadores predicen la capacidad de respuesta a los inhibidores de PARP. [28] Rucaparib es otro inhibidor de PARP que se está investigando en el cáncer de ovario avanzado recurrente BRCA positivo y BRCA negativo. Niraparib es un inhibidor de PARP que se está probando en el cáncer de ovario recurrente BRCA positivo. [114]
Los inhibidores de la tirosina quinasa son otra clase de fármacos en investigación que pueden tener aplicaciones en el cáncer de ovario. También se ha demostrado que los inhibidores de la angiogénesis en el grupo de inhibidores del receptor de tirosina quinasa , incluidos pazopanib , cediranib y nintedanib , aumentan la supervivencia libre de progresión (SSP), pero su beneficio para la supervivencia general no se ha investigado hasta 2015. [28] Investigación preliminar demostraron que cediranib combinado con platinos en el cáncer de ovario recurrente aumentó el tiempo hasta la segunda recurrencia en 3 a 4 meses y aumentó la supervivencia en 3 meses. [114] MK-1775 es un inhibidor de la tirosina quinasa que se usa en combinación con paclitaxel y carboplatino en cánceres sensibles al platino con mutaciones de p53. Se está investigando nintedanib como una terapia potencial en combinación con ciclofosfamida para personas con recurrencias. [114]
Los inhibidores de la histona desacetilasa (HDACi) son otra área de investigación.
Las terapias hormonales son un tema de investigación actual en el cáncer de ovario, en particular el valor de ciertos medicamentos utilizados para tratar el cáncer de mama. Estos incluyen tamoxifeno , letrozol y anastrozol . Los estudios preliminares han demostrado un beneficio del tamoxifeno en un pequeño número de personas con cáncer de ovario avanzado. El letrozol puede ayudar a retardar o detener el crecimiento del cáncer de ovario con receptores de estrógeno positivos. El anastrozol se está investigando en personas posmenopáusicas con cáncer con receptores de estrógeno positivos. [114]
También se están realizando investigaciones para mitigar los efectos secundarios del tratamiento del cáncer de ovario. La fibrosis por radiación, la formación de tejido cicatricial en un área tratada con radiación, puede aliviarse con oxigenoterapia hiperbárica , pero no se han completado investigaciones en esta área. El tratamiento del cáncer de ovario también puede provocar que las personas experimenten dificultades psiquiátricas, incluida la depresión . Se están realizando investigaciones para determinar cómo el asesoramiento y la psicoterapia pueden ayudar a las personas que tienen cáncer de ovario durante el tratamiento. [114]
Hay algunos indicios de que la enfermedad inflamatoria pélvica puede estar asociada con el cáncer de ovario, especialmente en países no occidentales. Puede deberse al proceso inflamatorio presente en la enfermedad inflamatoria pélvica. [150]
Los ensayos clínicos son supervisados y financiados por organizaciones gubernamentales de EE. UU. para probar opciones de tratamiento y ver si son seguras y efectivas. Estos incluyen NIH Clinical Research Trials and You ( Institutos Nacionales de Salud ), [151] Aprenda sobre los ensayos clínicos ( Instituto Nacional del Cáncer ), [152] Búsqueda de ensayos clínicos (Instituto Nacional del Cáncer), [153] ClinicalTrials.gov (Institutos Nacionales de salud). [154] [88] También se realizan ensayos clínicos en Canadá. [155]
{{cite book}}: |work=ignorado ( ayuda ){{cite book}}: |work=ignorado ( ayuda ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ){{cite book}}: |work=ignorado ( ayuda )