El síndrome de Cushing es un conjunto de signos y síntomas debidos a la exposición prolongada a glucocorticoides como el cortisol . [4] [9] [10] Los signos y síntomas pueden incluir presión arterial alta , obesidad abdominal pero con brazos y piernas delgados, estrías rojizas , una cara roja y redonda debido a la plétora facial , [11] un bulto de grasa entre los hombros , músculos débiles , huesos débiles , acné y piel frágil que cura mal. [12] [2] Las mujeres pueden tener más cabello y menstruación irregular . [2] Ocasionalmente puede haber cambios de humor, dolores de cabeza y una sensación crónica de cansancio . [2]
El síndrome de Cushing es causado por un exceso de medicación similar al cortisol, como la prednisona , o por un tumor que produce o resulta en la producción excesiva de cortisol por las glándulas suprarrenales . [13] Los casos debidos a un adenoma pituitario se conocen como enfermedad de Cushing , que es la segunda causa más común de síndrome de Cushing después de la medicación. [4] Varios otros tumores, a menudo denominados ectópicos debido a su ubicación fuera de la hipófisis, también pueden causar la enfermedad de Cushing. [4] [14] Algunos de estos están asociados con trastornos hereditarios como la neoplasia endocrina múltiple tipo 1 y el complejo de Carney . [8] El diagnóstico requiere una serie de pasos. [5] El primer paso es comprobar los medicamentos que toma una persona. [5] El segundo paso es medir los niveles de cortisol en la orina , la saliva o la sangre después de tomar dexametasona . [5] Si esta prueba es anormal, el cortisol se puede medir tarde en la noche. [5] Si el cortisol permanece alto, se puede realizar un análisis de sangre para detectar ACTH . [5]
La mayoría de los casos pueden tratarse y curarse. [7] Si se debe a medicamentos, estos a menudo pueden reducirse lentamente si aún son necesarios o suspenderse lentamente. [6] [15] Si es causado por un tumor, se puede tratar mediante una combinación de cirugía, quimioterapia y/o radiación . [6] Si la pituitaria se vio afectada, es posible que se requieran otros medicamentos para reemplazar su función perdida. [6] Con tratamiento, la esperanza de vida suele ser normal. [7] Algunas personas en quienes la cirugía no puede extirpar todo el tumor tienen un mayor riesgo de muerte. [dieciséis]
Aproximadamente dos o tres casos por millón de personas son causados abiertamente por un tumor. [8] Afecta con mayor frecuencia a personas de entre 20 y 50 años de edad. [4] Las mujeres se ven afectadas tres veces más que los hombres. [8] Sin embargo, es más común un grado leve de sobreproducción de cortisol sin síntomas obvios. [17] El síndrome de Cushing fue descrito por primera vez por el neurocirujano estadounidense Harvey Cushing en 1932. [18] El síndrome de Cushing también puede ocurrir en otros animales, incluidos gatos, perros y caballos. [19] [20]
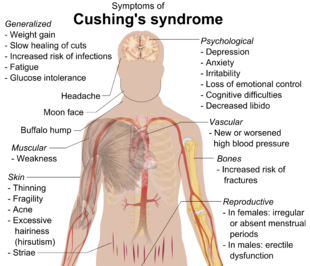


Los síntomas incluyen un rápido aumento de peso , particularmente en el tronco y la cara, sin afectar las extremidades ( obesidad central ). Los signos comunes incluyen el crecimiento de bolsas de grasa a lo largo de la clavícula , en la parte posterior del cuello ("joroba de búfalo" o lipodistrofia ) y en la cara (" cara de luna "). Otros síntomas incluyen exceso de sudoración , dilatación de los capilares , adelgazamiento de la piel (que provoca fácil aparición de hematomas y sequedad, especialmente en las manos) y de las mucosas, estrías moradas o rojas (el aumento de peso en el síndrome de Cushing estira la piel, que es fina y debilitada). , provocando hemorragia) en el tronco, nalgas, brazos, piernas o senos, debilidad de los músculos proximales (caderas, hombros) e hirsutismo (crecimiento de vello facial con patrón masculino), calvicie y/o cabello extremadamente seco y quebradizo. En casos raros, la enfermedad de Cushing puede causar hipocalcemia . El exceso de cortisol también puede afectar a otros sistemas endocrinos y provocar, por ejemplo, insomnio , inhibición de la aromatasa , reducción de la libido , impotencia en los hombres y amenorrea , oligomenorrea e infertilidad en las mujeres debido a las elevaciones de andrógenos . Los estudios también han demostrado que la amenorrea resultante se debe al hipercortisolismo, que se retroalimenta del hipotálamo y produce una disminución de los niveles de liberación de GnRH . [23]
Muchas de las características de la enfermedad de Cushing son las que se observan en el síndrome metabólico , incluida la resistencia a la insulina , la hipertensión , la obesidad y los niveles elevados de triglicéridos en sangre . [24]
Las condiciones cognitivas, incluidas las disfunciones de la memoria y la atención, así como la depresión, se asocian comúnmente con niveles elevados de cortisol [25] y pueden ser indicadores tempranos de enfermedad de Cushing exógena o endógena. Los trastornos de depresión y ansiedad también son comunes. [26]
Otros cambios cutáneos llamativos y angustiantes que pueden aparecer en el síndrome de Cushing incluyen acné facial, susceptibilidad a infecciones superficiales por hongos ( dermatofitos y malassezia ) y las características estrías atróficas violáceas en el abdomen. [27] : 500
Otros signos incluyen aumento de la micción (y el aumento de la sed que lo acompaña ), presión arterial alta persistente (debido a la mejora del cortisol del efecto vasoconstrictor de la epinefrina ) y resistencia a la insulina (especialmente común con la producción de ACTH fuera de la pituitaria), lo que lleva a niveles altos de azúcar en la sangre y resistencia a la insulina. lo que puede provocar diabetes mellitus . La resistencia a la insulina se acompaña de cambios en la piel como acantosis nigricans en la axila y alrededor del cuello, así como marcas en la piel en la axila. El síndrome de Cushing no tratado puede provocar enfermedades cardíacas y un aumento de la mortalidad . El cortisol también puede exhibir actividad mineralocorticoide en altas concentraciones, empeorando la hipertensión y provocando hipopotasemia (común en la secreción ectópica de ACTH) e hipernatremia (aumento de la concentración de iones Na+ en plasma). Además, el cortisol excesivo puede provocar trastornos gastrointestinales , infecciones oportunistas y problemas de cicatrización de heridas relacionados con la supresión de las respuestas inmunitarias e inflamatorias por parte del cortisol. La osteoporosis también es un problema en el síndrome de Cushing, ya que se inhibe la actividad de los osteoblastos. Además, el síndrome de Cushing puede causar dolor y dolor en las articulaciones, particularmente en la cadera, los hombros y la espalda baja. [ cita necesaria ]
Pueden producirse cambios cerebrales como atrofia cerebral. [28] Esta atrofia se asocia con áreas de altas concentraciones de receptores de glucocorticoides, como el hipocampo, y se correlaciona altamente con cambios psicopatológicos de la personalidad. [29] [30] [31] [32]
El síndrome de Cushing debido al exceso de ACTH también puede provocar hiperpigmentación . Esto se debe a la producción de hormona estimulante de los melanocitos como subproducto de la síntesis de ACTH a partir de proopiomelanocortina (POMC). Alternativamente, se propone que los altos niveles de ACTH, β-lipotropina y γ-lipotropina , que contienen una función débil de MSH, puedan actuar sobre el receptor de melanocortina 1 . Una variante de la enfermedad de Cushing puede ser causada por una producción de ACTH ectópica, es decir, extrapituitaria, de, por ejemplo, un cáncer de pulmón de células pequeñas. [33]
Cuando el síndrome de Cushing es causado por un aumento de cortisol a nivel de las glándulas suprarrenales (a través de un adenoma o hiperplasia), la retroalimentación negativa finalmente reduce la producción de ACTH en la hipófisis. En estos casos, los niveles de ACTH permanecen bajos y no se desarrolla hiperpigmentación. [33]
El síndrome de Cushing puede deberse a cualquier causa de aumento de los niveles de glucocorticoides, ya sea por medicación o procesos internos. [10] [34] Sin embargo, algunas fuentes no consideran la afección inducida por los medicamentos glucocorticoides como "síndrome de Cushing" propiamente dicho, sino que utilizan el término "Cushingoide" para describir los efectos secundarios del medicamento que imitan la afección endógena. [35] [34] [36]
La enfermedad de Cushing es un tipo específico de síndrome de Cushing causado por un tumor pituitario que conduce a una producción excesiva de ACTH (hormona adrenocorticotrópica). El exceso de ACTH estimula la corteza suprarrenal para que produzca altos niveles de cortisol, lo que produce el estado de enfermedad. Si bien todas las enfermedades de Cushing dan como resultado el síndrome de Cushing, no todos los síndromes de Cushing se deben a la enfermedad de Cushing. [37] Se conocen varias causas posibles del síndrome de Cushing, incluida la toma de suplementos a base de hierbas de venta libre que no incluyen glucocorticoides en sus ingredientes. [38] [39]
La causa más común del síndrome de Cushing es el uso de glucocorticoides recetados para tratar otras enfermedades ( síndrome de Cushing iatrogénico ). Los glucocorticoides se utilizan en el tratamiento de una variedad de trastornos, incluidos el asma y la artritis reumatoide , y también se utilizan para la inmunosupresión después de trasplantes de órganos. También es posible la administración de ACTH sintética, pero se prescribe con menos frecuencia debido al costo y la menor utilidad. En raras ocasiones, el síndrome de Cushing también puede deberse al uso de acetato de medroxiprogesterona . [40] [41] En la enfermedad de Cushing exógena, las glándulas suprarrenales a menudo pueden atrofiarse gradualmente debido a la falta de estimulación por parte de ACTH, cuya producción se suprime con medicamentos glucocorticoides. Por lo tanto, suspender abruptamente el medicamento puede provocar una insuficiencia suprarrenal aguda y potencialmente mortal y, por lo tanto, la dosis debe reducirse lenta y cuidadosamente para permitir que aumente la producción interna de cortisol. En algunos casos, los pacientes nunca recuperan niveles suficientes de producción interna y deben continuar tomando glucocorticoides a dosis fisiológicas de por vida. [35] [42]
El síndrome de Cushing en la infancia es especialmente raro y generalmente se debe al uso de glucocorticoides. [43]
El síndrome de Cushing endógeno resulta de algún trastorno del propio sistema de secreción de cortisol del cuerpo. Normalmente, la glándula pituitaria libera ACTH cuando es necesario para estimular la liberación de cortisol de las glándulas suprarrenales . [ cita necesaria ]
Los niveles elevados de cortisol total también pueden deberse al estrógeno que se encuentra en las píldoras anticonceptivas orales que contienen una mezcla de estrógeno y progesterona, lo que lleva al síndrome de pseudo-Cushing . El estrógeno puede provocar un aumento de la globulina fijadora de cortisol y, por tanto, elevar el nivel total de cortisol. Sin embargo, el cortisol libre total, que es la hormona activa en el cuerpo, medido mediante una recolección de cortisol libre en orina de 24 horas, es normal. [47]
El hipotálamo está en el cerebro y la glándula pituitaria se encuentra justo debajo de él. El núcleo paraventricular (PVN) del hipotálamo libera hormona liberadora de corticotropina (CRH), que estimula a la glándula pituitaria para que libere adrenocorticotropina ( ACTH ). La ACTH viaja a través de la sangre hasta la glándula suprarrenal, donde estimula la liberación de cortisol . El cortisol es secretado por la corteza de la glándula suprarrenal desde una región llamada zona fasciculata en respuesta a la ACTH. Los niveles elevados de cortisol ejercen una retroalimentación negativa sobre la CRH en el hipotálamo, lo que disminuye la cantidad de ACTH liberada por la glándula pituitaria anterior. [ cita necesaria ]
En sentido estricto, el síndrome de Cushing se refiere al exceso de cortisol de cualquier etiología (ya que síndrome significa un grupo de síntomas). Una de las causas del síndrome de Cushing es un adenoma secretor de cortisol en la corteza de la glándula suprarrenal (hipercortisolismo/hipercorticismo primario). El adenoma hace que los niveles de cortisol en la sangre sean muy altos y la retroalimentación negativa sobre la hipófisis debido a los niveles altos de cortisol hace que los niveles de ACTH sean muy bajos. [ cita necesaria ]
La enfermedad de Cushing se refiere únicamente al hipercortisolismo secundario a la producción excesiva de ACTH a partir de un adenoma hipofisario corticotropo (hipercortisolismo/hipercorticismo secundario) o debido a la producción excesiva de CRH ( hormona liberadora de corticotropina ) del hipotálamo (hipercortisolismo/hipercorticismo terciario). Esto hace que los niveles de ACTH en sangre se eleven junto con el cortisol de la glándula suprarrenal. Los niveles de ACTH permanecen altos porque el tumor no responde a la retroalimentación negativa de los niveles altos de cortisol. [ cita necesaria ]
Cuando el síndrome de Cushing se debe a un exceso de ACTH , se conoce como síndrome de Cushing ectópico. [48] Esto puede observarse en un síndrome paraneoplásico .
Cuando se sospecha el síndrome de Cushing, una prueba de supresión con dexametasona (administración de dexametasona y determinación frecuente de cortisol y nivel de ACTH) o una medición de cortisol en orina de 24 horas ofrece tasas de detección iguales. [49] La dexametasona es un glucocorticoide y simula los efectos del cortisol, incluida la retroalimentación negativa sobre la glándula pituitaria. Cuando se administra dexametasona y se analiza una muestra de sangre, los niveles de cortisol >50 nmol/L (1,81 μg/dL) serían indicativos de síndrome de Cushing porque existe una fuente ectópica de cortisol o ACTH (como el adenoma suprarrenal) que no es inhibida por la dexametasona. Un enfoque novedoso, aprobado recientemente por la FDA de EE. UU., es tomar muestras de cortisol en la saliva durante 24 horas, lo que puede ser igualmente sensible, ya que los niveles nocturnos de cortisol salival son altos en pacientes cushingoides. Es posible que sea necesario determinar otros niveles de hormonas pituitarias. Puede ser necesario realizar un examen físico para determinar cualquier defecto del campo visual si se sospecha una lesión hipofisaria, que puede comprimir el quiasma óptico , provocando la típica hemianopsia bitemporal . [ cita necesaria ]
Cuando cualquiera de estas pruebas es positiva, se realiza una tomografía computarizada de la glándula suprarrenal y una resonancia magnética de la glándula pituitaria para detectar la presencia de adenomas o incidentalomas suprarrenales o pituitarios (el descubrimiento incidental de lesiones inofensivas). En ocasiones es necesaria una gammagrafía de la glándula suprarrenal con gammagrafía con yodocolesterol . Ocasionalmente, es necesario determinar los niveles de ACTH en varias venas del cuerpo mediante cateterismo venoso, trabajando hacia la pituitaria ( muestreo del seno petroso ). En muchos casos, los tumores que causan la enfermedad de Cushing miden menos de 2 mm y son difíciles de detectar mediante imágenes por resonancia magnética o tomografía computarizada. En un estudio de 261 pacientes con enfermedad de Cushing hipofisaria confirmada, sólo el 48% de las lesiones hipofisarias se identificaron mediante resonancia magnética antes de la cirugía. [50]
Los niveles plasmáticos de CRH son inadecuados en el momento del diagnóstico (con la posible excepción de los tumores que secretan CRH) debido a la dilución periférica y la unión a CRHBP . [51]

La prueba de cortisol libre en orina de 24 horas, la prueba de supresión de dexametasona en dosis bajas y la medición del cortisol plasmático a medianoche o del cortisol salival nocturno son las tres pruebas principales que se utilizan para diagnosticar el síndrome de Cushing. [53]
El hipercortisolismo está relacionado con anomalías químicas habituales, como leucocitosis neutrofílica, hiperglucemia, hipopotasemia, hipercolesterolemia e hipercoagulabilidad. [54]
Los niveles de cortisol en orina reflejan directamente el cortisol libre circulante. [53] El exceso de cortisol satura las proteínas de unión y se elimina en la orina como cortisol libre, lo que lo convierte en un diagnóstico útil para la hipercortisolemia. [55] Los valores cuatro veces superiores al rango superior normal son poco comunes, especialmente en la enfermedad de Cushing. [56] Una sola medición carece de sensibilidad para las personas con hipercortisolemia intermitente. [57]
La mayoría de los casos de síntomas Cushingoides son causados por medicamentos corticosteroides, como los utilizados para el asma, la artritis, el eccema y otras afecciones inflamatorias. En consecuencia, la mayoría de los pacientes reciben un tratamiento eficaz reduciendo cuidadosamente (y eventualmente suspendiendo) la medicación que causa los síntomas. [ cita necesaria ]
Si se identifica un adenoma suprarrenal, es posible que se extirpe mediante cirugía. Un adenoma hipofisario corticotrófico secretor de ACTH debe extirparse después del diagnóstico. Independientemente de la ubicación del adenoma, la mayoría de los pacientes requieren reemplazo de esteroides en el posoperatorio, al menos mientras tanto, ya que la supresión a largo plazo de la ACTH hipofisaria y del tejido suprarrenal normal no se recupera inmediatamente. Claramente, si se extirpan ambas glándulas suprarrenales, es imperativo reemplazarlas con hidrocortisona o prednisolona . [ cita necesaria ]
En aquellos pacientes que no son aptos o no desean someterse a una cirugía, se ha descubierto que varios fármacos inhiben la síntesis de cortisol (p. ej., ketoconazol , metirapona ), pero tienen una eficacia limitada. [ cita necesaria ] La mifepristona es un potente antagonista del receptor de glucocorticoides tipo II y, dado que no interfiere con la transmisión normal del receptor de homeostasis del cortisol tipo I, puede ser especialmente útil para tratar los efectos cognitivos del síndrome de Cushing. [58] Sin embargo, el medicamento enfrenta una controversia considerable debido a su uso como abortivo . En febrero de 2012, la FDA aprobó la mifepristona para controlar los niveles elevados de azúcar en sangre ( hiperglucemia ) en pacientes adultos que no son candidatos a cirugía, o que no respondieron a una cirugía previa, con la advertencia de que la mifepristona nunca debe ser utilizada por mujeres embarazadas -aunque El embarazo es extremadamente raro durante el curso del síndrome de Cushing [59] [60] [61] [62] En marzo de 2020, la FDA aprobó las tabletas orales de Isturisa ( osilodrostat ), un inhibidor de la enzima 11-beta-hidroxilasa, para tratar a aquellos pacientes que no pueden someterse a una cirugía de hipófisis o para pacientes que se sometieron a una cirugía pero continúan teniendo la enfermedad. [63]

Ocasionalmente se realiza la extirpación de las glándulas suprarrenales en ausencia de un tumor conocido para eliminar la producción excesiva de cortisol. [64] En algunas ocasiones, esto elimina la retroalimentación negativa de un adenoma hipofisario previamente oculto, que comienza a crecer rápidamente y produce niveles extremos de ACTH, lo que lleva a hiperpigmentación. Esta situación clínica se conoce como síndrome de Nelson . [sesenta y cinco]
El síndrome de Cushing causado por el tratamiento con corticosteroides es la forma más común. La enfermedad de Cushing es rara; un estudio danés encontró una incidencia de menos de un caso por millón de personas por año. [66] Sin embargo, los microadenomas asintomáticos (menos de 10 mm de tamaño) de la hipófisis se encuentran en aproximadamente uno de cada seis individuos. [67]
Alrededor del 0,9 al 1% de las personas con síndrome de Cushing tienen tendencia a desarrollar trombosis venosa . Otros factores como la cirugía y la obesidad también aumentan las posibilidades de sufrir trombosis. [68]
{{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )