La glucosa es un azúcar con la fórmula molecular C 6 H 12 O 6 . La glucosa es en general el monosacárido más abundante , [4] una subcategoría de los carbohidratos . La glucosa es producida principalmente por las plantas y la mayoría de las algas durante la fotosíntesis a partir de agua y dióxido de carbono, utilizando la energía de la luz solar. Las plantas utilizan la glucosa para producir celulosa (el carbohidrato más abundante del mundo) para su uso en las paredes celulares , y todos los organismos vivos la utilizan para producir trifosfato de adenosina (ATP), que la célula utiliza como energía. [5] [6] [7]
En el metabolismo energético , la glucosa es la fuente de energía más importante en todos los organismos . La glucosa para el metabolismo se almacena como un polímero , en las plantas principalmente como amilosa y amilopectina , y en los animales como glucógeno . La glucosa circula en la sangre de los animales como azúcar en sangre . [5] [7] La forma natural de glucosa es la d -glucosa, mientras que su estereoisómero l -glucosa se produce sintéticamente en cantidades comparativamente pequeñas y es menos activa biológicamente. [7] La glucosa es un monosacárido que contiene seis átomos de carbono y un grupo aldehído , y por lo tanto es una aldohexosa . La molécula de glucosa puede existir en forma de cadena abierta (acíclica) así como en forma de anillo (cíclica). La glucosa se produce de forma natural y se encuentra en su estado libre en frutas y otras partes de las plantas. En los animales, la glucosa se libera a partir de la descomposición del glucógeno en un proceso conocido como glucogenólisis .
La glucosa, como solución de azúcar intravenosa , está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud . [8] También está en la lista en combinación con el cloruro de sodio (sal de mesa). [8]
El nombre glucosa se deriva del griego antiguo γλεῦκος ( gleûkos ) 'vino, mosto', de γλυκύς ( glykýs ) 'dulce'. [9] [10] El sufijo -osa es un clasificador químico que denota un azúcar.
La glucosa fue aislada por primera vez de las pasas en 1747 por el químico alemán Andreas Marggraf . [11] [12] La glucosa fue descubierta en las uvas por otro químico alemán, Johann Tobias Lowitz , en 1792, y distinguida por ser diferente del azúcar de caña ( sacarosa ). Glucosa es el término acuñado por Jean Baptiste Dumas en 1838, que ha prevalecido en la literatura química. Friedrich August Kekulé propuso el término dextrosa (del latín dexter , que significa "derecha"), porque en solución acuosa de glucosa, el plano de la luz polarizada linealmente está girado hacia la derecha. En contraste, la l-fructosa (generalmente denominada d -fructosa) (una cetohexosa) y la l-glucosa ( l -glucosa) giran la luz polarizada linealmente hacia la izquierda. La notación anterior según la rotación del plano de luz polarizada linealmente ( nomenclatura d y l ) fue posteriormente abandonada en favor de la notación d y l , que se refiere a la configuración absoluta del centro asimétrico más alejado del grupo carbonilo, y en concordancia con la configuración de d o l gliceraldehído. [13] [14]
Dado que la glucosa es una necesidad básica de muchos organismos, una correcta comprensión de su composición química y estructura contribuyó en gran medida a un avance general en la química orgánica . Esta comprensión se produjo en gran medida como resultado de las investigaciones de Emil Fischer , un químico alemán que recibió el Premio Nobel de Química en 1902 por sus hallazgos. [15] La síntesis de glucosa estableció la estructura de la materia orgánica y, en consecuencia, formó la primera validación definitiva de las teorías de Jacobus Henricus van 't Hoff sobre la cinética química y las disposiciones de los enlaces químicos en las moléculas portadoras de carbono. [16] Entre 1891 y 1894, Fischer estableció la configuración estereoquímica de todos los azúcares conocidos y predijo correctamente los posibles isómeros , aplicando la teoría de Van 't Hoff de los átomos de carbono asimétricos. Los nombres inicialmente se referían a las sustancias naturales. Sus enantiómeros recibieron el mismo nombre con la introducción de nomenclaturas sistemáticas, teniendo en cuenta la estereoquímica absoluta (por ejemplo, nomenclatura de Fischer, nomenclatura d / l ).
Por el descubrimiento del metabolismo de la glucosa, Otto Meyerhof recibió el Premio Nobel de Fisiología o Medicina en 1922. [17] Hans von Euler-Chelpin fue galardonado con el Premio Nobel de Química junto con Arthur Harden en 1929 por su "investigación sobre la fermentación del azúcar y su participación de las enzimas en este proceso". [18] [19] En 1947, Bernardo Houssay (por su descubrimiento del papel de la glándula pituitaria en el metabolismo de la glucosa y los carbohidratos derivados) así como Carl y Gerty Cori (por su descubrimiento de la conversión de glucógeno a partir de glucosa) recibieron el Premio Nobel de Fisiología o Medicina. [20] [21] [22] En 1970, Luis Leloir fue galardonado con el Premio Nobel de Química por el descubrimiento de nucleótidos de azúcar derivados de la glucosa en la biosíntesis de carbohidratos. [23]
La glucosa forma sólidos blancos o incoloros que son altamente solubles en agua y ácido acético , pero poco solubles en metanol y etanol . Se funden a 146 °C (295 °F) ( α ) y 150 °C (302 °F) ( beta ), se descomponen a partir de 188 °C (370 °F) con liberación de varios productos volátiles, dejando finalmente un residuo de carbono . [24] La glucosa tiene un valor de pKa de 12,16 a 25 °C (77 °F) en agua. [25]
Con seis átomos de carbono, se clasifica como una hexosa , una subcategoría de los monosacáridos . La d -glucosa es uno de los dieciséis estereoisómeros de aldohexosa . El isómero d , d -glucosa, también conocido como dextrosa, se encuentra ampliamente en la naturaleza, pero el isómero l , l -glucosa , no. La glucosa se puede obtener por hidrólisis de carbohidratos como el azúcar de la leche ( lactosa ), el azúcar de caña (sacarosa), la maltosa , la celulosa , el glucógeno , etc. La dextrosa se fabrica comúnmente comercialmente a partir de almidones , como el almidón de maíz en los EE. UU. y Japón, el almidón de patata y trigo en Europa y el almidón de tapioca en áreas tropicales. [26] El proceso de fabricación utiliza hidrólisis mediante vapor presurizado a pH controlado en un chorro seguido de una despolimerización enzimática adicional. [27] La glucosa no unida es uno de los principales ingredientes de la miel . [28] [29] [30] [31] [32]
El término dextrosa se utiliza a menudo en un contexto clínico (relacionado con el estado de salud del paciente) o nutricional (relacionado con la ingesta dietética, como las etiquetas de los alimentos o las pautas dietéticas), mientras que "glucosa" se utiliza en un contexto biológico o fisiológico (procesos químicos e interacciones moleculares), [33] [34] [35] [36] pero ambos términos se refieren a la misma molécula, específicamente D-glucosa. [35] [37]
La dextrosa monohidrato es la forma hidratada de la D-glucosa, lo que significa que es una molécula de glucosa con una molécula de agua adicional unida. [38] Su fórmula química es C 6 H 12 O 6 · H 2 O . [38] [39] La dextrosa monohidrato también se llama D-glucosa hidratada y comúnmente se fabrica a partir de almidones vegetales. [38] [40] La dextrosa monohidrato se utiliza como el tipo predominante de dextrosa en aplicaciones alimentarias, como mezclas de bebidas; es una forma común de glucosa ampliamente utilizada como suplemento nutricional en la producción de alimentos. La dextrosa monohidrato se consume principalmente en América del Norte como jarabe de maíz o jarabe de maíz con alto contenido de fructosa . [35]
La dextrosa anhidra , por otro lado, es glucosa que no tiene ninguna molécula de agua unida a ella. [40] [41] Las sustancias químicas anhidras se producen comúnmente eliminando agua de una sustancia hidratada a través de métodos como el calentamiento o el secado (desecación). [42] [43] [44] La dextrosa monohidrato se puede deshidratar a dextrosa anhidra en un entorno industrial. [45] [46] La dextrosa monohidrato se compone de aproximadamente 9,5% de agua en masa; a través del proceso de deshidratación, este contenido de agua se elimina para producir dextrosa anhidra (seca). [40]
La dextrosa anhidra tiene la fórmula química C 6 H 12 O 6 , sin ninguna molécula de agua unida, que es la misma que la glucosa. [38] La dextrosa anhidra al aire libre tiende a absorber humedad y transformarse en monohidrato, y es más cara de producir. [40] La dextrosa anhidra (D-glucosa anhidra) tiene una mayor estabilidad y una vida útil más larga, [43] tiene aplicaciones médicas, como en la prueba de tolerancia a la glucosa oral . [47]
Mientras que el peso molecular (masa molar) del monohidrato de D-glucosa es 198,17 g/mol, [48] [49] el de la D-glucosa anhidra es 180,16 g/mol [50] [51] [52] La densidad de estas dos formas de glucosa también es diferente. [ especificar ]
En términos de estructura química, la glucosa es un monosacárido, es decir, un azúcar simple. La glucosa contiene seis átomos de carbono y un grupo aldehído , y por lo tanto es una aldohexosa . La molécula de glucosa puede existir en forma de cadena abierta (acíclica) así como en forma de anillo (cíclica); debido a la presencia de grupos funcionales alcohol y aldehído o cetona , la forma que tiene la cadena recta puede convertirse fácilmente en una estructura de anillo hemiacetal similar a una silla que se encuentra comúnmente en los carbohidratos. [53]

La glucosa está presente en forma sólida como un monohidrato con un anillo de pirano cerrado (α-glucopiranosa monohidrato, a veces conocido con menos precisión como hidrato de dextrosa). En solución acuosa, por otro lado, es una cadena abierta en una pequeña medida y está presente predominantemente como α- o β- piranosa , que se interconvierten. A partir de soluciones acuosas, se pueden cristalizar las tres formas conocidas: α-glucopiranosa, β-glucopiranosa y α-glucopiranosa monohidrato. [54] La glucosa es un componente básico de los disacáridos lactosa y sacarosa (azúcar de caña o remolacha), de oligosacáridos como la rafinosa y de polisacáridos como el almidón , la amilopectina , el glucógeno y la celulosa . [7] [55] La temperatura de transición vítrea de la glucosa es 31 °C (88 °F) y la constante de Gordon-Taylor (una constante determinada experimentalmente para la predicción de la temperatura de transición vítrea para diferentes fracciones de masa de una mezcla de dos sustancias) [55] es 4,5. [56]

Una forma de cadena abierta de glucosa constituye menos del 0,02% de las moléculas de glucosa en una solución acuosa en equilibrio. [57] El resto es una de las dos formas hemiacetales cíclicas. En su forma de cadena abierta , la molécula de glucosa tiene una cadena principal abierta (a diferencia de la cíclica ) no ramificada de seis átomos de carbono, donde C-1 es parte de un grupo aldehído H(C=O)− . Por lo tanto, la glucosa también se clasifica como una aldosa o una aldohexosa . El grupo aldehído convierte a la glucosa en un azúcar reductor que da una reacción positiva con la prueba de Fehling .
En soluciones, la forma de cadena abierta de la glucosa (ya sea " D -" o " L -") existe en equilibrio con varios isómeros cíclicos , cada uno de los cuales contiene un anillo de carbonos cerrado por un átomo de oxígeno. Sin embargo, en solución acuosa, más del 99% de las moléculas de glucosa existen como formas de piranosa . La forma de cadena abierta está limitada a aproximadamente el 0,25%, y las formas de furanosa existen en cantidades insignificantes. Los términos "glucosa" y " D -glucosa" también se utilizan generalmente para estas formas cíclicas. El anillo surge de la forma de cadena abierta por una reacción de adición nucleofílica intramolecular entre el grupo aldehído (en C-1) y el grupo hidroxilo C-4 o C-5, formando un enlace hemiacetal , −C(OH)H−O− .
La reacción entre C-1 y C-5 produce un sistema heterocíclico de seis miembros llamado piranosa, que es un azúcar monosacárido (de ahí "-osa") que contiene un esqueleto de pirano derivatizado . La reacción (mucho más rara) entre C-1 y C-4 produce un anillo de furanosa de cinco miembros, llamado así por el éter cíclico furano . En cualquier caso, cada carbono del anillo tiene un hidrógeno y un hidroxilo unidos, excepto el último carbono (C-4 o C-5) donde el hidroxilo es reemplazado por el resto de la molécula abierta (que es −(C(CH 2 OH)HOH)−H o −(CHOH)−H respectivamente).
La reacción de cierre del anillo puede dar lugar a dos productos, denominados "α-" y "β-". Cuando se dibuja una molécula de glucopiranosa en la proyección de Haworth , la designación "α-" significa que el grupo hidroxilo unido a C-1 y el grupo −CH 2 OH en C-5 se encuentran en lados opuestos del plano del anillo (una disposición trans ), mientras que "β-" significa que están en el mismo lado del plano (una disposición cis ). Por lo tanto, el isómero de cadena abierta D -glucosa da lugar a cuatro isómeros cíclicos distintos: α- D -glucopiranosa, β- D -glucopiranosa, α- D -glucofuranosa y β- D -glucofuranosa. Estas cinco estructuras existen en equilibrio y se interconvierten, y la interconversión es mucho más rápida con catálisis ácida .

El otro isómero de cadena abierta, L -glucosa, da lugar de manera similar a cuatro formas cíclicas distintas de L -glucosa, cada una de las cuales es la imagen especular de la D -glucosa correspondiente.
El anillo de glucopiranosa (α o β) puede adoptar varias formas no planas, análogas a las conformaciones de "silla" y "barco" del ciclohexano . De manera similar, el anillo de glucofuranosa puede adoptar varias formas, análogas a las conformaciones de "envoltura" del ciclopentano .
En estado sólido sólo se observan las formas de glucopiranosa.
Algunos derivados de la glucofuranosa, como la 1,2-O-isopropilideno-D-glucofuranosa, son estables y se pueden obtener puros como sólidos cristalinos. [58] [59] Por ejemplo, la reacción de la α-D-glucosa con el ácido para-tolilborónico H 3 C−(C 6 H 4 )−B(OH) 2 reforma el anillo de piranosa normal para producir el éster cuádruple α-D-glucofuranosa-1,2:3,5-bis( p -tolilboronato). [60]
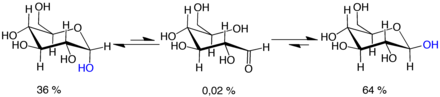
La mutarrotación consiste en una inversión temporal de la reacción de formación del anillo, que da como resultado la forma de cadena abierta, seguida de una reformación del anillo. El paso de cierre del anillo puede utilizar un grupo −OH diferente al recreado en el paso de apertura (cambiando así entre las formas piranosa y furanosa), o el nuevo grupo hemiacetal creado en C-1 puede tener la misma o opuesta quiralidad que el original (cambiando así entre las formas α y β). Por lo tanto, aunque la forma de cadena abierta es apenas detectable en solución, es un componente esencial del equilibrio.
La forma de cadena abierta es termodinámicamente inestable y se isomeriza espontáneamente a las formas cíclicas. (Aunque la reacción de cierre de anillo podría en teoría crear anillos de cuatro o tres átomos, estos estarían muy tensos y no se observan en la práctica). En soluciones a temperatura ambiente , los cuatro isómeros cíclicos se interconvierten en una escala de tiempo de horas, en un proceso llamado mutarrotación . [61] A partir de cualquier proporción, la mezcla converge a una relación estable de α:β 36:64. La relación sería α:β 11:89 si no fuera por la influencia del efecto anomérico . [62] La mutarrotación es considerablemente más lenta a temperaturas cercanas a 0 °C (32 °F).
Ya sea en agua o en forma sólida, la d -(+)-glucosa es dextrógira , lo que significa que rotará la dirección de la luz polarizada en el sentido de las agujas del reloj, como se ve al mirar hacia la fuente de luz. El efecto se debe a la quiralidad de las moléculas y, de hecho, el isómero de imagen especular, la l -(−)-glucosa, es levógira (rota la luz polarizada en el sentido contrario a las agujas del reloj) en la misma cantidad. La intensidad del efecto es diferente para cada uno de los cinco tautómeros .
El prefijo d- no se refiere directamente a las propiedades ópticas del compuesto. Indica que el centro quiral C-5 tiene la misma lateralidad que el del d -gliceraldehído (que se denominó así porque es dextrógiro). El hecho de que la d -glucosa sea dextrógira es un efecto combinado de sus cuatro centros quirales, no solo del C-5; algunas de las otras d -aldohexosas son levógiras.
La conversión entre los dos anómeros se puede observar en un polarímetro , ya que la α- d -glucosa pura tiene un ángulo de rotación específico de +112,2° mL/(dm·g), la β- d -glucosa pura de +17,5° mL/(dm·g). [63] Cuando se ha alcanzado el equilibrio después de un cierto tiempo debido a la mutarrotación, el ángulo de rotación es de +52,7° mL/(dm·g). [63] Al añadir ácido o base, esta transformación se acelera mucho. El equilibrio se produce a través de la forma de aldehído de cadena abierta.
En hidróxido de sodio diluido u otras bases diluidas, los monosacáridos manosa , glucosa y fructosa se interconvierten (a través de una transformación de Lobry de Bruyn–Alberda–Van Ekenstein ), de modo que se forma un equilibrio entre estos isómeros. Esta reacción se lleva a cabo a través de un enediol :
La glucosa es el monosacárido más abundante. La glucosa es también la aldohexosa más utilizada en la mayoría de los organismos vivos. Una posible explicación para esto es que la glucosa tiene una tendencia menor que otras aldohexosas a reaccionar de forma no específica con los grupos amina de las proteínas . [64] Esta reacción, la glicación , perjudica o destruye la función de muchas proteínas, [64] por ejemplo, en la hemoglobina glucosilada . La baja tasa de glicación de la glucosa se puede atribuir a que tiene una forma cíclica más estable en comparación con otras aldohexosas, lo que significa que pasa menos tiempo que ellas en su forma reactiva de cadena abierta. [64] La razón por la que la glucosa tiene la forma cíclica más estable de todas las aldohexosas es que sus grupos hidroxi (con la excepción del grupo hidroxi en el carbono anomérico de la d -glucosa) están en la posición ecuatorial . Presumiblemente, la glucosa es el monosacárido natural más abundante porque está menos glicosilada con proteínas que otros monosacáridos. [64] [65] Otra hipótesis es que la glucosa, al ser la única d -aldohexosa que tiene los cinco sustituyentes hidroxi en la posición ecuatorial en forma de β- d -glucosa, es más fácilmente accesible a las reacciones químicas, [66] : 194, 199 por ejemplo, para la esterificación [67] : 363 o la formación de acetal . [68] Por esta razón, la d -glucosa también es un bloque de construcción altamente preferido en los polisacáridos naturales (glucanos). Los polisacáridos que están compuestos únicamente de glucosa se denominan glucanos .
La glucosa es producida por las plantas a través de la fotosíntesis utilizando la luz solar, [69] [70] agua y dióxido de carbono y puede ser utilizada por todos los organismos vivos como fuente de energía y carbono. Sin embargo, la mayor parte de la glucosa no se presenta en su forma libre, sino en forma de sus polímeros, es decir, lactosa, sacarosa, almidón y otros que son sustancias de reserva energética, y celulosa y quitina , que son componentes de la pared celular en plantas u hongos y artrópodos , respectivamente. Estos polímeros, cuando son consumidos por animales, hongos y bacterias, se degradan a glucosa utilizando enzimas. Todos los animales también son capaces de producir glucosa por sí mismos a partir de ciertos precursores según surja la necesidad. Las neuronas , las células de la médula renal y los eritrocitos dependen de la glucosa para su producción de energía. [70] En los humanos adultos, hay alrededor de 18 g (0,63 oz) de glucosa, [71] de los cuales alrededor de 4 g (0,14 oz) están presentes en la sangre. [72] El hígado de un adulto produce aproximadamente entre 180 y 220 g (6,3 y 7,8 oz) de glucosa en 24 horas. [71]
Muchas de las complicaciones a largo plazo de la diabetes (por ejemplo, ceguera , insuficiencia renal y neuropatía periférica ) probablemente se deben a la glicación de proteínas o lípidos . [73] Por el contrario, la adición de azúcares a las proteínas regulada por enzimas se denomina glicosilación y es esencial para la función de muchas proteínas. [74]
La glucosa ingerida se une inicialmente al receptor del sabor dulce en la lengua en los humanos. Este complejo de las proteínas T1R2 y T1R3 permite identificar fuentes de alimentos que contienen glucosa. [75] [76] La glucosa proviene principalmente de los alimentos: alrededor de 300 g (11 oz) por día se producen por la conversión de alimentos, [76] pero también se sintetiza a partir de otros metabolitos en las células del cuerpo. En los humanos, la descomposición de los polisacáridos que contienen glucosa ocurre en parte ya durante la masticación por medio de la amilasa , que está contenida en la saliva , así como por la maltasa , la lactasa y la sacarasa en el borde en cepillo del intestino delgado . La glucosa es un componente básico de muchos carbohidratos y puede separarse de ellos utilizando ciertas enzimas. Las glucosidasas , un subgrupo de las glucosidasas, primero catalizan la hidrólisis de los polisacáridos de cadena larga que contienen glucosa, eliminando la glucosa terminal. A su vez, los disacáridos son degradados principalmente por glicosidasas específicas a glucosa. Los nombres de las enzimas degradadoras a menudo se derivan del poli- y disacárido en particular; entre otras, para la degradación de cadenas de polisacáridos existen amilasas (nombradas por la amilosa, un componente del almidón), celulasas (nombradas por la celulosa), quitinasas (nombradas por la quitina), y más. Además, para la escisión de disacáridos, existen maltasa, lactasa, sacarasa, trehalasa y otras. En los humanos, se conocen alrededor de 70 genes que codifican para glicosidasas. Tienen funciones en la digestión y degradación de glucógeno, esfingolípidos , mucopolisacáridos y poli ( ADP-ribosa ). Los humanos no producen celulasas, quitinasas o trehalasas, pero las bacterias en la microbiota intestinal sí lo hacen.
Para entrar o salir de las membranas celulares de las células y las membranas de los compartimentos celulares, la glucosa requiere proteínas de transporte especiales de la superfamilia de facilitadores principales . En el intestino delgado (más precisamente, en el yeyuno ), [77] la glucosa es absorbida por el epitelio intestinal con la ayuda de transportadores de glucosa [78] a través de un mecanismo de transporte activo secundario llamado simporte de iones de sodio-glucosa a través del cotransportador de sodio/glucosa 1 (SGLT1). [79] La transferencia adicional ocurre en el lado basolateral de las células epiteliales intestinales a través del transportador de glucosa GLUT2 , [79] así como la absorción en células hepáticas , células renales, células de los islotes de Langerhans , neuronas , astrocitos y tanicitos . [80] La glucosa ingresa al hígado a través de la vena porta y se almacena allí como glucógeno celular. [81] En la célula hepática, es fosforilada por la glucoquinasa en la posición 6 para formar glucosa 6-fosfato , que no puede salir de la célula. La glucosa 6-fosfatasa puede convertir la glucosa 6-fosfato nuevamente en glucosa exclusivamente en el hígado, por lo que el cuerpo puede mantener una concentración suficiente de glucosa en sangre. En otras células, la captación ocurre por transporte pasivo a través de una de las 14 proteínas GLUT. [79] En los otros tipos de células, la fosforilación ocurre a través de una hexoquinasa , con lo cual la glucosa ya no puede difundirse fuera de la célula.
El transportador de glucosa GLUT1 es producido por la mayoría de los tipos de células y es de particular importancia para las células nerviosas y las células β pancreáticas . [79] GLUT3 se expresa en gran medida en las células nerviosas. [79] La glucosa del torrente sanguíneo es absorbida por GLUT4 de las células musculares (del músculo esquelético [82] y del músculo cardíaco ) y de las células grasas . [83] GLUT14 se expresa exclusivamente en los testículos . [84] El exceso de glucosa se descompone y se convierte en ácidos grasos, que se almacenan como triglicéridos . En los riñones , la glucosa en la orina se absorbe a través de SGLT1 y SGLT2 en las membranas celulares apicales y se transmite a través de GLUT2 en las membranas celulares basolaterales. [85] Aproximadamente el 90% de la reabsorción de glucosa en los riñones se realiza a través de SGLT2 y aproximadamente el 3% a través de SGLT1. [86]
En las plantas y algunos procariotas , la glucosa es un producto de la fotosíntesis . [69] La glucosa también se forma por la descomposición de formas poliméricas de glucosa como el glucógeno (en animales y hongos ) o el almidón (en plantas). La escisión del glucógeno se denomina glucogenólisis, la escisión del almidón se denomina degradación del almidón. [87]
La vía metabólica que comienza con moléculas que contienen de dos a cuatro átomos de carbono (C) y termina en la molécula de glucosa que contiene seis átomos de carbono se llama gluconeogénesis y ocurre en todos los organismos vivos. Los materiales de partida más pequeños son el resultado de otras vías metabólicas. En última instancia, casi todas las biomoléculas provienen de la asimilación de dióxido de carbono en plantas y microbios durante la fotosíntesis. [67] : 359 La energía libre de formación de α- d -glucosa es de 917,2 kilojulios por mol. [67] : 59 En los humanos, la gluconeogénesis ocurre en el hígado y el riñón, [88] pero también en otros tipos de células. En el hígado se almacenan alrededor de 150 g (5,3 oz) de glucógeno, en el músculo esquelético alrededor de 250 g (8,8 oz). [89] Sin embargo, la glucosa liberada en las células musculares tras la escisión del glucógeno no puede ser entregada a la circulación porque la glucosa es fosforilada por la hexoquinasa, y no se expresa una glucosa-6-fosfatasa para eliminar el grupo fosfato. A diferencia de la glucosa, no existe una proteína de transporte para la glucosa-6-fosfato . La gluconeogénesis permite al organismo generar glucosa a partir de otros metabolitos, incluido el lactato o ciertos aminoácidos , mientras consume energía. Las células tubulares renales también pueden producir glucosa.
La glucosa también se puede encontrar fuera de los organismos vivos, en el ambiente. Las concentraciones de glucosa en la atmósfera se detectan mediante la recolección de muestras por avión y se sabe que varían de un lugar a otro. Por ejemplo, las concentraciones de glucosa en el aire atmosférico del interior de China varían de 0,8 a 20,1 pg/L, mientras que las concentraciones de glucosa en la costa este de China varían de 10,3 a 142 pg/L. [90]
En los seres humanos, la glucosa se metaboliza mediante la glucólisis [91] y la vía de las pentosas fosfato. [92] La glucólisis es utilizada por todos los organismos vivos, [66] : 551 [93] con pequeñas variaciones, y todos los organismos generan energía a partir de la descomposición de los monosacáridos. [93] En el curso posterior del metabolismo, puede degradarse completamente a través de la descarboxilación oxidativa , el ciclo del ácido cítrico (sinónimo ciclo de Krebs ) y la cadena respiratoria a agua y dióxido de carbono. Si no hay suficiente oxígeno disponible para esto, la degradación de la glucosa en los animales ocurre de forma anaeróbica a lactato a través de la fermentación del ácido láctico y libera mucha menos energía. El lactato muscular ingresa al hígado a través del torrente sanguíneo en los mamíferos, donde ocurre la gluconeogénesis ( ciclo de Cori ). Con un alto suministro de glucosa, el metabolito acetil-CoA del ciclo de Krebs también se puede utilizar para la síntesis de ácidos grasos . [94] La glucosa también se utiliza para reponer las reservas de glucógeno del organismo, que se encuentran principalmente en el hígado y el músculo esquelético. Estos procesos están regulados hormonalmente .
En otros organismos vivos, pueden ocurrir otras formas de fermentación. La bacteria Escherichia coli puede crecer en medios nutritivos que contengan glucosa como única fuente de carbono. [67] : 59 En algunas bacterias y, en forma modificada, también en arqueas, la glucosa se degrada a través de la vía de Entner-Doudoroff . [95] Con la glucosa, se descubrió un mecanismo de regulación genética en E. coli , la represión de catabolitos (antes conocida como efecto glucosa ). [96]
La glucosa se utiliza como fuente de energía en las células mediante respiración aeróbica, respiración anaeróbica o fermentación. [97] El primer paso de la glucólisis es la fosforilación de la glucosa por una hexoquinasa para formar glucosa 6-fosfato . La razón principal de la fosforilación inmediata de la glucosa es evitar su difusión fuera de la célula, ya que el grupo fosfato cargado evita que la glucosa 6-fosfato cruce fácilmente la membrana celular . [97] Además, la adición del grupo fosfato de alta energía activa la glucosa para su posterior descomposición en pasos posteriores de la glucólisis. [98]
En la respiración anaeróbica, una molécula de glucosa produce una ganancia neta de dos moléculas de ATP (cuatro moléculas de ATP se producen durante la glucólisis a través de la fosforilación a nivel de sustrato, pero dos son necesarias para las enzimas utilizadas durante el proceso). [99] En la respiración aeróbica, una molécula de glucosa es mucho más rentable ya que se genera una producción neta máxima de 30 o 32 moléculas de ATP (según el organismo). [100]
Haga clic en los genes, proteínas y metabolitos que aparecen a continuación para acceder a los artículos correspondientes. [§ 1]
Las células tumorales suelen crecer comparativamente rápido y consumen una cantidad de glucosa superior a la media mediante la glucólisis, [101] lo que conduce a la formación de lactato, el producto final de la fermentación en los mamíferos, incluso en presencia de oxígeno. Esto se denomina efecto Warburg . Para la mayor absorción de glucosa en los tumores se producen en exceso diversos SGLT y GLUT. [102] [103]
En la levadura , el etanol se fermenta en concentraciones altas de glucosa, incluso en presencia de oxígeno (lo que normalmente conduce a la respiración en lugar de a la fermentación). Esto se denomina efecto Crabtree .
La glucosa también puede degradarse para formar dióxido de carbono por medios abióticos. Se ha demostrado experimentalmente que esto ocurre mediante oxidación e hidrólisis a 22 °C y un pH de 2,5. [104]
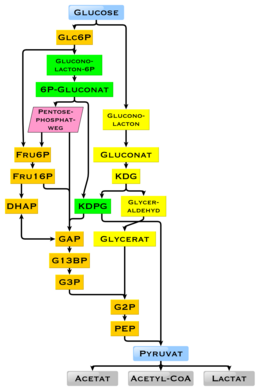
La glucosa es un combustible omnipresente en biología . Se utiliza como fuente de energía en los organismos, desde las bacterias hasta los humanos, a través de la respiración aeróbica , la respiración anaeróbica (en bacterias) o la fermentación . La glucosa es la fuente clave de energía del cuerpo humano, a través de la respiración aeróbica, proporcionando alrededor de 3,75 kilocalorías (16 kilojulios ) de energía alimentaria por gramo. [105] La descomposición de los carbohidratos (p. ej., el almidón) produce mono y disacáridos , la mayoría de los cuales es glucosa. A través de la glucólisis y más tarde en las reacciones del ciclo del ácido cítrico y la fosforilación oxidativa , la glucosa se oxida para finalmente formar dióxido de carbono y agua, produciendo energía principalmente en forma de trifosfato de adenosina (ATP). La reacción de la insulina y otros mecanismos regulan la concentración de glucosa en la sangre. El valor calórico fisiológico de la glucosa, dependiendo de la fuente, es de 16,2 kilojulios por gramo [106] o 15,7 kJ/g (3,74 kcal/g). [107] La alta disponibilidad de carbohidratos de la biomasa vegetal ha llevado a una variedad de métodos durante la evolución, especialmente en microorganismos, para utilizar la glucosa para energía y almacenamiento de carbono. Existen diferencias en cuanto a qué producto final ya no se puede utilizar para la producción de energía. La presencia de genes individuales y sus productos genéticos, las enzimas, determina qué reacciones son posibles. La vía metabólica de la glucólisis es utilizada por casi todos los seres vivos. Una diferencia esencial en el uso de la glucólisis es la recuperación de NADPH como reductor para el anabolismo que de otro modo tendría que generarse indirectamente. [108]
La glucosa y el oxígeno suministran casi toda la energía para el cerebro , [109] por lo que su disponibilidad influye en los procesos psicológicos . Cuando la glucosa es baja , los procesos psicológicos que requieren esfuerzo mental (por ejemplo, autocontrol , toma de decisiones con esfuerzo) se ven afectados. [110] [111] [112] [113] En el cerebro, que depende de la glucosa y el oxígeno como principal fuente de energía, la concentración de glucosa suele ser de 4 a 6 mM (5 mM equivalen a 90 mg/dL), [71] pero disminuye a 2 a 3 mM en ayunas. [114] La confusión ocurre por debajo de 1 mM y el coma a niveles más bajos. [114]
La glucosa en la sangre se llama azúcar en sangre . Los niveles de azúcar en sangre están regulados por las células nerviosas que se unen a la glucosa en el hipotálamo . [115] Además, la glucosa en el cerebro se une a los receptores de glucosa del sistema de recompensa en el núcleo accumbens . [115] La unión de la glucosa al receptor dulce en la lengua induce una liberación de varias hormonas del metabolismo energético, ya sea a través de la glucosa o a través de otros azúcares, lo que lleva a una mayor captación celular y niveles más bajos de azúcar en sangre. [116] Los edulcorantes artificiales no reducen los niveles de azúcar en sangre. [116]
El contenido de azúcar en sangre de una persona sana en estado de ayuno breve, por ejemplo después del ayuno nocturno, es de aproximadamente 70 a 100 mg/dl de sangre (4 a 5,5 mM). En el plasma sanguíneo , los valores medidos son aproximadamente un 10-15% más altos. Además, los valores en la sangre arterial son más altos que las concentraciones en la sangre venosa , ya que la glucosa se absorbe en el tejido durante el paso del lecho capilar . También en la sangre capilar, que se utiliza a menudo para la determinación de azúcar en sangre, los valores son a veces más altos que en la sangre venosa. El contenido de glucosa de la sangre está regulado por las hormonas insulina , incretina y glucagón . [115] [117] La insulina reduce el nivel de glucosa, el glucagón lo aumenta. [71] Además, las hormonas adrenalina , tiroxina , glucocorticoides , somatotropina y adrenocorticotropina conducen a un aumento del nivel de glucosa. [71] También existe una regulación independiente de las hormonas, que se denomina autorregulación de la glucosa. [118] Después de la ingesta de alimentos, la concentración de azúcar en sangre aumenta. Los valores superiores a 180 mg/dL en sangre venosa completa son patológicos y se denominan hiperglucemia , los valores inferiores a 40 mg/dL se denominan hipoglucemia . [119] Cuando es necesario, la glucosa-6-fosfatasa libera glucosa en el torrente sanguíneo a partir de la glucosa-6-fosfato que se origina en el glucógeno del hígado y el riñón, regulando así la homeostasis de la concentración de glucosa en sangre. [88] [70] En los rumiantes , la concentración de glucosa en sangre es menor (60 mg/dL en el ganado vacuno y 40 mg/dL en las ovejas ), porque los carbohidratos son convertidos más por su microbiota intestinal en ácidos grasos de cadena corta . [120]
Una parte de la glucosa se convierte en ácido láctico por los astrocitos , que luego se utiliza como fuente de energía por las células cerebrales ; otra parte de la glucosa es utilizada por las células intestinales y los glóbulos rojos , mientras que el resto llega al hígado , al tejido adiposo y a las células musculares , donde se absorbe y se almacena como glucógeno (bajo la influencia de la insulina ). El glucógeno de las células hepáticas se puede convertir en glucosa y devolver a la sangre cuando la insulina es baja o ausente; el glucógeno de las células musculares no se devuelve a la sangre debido a la falta de enzimas. En las células grasas , la glucosa se utiliza para impulsar las reacciones que sintetizan algunos tipos de grasa y tienen otros fines. El glucógeno es el mecanismo de "almacenamiento de energía de glucosa" del cuerpo, porque es mucho más "eficiente en el espacio" y menos reactivo que la propia glucosa.
Como resultado de su importancia en la salud humana, la glucosa es un analito en las pruebas de glucosa que son análisis de sangre médicos comunes . [121] Comer o ayunar antes de tomar una muestra de sangre tiene un efecto en los análisis de glucosa en la sangre; un alto nivel de azúcar en sangre en ayunas puede ser un signo de prediabetes o diabetes mellitus . [122]
El índice glucémico es un indicador de la velocidad de reabsorción y conversión a niveles de glucosa en sangre de los carbohidratos ingeridos, medido como el área bajo la curva de los niveles de glucosa en sangre después del consumo en comparación con la glucosa (la glucosa se define como 100). [123] La importancia clínica del índice glucémico es controvertida, [123] [124] ya que los alimentos con alto contenido de grasa retardan la reabsorción de carbohidratos y reducen el índice glucémico, por ejemplo, el helado. [124] Un indicador alternativo es el índice de insulina , [125] medido como el impacto del consumo de carbohidratos en los niveles de insulina en sangre. La carga glucémica es un indicador de la cantidad de glucosa agregada a los niveles de glucosa en sangre después del consumo, según el índice glucémico y la cantidad de alimento consumido.
Los organismos utilizan la glucosa como precursor para la síntesis de varias sustancias importantes. El almidón, la celulosa y el glucógeno ("almidón animal") son polímeros de glucosa comunes (polisacáridos). Algunos de estos polímeros (almidón o glucógeno) sirven como depósitos de energía, mientras que otros (celulosa y quitina , que se fabrica a partir de un derivado de la glucosa) tienen funciones estructurales. Los oligosacáridos de glucosa combinados con otros azúcares sirven como importantes depósitos de energía. Estos incluyen la lactosa, el azúcar predominante en la leche, que es un disacárido de glucosa-galactosa, y la sacarosa, otro disacárido que se compone de glucosa y fructosa. La glucosa también se añade a ciertas proteínas y lípidos en un proceso llamado glicosilación . Esto suele ser fundamental para su funcionamiento. Las enzimas que unen la glucosa a otras moléculas suelen utilizar glucosa fosforilada para impulsar la formación del nuevo enlace acoplándolo con la ruptura del enlace glucosa-fosfato.
Además de su uso directo como monómero, la glucosa se puede descomponer para sintetizar una amplia variedad de otras biomoléculas. Esto es importante, ya que la glucosa sirve tanto como almacén primario de energía como fuente de carbono orgánico. La glucosa se puede descomponer y convertir en lípidos. También es un precursor para la síntesis de otras moléculas importantes como la vitamina C (ácido ascórbico). En los organismos vivos, la glucosa se convierte en varios otros compuestos químicos que son el material de partida para varias vías metabólicas . Entre ellos, todos los demás monosacáridos [126] como la fructosa (a través de la vía del poliol ), [79] la manosa (el epímero de la glucosa en la posición 2), la galactosa (el epímero en la posición 4), la fucosa, varios ácidos urónicos y los aminoazúcares se producen a partir de la glucosa. [81] Además de la fosforilación a glucosa-6-fosfato, que es parte de la glucólisis, la glucosa puede oxidarse durante su degradación a glucono-1,5-lactona. La glucosa se utiliza en algunas bacterias como un bloque de construcción en la biosíntesis de trehalosa o dextrano y en animales como un bloque de construcción de glucógeno. La glucosa también puede convertirse de la xilosa isomerasa bacteriana a fructosa. Además, los metabolitos de la glucosa producen todos los aminoácidos no esenciales, alcoholes de azúcar como manitol y sorbitol , ácidos grasos , colesterol y ácidos nucleicos . [126] Finalmente, la glucosa se utiliza como un bloque de construcción en la glicosilación de proteínas a glicoproteínas , glicolípidos , peptidoglicanos , glicósidos y otras sustancias (catalizada por glicosiltransferasas ) y puede escindirse de ellas por glicosidasas .
La diabetes es un trastorno metabólico en el que el cuerpo es incapaz de regular los niveles de glucosa en la sangre, ya sea por falta de insulina en el cuerpo o por la incapacidad, por parte de las células del cuerpo, de responder adecuadamente a la insulina. Cada una de estas situaciones puede ser causada por elevaciones persistentemente altas de los niveles de glucosa en sangre, a través del agotamiento pancreático y la resistencia a la insulina . El páncreas es el órgano responsable de la secreción de las hormonas insulina y glucagón. [127] La insulina es una hormona que regula los niveles de glucosa, permitiendo que las células del cuerpo absorban y utilicen la glucosa. Sin ella, la glucosa no puede entrar en la célula y, por lo tanto, no puede usarse como combustible para las funciones del cuerpo. [128] Si el páncreas se expone a elevaciones persistentemente altas de los niveles de glucosa en sangre, las células productoras de insulina en el páncreas podrían dañarse, causando una falta de insulina en el cuerpo. La resistencia a la insulina ocurre cuando el páncreas intenta producir cada vez más insulina en respuesta a niveles de glucosa en sangre persistentemente elevados. Con el tiempo, el resto del cuerpo se vuelve resistente a la insulina que produce el páncreas, por lo que se necesita más insulina para lograr el mismo efecto de reducción de la glucosa en sangre y se obliga al páncreas a producir aún más insulina para competir con la resistencia. Esta espiral negativa contribuye al agotamiento pancreático y a la progresión de la diabetes.
Para controlar la respuesta del organismo a la terapia para reducir la glucemia, se pueden medir los niveles de glucosa. El control de la glucemia se puede realizar mediante varios métodos, como la prueba de glucosa en ayunas, que mide el nivel de glucosa en sangre después de 8 horas de ayuno. Otra prueba es la prueba de tolerancia a la glucosa de 2 horas (GTT, por sus siglas en inglés): para esta prueba, la persona se realiza una prueba de glucosa en ayunas, luego bebe una bebida con glucosa de 75 gramos y se vuelve a realizar la prueba. Esta prueba mide la capacidad del cuerpo de la persona para procesar la glucosa. Con el tiempo, los niveles de glucosa en sangre deberían disminuir a medida que la insulina permite que las células la absorban y la eliminen del torrente sanguíneo.

Las personas con diabetes u otras afecciones que provocan niveles bajos de azúcar en sangre suelen llevar consigo pequeñas cantidades de azúcar en diversas formas. Un azúcar que se utiliza habitualmente es la glucosa, a menudo en forma de comprimidos de glucosa (glucosa prensada en forma de comprimido, a veces con uno o más ingredientes adicionales como aglutinante), caramelos duros o sobres de azúcar .

La mayoría de los carbohidratos de la dieta contienen glucosa, ya sea como su único componente básico (como en los polisacáridos almidón y glucógeno), o junto con otro monosacárido (como en los heteropolisacáridos sacarosa y lactosa). [129] La glucosa libre es uno de los principales ingredientes de la miel. La glucosa es extremadamente abundante y se ha aislado de una variedad de fuentes naturales en todo el mundo, incluidos los conos masculinos del árbol conífero Wollemia nobilis en Roma, [130] las raíces de las plantas Ilex asprella en China, [131] y la paja de arroz en California. [132]
La glucosa se produce industrialmente a partir del almidón mediante hidrólisis enzimática utilizando glucosa amilasa o mediante el uso de ácidos . La hidrólisis enzimática ha desplazado en gran medida las reacciones de hidrólisis catalizada por ácidos. [134] El resultado es jarabe de glucosa (enzimáticamente con más del 90% de glucosa en la materia seca) [134] con un volumen de producción mundial anual de 20 millones de toneladas (a partir de 2011). [135] Esta es la razón del antiguo nombre común "azúcar de almidón". Las amilasas provienen con mayor frecuencia de Bacillus licheniformis [136] o Bacillus subtilis (cepa MN-385), [136] que son más termoestables que las enzimas utilizadas originalmente. [136] [137] A partir de 1982, las pululanasas de Aspergillus niger se utilizaron en la producción de jarabe de glucosa para convertir la amilopectina en almidón (amilosa), aumentando así el rendimiento de glucosa. [138] La reacción se lleva a cabo a un pH de 4,6–5,2 y una temperatura de 55–60 °C. [11] El jarabe de maíz tiene entre un 20% y un 95% de glucosa en la materia seca. [139] [140] La forma japonesa del jarabe de glucosa, Mizuame , se elabora a partir de almidón de batata o de arroz . [141] La maltodextrina contiene aproximadamente un 20% de glucosa.
Muchos cultivos pueden utilizarse como fuente de almidón. El maíz , [134] el arroz, [134] el trigo , [134] la mandioca , [134] la patata , [134] la cebada , [134] la batata, [142] la cáscara de maíz y el sagú se utilizan en varias partes del mundo. En los Estados Unidos , el almidón de maíz (de maíz) se utiliza casi exclusivamente. Algo de glucosa comercial se presenta como un componente del azúcar invertido , una mezcla aproximadamente 1:1 de glucosa y fructosa que se produce a partir de la sacarosa. En principio, la celulosa podría hidrolizarse a glucosa, pero este proceso aún no es comercialmente práctico. [54]
En los EE. UU., se utiliza casi exclusivamente maíz (más precisamente, jarabe de maíz) como fuente de glucosa para la producción de isoglucosa , que es una mezcla de glucosa y fructosa, ya que la fructosa tiene un mayor poder edulcorante, con el mismo valor calorífico fisiológico de 374 kilocalorías por 100 g. La producción mundial anual de isoglucosa es de 8 millones de toneladas (a partir de 2011). [135] Cuando se elabora a partir de jarabe de maíz, el producto final es el jarabe de maíz con alto contenido de fructosa (JMAF).

La glucosa se utiliza principalmente para la producción de fructosa y de alimentos que contienen glucosa. En los alimentos, se utiliza como edulcorante, humectante , para aumentar el volumen y crear una sensación en boca más suave . [134] Varias fuentes de glucosa, como el jugo de uva (para el vino) o la malta (para la cerveza), se utilizan para la fermentación a etanol durante la producción de bebidas alcohólicas . La mayoría de los refrescos en los EE. UU. utilizan JMAF-55 (con un contenido de fructosa del 55% en la masa seca), mientras que la mayoría de los demás alimentos endulzados con JMAF en los EE. UU. utilizan JMAF-42 (con un contenido de fructosa del 42% en la masa seca). [144] En México, por otro lado, los refrescos se endulzan con azúcar de caña, que tiene un mayor poder edulcorante. [145] Además, el jarabe de glucosa se utiliza, entre otras cosas, en la producción de confitería como caramelos , toffee y fondant . [146] Las reacciones químicas típicas de la glucosa cuando se calienta en condiciones sin agua son la caramelización y, en presencia de aminoácidos, la reacción de Maillard .
Además, se pueden producir biotecnológicamente diversos ácidos orgánicos a partir de glucosa, por ejemplo mediante fermentación con Clostridium thermoaceticum para producir ácido acético , con Penicillium notatum para la producción de ácido araboascórbico, con Rhizopus delemar para la producción de ácido fumárico , con Aspergillus niger para la producción de ácido glucónico , con Candida brumptii para producir ácido isocítrico , con Aspergillus terreus para la producción de ácido itacónico , con Pseudomonas fluorescens para la producción de ácido 2-cetoglucónico, con Gluconobacter suboxydans para la producción de ácido 5-cetoglucónico, con Aspergillus oryzae para la producción de ácido kójico , con Lactobacillus delbrueckii para la producción de ácido láctico , con Lactobacillus brevis para la producción de ácido málico , con Propionibacter shermanii para la producción de ácido propiónico , con Pseudomonas aeruginosa para la producción de ácido pirúvico y con Gluconobacter suboxydans para la producción de ácido tartárico . [147] [ cita(s) adicional(es) necesaria(s ) ] Se ha informado recientemente de productos naturales bioactivos potentes como la triptolida que inhibe la transcripción en mamíferos a través de la inhibición de la subunidad XPB del factor de transcripción general TFIIH como un conjugado de glucosa para dirigirse a las células cancerosas hipóxicas con mayor expresión del transportador de glucosa. [148] Recientemente, la glucosa ha estado ganando uso comercial como un componente clave de los "kits" que contienen ácido láctico e insulina destinados a inducir hipoglucemia e hiperlactatemia para combatir diferentes cánceres e infecciones. [149]
Cuando se desea detectar una molécula de glucosa en una posición determinada en una molécula más grande, se realiza una espectroscopia de resonancia magnética nuclear , un análisis de cristalografía de rayos X o una inmunotinción de lectina con el conjugado de la enzima reportera concanavalina A , que se une únicamente a la glucosa o la manosa.
Estas reacciones sólo tienen importancia histórica:
La prueba de Fehling es un método clásico para la detección de aldosas. [150] Debido a la mutarrotación, la glucosa siempre está presente en una pequeña medida como un aldehído de cadena abierta. Al agregar los reactivos de Fehling (solución de Fehling (I) y solución de Fehling (II)), el grupo aldehído se oxida a un ácido carboxílico , mientras que el complejo de tartrato de Cu 2+ se reduce a Cu + y forma un precipitado rojo ladrillo (Cu 2 O).
En la prueba de Tollens , después de agregar AgNO 3 amoniacal a la solución de muestra, la glucosa reduce Ag + a plata elemental . [151]
En la prueba de Barfoed , [152] se añade una solución de acetato de cobre disuelto , acetato de sodio y ácido acético a la solución de azúcar que se va a analizar y posteriormente se calienta en un baño de agua durante unos minutos. La glucosa y otros monosacáridos producen rápidamente un color rojizo y óxido de cobre (I) (Cu 2 O) de color marrón rojizo.
Como azúcar reductor, la glucosa reacciona en la prueba de Nylander . [153]
Al calentar una solución diluida de hidróxido de potasio con glucosa a 100 °C, se desarrolla un fuerte color marrón rojizo y un olor parecido al caramelo. [154] El ácido sulfúrico concentrado disuelve la glucosa seca sin ennegrecerse a temperatura ambiente formando ácido sulfúrico de azúcar. [154] [ verificación necesaria ] En una solución de levadura, la fermentación alcohólica produce dióxido de carbono en la proporción de 2,0454 moléculas de glucosa por una molécula de CO 2 . [154] La glucosa forma una masa negra con cloruro estannoso . [154] En una solución de plata amoniacal, la glucosa (así como la lactosa y la dextrina) conduce a la deposición de plata. En una solución de acetato de plomo amoniacal , se forma glicósido de plomo blanco en presencia de glucosa, que se vuelve menos soluble al cocinarlo y se vuelve marrón. [154] En una solución de cobre amoniacal, se forma hidrato de óxido de cobre amarillo con glucosa a temperatura ambiente, mientras que se forma óxido de cobre rojo durante la ebullición (lo mismo con la dextrina, excepto con una solución de acetato de cobre amoniacal). [154] Con el reactivo de Hager , la glucosa forma óxido de mercurio durante la ebullición. [154] Se utiliza una solución alcalina de bismuto para precipitar bismuto elemental de color negro-marrón con glucosa. [154] La glucosa hervida en una solución de molibdato de amonio vuelve azul la solución. Una solución con carmín índigo y carbonato de sodio se decolora cuando se hierve con glucosa. [154]
En soluciones concentradas de glucosa con una proporción reducida de otros hidratos de carbono, su concentración se puede determinar con un polarímetro. En el caso de mezclas de azúcares, la concentración se puede determinar con un refractómetro , por ejemplo, en la determinación de Oechsle durante la producción de vino.
La enzima glucosa oxidasa (GOx) convierte la glucosa en ácido glucónico y peróxido de hidrógeno mientras consume oxígeno. Otra enzima, la peroxidasa, cataliza una reacción cromogénica (reacción de Trinder) [155] del fenol con 4-aminoantipirina para formar un colorante violeta. [156]
El método de la tira reactiva utiliza la conversión enzimática antes mencionada de glucosa en ácido glucónico para formar peróxido de hidrógeno. Los reactivos se inmovilizan en una matriz de polímero, la llamada tira reactiva, que adquiere un color más o menos intenso. Esto se puede medir reflectométricamente a 510 nm con la ayuda de un fotómetro portátil basado en LED. Esto permite la determinación rutinaria de azúcar en sangre por parte de no científicos. Además de la reacción del fenol con 4-aminoantipirina, se han desarrollado nuevas reacciones cromogénicas que permiten la fotometría a longitudes de onda más altas (550 nm, 750 nm). [156] [157]
El electroanálisis de la glucosa también se basa en la reacción enzimática mencionada anteriormente. El peróxido de hidrógeno producido se puede cuantificar amperométricamente mediante oxidación anódica a un potencial de 600 mV. [158] El GOx se inmoviliza en la superficie del electrodo o en una membrana colocada cerca del electrodo. Los metales preciosos como el platino o el oro se utilizan en los electrodos, así como electrodos de nanotubos de carbono, que, por ejemplo, están dopados con boro. [159] Los nanocables de Cu–CuO también se utilizan como electrodos amperométricos sin enzimas, alcanzando un límite de detección de 50 μmol/L. [160] Un método especialmente prometedor es el denominado "cableado enzimático", en el que el electrón que fluye durante la oxidación se transfiere a través de un cable molecular directamente desde la enzima al electrodo. [161]
Existen otros sensores químicos para medir la glucosa. [162] [163] Dada la importancia del análisis de la glucosa en las ciencias de la vida, también se han desarrollado numerosas sondas ópticas para sacáridos basadas en el uso de ácidos borónicos, [164] que son particularmente útiles para aplicaciones sensoriales intracelulares donde otros métodos (ópticos) no son o solo se pueden usar de manera condicional. Además de los derivados orgánicos del ácido borónico, que a menudo se unen de manera muy específica a los grupos 1,2-diol de los azúcares, también existen otros conceptos de sonda clasificados por mecanismos funcionales que utilizan proteínas selectivas de unión a la glucosa (por ejemplo, concanavalina A) como receptor. Además, se desarrollaron métodos que detectan indirectamente la concentración de glucosa a través de la concentración de productos metabolizados, por ejemplo, por el consumo de oxígeno utilizando sensores ópticos de fluorescencia. [165] Finalmente, existen conceptos basados en enzimas que utilizan la absorbancia intrínseca o la fluorescencia de enzimas (marcadas con fluorescencia) como reporteros. [162]
La glucosa se puede cuantificar mediante yodometría de cobre. [166]
En particular, para el análisis de mezclas complejas que contienen glucosa, por ejemplo en la miel, a menudo se utilizan métodos cromatográficos como la cromatografía líquida de alto rendimiento y la cromatografía de gases [166] en combinación con la espectrometría de masas . [167] [168] Teniendo en cuenta las proporciones de isótopos, también es posible detectar de forma fiable la adulteración de la miel por azúcares añadidos con estos métodos. [169] La derivatización mediante reactivos de sililación se utiliza habitualmente. [170] Además, se pueden cuantificar las proporciones de di- y trisacáridos.
La captación de glucosa en las células de los organismos se mide con 2-desoxi-D-glucosa o fluorodesoxiglucosa . [114] La ( 18 F)fluorodesoxiglucosa se utiliza como trazador en la tomografía por emisión de positrones en oncología y neurología, [171] donde es, con diferencia, el agente de diagnóstico más utilizado. [172]