El agua es un compuesto inorgánico con la fórmula química H 2 O . Es una sustancia química transparente, insípida, inodoro [c] y casi incolora , y es el principal constituyente de la hidrosfera de la Tierra y de los fluidos de todos los organismos vivos conocidos (en los que actúa como disolvente [19] ). Es vital para todas las formas de vida conocidas , a pesar de no proporcionar energía alimentaria ni micronutrientes orgánicos . Su fórmula química, H 2 O , indica que cada una de sus moléculas contiene un átomo de oxígeno y dos de hidrógeno , conectados por enlaces covalentes . Los átomos de hidrógeno están unidos al átomo de oxígeno en un ángulo de 104,45°. [20] "Agua" es también el nombre del estado líquido del H 2 O a temperatura y presión estándar .
Debido a que el entorno de la Tierra está relativamente cerca del punto triple del agua , el agua existe en la Tierra como sólido , líquido y gas . [21] Forma precipitaciones en forma de lluvia y aerosoles en forma de niebla . Las nubes están formadas por gotas suspendidas de agua y hielo , su estado sólido. Cuando está finamente dividido, el hielo cristalino puede precipitar en forma de nieve . El estado gaseoso del agua es vapor o vapor de agua .
El agua cubre aproximadamente el 71% de la superficie de la Tierra, y los mares y océanos constituyen la mayor parte del volumen de agua (alrededor del 96,5%). [22] Pequeñas porciones de agua se encuentran en forma de agua subterránea (1,7%), en los glaciares y los casquetes polares de la Antártida y Groenlandia (1,7%), y en el aire en forma de vapor , nubes (compuestas de hielo y agua líquida suspendidas en el aire). y precipitación (0,001%). [23] [24] El agua se mueve continuamente a través del ciclo del agua de evaporación , transpiración ( evapotranspiración ), condensación , precipitación y escorrentía , llegando generalmente al mar.
El agua juega un papel importante en la economía mundial . Aproximadamente el 70% del agua dulce utilizada por los seres humanos se destina a la agricultura . [25] La pesca en masas de agua dulce y salada ha sido, y sigue siendo, una importante fuente de alimento para muchas partes del mundo, proporcionando el 6,5% de las proteínas mundiales. [26] Gran parte del comercio de productos básicos a larga distancia (como petróleo, gas natural y productos manufacturados) se transporta en barcos a través de mares, ríos, lagos y canales. Se utilizan grandes cantidades de agua, hielo y vapor para enfriar y calentar en la industria y en los hogares. El agua es un excelente disolvente para una amplia variedad de sustancias, tanto minerales como orgánicas; como tal, se utiliza ampliamente en procesos industriales y en la cocción y el lavado. El agua, el hielo y la nieve también son fundamentales para muchos deportes y otras formas de entretenimiento, como la natación, la navegación de recreo, las regatas, el surf, la pesca deportiva, el buceo, el patinaje sobre hielo, el snowboard y el esquí.
La palabra agua proviene del inglés antiguo wæter , del protogermánico * watar (fuente también del antiguo sajón watar , antiguo frisón wetir , holandés agua , antiguo alto alemán wazzar , alemán Wasser , vatn , gótico 𐍅𐌰𐍄𐍉 ( wato )), del proto- Indoeuropeo * wod-or , forma sufijada de raíz * wed- ( ' agua ' ; ' mojado ' ). [27] También afín , a través de la raíz indoeuropea, con el griego ύδωρ ( ýdor ; del griego antiguo ὕδωρ ( hýdōr ), de donde el inglés ' hidro- ' ), el ruso вода́ ( vodá ), el uisce irlandés y el ujë albanés .
Un factor para estimar cuándo apareció el agua en la Tierra es que continuamente se pierde agua en el espacio. Las moléculas de H 2 O en la atmósfera se rompen mediante fotólisis y los átomos de hidrógeno libres resultantes a veces pueden escapar de la atracción gravitacional de la Tierra. Cuando la Tierra era más joven y menos masiva , el agua se habría perdido en el espacio con mayor facilidad. Se espera que elementos más ligeros como el hidrógeno y el helio se escapen continuamente de la atmósfera, pero las proporciones isotópicas de los gases nobles más pesados en la atmósfera moderna sugieren que incluso los elementos más pesados de la atmósfera primitiva estaban sujetos a pérdidas significativas. [28] En particular, el xenón es útil para calcular la pérdida de agua a lo largo del tiempo. No sólo es un gas noble (y por lo tanto no se elimina de la atmósfera mediante reacciones químicas con otros elementos), sino que las comparaciones entre las abundancias de sus nueve isótopos estables en la atmósfera moderna revelan que la Tierra perdió al menos un océano de agua temprano. en su historia, entre los eones Hadeano y Arcaico . [29] [ se necesita aclaración ]
Cualquier agua en la Tierra durante la última parte de su acreción habría sido perturbada por el impacto que formó la Luna (hace ~4.500 millones de años), que probablemente vaporizó gran parte de la corteza terrestre y el manto superior y creó una atmósfera de vapor de roca alrededor del joven planeta. . [30] [31] El vapor de roca se habría condensado en dos mil años, dejando atrás volátiles calientes que probablemente dieron como resultado una atmósfera mayoritaria de dióxido de carbono con hidrógeno y vapor de agua . Posteriormente, es posible que existieran océanos de agua líquida a pesar de la temperatura superficial de 230 °C debido al aumento de la presión atmosférica de la atmósfera de CO 2 . A medida que continuaba el enfriamiento, la mayor parte del CO 2 fue eliminado de la atmósfera mediante subducción y disolución en el agua del océano, pero los niveles oscilaron enormemente a medida que aparecían nuevos ciclos en la superficie y el manto . [32]

La evidencia geológica también ayuda a limitar el marco temporal de la existencia de agua líquida en la Tierra. Se recuperó una muestra de basalto tipo almohada (un tipo de roca formada durante una erupción submarina) del cinturón de piedras verdes de Isua y proporciona evidencia de que existía agua en la Tierra hace 3.800 millones de años. [33] En el cinturón de piedras verdes de Nuvvuagittuq , Quebec, Canadá, rocas fechadas en 3.800 millones de años según un estudio [34] y 4.280 millones de años según otro [35] muestran evidencia de la presencia de agua en estas edades. [33] Si los océanos existieron antes, aún no se ha descubierto ninguna evidencia geológica (lo que puede deberse a que dicha evidencia potencial ha sido destruida por procesos geológicos como el reciclaje de la corteza terrestre ). Más recientemente, en agosto de 2020, los investigadores informaron que es posible que siempre haya habido suficiente agua para llenar los océanos en la Tierra desde el comienzo de la formación del planeta . [36] [37] [38]
A diferencia de las rocas, los minerales llamados circones son muy resistentes a la erosión y a los procesos geológicos y, por lo tanto, se utilizan para comprender las condiciones de la Tierra primitiva. La evidencia mineralógica de los circones ha demostrado que el agua líquida y la atmósfera debieron existir hace 4,404 ± 0,008 mil millones de años, muy poco después de la formación de la Tierra. [39] [40] [41] [42] Esto presenta una especie de paradoja, ya que la hipótesis de la Tierra primitiva y fría sugiere que las temperaturas eran lo suficientemente frías como para congelar el agua hace aproximadamente 4,4 mil millones y 4,0 mil millones de años. Otros estudios sobre circones encontrados en rocas del Hadeano australiano apuntan a la existencia de placas tectónicas hace ya 4 mil millones de años. De ser cierto, eso implica que, en lugar de una superficie caliente y fundida y una atmósfera llena de dióxido de carbono, la superficie de la Tierra primitiva era muy parecida a la actual (en términos de aislamiento térmico ). La acción de la tectónica de placas atrapa grandes cantidades de CO 2 , reduciendo así los efectos de invernadero , lo que conduce a una temperatura superficial mucho más fría y a la formación de roca sólida y agua líquida. [43]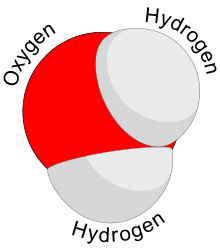
El agua ( H 2 O ) es un compuesto inorgánico polar . A temperatura ambiente es un líquido insípido e inodoro , casi incoloro con un toque azul . Este calcogenuro de hidrógeno más simple es, con diferencia, el compuesto químico más estudiado y se describe como el "disolvente universal" por su capacidad para disolver muchas sustancias. [44] [45] Esto le permite ser el " disolvente de la vida": [46] de hecho, el agua tal como se encuentra en la naturaleza casi siempre incluye varias sustancias disueltas, y se requieren pasos especiales para obtener agua químicamente pura . El agua es la única sustancia común que existe como sólido , líquido y gas en condiciones terrestres normales. [47]

Junto con el oxidano , el agua es uno de los dos nombres oficiales del compuesto químico H.
2Oh ; [48] también es la fase líquida de H
2O. _ [49] Los otros dos estados comunes de la materia del agua son la fase sólida, hielo , y la fase gaseosa, vapor de agua o vapor . La adición o eliminación de calor puede provocar transiciones de fase : congelación (agua a hielo), fusión (hielo a agua), vaporización (agua a vapor), condensación (vapor a agua), sublimación (hielo a vapor) y deposición (vapor a agua). hielo). [50]
El agua se diferencia de la mayoría de los líquidos en que se vuelve menos densa a medida que se congela. [d] A 1 atm de presión, alcanza su densidad máxima de 999,972 kg/m 3 (62,4262 lb/cu ft) a 3,98 °C (39,16 °F), o casi 1.000 kg/m 3 (62,43 lb/cu ft). a casi 4 °C (39 °F). [52] [53] La densidad del hielo es 917 kg/m 3 (57,25 lb/pie cúbico), una expansión del 9%. [54] [55] Esta expansión puede ejercer una presión enorme, haciendo estallar tuberías y agrietando rocas. [56]
En un lago u océano, el agua a 4 °C (39 °F) se hunde hasta el fondo y se forma hielo en la superficie, que flota sobre el agua líquida. Este hielo aísla el agua que se encuentra debajo, evitando que se congele. Sin esta protección, la mayoría de los organismos acuáticos que residen en los lagos morirían durante el invierno. [57]
El agua es un material diamagnético . [58] Aunque la interacción es débil, con imanes superconductores se puede lograr una interacción notable. [58]
A una presión de una atmósfera (atm), el hielo se derrite o el agua se congela (solidifica) a 0 °C (32 °F) y el agua hierve o el vapor se condensa a 100 °C (212 °F). Sin embargo, incluso por debajo del punto de ebullición, el agua puede convertirse en vapor en su superficie por evaporación (la vaporización en todo el líquido se conoce como ebullición ). La sublimación y la deposición también ocurren en las superficies. [50] Por ejemplo, la escarcha se deposita sobre superficies frías, mientras que los copos de nieve se forman por deposición sobre una partícula de aerosol o un núcleo de hielo. [59] En el proceso de liofilización , un alimento se congela y luego se almacena a baja presión para que el hielo de su superficie se sublime. [60]
Los puntos de fusión y ebullición dependen de la presión. Una buena aproximación a la tasa de cambio de la temperatura de fusión con la presión viene dada por la relación de Clausius-Clapeyron :
donde y son los volúmenes molares de las fases líquida y sólida, y es el calor latente molar de fusión. En la mayoría de las sustancias, el volumen aumenta cuando se produce la fusión, por lo que la temperatura de fusión aumenta con la presión. Sin embargo, como el hielo es menos denso que el agua, la temperatura de fusión disminuye. [51] En los glaciares, el derretimiento por presión puede ocurrir bajo volúmenes de hielo suficientemente gruesos, lo que resulta en lagos subglaciales . [61] [62]
La relación Clausius-Clapeyron también se aplica al punto de ebullición, pero con la transición líquido/gas la fase de vapor tiene una densidad mucho menor que la fase líquida, por lo que el punto de ebullición aumenta con la presión. [63] El agua puede permanecer en estado líquido a altas temperaturas en las profundidades del océano o bajo tierra. Por ejemplo, las temperaturas superan los 205 °C (401 °F) en Old Faithful , un géiser en el Parque Nacional de Yellowstone . [64] En los respiraderos hidrotermales , la temperatura puede superar los 400 °C (752 °F). [sesenta y cinco]
Al nivel del mar , el punto de ebullición del agua es de 100 °C (212 °F). A medida que la presión atmosférica disminuye con la altitud, el punto de ebullición disminuye 1 °C cada 274 metros. Cocinar a gran altitud lleva más tiempo que cocinar al nivel del mar. Por ejemplo, a 1.524 metros (5.000 pies), el tiempo de cocción debe aumentarse en una cuarta parte para lograr el resultado deseado. [66] Por el contrario, se puede utilizar una olla a presión para disminuir los tiempos de cocción aumentando la temperatura de ebullición. [67] En el vacío, el agua hervirá a temperatura ambiente. [68]

En un diagrama de fases de presión/temperatura (ver figura), hay curvas que separan el sólido del vapor, el vapor del líquido y el líquido del sólido. Estos se encuentran en un único punto llamado punto triple , donde pueden coexistir las tres fases. El punto triple está a una temperatura de 273,16 K (0,01 °C; 32,02 °F) y una presión de 611,657 pascales (0,00604 atm; 0,0887 psi); [69] es la presión más baja a la que puede existir el agua líquida. Hasta 2019 , se utilizaba el punto triple para definir la escala de temperatura Kelvin . [70] [71]
La curva de fase agua/vapor termina en 647,096 K (373,946 °C; 705,103 °F) y 22,064 megapascales (3200,1 psi; 217,75 atm). [72] Esto se conoce como el punto crítico . A temperaturas y presiones más altas, las fases líquida y de vapor forman una fase continua llamada fluido supercrítico . Puede comprimirse o expandirse gradualmente entre densidades similares a gaseosas y líquidas; sus propiedades (que son bastante diferentes a las del agua ambiental) son sensibles a la densidad. Por ejemplo, para presiones y temperaturas adecuadas, puede mezclarse libremente con compuestos no polares , incluida la mayoría de los compuestos orgánicos . Esto lo hace útil en una variedad de aplicaciones, incluida la electroquímica de alta temperatura y como disolvente o catalizador ecológicamente benigno en reacciones químicas que involucran compuestos orgánicos. En el manto terrestre, actúa como disolvente durante la formación, disolución y deposición de minerales. [73] [74]
La forma normal de hielo en la superficie de la Tierra es hielo I h , una fase que forma cristales con simetría hexagonal . Otro con simetría cristalina cúbica , el hielo I c , puede ocurrir en la atmósfera superior. [75] A medida que aumenta la presión, el hielo forma otras estructuras cristalinas . Hasta 2019, se han confirmado experimentalmente diecisiete y se predicen teóricamente varios más. [76] La decimoctava forma de hielo, hielo XVIII , una fase de hielo superiónica cúbica centrada en la cara, se descubrió cuando una gota de agua fue sometida a una onda de choque que elevó la presión del agua a millones de atmósferas y su temperatura a miles. de grados, dando como resultado una estructura de átomos de oxígeno rígidos en la que los átomos de hidrógeno fluían libremente. [77] [78] Cuando se intercala entre capas de grafeno , el hielo forma una red cuadrada. [79]
Los detalles de la naturaleza química del agua líquida no se comprenden bien; algunas teorías sugieren que su comportamiento inusual se debe a la existencia de dos estados líquidos. [53] [80] [81] [82]
El agua pura generalmente se describe como insípida e inodoro, aunque los humanos tienen sensores específicos que pueden sentir la presencia de agua en la boca, [83] [84] y se sabe que las ranas pueden olerla. [85] Sin embargo, el agua de fuentes ordinarias (incluida el agua mineral ) suele tener muchas sustancias disueltas, que pueden darle diferentes sabores y olores. Los humanos y otros animales han desarrollado sentidos que les permiten evaluar la potabilidad del agua para evitar agua demasiado salada o pútrida . [86]
El agua pura es visiblemente azul debido a la absorción de luz en la región c. 600 a 800 nm. [87] El color se puede observar fácilmente en un vaso de agua del grifo colocado sobre un fondo blanco puro, a la luz del día. Las principales bandas de absorción responsables del color son matices de las vibraciones de estiramiento O-H . La intensidad aparente del color aumenta con la profundidad de la columna de agua, siguiendo la ley de Beer . Esto también se aplica, por ejemplo, a una piscina cuando la fuente de luz es la luz solar reflejada por las baldosas blancas de la piscina.
En la naturaleza, el color también puede modificarse de azul a verde debido a la presencia de sólidos en suspensión o algas.
En la industria, la espectroscopia de infrarrojo cercano se utiliza con soluciones acuosas, ya que la mayor intensidad de los matices más bajos del agua significa que se pueden emplear cubetas de vidrio con un camino óptico corto. Para observar el espectro de absorción de estiramiento fundamental del agua o de una solución acuosa en la región alrededor de 3500 cm −1 (2,85 μm) [88] se necesita una longitud de camino de aproximadamente 25 μm. Además, la cubeta debe ser transparente a unos 3500 cm −1 e insoluble en agua; El fluoruro de calcio es un material de uso común para las ventanas de las cubetas con soluciones acuosas.
Las vibraciones fundamentales activas Raman se pueden observar, por ejemplo, con una celda de muestra de 1 cm.
Las plantas acuáticas , las algas y otros organismos fotosintéticos pueden vivir en agua hasta cientos de metros de profundidad, porque la luz del sol puede alcanzarlos. Prácticamente ninguna luz solar llega a las partes de los océanos que se encuentran por debajo de los 1.000 metros (3.300 pies) de profundidad.
El índice de refracción del agua líquida (1,333 a 20 °C (68 °F)) es mucho mayor que el del aire (1,0), similar a los de los alcanos y el etanol , pero menor que los del glicerol (1,473), el benceno (1,501 ), disulfuro de carbono (1,627) y tipos comunes de vidrio (1,4 a 1,6). El índice de refracción del hielo (1,31) es menor que el del agua líquida.

En una molécula de agua, los átomos de hidrógeno forman un ángulo de 104,5° con el átomo de oxígeno. Los átomos de hidrógeno están cerca de dos vértices de un tetraedro centrado en el oxígeno. En las otras dos esquinas hay pares solitarios de electrones de valencia que no participan en el enlace. En un tetraedro perfecto, los átomos formarían un ángulo de 109,5°, pero la repulsión entre los pares libres es mayor que la repulsión entre los átomos de hidrógeno. [89] [90] La longitud del enlace O – H es de aproximadamente 0,096 nm. [91]
Otras sustancias tienen una estructura molecular tetraédrica, por ejemplo, el metano ( CH
4) y sulfuro de hidrógeno ( H
2S ). Sin embargo, el oxígeno es más electronegativo que la mayoría de los otros elementos, por lo que el átomo de oxígeno retiene una carga negativa mientras que los átomos de hidrógeno están cargados positivamente. Junto con la estructura curvada, esto le da a la molécula un momento dipolar eléctrico y se clasifica como molécula polar . [92]
El agua es un buen disolvente polar , que disuelve muchas sales y moléculas orgánicas hidrófilas como azúcares y alcoholes simples como el etanol . El agua también disuelve muchos gases, como el oxígeno y el dióxido de carbono ; este último produce las burbujas de las bebidas carbonatadas , los vinos espumosos y las cervezas. Además, muchas sustancias de los organismos vivos, como las proteínas , el ADN y los polisacáridos , se disuelven en agua. Las interacciones entre el agua y las subunidades de estas biomacromoléculas dan forma al plegamiento de proteínas , al emparejamiento de bases del ADN y a otros fenómenos cruciales para la vida ( efecto hidrofóbico ).
Muchas sustancias orgánicas (como las grasas, los aceites y los alcanos ) son hidrófobas , es decir, insolubles en agua. Muchas sustancias inorgánicas también son insolubles, incluidos la mayoría de los óxidos , sulfuros y silicatos de metales .

Debido a su polaridad, una molécula de agua en estado líquido o sólido puede formar hasta cuatro enlaces de hidrógeno con moléculas vecinas. Los enlaces de hidrógeno son aproximadamente diez veces más fuertes que la fuerza de Van der Waals que atrae las moléculas entre sí en la mayoría de los líquidos. Esta es la razón por la que los puntos de fusión y ebullición del agua son mucho más altos que los de otros compuestos análogos como el sulfuro de hidrógeno. También explican su capacidad calorífica específica excepcionalmente alta (aproximadamente 4,2 J /(g·K)), calor de fusión (aproximadamente 333 J/g), calor de vaporización ( 2257 J/g ) y conductividad térmica (entre 0,561 y 0,679). W/(m·K)). Estas propiedades hacen que el agua sea más eficaz para moderar el clima de la Tierra , al almacenar calor y transportarlo entre los océanos y la atmósfera. Los enlaces de hidrógeno del agua son de alrededor de 23 kJ/mol (en comparación con un enlace OH covalente de 492 kJ/mol). De esto, se estima que el 90% es atribuible a la electrostática, mientras que el 10% restante es parcialmente covalente. [93]
Estos enlaces son la causa de la alta tensión superficial del agua [94] y de las fuerzas capilares. La acción capilar se refiere a la tendencia del agua a subir por un tubo estrecho contra la fuerza de la gravedad . Todas las plantas vasculares , como los árboles, confían en esta propiedad . [ cita necesaria ]

El agua es una solución débil de hidróxido de hidronio; hay un equilibrio 2H
2O ⇌ H
3oh+
+ OH−
, en combinación con solvatación de los iones hidronio e hidróxido resultantes .
El agua pura tiene una baja conductividad eléctrica , que aumenta con la disolución de una pequeña cantidad de material iónico como la sal común .
El agua líquida se puede dividir en los elementos hidrógeno y oxígeno haciendo pasar una corriente eléctrica a través de ella, un proceso llamado electrólisis . La descomposición requiere más aporte de energía que el calor liberado por el proceso inverso (285,8 kJ/ mol , o 15,9 MJ/kg). [96]
Se puede suponer que el agua líquida es incompresible para la mayoría de los fines: su compresibilidad oscila entre 4,4 y5,1 × 10 −10 Pa −1 en condiciones normales. [97] Incluso en océanos a 4 km de profundidad, donde la presión es de 400 atm, el agua sufre sólo una disminución de volumen del 1,8%. [98]
La viscosidad del agua es de aproximadamente 10 −3 Pa· s o 0,01 poise a 20 °C (68 °F), y la velocidad del sonido en agua líquida oscila entre 1.400 y 1.540 metros por segundo (4.600 y 5.100 pies/s) dependiendo sobre la temperatura. El sonido viaja largas distancias en el agua con poca atenuación , especialmente en bajas frecuencias (aproximadamente 0,03 dB /km para 1 kHz ), una propiedad que aprovechan los cetáceos y los humanos para la comunicación y la detección del entorno ( sonar ). [99]
Los elementos metálicos que son más electropositivos que el hidrógeno, particularmente los metales alcalinos y alcalinotérreos como el litio , el sodio , el calcio , el potasio y el cesio , desplazan el hidrógeno del agua, formando hidróxidos y liberando hidrógeno. A altas temperaturas, el carbono reacciona con el vapor para formar monóxido de carbono e hidrógeno. [ cita necesaria ]
La hidrología es el estudio del movimiento, distribución y calidad del agua en toda la Tierra. El estudio de la distribución del agua es la hidrografía . El estudio de la distribución y movimiento de las aguas subterráneas es la hidrogeología , de los glaciares es la glaciología , de las aguas continentales es la limnología y la distribución de los océanos es la oceanografía . Los procesos ecológicos con hidrología están en el foco de la ecohidrología .
La masa colectiva de agua que se encuentra sobre, debajo y sobre la superficie de un planeta se llama hidrosfera . El volumen de agua aproximado de la Tierra (el suministro total de agua del mundo) es de 1.386 millones de kilómetros cúbicos (333 millones de millas cúbicas). [23]
El agua líquida se encuentra en cuerpos de agua , como un océano, mar, lago, río, arroyo, canal , estanque o charco . La mayor parte del agua de la Tierra es agua de mar . El agua también está presente en la atmósfera en estado sólido, líquido y vapor. También existe como agua subterránea en acuíferos .
El agua es importante en muchos procesos geológicos. El agua subterránea está presente en la mayoría de las rocas y la presión de esta agua subterránea afecta los patrones de fallas . El agua del manto es responsable del deshielo que produce los volcanes en las zonas de subducción . En la superficie de la Tierra, el agua es importante en los procesos de meteorización tanto química como física . El agua y, en menor medida, pero aún significativa, el hielo, también son responsables de una gran cantidad de transporte de sedimentos que se produce en la superficie de la Tierra. La deposición de sedimentos transportados forma muchos tipos de rocas sedimentarias , que constituyen el registro geológico de la historia de la Tierra .

El ciclo del agua (conocido científicamente como ciclo hidrológico) es el intercambio continuo de agua dentro de la hidrosfera , entre la atmósfera , el agua del suelo , el agua superficial , el agua subterránea y las plantas.
El agua se mueve perpetuamente a través de cada una de estas regiones en el ciclo del agua que consta de los siguientes procesos de transferencia:
La mayoría del vapor de agua que se encuentra principalmente en el océano regresa a él, pero los vientos transportan vapor de agua sobre la tierra al mismo ritmo que la escorrentía hacia el mar, alrededor de 47 Tt por año, mientras que la evaporación y la transpiración que ocurren en las masas terrestres también contribuyen con otras 72 Tt por año. La precipitación, a una tasa de 119 Tt por año sobre la tierra, tiene varias formas: más comúnmente lluvia, nieve y granizo , con alguna contribución de la niebla y el rocío . [100] El rocío son pequeñas gotas de agua que se condensan cuando una alta densidad de vapor de agua se encuentra con una superficie fría. El rocío suele formarse por la mañana cuando la temperatura es más baja, justo antes del amanecer y cuando la temperatura de la superficie terrestre comienza a aumentar. [101] El agua condensada en el aire también puede refractar la luz solar para producir arcoíris .
El agua de escorrentía a menudo se acumula sobre las cuencas que desembocan en los ríos. A través de la erosión , la escorrentía da forma al medio ambiente creando valles fluviales y deltas que proporcionan suelo rico y terreno llano para el establecimiento de centros de población. Una inundación ocurre cuando un área de tierra, generalmente baja, se cubre de agua, lo que ocurre cuando un río se desborda de sus orillas o se produce una marejada ciclónica. Por otro lado, la sequía es un período prolongado de meses o años en el que una región nota una deficiencia en su suministro de agua. Esto ocurre cuando una región recibe consistentemente precipitaciones por debajo del promedio ya sea debido a su topografía o a su ubicación en términos de latitud .
Los recursos hídricos son recursos naturales de agua que son potencialmente útiles para los humanos, [102] por ejemplo como fuente de suministro de agua potable o agua de riego . El agua se presenta tanto en "existencias" como en "flujos". El agua se puede almacenar en forma de lagos, vapor de agua, aguas subterráneas o acuíferos, hielo y nieve. Del volumen total de agua dulce mundial, se estima que el 69 por ciento está almacenado en glaciares y capas de nieve permanente; el 30 por ciento está en aguas subterráneas; y el 1 por ciento restante en lagos, ríos, la atmósfera y la biota. [103] El tiempo que el agua permanece almacenada es muy variable: algunos acuíferos consisten en agua almacenada durante miles de años, pero el volumen de los lagos puede fluctuar según las estaciones, disminuyendo durante los períodos secos y aumentando durante los húmedos. Una fracción sustancial del suministro de agua de algunas regiones consiste en agua extraída del agua almacenada en reservas, y cuando las extracciones superan la recarga, las reservas disminuyen. Según algunas estimaciones, hasta el 30 por ciento del agua total utilizada para riego proviene de extracciones insostenibles de agua subterránea, lo que provoca su agotamiento . [104]
El agua de mar contiene aproximadamente un 3,5% de cloruro de sodio en promedio, además de cantidades menores de otras sustancias. Las propiedades físicas del agua de mar difieren de las del agua dulce en algunos aspectos importantes. Se congela a una temperatura más baja (aproximadamente -1,9 °C (28,6 °F)) y su densidad aumenta al disminuir la temperatura hasta el punto de congelación, en lugar de alcanzar la densidad máxima a una temperatura por encima del punto de congelación. La salinidad del agua en los mares principales varía desde aproximadamente el 0,7% en el Mar Báltico hasta el 4,0% en el Mar Rojo . (El Mar Muerto , conocido por sus niveles ultra altos de salinidad, de entre el 30 y el 40 %, es en realidad un lago salado ).
Las mareas son el ascenso y descenso cíclico del nivel del mar local causado por las fuerzas de marea de la Luna y el Sol que actúan sobre los océanos. Las mareas provocan cambios en la profundidad de los cuerpos de agua marinos y estuarinos y producen corrientes oscilantes conocidas como corrientes de marea. El cambio de marea producido en un lugar determinado es el resultado de las posiciones cambiantes de la Luna y el Sol en relación con la Tierra, junto con los efectos de la rotación de la Tierra y la batimetría local . La franja de costa que queda sumergida durante la marea alta y expuesta durante la marea baja, la zona intermareal , es un importante producto ecológico de las mareas oceánicas.

Desde un punto de vista biológico , el agua tiene muchas propiedades distintas que son críticas para la proliferación de la vida. Lleva a cabo esta función al permitir que los compuestos orgánicos reaccionen de manera que, en última instancia, permitan la replicación . Todas las formas de vida conocidas dependen del agua. El agua es vital como disolvente en el que se disuelven muchos de los solutos del cuerpo y como parte esencial de muchos procesos metabólicos dentro del cuerpo. El metabolismo es la suma total del anabolismo y el catabolismo . En el anabolismo, se elimina agua de las moléculas (a través de energía que requiere reacciones químicas enzimáticas) para hacer crecer moléculas más grandes (p. ej., almidones, triglicéridos y proteínas para el almacenamiento de combustibles e información). En el catabolismo, el agua se utiliza para romper enlaces con el fin de generar moléculas más pequeñas (p. ej., glucosa, ácidos grasos y aminoácidos que se utilizarán como combustibles para uso energético u otros fines). Sin agua, estos procesos metabólicos particulares no podrían existir.
El agua es fundamental tanto para la fotosíntesis como para la respiración. Las células fotosintéticas utilizan la energía del sol para separar el hidrógeno del agua del oxígeno. [105] En presencia de luz solar, el hidrógeno se combina con CO
2(absorbido del aire o del agua) para formar glucosa y liberar oxígeno. [106] Todas las células vivas utilizan dichos combustibles y oxidan el hidrógeno y el carbono para capturar la energía del sol y reformar el agua y el CO.
2en el proceso (respiración celular).
El agua también es fundamental para la neutralidad ácido-base y la función enzimática. Un ácido, un ion hidrógeno ( H+
, es decir, un donante de protones, puede neutralizarse mediante una base, un aceptor de protones como un ion hidróxido ( OH−
) para formar agua. El agua se considera neutra, con un pH (el logaritmo negativo de la concentración de iones de hidrógeno) de 7. Los ácidos tienen valores de pH inferiores a 7, mientras que las bases tienen valores superiores a 7.
Las aguas superficiales de la Tierra están llenas de vida. Las primeras formas de vida aparecieron en el agua; Casi todos los peces viven exclusivamente en el agua y hay muchos tipos de mamíferos marinos, como los delfines y las ballenas. Algunos tipos de animales, como los anfibios , pasan partes de su vida en el agua y otras en la tierra. Plantas como las algas marinas y las algas crecen en el agua y son la base de algunos ecosistemas submarinos. El plancton es generalmente la base de la cadena alimentaria oceánica .
Los vertebrados acuáticos deben obtener oxígeno para sobrevivir y lo hacen de diversas formas. Los peces tienen branquias en lugar de pulmones , aunque algunas especies de peces, como el pez pulmonado , tienen ambos. Los mamíferos marinos , como los delfines, las ballenas, las nutrias y las focas , necesitan salir a la superficie periódicamente para respirar aire. Algunos anfibios pueden absorber oxígeno a través de la piel. Los invertebrados exhiben una amplia gama de modificaciones para sobrevivir en aguas poco oxigenadas, incluidos tubos respiratorios (ver sifones de insectos y moluscos ) y branquias ( Carcinus ). Sin embargo, como la vida de los invertebrados evolucionó en un hábitat acuático, la mayoría tiene poca o ninguna especialización para la respiración en el agua.

Históricamente, la civilización ha florecido alrededor de ríos y vías fluviales importantes; Mesopotamia , una de las llamadas cunas de la civilización , estaba situada entre los principales ríos Tigris y Éufrates ; la antigua sociedad de los egipcios dependía enteramente del Nilo . La civilización temprana del valle del Indo ( c. 3300 a. C. – c. 1300 a. C. ) se desarrolló a lo largo del río Indo y los afluentes que fluían desde el Himalaya . Roma también fue fundada a orillas del río italiano Tíber . Las grandes metrópolis como Rotterdam , Londres , Montreal , París , Nueva York , Buenos Aires , Shanghai , Tokio , Chicago y Hong Kong deben su éxito en parte a su fácil acceso a través del agua y a la consiguiente expansión del comercio. Las islas con puertos de aguas seguras, como Singapur , han florecido por la misma razón. En lugares como el norte de África y Oriente Medio, donde el agua es más escasa, el acceso al agua potable fue y es un factor importante para el desarrollo humano.

El agua apta para el consumo humano se denomina agua potable o agua potable. El agua que no es potable puede hacerse potable mediante filtración o destilación , o mediante una variedad de otros métodos . Más de 660 millones de personas no tienen acceso a agua potable. [107] [108]
El agua que no es apta para beber pero que no es dañina para los humanos cuando se usa para nadar o bañarse recibe varios nombres además de agua potable o potable, y a veces se la llama agua segura o "segura para bañarse". El cloro es un irritante de la piel y las membranas mucosas que se utiliza para hacer que el agua sea segura para bañarse o beber. Su uso es altamente técnico y generalmente está controlado por regulaciones gubernamentales (normalmente 1 parte por millón (ppm) para el agua potable y 1 a 2 ppm de cloro que aún no ha reaccionado con las impurezas para el agua de baño). El agua para bañarse puede mantenerse en condiciones microbiológicas satisfactorias utilizando desinfectantes químicos como cloro u ozono o mediante el uso de luz ultravioleta .
La recuperación de agua es el proceso de convertir aguas residuales (más comúnmente aguas residuales , también llamadas aguas residuales municipales) en agua que puede reutilizarse para otros fines. Hay 2.300 millones de personas que residen en países con escasez de agua, lo que significa que cada individuo recibe menos de 1.700 metros cúbicos (60.000 pies cúbicos) de agua al año. Cada año se producen en todo el mundo 380 mil millones de metros cúbicos (13 × 10 12 pies cúbicos) de aguas residuales municipales. [109] [110] [111]
El agua dulce es un recurso renovable, recirculado por el ciclo hidrológico natural , pero las presiones sobre el acceso a ella resultan de la distribución naturalmente desigual en el espacio y el tiempo, las crecientes demandas económicas de la agricultura y la industria y el aumento de las poblaciones. Actualmente, casi mil millones de personas en todo el mundo carecen de acceso a agua segura y asequible. En el año 2000, las Naciones Unidas establecieron los Objetivos de Desarrollo del Milenio en materia de agua para reducir a la mitad para 2015 la proporción de personas en todo el mundo sin acceso a agua potable y saneamiento . El progreso hacia ese objetivo fue desigual, y en 2015 la ONU se comprometió con los Objetivos de Desarrollo Sostenible de lograr el acceso universal al agua y al saneamiento seguros y asequibles para 2030. La mala calidad del agua y el mal saneamiento son mortales; Unos cinco millones de muertes al año son causadas por enfermedades relacionadas con el agua. La Organización Mundial de la Salud estima que el agua potable podría prevenir 1,4 millones de muertes infantiles por diarrea cada año. [112]
En los países en desarrollo, el 90% de todas las aguas residuales municipales todavía van sin tratamiento a los ríos y arroyos locales. [113] Unos 50 países, con aproximadamente un tercio de la población mundial, también sufren una escasez de agua media o alta y 17 de ellos extraen anualmente más agua de la que recargan a través de sus ciclos naturales del agua. [114] La cepa no solo afecta a los cuerpos de agua dulce superficiales como ríos y lagos, sino que también degrada los recursos de agua subterránea.

El uso humano más importante del agua es la agricultura, incluida la agricultura de regadío, que representa entre el 80 y el 90 por ciento del consumo humano total de agua. [116] En los Estados Unidos, el 42% del agua dulce extraída para su uso se destina al riego, pero la gran mayoría del agua "consumida" (utilizada y no devuelta al medio ambiente) se destina a la agricultura. [117]
El acceso al agua dulce a menudo se da por sentado, especialmente en los países desarrollados que han construido sistemas hídricos sofisticados para recolectar, purificar y distribuir agua, y eliminar las aguas residuales. Pero las crecientes presiones económicas, demográficas y climáticas están aumentando la preocupación por los problemas del agua, lo que lleva a una mayor competencia por los recursos hídricos fijos, dando lugar al concepto de pico de agua . [118] A medida que las poblaciones y las economías continúan creciendo, se expande el consumo de carne sedienta de agua y aumentan las nuevas demandas de biocombustibles o nuevas industrias con uso intensivo de agua, es probable que surjan nuevos desafíos relacionados con el agua. [119]
En 2007, el Instituto Internacional de Gestión del Agua de Sri Lanka llevó a cabo una evaluación de la gestión del agua en la agricultura para ver si el mundo tenía suficiente agua para proporcionar alimentos a su creciente población. [120] Evaluó la disponibilidad actual de agua para la agricultura a escala global y trazó un mapa de lugares que sufren escasez de agua. Encontró que una quinta parte de la población mundial, más de 1.200 millones, vive en zonas de escasez física de agua , donde no hay suficiente agua para satisfacer todas las demandas. Otros 1.600 millones de personas viven en zonas que experimentan escasez económica de agua , donde la falta de inversión en agua o la insuficiente capacidad humana hacen imposible que las autoridades satisfagan la demanda de agua. El informe encontró que sería posible producir los alimentos necesarios en el futuro, pero que la continuación de la producción de alimentos y las tendencias ambientales actuales conducirían a crisis en muchas partes del mundo. Para evitar una crisis mundial del agua, los agricultores tendrán que esforzarse por aumentar la productividad para satisfacer la creciente demanda de alimentos, mientras que las industrias y las ciudades encuentran formas de utilizar el agua de manera más eficiente. [121]
La escasez de agua también se debe a la producción de productos que consumen mucha agua. Por ejemplo, algodón : 1 kg de algodón, equivalente a un par de jeans, requiere 10,9 metros cúbicos (380 pies cúbicos) de agua para su producción. Si bien el algodón representa el 2,4% del uso mundial de agua, el agua se consume en regiones que ya corren el riesgo de sufrir escasez de agua. Se han causado importantes daños medioambientales: por ejemplo, la desviación de agua por parte de la antigua Unión Soviética de los ríos Amu Darya y Syr Darya para producir algodón fue en gran medida responsable de la desaparición del mar de Aral . [122]
El 7 de abril de 1795, el gramo fue definido en Francia como igual al "peso absoluto de un volumen de agua pura igual a un cubo de una centésima de metro, y a la temperatura del hielo derretido". [123] Sin embargo, para fines prácticos, se necesitaba un estándar de referencia metálico, mil veces más masivo, el kilogramo. Por ello se encargó trabajar para determinar con precisión la masa de un litro de agua. A pesar de que la definición decretada del gramo especificaba agua a 0 °C (32 °F), una temperatura altamente reproducible , los científicos optaron por redefinir el estándar y realizar sus mediciones a la temperatura de mayor densidad del agua , lo que en ese momento se midió como 4 °C (39 °F). [124]
La escala de temperatura Kelvin del sistema SI se basó en el punto triple del agua, definido como exactamente 273,16 K (0,01 °C; 32,02 °F), pero a partir de mayo de 2019 se basa en la constante de Boltzmann . La escala es una escala de temperatura absoluta con el mismo incremento que la escala de temperatura Celsius, que originalmente se definió según el punto de ebullición (establecido en 100 °C (212 °F)) y el punto de fusión (establecido en 0 °C (32 °F). F)) de agua.
El agua natural se compone principalmente de los isótopos hidrógeno-1 y oxígeno-16, pero también hay una pequeña cantidad de isótopos más pesados oxígeno-18, oxígeno-17 e hidrógeno-2 ( deuterio ). El porcentaje de isótopos más pesados es muy pequeño, pero aún afecta las propiedades del agua. El agua de ríos y lagos tiende a contener isótopos menos pesados que el agua de mar. Por lo tanto, el agua estándar se define en la especificación de Viena sobre el agua media estándar del océano .



El cuerpo humano contiene entre un 55% y un 78% de agua, según el tamaño del cuerpo. [125] [¿ fuente generada por el usuario? ] Para funcionar correctamente, el cuerpo requiere entre uno y siete litros (0,22 y 1,54 imp gal; 0,26 y 1,85 gal EE.UU.) [ cita necesaria ] de agua por día para evitar la deshidratación ; la cantidad precisa depende del nivel de actividad, temperatura, humedad y otros factores. La mayor parte se ingiere a través de alimentos o bebidas distintas al agua pura. No está claro cuánta ingesta de agua necesitan las personas sanas, aunque la Asociación Dietética Británica aconseja que 2,5 litros de agua total al día es el mínimo para mantener una hidratación adecuada, incluidos 1,8 litros (6 a 7 vasos) obtenidos directamente de las bebidas. [126] La literatura médica favorece un consumo menor, típicamente 1 litro de agua para un hombre promedio, excluyendo las necesidades adicionales debido a la pérdida de líquidos debido al ejercicio o al clima cálido. [127]
Los riñones sanos pueden excretar de 0,8 a 1 litro de agua por hora, pero el estrés como el ejercicio puede reducir esta cantidad. Las personas pueden beber mucha más agua de la necesaria mientras hacen ejercicio, lo que las pone en riesgo de sufrir una intoxicación por agua (hiperhidratación), que puede ser mortal. [128] [129] La afirmación popular de que "una persona debe consumir ocho vasos de agua por día" parece no tener una base científica real. [130] Los estudios han demostrado que la ingesta adicional de agua, especialmente hasta 500 mililitros (18 imp fl oz; 17 US fl oz) a la hora de comer, se asoció con la pérdida de peso. [131] [132] [133] [134] [135] [136] La ingesta adecuada de líquidos es útil para prevenir el estreñimiento. [137]

Una recomendación original para la ingesta de agua en 1945 por la Junta de Alimentos y Nutrición del Consejo Nacional de Investigación de EE.UU. decía: "Un estándar ordinario para diversas personas es 1 mililitro por cada caloría de alimento. La mayor parte de esta cantidad está contenida en alimentos preparados". [138] El último informe de ingesta dietética de referencia del Consejo Nacional de Investigación de EE. UU. recomienda en general, según la mediana de la ingesta total de agua de los datos de una encuesta de EE. UU. (incluidas las fuentes de alimentos): 3,7 litros (0,81 imp gal; 0,98 gal EE.UU.) para hombres y 2,7 litros (0,59 imp gal; 0,71 gal EE.UU.) de agua en total para las mujeres, teniendo en cuenta que el agua contenida en los alimentos proporcionó aproximadamente el 19% de la ingesta total de agua en la encuesta. [139]
Específicamente, las mujeres embarazadas y lactantes necesitan líquidos adicionales para mantenerse hidratadas. El Instituto de Medicina de EE. UU . recomienda que, en promedio, los hombres consuman 3 litros (0,66 gal imp; 0,79 gal EE. UU.) y las mujeres 2,2 litros (0,48 gal imp; 0,58 gal EE. UU.); las mujeres embarazadas deben aumentar la ingesta a 2,4 litros (0,53 imp gal; 0,63 gal EE.UU.) y las mujeres que amamantan deben consumir 3 litros (12 tazas), ya que durante la lactancia se pierde una cantidad especialmente grande de líquido. [140] También se observa que normalmente, alrededor del 20% de la ingesta de agua proviene de los alimentos, mientras que el resto proviene del agua potable y bebidas ( con cafeína incluida). El agua se excreta del cuerpo en múltiples formas; a través de la orina y las heces , a través del sudor y por la exhalación de vapor de agua en el aliento. Con el esfuerzo físico y la exposición al calor, la pérdida de agua aumentará y también pueden aumentar las necesidades diarias de líquidos.
Los humanos necesitamos agua con pocas impurezas. Las impurezas comunes incluyen sales y óxidos metálicos, incluidos cobre, hierro, calcio y plomo, [141] [ cita completa necesaria ] y bacterias dañinas, como Vibrio . Algunos solutos son aceptables e incluso deseables para mejorar el sabor y proporcionar los electrolitos necesarios . [142]
El recurso de agua dulce más grande (en volumen) apto para beber es el lago Baikal en Siberia. [143]

El lavado es un método de limpieza , generalmente con agua y jabón o detergente . Lavar y luego enjuagar tanto el cuerpo como la ropa es una parte esencial de una buena higiene y salud. [ cita necesaria ]
A menudo la gente usa jabones y detergentes para ayudar a emulsionar los aceites y las partículas de suciedad para poder eliminarlos con el lavado. El jabón se puede aplicar directamente o con ayuda de una toallita .
Las personas se lavan o bañan periódicamente con fines rituales religiosos o terapéuticos [144] o como actividad recreativa.
En Europa , algunas personas utilizan un bidé para lavarse los genitales externos y la región anal después de ir al baño , en lugar de utilizar papel higiénico . [145] El bidé es común en países predominantemente católicos donde el agua se considera esencial para la limpieza anal . [146]
Es más frecuente lavarse sólo las manos , por ejemplo, antes y después de preparar alimentos y comer, después de ir al baño, después de manipular algo sucio, etc. Lavarse las manos es importante para reducir la propagación de gérmenes . [147] [148] También es común lavarse la cara, que se hace después de despertarse, o para mantenerse fresco durante el día. Cepillarse los dientes también es fundamental para la higiene y forma parte del lavado.
'Lavado' también puede referirse al lavado de ropa u otros artículos de tela, como sábanas, ya sea a mano o con lavadora . También puede referirse a lavar el auto , enjabonando el exterior con jabón para autos y luego enjuagándolo con una manguera, o lavando utensilios de cocina .

El transporte marítimo (o transporte oceánico) o, más generalmente, el transporte acuático, es el transporte de personas ( pasajeros ) o mercancías ( carga ) a través de vías navegables . El transporte de mercancías por mar ha sido ampliamente utilizado a lo largo de la historia . La llegada de la aviación ha disminuido la importancia de los viajes por mar para los pasajeros, aunque sigue siendo popular para viajes cortos y cruceros de placer . El transporte por agua es más barato que el transporte por aire o por tierra, [151] pero significativamente más lento para distancias más largas. El transporte marítimo representa aproximadamente el 80% del comercio internacional , según la UNCTAD en 2020.
El transporte marítimo se puede realizar a cualquier distancia en barco, barco, velero o barcaza , a través de océanos y lagos, a través de canales o a lo largo de ríos. El envío puede tener fines comerciales , recreativos o militares . Si bien el transporte marítimo interior extensivo es menos crítico hoy en día, las principales vías navegables del mundo, incluidos muchos canales, siguen siendo muy importantes y son partes integrales de las economías mundiales . En particular, especialmente cualquier material puede ser movido por agua; sin embargo, el transporte por agua se vuelve poco práctico cuando la entrega de materiales es crítica en términos de tiempo , como varios tipos de productos perecederos . Aun así, el transporte acuático es muy rentable con cargas regulares programables, como el transporte transoceánico de productos de consumo, y especialmente para cargas pesadas o a granel , como carbón , coque , minerales o cereales . Podría decirse que la revolución industrial tuvo sus primeros impactos cuando el transporte acuático barato por canales, la navegación o el transporte marítimo en todo tipo de embarcaciones por vías navegables naturales respaldaron el transporte a granel rentable .
La contenerización revolucionó el transporte marítimo a partir de los años 1970. La "carga general" incluye mercancías empaquetadas en cajas, estuches, paletas y barriles. Cuando una carga se transporta en más de un modo, se trata de intermodal o comodal .El agua se utiliza ampliamente en reacciones químicas como disolvente o reactivo y, con menos frecuencia, como soluto o catalizador. En las reacciones inorgánicas, el agua es un disolvente común, que disuelve muchos compuestos iónicos, así como otros compuestos polares como el amoníaco y compuestos estrechamente relacionados con el agua . En reacciones orgánicas no se suele utilizar como disolvente de reacción, porque no disuelve bien los reactivos y es anfótero (ácido y básico) y nucleófilo . Sin embargo, estas propiedades son a veces deseables. Además, se ha observado la aceleración de las reacciones de Diels-Alder por el agua. El agua supercrítica ha sido recientemente un tema de investigación. El agua supercrítica saturada de oxígeno quema eficazmente los contaminantes orgánicos.
El agua y el vapor son un fluido habitual utilizado para el intercambio de calor , debido a su disponibilidad y alta capacidad calorífica , tanto para refrigeración como para calefacción. Incluso puede haber agua fría disponible de forma natural en un lago o en el mar. Es especialmente eficaz para transportar calor mediante vaporización y condensación de agua debido a su gran calor latente de vaporización . Una desventaja es que los metales que se encuentran comúnmente en industrias como el acero y el cobre se oxidan más rápido con agua y vapor sin tratar. En casi todas las centrales térmicas , el agua se utiliza como fluido de trabajo (utilizado en un circuito cerrado entre la caldera, la turbina de vapor y el condensador) y como refrigerante (utilizado para intercambiar el calor residual a una masa de agua o transportarlo por evaporación en una torre de enfriamiento ). En los Estados Unidos, la refrigeración de las centrales eléctricas es el mayor uso de agua. [152]
En la industria de la energía nuclear , el agua también se puede utilizar como moderador de neutrones . En la mayoría de los reactores nucleares , el agua es a la vez refrigerante y moderador. Esto proporciona una especie de medida de seguridad pasiva, ya que eliminar el agua del reactor también ralentiza la reacción nuclear . Sin embargo, se prefieren otros métodos para detener una reacción y se prefiere mantener el núcleo nuclear cubierto con agua para asegurar un enfriamiento adecuado.

El agua tiene un alto calor de vaporización y es relativamente inerte, lo que la convierte en un buen fluido extintor de incendios . La evaporación del agua aleja el calor del fuego. Es peligroso usar agua en incendios que involucran aceites y solventes orgánicos porque muchos materiales orgánicos flotan en el agua y el agua tiende a esparcir el líquido ardiendo.
El uso de agua en la lucha contra incendios también debe tener en cuenta los peligros de una explosión de vapor , que puede ocurrir cuando se utiliza agua en incendios muy calientes en espacios confinados, y de una explosión de hidrógeno, cuando sustancias que reaccionan con el agua, como ciertos metales. o carbón caliente como carbón, carbón vegetal o grafito de coque , descomponen el agua, produciendo gas de agua .
La potencia de este tipo de explosiones quedó patente en el desastre de Chernóbil , aunque el agua implicada en este caso no procedía de los medios de extinción de incendios sino del propio sistema de refrigeración por agua del reactor. Se produjo una explosión de vapor cuando el sobrecalentamiento extremo del núcleo provocó que el agua se convirtiera en vapor. Es posible que se haya producido una explosión de hidrógeno como resultado de una reacción entre vapor y circonio caliente .
Algunos óxidos metálicos, sobre todo los de los metales alcalinos y alcalinotérreos , producen tanto calor al reaccionar con el agua que puede producirse un riesgo de incendio. La cal viva de óxido alcalinotérreo , también conocida como óxido de calcio, es una sustancia producida en masa que a menudo se transporta en bolsas de papel. Si se empapan, pueden inflamarse ya que su contenido reacciona con el agua. [153]

Los seres humanos utilizamos el agua para muchos fines recreativos, así como para hacer ejercicio y practicar deportes. Algunos de ellos incluyen natación, esquí acuático , paseos en bote , surf y buceo . Además, algunos deportes, como el hockey sobre hielo y el patinaje sobre hielo , se practican sobre hielo. Las orillas de los lagos, las playas y los parques acuáticos son lugares populares para que la gente vaya a relajarse y disfrutar de la recreación. Muchos encuentran calmantes el sonido y la apariencia del agua que fluye, y las fuentes y otras estructuras de agua que fluye son decoraciones populares. Algunos mantienen peces y otra flora y fauna dentro de acuarios o estanques para espectáculo, diversión y compañía. Los seres humanos también utilizan el agua para practicar deportes de nieve como esquí , trineos , motos de nieve o snowboard , que requieren que el agua esté a baja temperatura, ya sea en forma de hielo o cristalizada en nieve .
La industria del agua proporciona servicios de agua potable y aguas residuales (incluido el tratamiento de aguas residuales ) a los hogares y la industria. Las instalaciones de suministro de agua incluyen pozos de agua , cisternas para la recolección de agua de lluvia , redes de suministro de agua e instalaciones de purificación de agua , tanques de agua , torres de agua y tuberías de agua, incluidos los antiguos acueductos . Se están desarrollando generadores de agua atmosférica .
El agua potable a menudo se recolecta en manantiales , se extrae de perforaciones artificiales (pozos) en el suelo o se bombea desde lagos y ríos. Por lo tanto, construir más pozos en lugares adecuados es una forma posible de producir más agua, suponiendo que los acuíferos puedan suministrar un flujo adecuado. Otras fuentes de agua incluyen la recolección de agua de lluvia. El agua puede requerir purificación para consumo humano. Esto puede implicar la eliminación de sustancias no disueltas, sustancias disueltas y microbios nocivos . Los métodos populares son filtrar con arena, que solo elimina el material no disuelto, mientras que la cloración y la ebullición matan los microbios dañinos. La destilación realiza las tres funciones. Existen técnicas más avanzadas, como la ósmosis inversa . La desalinización de abundante agua de mar es una solución más costosa utilizada en climas áridos costeros .
La distribución de agua potable se realiza a través de sistemas municipales de agua , entrega en camiones cisterna o agua embotellada . Los gobiernos de muchos países tienen programas para distribuir agua a los necesitados sin costo alguno.
Otra opción es reducir el uso utilizando agua potable (potable) sólo para consumo humano. En algunas ciudades como Hong Kong, el agua de mar se utiliza ampliamente para tirar de la cadena de los inodoros de toda la ciudad con el fin de conservar los recursos de agua dulce .
La contaminación del agua puede ser el mayor uso indebido del agua; en la medida en que un contaminante limita otros usos del agua, se convierte en un desperdicio del recurso, independientemente de los beneficios para quien contamina. Al igual que otros tipos de contaminación, ésta no entra en la contabilidad estándar de los costos de mercado, ya que se concibe como externalidades que el mercado no puede tomar en cuenta. Así, otras personas pagan el precio de la contaminación del agua, mientras que los beneficios de las empresas privadas no se redistribuyen entre la población local, víctima de esta contaminación. Los productos farmacéuticos consumidos por los humanos a menudo terminan en los cursos de agua y pueden tener efectos perjudiciales para la vida acuática si se bioacumulan y no son biodegradables .
Las aguas residuales municipales e industriales normalmente se tratan en plantas de tratamiento de aguas residuales . La mitigación de la escorrentía superficial contaminada se aborda mediante una variedad de técnicas de prevención y tratamiento .
Muchos procesos industriales dependen de reacciones que utilizan productos químicos disueltos en agua, suspensión de sólidos en lodos de agua o el uso de agua para disolver y extraer sustancias, o para lavar productos o equipos de proceso. Procesos como la minería , la fabricación de pulpa química , el blanqueo de pulpa, la fabricación de papel , la producción textil, el teñido, la impresión y el enfriamiento de plantas de energía utilizan grandes cantidades de agua, requieren una fuente de agua dedicada y, a menudo, causan una contaminación significativa del agua.
El agua se utiliza en la generación de energía . La hidroelectricidad es la electricidad obtenida a partir de energía hidroeléctrica . La energía hidroeléctrica proviene del agua que impulsa una turbina hidráulica conectada a un generador. La hidroelectricidad es una fuente de energía renovable, no contaminante y de bajo coste. La energía es suministrada por el movimiento del agua. Normalmente se construye una presa en un río, creando un lago artificial detrás de él. El agua que sale del lago pasa por turbinas que hacen girar generadores.
El agua a presión se utiliza en la limpieza con chorro de agua y en las cortadoras por chorro de agua . Se utilizan pistolas de agua a alta presión para realizar cortes precisos. Funciona muy bien, es relativamente seguro y no es perjudicial para el medio ambiente. También se utiliza en el enfriamiento de maquinaria para evitar el sobrecalentamiento o evitar que las hojas de sierra se sobrecalienten.
El agua también se utiliza en muchos procesos y máquinas industriales, como la turbina de vapor y el intercambiador de calor , además de su uso como disolvente químico . El vertido de agua no tratada procedente de usos industriales es contaminación . La contaminación incluye solutos vertidos (contaminación química) y agua refrigerante vertida ( contaminación térmica ). La industria requiere agua pura para muchas aplicaciones y utiliza una variedad de técnicas de purificación tanto en el suministro como en la descarga de agua.


Hervir , cocinar al vapor y hervir a fuego lento son métodos de cocción populares que a menudo requieren sumergir los alimentos en agua o en su estado gaseoso, el vapor. [154] El agua también se utiliza para lavar platos . El agua también desempeña muchas funciones críticas en el campo de la ciencia de los alimentos .
Los solutos como las sales y los azúcares que se encuentran en el agua afectan las propiedades físicas del agua. Los puntos de ebullición y congelación del agua se ven afectados por los solutos, así como por la presión del aire , que a su vez se ve afectada por la altitud. El agua hierve a temperaturas más bajas con la menor presión del aire que se produce en elevaciones más altas. Un mol de sacarosa (azúcar) por kilogramo de agua aumenta el punto de ebullición del agua en 0,51 °C (0,918 °F) y un mol de sal por kg aumenta el punto de ebullición en 1,02 °C (1,836 °F); de manera similar, aumentar la cantidad de partículas disueltas reduce el punto de congelación del agua. [155]
Los solutos en el agua también afectan la actividad del agua, que afecta muchas reacciones químicas y el crecimiento de microbios en los alimentos. [156] La actividad del agua se puede describir como una relación entre la presión de vapor del agua en una solución y la presión de vapor del agua pura. [155] Los solutos en el agua reducen la actividad del agua; es importante saber esto porque la mayor parte del crecimiento bacteriano cesa en niveles bajos de actividad del agua. [156] El crecimiento microbiano no solo afecta la seguridad de los alimentos, sino también la conservación y vida útil de los alimentos.
La dureza del agua también es un factor crítico en el procesamiento de alimentos y puede modificarse o tratarse mediante el uso de un sistema químico de intercambio iónico. Puede afectar drásticamente la calidad de un producto, además de desempeñar un papel en el saneamiento. La dureza del agua se clasifica según la concentración de carbonato de calcio que contiene. El agua se clasifica como blanda si contiene menos de 100 mg/L (Reino Unido) [157] o menos de 60 mg/L (EE. UU.). [158]
Según un informe publicado por la organización Water Footprint en 2010, un solo kilogramo de carne de res requiere 15 mil litros (3,3 × 10 3 imp gal; 4,0 × 10 3 gal EE.UU.) de agua; sin embargo, los autores también dejan claro que se trata de un promedio mundial y que factores circunstanciales determinan la cantidad de agua utilizada en la producción de carne vacuna. [159]
El agua para inyección está en la lista de medicamentos esenciales de la Organización Mundial de la Salud . [160]

Gran parte del agua del universo se produce como subproducto de la formación de estrellas . La formación de estrellas va acompañada de un fuerte viento de salida de gas y polvo. Cuando esta salida de material finalmente impacta el gas circundante, las ondas de choque que se crean comprimen y calientan el gas. El agua observada se produce rápidamente en este gas cálido y denso. [162]
El 22 de julio de 2011, un informe describió el descubrimiento de una gigantesca nube de vapor de agua que contenía "140 billones de veces más agua que todos los océanos de la Tierra juntos" alrededor de un quásar situado a 12 mil millones de años luz de la Tierra. Según los investigadores, "el descubrimiento demuestra que el agua ha estado presente en el universo durante casi toda su existencia". [163] [164]
Se ha detectado agua en nubes interestelares dentro de la Vía Láctea . [165] El agua probablemente también exista en abundancia en otras galaxias, porque sus componentes, hidrógeno y oxígeno, se encuentran entre los elementos más abundantes del universo. Según los modelos de formación y evolución del Sistema Solar y de otros sistemas estelares, es probable que la mayoría de los demás sistemas planetarios tengan ingredientes similares.
El agua está presente en forma de vapor en:
El agua líquida está presente en la Tierra y cubre el 71% de su superficie. [22] Ocasionalmente también hay agua líquida presente en pequeñas cantidades en Marte . [186] Los científicos creen que hay agua líquida presente en las lunas saturninas de Encelado , como un océano de 10 kilómetros de espesor aproximadamente a 30-40 kilómetros debajo de la superficie del polo sur de Encelado, [187] [188] y Titán , como una capa subsuperficial, posiblemente mezclado con amoníaco . [189] Europa , la luna de Júpiter, tiene características superficiales que sugieren un océano de agua líquida bajo la superficie. [190] También puede existir agua líquida en Ganímedes , la luna de Júpiter, como una capa intercalada entre hielo y roca a alta presión. [191]
El agua está presente en forma de hielo en:

Y es probable que también esté presente en:
El agua y otros volátiles probablemente comprenden gran parte de las estructuras internas de Urano y Neptuno y el agua en las capas más profundas puede estar en forma de agua iónica en la que las moléculas se descomponen en una sopa de iones de hidrógeno y oxígeno, y más profundamente aún como agua superiónica . agua en la que el oxígeno cristaliza, pero los iones de hidrógeno flotan libremente dentro de la red de oxígeno. [210]
La existencia de agua líquida, y en menor medida de sus formas gaseosa y sólida, en la Tierra es vital para la existencia de vida en la Tierra tal como la conocemos. La Tierra está situada en la zona habitable del Sistema Solar ; si estuviera un poco más cerca o más lejos del Sol (alrededor del 5%, o alrededor de 8 millones de kilómetros), sería mucho menos probable que existieran las condiciones que permiten que las tres formas estén presentes simultáneamente. [211] [212]
La gravedad de la Tierra le permite mantener una atmósfera . El vapor de agua y el dióxido de carbono en la atmósfera proporcionan un amortiguador de temperatura ( efecto invernadero ) que ayuda a mantener una temperatura superficial relativamente estable. Si la Tierra fuera más pequeña, una atmósfera más delgada permitiría temperaturas extremas, evitando así la acumulación de agua excepto en los casquetes polares (como en Marte ). [ cita necesaria ]
La temperatura de la superficie de la Tierra ha sido relativamente constante a lo largo del tiempo geológico a pesar de los diferentes niveles de radiación solar entrante ( insolación ), lo que indica que un proceso dinámico gobierna la temperatura de la Tierra a través de una combinación de gases de efecto invernadero y albedo superficial o atmosférico . Esta propuesta se conoce como hipótesis Gaia . [ cita necesaria ]
El estado del agua en un planeta depende de la presión ambiental, que está determinada por la gravedad del planeta. Si un planeta es lo suficientemente masivo, el agua que contiene puede ser sólida incluso a altas temperaturas, debido a la alta presión causada por la gravedad, como se observó en los exoplanetas Gliese 436 b [213] y GJ 1214 b . [214]

La política del agua es la política afectada por el agua y los recursos hídricos . El agua, en particular el agua dulce, es un recurso estratégico en todo el mundo y un elemento importante en muchos conflictos políticos. Provoca impactos en la salud y daños a la biodiversidad.
El acceso al agua potable ha mejorado en las últimas décadas en casi todas partes del mundo, pero aproximadamente mil millones de personas todavía carecen de acceso a agua potable y más de 2.500 millones carecen de acceso a servicios sanitarios adecuados . [215] Sin embargo, algunos observadores han estimado que para 2025 más de la mitad de la población mundial se enfrentará a una vulnerabilidad basada en el agua. [216] Un informe, publicado en noviembre de 2009, sugiere que para 2030, en algunas regiones en desarrollo del mundo, la demanda de agua superará la oferta en un 50%. [217]
1.600 millones de personas han obtenido acceso a una fuente de agua potable desde 1990. [218] Se calcula que la proporción de personas en los países en desarrollo con acceso a agua potable ha mejorado del 30% en 1970 [219] al 71% en 1990, el 79% en 2000 y el 84 por ciento en 2004. [215]
Un informe de las Naciones Unidas de 2006 afirmó que "hay suficiente agua para todos", pero que el acceso a ella se ve obstaculizado por la mala gestión y la corrupción. [220] Además, las iniciativas globales para mejorar la eficiencia de la prestación de ayuda, como la Declaración de París sobre la Eficacia de la Ayuda , no han sido adoptadas por los donantes del sector hídrico con tanta eficacia como lo han hecho en educación y salud, lo que potencialmente deja a múltiples donantes trabajando en proyectos superpuestos y gobiernos receptores sin poder para actuar. [221]
Los autores de la Evaluación Integral de la Gestión del Agua en la Agricultura de 2007 citaron la mala gobernanza como una de las razones de algunas formas de escasez de agua. La gobernanza del agua es el conjunto de procesos formales e informales a través de los cuales se toman decisiones relacionadas con la gestión del agua. La buena gobernanza del agua consiste principalmente en saber qué procesos funcionan mejor en un contexto físico y socioeconómico particular. A veces se han cometido errores al intentar aplicar "modelos" que funcionan en el mundo desarrollado a ubicaciones y contextos del mundo en desarrollo. El río Mekong es un ejemplo; Una revisión realizada por el Instituto Internacional de Gestión del Agua de las políticas en seis países que dependen del río Mekong para obtener agua encontró que rara vez se llevaban a cabo análisis exhaustivos y transparentes de costos-beneficios y evaluaciones de impacto ambiental. También descubrieron que el proyecto de ley de aguas de Camboya era mucho más complejo de lo necesario. [222]
En 2004, la organización benéfica británica WaterAid informó que un niño muere cada 15 segundos a causa de enfermedades relacionadas con el agua que se pueden prevenir fácilmente; A menudo esto significa falta de eliminación de aguas residuales . [ cita necesaria ]
Desde 2003, el Informe de las Naciones Unidas sobre el desarrollo de los recursos hídricos en el mundo , elaborado por el Programa Mundial de Evaluación de los Recursos Hídricos de la UNESCO , ha proporcionado a los tomadores de decisiones herramientas para desarrollar políticas hídricas sostenibles . [223] El informe de 2023 afirma que dos mil millones de personas (26% de la población) no tienen acceso a agua potable y 3.600 millones (46%) carecen de acceso a servicios de saneamiento gestionados de forma segura. [224] Las personas en áreas urbanas (2,4 mil millones) enfrentarán escasez de agua para 2050. [223] La escasez de agua ha sido descrita como endémica, debido al consumo excesivo y la contaminación . [225] El informe afirma que el 10% de la población mundial vive en países con estrés hídrico alto o crítico. Sin embargo, en los últimos 40 años, el consumo de agua ha aumentado alrededor de un 1% anual y se espera que crezca al mismo ritmo hasta 2050. Desde 2000, las inundaciones en los trópicos se han cuadruplicado, mientras que las inundaciones en las latitudes medias del norte han aumentado en un factor de 2,5. [226] El costo de estas inundaciones entre 2000 y 2019 fue de 100.000 muertes y 650 millones de dólares. [223]
Las organizaciones preocupadas por la protección del agua incluyen la Asociación Internacional del Agua (IWA), WaterAid, Water 1st y la Asociación Estadounidense de Recursos Hídricos. El Instituto Internacional para la Gestión del Agua lleva a cabo proyectos con el objetivo de utilizar una gestión eficaz del agua para reducir la pobreza. Los convenios relacionados con el agua son la Convención de las Naciones Unidas de Lucha contra la Desertificación (UNCCD), la Convención Internacional para la Prevención de la Contaminación por los Buques , la Convención de las Naciones Unidas sobre el Derecho del Mar y la Convención de Ramsar . El Día Mundial del Agua se celebra el 22 de marzo [227] y el Día Mundial de los Océanos el 8 de junio. [228]

El agua se considera un purificador en la mayoría de las religiones. Las religiones que incorporan el lavado ritual ( ablución ) incluyen el cristianismo , [229] el hinduismo , el islam , el judaísmo , el movimiento rastafari , el sintoísmo , el taoísmo y la wicca . La inmersión (o aspersión o afusión ) de una persona en agua es un sacramento central del cristianismo (donde se le llama bautismo ); También es parte de la práctica de otras religiones, incluido el Islam ( Ghusl ), el judaísmo ( mikvah ) y el sijismo ( Amrit Sanskar ). Además, en muchas religiones, incluidos el islam y el judaísmo, se realiza un baño ritual en agua pura para los muertos. En el Islam, las cinco oraciones diarias se pueden realizar en la mayoría de los casos después de lavar ciertas partes del cuerpo con agua limpia ( wudu ), a menos que no haya agua disponible (ver Tayammum ). En el sintoísmo, el agua se utiliza en casi todos los rituales para limpiar a una persona o un área (por ejemplo, en el ritual del misogi ).
En el cristianismo, el agua bendita es agua que ha sido santificada por un sacerdote con fines de bautismo , bendición de personas, lugares y objetos, o como medio para repeler el mal. [230] [231]
En el zoroastrismo , el agua ( āb ) es respetada como fuente de vida. [232]

El filósofo griego Empédocles veía el agua como uno de los cuatro elementos clásicos (junto con el fuego, la tierra y el aire ) y la consideraba un ylem o sustancia básica del universo. Tales , a quien Aristóteles describió como un astrónomo e ingeniero, teorizó que la Tierra, que es más densa que el agua, surgió del agua. Tales, un monista , creía además que todas las cosas están hechas de agua. Platón creía que la forma del agua es un icosaedro , que fluye fácilmente en comparación con la tierra en forma de cubo. [233]
La teoría de los cuatro humores corporales asociaba el agua con la flema , como algo frío y húmedo. El elemento clásico agua era también uno de los cinco elementos de la filosofía tradicional china (junto con la tierra , el fuego , la madera y el metal ).
Algunos sistemas filosóficos asiáticos tradicionales y populares toman el agua como modelo a seguir. La traducción de James Legge de 1891 del Dao De Jing afirma: "La excelencia más elevada es como (la del) agua. La excelencia del agua aparece en su beneficio para todas las cosas y en su ocupación, sin esforzarse (en lo contrario), en el lugar bajo que todos los hombres desagradan. Por lo tanto (su camino) está cerca (del) Tao " y "No hay nada en el mundo más suave y débil que el agua, y sin embargo, para atacar las cosas que son firmes y fuertes no hay nada eso puede tener prioridad sobre él, porque no hay nada (tan eficaz) por lo que se pueda cambiar ". [234] Guanzi en el capítulo "Shui di" 水地 profundiza en el simbolismo del agua, proclamando que "el hombre es agua" y atribuyendo cualidades naturales de la gente de diferentes regiones chinas al carácter de los recursos hídricos locales. [235]
El "agua viva" aparece en los cuentos populares germánicos y eslavos como medio para resucitar a los muertos. Nótese el cuento de hadas de los Grimm (" El agua de la vida ") y la dicotomía rusa entre agua viva y agua muerta . La Fuente de la Juventud representa un concepto relacionado de aguas mágicas que supuestamente previenen el envejecimiento.
La pintora y activista Fredericka Foster fue curadora de El valor del agua , en la Catedral de San Juan el Divino en la ciudad de Nueva York, [236] que ancló una iniciativa de un año de duración de la Catedral sobre nuestra dependencia del agua. [237] [238] La exposición más grande jamás presentada en la Catedral, [239] contó con más de cuarenta artistas, incluidos Jenny Holzer , Robert Longo , Mark Rothko , William Kentridge , April Gornik , Kiki Smith , Pat Steir , Alice Dalton Brown. , Teresita Fernández y Bill Viola . [240] [241] Foster creó Think About Water, [242] [ cita completa necesaria ] un colectivo ecológico de artistas que utilizan el agua como tema o medio. Los miembros incluyen a Basia Irland, [243] [ cita completa necesaria ] Aviva Rahmani , Betsy Damon , Diane Burko , Leila Daw , Stacy Levy , Charlotte Coté, [244] Meridel Rubenstein y Anna Macleod .
Para conmemorar el décimo aniversario de la declaración del acceso al agua y al saneamiento como un derecho humano por parte de la ONU, la organización benéfica WaterAid encargó a diez artistas visuales que mostraran el impacto del agua potable en la vida de las personas. [245] [246]
El nombre químico técnicamente correcto pero poco utilizado del agua , monóxido de dihidrógeno, se ha utilizado en una serie de engaños y bromas que se burlan del analfabetismo científico . Esto comenzó en 1983, cuando apareció un artículo del Día de los Inocentes en un periódico de Durand, Michigan . La historia falsa consistía en preocupaciones sobre la seguridad de la sustancia. [247]
La palabra "Agua" ha sido utilizada por muchos raperos de Florida como una especie de eslogan o improvisación. Los raperos que han hecho esto incluyen a BLP Kosher y Ski Mask the Slump God . [248] Para ir aún más lejos, algunos raperos han hecho canciones enteras dedicadas al agua en Florida, como la canción de 2023 de Danny Towers "Florida Water". [249] Otros han hecho canciones enteras dedicadas al agua en su conjunto, como XXXTentacion y Ski Mask the Slump God con su exitosa canción "H2O".
A veces estos compuestos tienen nombres genéricos o comunes (p. ej., H2O es "agua") y también tienen nombres sistemáticos (p. ej., H2O, monóxido de dihidrógeno).
Tenga en cuenta que el entorno de la Tierra está cerca del punto triple y que en la superficie pueden existir agua, vapor y hielo.
Las duchas vaginales se practican comúnmente en los países católicos. El bidé... todavía se encuentra comúnmente en Francia y otros países católicos.
El agua también juega un papel en otros rituales cristianos. ... En los primeros días del cristianismo, dos o tres siglos después de Cristo, el lavabo (en latín, "me lavo"), un recipiente y cuenco ritual para lavarse las manos, se introdujo como parte del servicio de la Iglesia.