
La destilación , también destilación clásica , es el proceso de separación de las sustancias componentes de una mezcla líquida de dos o más sustancias químicamente discretas; el proceso de separación se realiza mediante la ebullición selectiva de la mezcla y la condensación de los vapores en un alambique .
La destilación seca ( termólisis y pirólisis ) es el calentamiento de materiales sólidos para producir gases que se condensan en productos fluidos o en productos sólidos. El término destilación seca incluye los procesos de separación de destilación destructiva y de craqueo químico , que descomponen las moléculas grandes de hidrocarburos en moléculas de hidrocarburos más pequeñas. Además, una destilación parcial da como resultado separaciones parciales de los componentes de la mezcla, proceso que produce componentes casi puros; la destilación parcial también realiza separaciones parciales de la mezcla para aumentar las concentraciones de componentes seleccionados. En cualquiera de los métodos, el proceso de separación de la destilación explota las diferencias en la volatilidad relativa de las sustancias componentes de la mezcla calentada.
En las aplicaciones industriales de la destilación clásica, el término destilación se utiliza como una unidad de operación que identifica y denota un proceso de separación física, no una reacción química ; así, una instalación industrial que produce bebidas destiladas , es una destilería de alcohol . Estas son algunas aplicaciones del proceso de separación química que es la destilación:
Se encontraron evidencias tempranas de destilación en tablillas acádicas que datan de alrededor del año 1200 a. C. y que describen operaciones de perfumería. Las tablillas proporcionaron evidencia textual de que los babilonios de la antigua Mesopotamia conocían una forma temprana y primitiva de destilación . [5]
Según el químico británico T. Fairley, ni los griegos ni los romanos tenían un término para el concepto moderno de destilación. Palabras como "destilar" se habrían referido a otra cosa, en la mayoría de los casos a una parte de algún proceso no relacionado con lo que hoy se conoce como destilación. En palabras de Fairley y del ingeniero químico alemán Norbert Kockmann respectivamente:
El término latino "destilar", de de-stillo, de stilla, gota, se refería a la acción de dejar caer un líquido por medios humanos o artificiales, y se aplicaba a cualquier proceso en el que se separaba un líquido en gotas. Destilar en el sentido moderno sólo podía expresarse de manera indirecta. [6]
La destilación tenía un significado más amplio en la antigüedad y la época medieval porque casi todas las operaciones de purificación y separación se incluían bajo el término destilación , como la filtración, la cristalización, la extracción, la sublimación o el prensado mecánico del aceite. [7]
Según el historiador químico holandés Robert J. Forbes , la palabra distillare (gotear) cuando la usaban los romanos, por ejemplo Séneca y Plinio el Viejo , "nunca se usó en nuestro sentido". [8]
Aristóteles sabía que el agua que se condensa al evaporarse el agua del mar es dulce: [9]
He demostrado experimentalmente que el agua salada evaporada forma agua dulce, y el vapor, cuando se condensa, no vuelve a condensarse en agua de mar.
Dejar que el agua de mar se evapore y se condense en agua dulce no puede llamarse "destilación", ya que la destilación implica hervir, pero el experimento puede haber sido un paso importante hacia la destilación. [10]

Se han encontrado evidencias tempranas de destilación relacionadas con alquimistas que trabajaban en Alejandría, en el Egipto romano, en el siglo I d. C. [14] : 57, 89
El agua destilada se ha utilizado al menos desde alrededor del año 200 d. C. , cuando Alejandro de Afrodisias describió el proceso. [15] [16] El trabajo sobre la destilación de otros líquidos continuó en el Egipto bizantino temprano bajo Zósimo de Panópolis en el siglo III.
La destilación se practicaba en el antiguo subcontinente indio , como lo demuestran las retortas y receptores de arcilla cocida encontrados en Taxila , Shaikhan Dheri y Charsadda en Pakistán y Rang Mahal en la India que datan de los primeros siglos de la era común . [17] [18] [19] Frank Raymond Allchin dice que estos tubos de destilación de terracota fueron "hechos para imitar el bambú". [20] Estos " alambiques Gandhara " solo eran capaces de producir licor muy débil , ya que no había medios eficientes para recolectar los vapores a baja temperatura. [21]
La destilación en China puede haber comenzado durante la dinastía Han del Este (siglos I-II d. C.)
Químicos musulmanes medievales como Jābir ibn Ḥayyān (latín: Geber, siglo IX) y Abū Bakr al-Rāzī (latín: Rhazes, c. 865-925 ) experimentaron extensamente con la destilación de varias sustancias. La destilación fraccionada de sustancias orgánicas juega un papel importante en las obras atribuidas a Jābir, como en el Kitāb al-Sabʿīn ('El libro de los setenta'), traducido al latín por Gerardo de Cremona ( c. 1114-1187 ) bajo el título Liber de septuaginta . [22] Los experimentos jabirianos con la destilación fraccionada de sustancias animales y vegetales, y en menor grado también de sustancias minerales, son el tema principal del De anima in arte alkimiae , una obra originalmente árabe falsamente atribuida a Avicena que fue traducida al latín y que luego constituiría la fuente alquímica más importante para Roger Bacon ( c. 1220–1292 ). [23]
La destilación del vino está atestiguada en obras árabes atribuidas a al-Kindī ( c. 801-873 d. C. ) y a al-Fārābī ( c. 872-950 ), y en el libro 28 del Kitāb al-Taṣrīf de al-Zahrāwī (latín: Abulcasis, 936-1013) (posteriormente traducido al latín como Liber servatoris ). [24] En el siglo XII, las recetas para la producción de aqua ardens ("agua ardiente", es decir, etanol) mediante la destilación del vino con sal comenzaron a aparecer en varias obras latinas, y para fines del siglo XIII se había convertido en una sustancia ampliamente conocida entre los químicos de Europa occidental. [25] Las obras de Taddeo Alderotti (1223-1296) describen un método para concentrar alcohol que implicaba una destilación repetida a través de un alambique enfriado por agua, con el que se podía obtener una pureza de alcohol del 90%. [26]
Según las evidencias arqueológicas, la destilación de bebidas comenzó en las dinastías Song del Sur (siglos X-XIII) y Jin (siglos XII-XIII). [27] Se encontró un alambique en un yacimiento arqueológico de Qinglong, provincia de Hebei , China, que data del siglo XII. Las bebidas destiladas eran comunes durante la dinastía Yuan (siglos XIII-XIV). [27]
En 1500, el alquimista alemán Hieronymus Brunschwig publicó Liber de arte distillandi de simplicibus ( El libro del arte de destilar a partir de ingredientes simples ), [28] el primer libro dedicado exclusivamente al tema de la destilación, seguido en 1512 por una versión mucho más amplia. Inmediatamente después, en 1518, se fundó la destilería más antigua de Europa, The Green Tree Distillery . [29]
En 1651, John French publicó El arte de la destilación , [30] el primer compendio importante en inglés sobre la práctica, pero se ha afirmado [31] que gran parte de él se deriva del trabajo de Braunschweig. Esto incluye diagramas con personas que muestran la escala industrial en lugar de la escala de laboratorio de la operación.


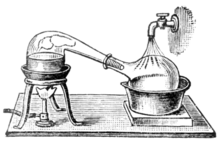


A medida que la alquimia evolucionó hacia la ciencia de la química , se empezaron a utilizar recipientes llamados retortas para las destilaciones. Tanto los alambiques como las retortas son formas de cristalería con cuellos largos que apuntan hacia un lado en un ángulo hacia abajo para actuar como condensadores enfriados por aire para condensar el destilado y dejar que gotee hacia abajo para su recolección. Más tarde, se inventaron los alambiques de cobre. Las juntas remachadas a menudo se mantenían herméticas mediante el uso de varias mezclas, por ejemplo, una masa hecha de harina de centeno. [32] Estos alambiques a menudo presentaban un sistema de enfriamiento alrededor del pico, utilizando agua fría, por ejemplo, lo que hacía que la condensación del alcohol fuera más eficiente. Estos se llamaban alambiques de olla . Hoy en día, las retortas y los alambiques de olla han sido reemplazados en gran medida por métodos de destilación más eficientes en la mayoría de los procesos industriales. Sin embargo, el alambique de olla todavía se utiliza ampliamente para la elaboración de algunos alcoholes finos, como el coñac , el whisky escocés , el whisky irlandés , el tequila , el ron , la cachaça y algunos vodkas . Los alambiques de olla hechos de diversos materiales (madera, arcilla, acero inoxidable) también son utilizados por los contrabandistas en varios países. También se venden pequeños alambiques de olla para su uso en la producción doméstica [33] de agua de flores o aceites esenciales .
Las primeras formas de destilación implicaban procesos discontinuos que utilizaban una vaporización y una condensación. La pureza se mejoraba mediante una mayor destilación del condensado. Se procesaban mayores volúmenes simplemente repitiendo la destilación. Se dice que los químicos realizaban entre 500 y 600 destilaciones para obtener un compuesto puro. [34]
A principios del siglo XIX, se desarrollaron los conceptos básicos de las técnicas modernas, incluido el precalentamiento y el reflujo . [34] En 1822, Anthony Perrier desarrolló uno de los primeros alambiques continuos y luego, en 1826, Robert Stein mejoró ese diseño para fabricar su alambique patentado . En 1830, Aeneas Coffey obtuvo una patente para mejorar aún más el diseño. [35] El alambique continuo de Coffey puede considerarse el arquetipo de las unidades petroquímicas modernas. El ingeniero francés Armand Savalle desarrolló su regulador de vapor alrededor de 1846. [14] : 323 En 1877, Ernest Solvay recibió una patente estadounidense para una columna de bandejas para la destilación de amoníaco , [36] y el mismo año y los posteriores vieron desarrollos en este tema para aceites y licores.
Con el surgimiento de la ingeniería química como disciplina a finales del siglo XIX, se pudieron aplicar métodos científicos en lugar de empíricos. La industria petrolera en desarrollo a principios del siglo XX proporcionó el impulso para el desarrollo de métodos de diseño precisos, como el método McCabe-Thiele de Ernest Thiele y la ecuación de Fenske . La primera planta industrial en los Estados Unidos que utilizó la destilación como medio de desalinización oceánica se inauguró en Freeport, Texas, en 1961 con la esperanza de brindar seguridad hídrica a la región. [37] La disponibilidad de computadoras potentes ha permitido realizar simulaciones informáticas directas de columnas de destilación.
Las aplicaciones de la destilación se pueden dividir en cuatro grupos: escala de laboratorio, destilación industrial, destilación de hierbas para perfumería y medicinas ( destilados de hierbas ) y procesamiento de alimentos. Los dos últimos son claramente diferentes de los dos anteriores en que la destilación no se utiliza como un verdadero método de purificación, sino más bien para transferir todos los volátiles de los materiales de origen al destilado en el procesamiento de bebidas y hierbas.
La principal diferencia entre la destilación a escala de laboratorio y la destilación industrial es que la destilación a escala de laboratorio a menudo se realiza por lotes, mientras que la destilación industrial a menudo se realiza de forma continua. En la destilación por lotes , la composición del material de origen, los vapores de los compuestos de destilación y el destilado cambian durante la destilación. En la destilación por lotes, se carga (se suministra) un alambique con un lote de mezcla de alimentación, que luego se separa en sus fracciones componentes, que se recogen secuencialmente desde la más volátil a la menos volátil, y las partes inferiores (la fracción menos volátil o no volátil restante) se eliminan al final. Luego, se puede recargar el alambique y repetir el proceso.
En la destilación continua , los materiales de partida, los vapores y el destilado se mantienen en una composición constante mediante la reposición cuidadosa del material de partida y la eliminación de fracciones tanto del vapor como del líquido en el sistema. Esto da como resultado un control más detallado del proceso de separación.
El punto de ebullición de un líquido es la temperatura a la que la presión de vapor del líquido es igual a la presión que lo rodea, lo que permite que se formen burbujas sin que se aplasten. Un caso especial es el punto de ebullición normal , en el que la presión de vapor del líquido es igual a la presión atmosférica ambiental .
Es un error pensar que, en una mezcla líquida a una presión dada, cada componente hierve en el punto de ebullición correspondiente a la presión dada, lo que permite que los vapores de cada componente se acumulen por separado y de forma pura. Sin embargo, esto no ocurre, ni siquiera en un sistema idealizado. Los modelos idealizados de destilación se rigen esencialmente por la ley de Raoult y la ley de Dalton y suponen que se alcanzan los equilibrios vapor-líquido .
La ley de Raoult establece que la presión de vapor de una solución depende de 1) la presión de vapor de cada componente químico en la solución y 2) la fracción de solución que cada componente constituye, también conocida como fracción molar . Esta ley se aplica a soluciones ideales o soluciones que tienen diferentes componentes pero cuyas interacciones moleculares son iguales o muy similares a las soluciones puras.
La ley de Dalton establece que la presión total es la suma de las presiones parciales de cada componente individual de la mezcla. Cuando se calienta un líquido de varios componentes, la presión de vapor de cada componente aumenta, lo que hace que la presión de vapor total aumente. Cuando la presión de vapor total alcanza la presión que rodea al líquido, se produce la ebullición y el líquido se convierte en gas en toda su masa. Una mezcla con una composición determinada tiene un punto de ebullición a una presión determinada cuando los componentes son mutuamente solubles. Una mezcla de composición constante no tiene múltiples puntos de ebullición.
Una implicación de un punto de ebullición es que los componentes más ligeros nunca "hierven primero" de forma limpia. En el punto de ebullición, todos los componentes volátiles hierven, pero para un componente, su porcentaje en el vapor es el mismo que su porcentaje de la presión de vapor total. Los componentes más ligeros tienen una presión parcial más alta y, por lo tanto, se concentran en el vapor, pero los componentes volátiles más pesados también tienen una presión parcial (menor) y necesariamente también se vaporizan, aunque a una concentración menor en el vapor. De hecho, la destilación por lotes y el fraccionamiento tienen éxito al variar la composición de la mezcla. En la destilación por lotes, el lote se vaporiza, lo que cambia su composición; en el fraccionamiento, el líquido que se encuentra más arriba en la columna de fraccionamiento contiene más componentes ligeros y hierve a temperaturas más bajas. Por lo tanto, a partir de una mezcla dada, parece tener un rango de ebullición en lugar de un punto de ebullición, aunque esto se debe a que su composición cambia: cada mezcla intermedia tiene su propio punto de ebullición singular.
El modelo idealizado es preciso en el caso de líquidos químicamente similares, como el benceno y el tolueno . En otros casos, se observan desviaciones graves de la ley de Raoult y la ley de Dalton, la más famosa en la mezcla de etanol y agua. Estos compuestos, cuando se calientan juntos, forman un azeótropo , que es cuando la fase de vapor y la fase líquida contienen la misma composición. Aunque existen métodos computacionales que se pueden utilizar para estimar el comportamiento de una mezcla de componentes arbitrarios, la única forma de obtener datos precisos de equilibrio vapor-líquido es mediante medición.
No es posible purificar completamente una mezcla de componentes mediante destilación, ya que esto requeriría que cada componente de la mezcla tenga una presión parcial cero . Si el objetivo son productos ultrapuros, entonces se debe aplicar una separación química adicional . Cuando se vaporiza una mezcla binaria y el otro componente, por ejemplo, una sal, tiene una presión parcial cero para fines prácticos, el proceso es más simple.
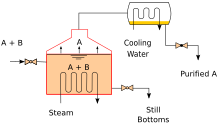
Calentar una mezcla ideal de dos sustancias volátiles, A y B, donde A tiene la mayor volatilidad o el punto de ebullición más bajo, en una configuración de destilación por lotes (como en un aparato representado en la figura inicial) hasta que la mezcla hierva da como resultado un vapor por encima del líquido que contiene una mezcla de A y B. La relación entre A y B en el vapor será diferente de la relación en el líquido. La relación en el líquido estará determinada por cómo se preparó la mezcla original, mientras que la relación en el vapor se enriquecerá con el compuesto más volátil, A (debido a la Ley de Raoult, véase más arriba). El vapor pasa por el condensador y se elimina del sistema. Esto, a su vez, significa que la relación de compuestos en el líquido restante ahora es diferente de la relación inicial (es decir, más enriquecida en B que en el líquido de partida).
El resultado es que la proporción en la mezcla líquida va cambiando, volviéndose más rica en el componente B. Esto hace que el punto de ebullición de la mezcla aumente, lo que resulta en un aumento de la temperatura en el vapor, lo que resulta en un cambio de la proporción de A : B en la fase gaseosa (a medida que continúa la destilación, hay una proporción creciente de B en la fase gaseosa). Esto resulta en un cambio lento de la proporción de A : B en el destilado.
Si la diferencia de presión de vapor entre los dos componentes A y B es grande –generalmente expresada como la diferencia de puntos de ebullición– la mezcla al comienzo de la destilación está altamente enriquecida en el componente A, y cuando el componente A se ha destilado, el líquido en ebullición está enriquecido en el componente B.
La destilación continua es una destilación continua en la que se introduce una mezcla líquida de forma continua (sin interrupción) en el proceso y se eliminan fracciones separadas de forma continua a medida que se producen corrientes de salida a lo largo del tiempo durante la operación. La destilación continua produce un mínimo de dos fracciones de salida, incluida al menos una fracción de destilado volátil , que ha hervido y se ha capturado por separado como vapor y luego se ha condensado en un líquido. Siempre hay una fracción de fondo (o residuo), que es el residuo menos volátil que no se ha capturado por separado como vapor condensado.
La destilación continua se diferencia de la destilación por lotes en que las concentraciones no deben cambiar con el tiempo. La destilación continua se puede ejecutar en un estado estable durante un período de tiempo arbitrario. Para cualquier material fuente de composición específica, las principales variables que afectan la pureza de los productos en la destilación continua son la relación de reflujo y el número de etapas de equilibrio teóricas, que en la práctica se determinan por el número de platos o la altura del relleno. El reflujo es un flujo desde el condensador de regreso a la columna, que genera un reciclado que permite una mejor separación con un número determinado de platos. Las etapas de equilibrio son pasos ideales donde las composiciones alcanzan el equilibrio vapor-líquido, repitiendo el proceso de separación y permitiendo una mejor separación dada una relación de reflujo. Una columna con una relación de reflujo alta puede tener menos etapas, pero refluye una gran cantidad de líquido, lo que da como resultado una columna ancha con una gran retención. Por el contrario, una columna con una relación de reflujo baja debe tener una gran cantidad de etapas, por lo que requiere una columna más alta.
Tanto las destilaciones continuas como las discontinuas se pueden mejorar utilizando una columna de fraccionamiento en la parte superior del matraz de destilación. La columna mejora la separación al proporcionar una mayor superficie para que el vapor y el condensado entren en contacto. Esto ayuda a que permanezcan en equilibrio durante el mayor tiempo posible. La columna puede incluso constar de pequeños subsistemas ("bandejas" o "platos") que contienen una mezcla de líquido enriquecido y en ebullición, todos con su propio equilibrio vapor-líquido.
Existen diferencias entre las columnas de fraccionamiento a escala de laboratorio y a escala industrial, pero los principios son los mismos. Algunos ejemplos de columnas de fraccionamiento a escala de laboratorio (que aumentan su eficiencia) son:
Las destilaciones a escala de laboratorio se realizan casi exclusivamente como destilaciones por lotes. El dispositivo utilizado en la destilación, a veces denominado alambique , consta como mínimo de un recalentador o caldero en el que se calienta el material de origen, un condensador en el que el vapor calentado se enfría de nuevo al estado líquido y un receptor en el que se recoge el líquido concentrado o purificado, llamado destilado. Existen varias técnicas de destilación a escala de laboratorio (consulte también tipos de destilación ).
Un aparato de destilación completamente sellado podría experimentar una presión interna extrema y que varía rápidamente, lo que podría hacer que se abriera por las juntas. Por lo tanto, generalmente se deja algún camino abierto (por ejemplo, en el matraz receptor) para permitir que la presión interna se iguale con la presión atmosférica. Alternativamente, se puede utilizar una bomba de vacío para mantener el aparato a una presión inferior a la atmosférica. Si las sustancias involucradas son sensibles al aire o a la humedad, la conexión con la atmósfera se puede realizar a través de uno o más tubos de secado llenos de materiales que eliminan los componentes de aire no deseados, o a través de burbujeadores que proporcionan una barrera líquida móvil. Finalmente, la entrada de componentes de aire no deseados se puede evitar bombeando un flujo bajo pero constante de gas inerte adecuado, como nitrógeno , en el aparato.

En la destilación simple, el vapor se canaliza inmediatamente hacia un condensador. Por lo tanto, el destilado no es puro, sino que su composición es idéntica a la composición de los vapores a la temperatura y presión dadas. Esa concentración sigue la ley de Raoult .
Como resultado, la destilación simple es efectiva solo cuando los puntos de ebullición de los líquidos difieren mucho (la regla general es 25 °C) [38] o cuando se separan líquidos de sólidos no volátiles o aceites. Para estos casos, las presiones de vapor de los componentes suelen ser lo suficientemente diferentes como para que el destilado sea lo suficientemente puro para el propósito previsto.
A la derecha se muestra un esquema en corte de una operación de destilación sencilla. El líquido de partida 15 en el matraz de ebullición 2 se calienta mediante una placa calefactora combinada y un agitador magnético 13 a través de un baño de aceite de silicona (naranja, 14). El vapor fluye a través de una columna Vigreux corta 3, luego a través de un condensador Liebig 5, se enfría con agua (azul) que circula a través de los puertos 6 y 7. El líquido condensado gotea en el matraz receptor 8, que se encuentra en un baño de enfriamiento (azul, 16). El adaptador 10 tiene una conexión 9 que se puede conectar a una bomba de vacío. Los componentes están conectados mediante juntas de vidrio esmerilado .
En muchos casos, los puntos de ebullición de los componentes de la mezcla estarán lo suficientemente próximos como para que sea necesario tener en cuenta la ley de Raoult . Por lo tanto, se debe utilizar la destilación fraccionada para separar los componentes mediante ciclos repetidos de vaporización-condensación dentro de una columna fraccionadora de relleno. Esta separación, mediante destilaciones sucesivas, también se denomina rectificación. [39]
A medida que la solución a purificar se calienta, sus vapores suben a la columna de fraccionamiento . A medida que asciende, se enfría, condensándose en las paredes del condensador y las superficies del material de relleno. Aquí, el condensado continúa siendo calentado por los vapores calientes ascendentes; se vaporiza una vez más. Sin embargo, la composición de los vapores frescos está determinada una vez más por la ley de Raoult. Cada ciclo de vaporización-condensación (llamado plato teórico ) producirá una solución más pura del componente más volátil. [40] En realidad, cada ciclo a una temperatura dada no ocurre exactamente en la misma posición en la columna de fraccionamiento; el plato teórico es, por lo tanto, un concepto en lugar de una descripción precisa.
Un mayor número de platos teóricos permite una mejor separación. Un sistema de destilación por banda giratoria utiliza una banda giratoria de teflón o metal para forzar a los vapores ascendentes a entrar en estrecho contacto con el condensado descendente, lo que aumenta el número de platos teóricos. [41]
Al igual que la destilación al vacío , la destilación al vapor es un método para destilar compuestos sensibles al calor. [1] : 151–153 La temperatura del vapor es más fácil de controlar que la superficie de un elemento calefactor y permite una alta tasa de transferencia de calor sin calentar a una temperatura muy alta. Este proceso implica burbujear vapor a través de una mezcla calentada de la materia prima. Según la ley de Raoult, parte del compuesto objetivo se vaporizará (de acuerdo con su presión parcial). La mezcla de vapor se enfría y se condensa, lo que generalmente produce una capa de aceite y una capa de agua.
La destilación al vapor de diversas hierbas y flores aromáticas puede dar lugar a dos productos: un aceite esencial y un destilado acuoso de hierbas . Los aceites esenciales se utilizan a menudo en perfumería y aromaterapia, mientras que los destilados acuosos tienen muchas aplicaciones en aromaterapia , procesamiento de alimentos y cuidado de la piel .


Algunos compuestos tienen puntos de ebullición muy altos. Para hervir dichos compuestos, a menudo es mejor reducir la presión a la que se hierven en lugar de aumentar la temperatura. Una vez que la presión se reduce a la presión de vapor del compuesto (a la temperatura dada), puede comenzar la ebullición y el resto del proceso de destilación. Esta técnica se conoce como destilación al vacío y se encuentra comúnmente en el laboratorio en forma de evaporador rotatorio .
Esta técnica también es muy útil para compuestos que hierven más allá de su temperatura de descomposición a presión atmosférica y que, por lo tanto, se descompondrían con cualquier intento de hervirlos bajo presión atmosférica.
La destilación molecular es la destilación al vacío por debajo de la presión de 0,01 torr . 0,01 torr es un orden de magnitud por encima del alto vacío , donde los fluidos están en el régimen de flujo molecular libre , es decir, el camino libre medio de las moléculas es comparable al tamaño del equipo. La fase gaseosa ya no ejerce una presión significativa sobre la sustancia que se va a evaporar y, en consecuencia, la velocidad de evaporación ya no depende de la presión. Es decir, debido a que los supuestos continuos de la dinámica de fluidos ya no se aplican, el transporte de masa está regido por la dinámica molecular en lugar de la dinámica de fluidos. Por lo tanto, es necesario un camino corto entre la superficie caliente y la superficie fría, típicamente suspendiendo una placa caliente cubierta con una película de alimento junto a una placa fría con una línea de visión en el medio. La destilación molecular se utiliza industrialmente para la purificación de aceites.
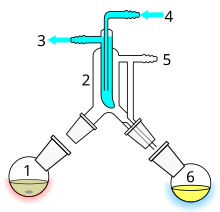
La destilación de recorrido corto es una técnica de destilación que implica que el destilado recorra una distancia corta, a menudo solo unos pocos centímetros, y normalmente se realiza a presión reducida. [1] : 150 Un ejemplo clásico sería una destilación que implica que el destilado se desplace de un bulbo de vidrio a otro, sin la necesidad de un condensador que separe las dos cámaras. Esta técnica se utiliza a menudo para compuestos que son inestables a altas temperaturas o para purificar pequeñas cantidades de compuesto. La ventaja es que la temperatura de calentamiento puede ser considerablemente más baja (a presión reducida) que el punto de ebullición del líquido a presión estándar, y el destilado solo tiene que recorrer una distancia corta antes de condensarse. Un recorrido corto asegura que se pierda poco compuesto en los lados del aparato. El aparato Kugelrohr es un tipo de método de destilación de recorrido corto que a menudo contiene múltiples cámaras para recolectar fracciones de destilado.
Algunos compuestos tienen puntos de ebullición elevados y además son sensibles al aire . Se puede utilizar un sistema de destilación al vacío sencillo como el que se ejemplifica más arriba, en el que el vacío se sustituye por un gas inerte una vez finalizada la destilación. Sin embargo, este sistema es menos satisfactorio si se desea recoger fracciones a presión reducida. Para ello se puede añadir un adaptador de "vaca" o "cerdo" al extremo del condensador o, para obtener mejores resultados o para compuestos muy sensibles al aire, se puede utilizar un aparato de triángulo Perkin .
El triángulo de Perkin tiene un medio a través de una serie de grifos de vidrio o teflón para permitir que las fracciones se aíslen del resto del alambique , sin que el cuerpo principal de la destilación se retire del vacío o de la fuente de calor, y así puede permanecer en un estado de reflujo . Para hacer esto, primero se aísla la muestra del vacío por medio de los grifos, luego el vacío sobre la muestra se reemplaza con un gas inerte (como nitrógeno o argón ) y luego se puede tapar y eliminar. Luego se puede agregar un recipiente de recolección nuevo al sistema, evacuarlo y vincularlo nuevamente al sistema de destilación a través de los grifos para recolectar una segunda fracción, y así sucesivamente, hasta que se hayan recolectado todas las fracciones.
La destilación por zonas es un proceso de destilación en un recipiente largo con fusión parcial de la materia refinada en la zona de líquido en movimiento y condensación del vapor en la fase sólida al extraer el condensado en la zona fría. El proceso funciona en teoría. Cuando el calentador de zona se mueve desde la parte superior a la inferior del recipiente, se forma un condensado sólido con una distribución irregular de impurezas. Luego, la parte más pura del condensado se puede extraer como producto. El proceso se puede iterar muchas veces moviendo (sin rotación) el condensado recibido a la parte inferior del recipiente en lugar de la materia refinada. La distribución irregular de impurezas en el condensado (es decir, la eficiencia de purificación) aumenta con el número de iteraciones. La destilación por zonas es el análogo de destilación de la recristalización por zonas. La distribución de impurezas en el condensado se describe mediante ecuaciones conocidas de recristalización por zonas, con el reemplazo del coeficiente de distribución k de cristalización por el factor de separación α de destilación. [42] [43] [44]
El gas no condensable puede ser expulsado del aparato por el vapor de un cosolvente relativamente volátil, que se evapora espontáneamente durante el bombeo inicial, y esto puede lograrse con una bomba de aceite o de diafragma normal. [45] [46]
El proceso unitario de evaporación también puede llamarse "destilación":
Otros usos:
Las interacciones entre los componentes de la solución crean propiedades exclusivas de la solución, ya que la mayoría de los procesos implican mezclas no ideales, en las que no se cumple la ley de Raoult . Tales interacciones pueden dar como resultado un azeótropo de ebullición constante que se comporta como si fuera un compuesto puro (es decir, hierve a una sola temperatura en lugar de a un rango). En un azeótropo, la solución contiene el componente dado en la misma proporción que el vapor, de modo que la evaporación no cambia la pureza y la destilación no da como resultado la separación. Por ejemplo, el 95,6 % de etanol (en masa) en agua forma un azeótropo a 78,1 °C.
Si el azeótropo no se considera lo suficientemente puro para su uso, existen algunas técnicas para romperlo y obtener un destilado más puro. Estas técnicas se conocen como destilación azeotrópica . Algunas técnicas lo consiguen "saltando" sobre la composición azeotrópica (añadiendo otro componente para crear un nuevo azeótropo o variando la presión). Otras funcionan eliminando o secuestrando química o físicamente la impureza. Por ejemplo, para purificar el etanol más allá del 95%, se puede añadir un agente secante (o desecante , como el carbonato de potasio ) para convertir el agua soluble en agua insoluble de cristalización . Los tamices moleculares también se utilizan a menudo para este fin.
Los líquidos inmiscibles , como el agua y el tolueno , forman fácilmente azeótropos. Comúnmente, estos azeótropos se conocen como azeótropos de bajo punto de ebullición porque el punto de ebullición del azeótropo es menor que el punto de ebullición de cualquiera de los componentes puros. La temperatura y la composición del azeótropo se predicen fácilmente a partir de la presión de vapor de los componentes puros, sin usar la ley de Raoult. El azeótropo se rompe fácilmente en una configuración de destilación utilizando un separador líquido-líquido (un decantador) para separar las dos capas líquidas que se condensan en la parte superior. Solo una de las dos capas líquidas se refluye a la configuración de destilación.
También existen azeótropos de alto punto de ebullición, como una mezcla de ácido clorhídrico en agua al 20 por ciento en peso. Como lo indica el nombre, el punto de ebullición del azeótropo es mayor que el punto de ebullición de cualquiera de los componentes puros.
Los puntos de ebullición de los componentes de un azeótropo se superponen para formar una banda. Al exponer un azeótropo al vacío o a una presión positiva, es posible desviar el punto de ebullición de un componente del otro aprovechando las diferentes curvas de presión de vapor de cada uno; las curvas pueden superponerse en el punto azeotrópico, pero es poco probable que permanezcan idénticas más allá del eje de presión a ambos lados del punto azeotrópico. Cuando el sesgo es lo suficientemente grande, los dos puntos de ebullición ya no se superponen y, por lo tanto, la banda azeotrópica desaparece.
Este método puede eliminar la necesidad de agregar otros productos químicos a una destilación, pero tiene dos inconvenientes potenciales.
En condiciones de presión negativa, se necesita energía para una fuente de vacío y los puntos de ebullición reducidos de los destilados requieren que el condensador funcione a menor temperatura para evitar que los vapores de los destilados se pierdan en la fuente de vacío. Las mayores demandas de refrigeración a menudo requerirán energía adicional y, posiblemente, nuevos equipos o un cambio de refrigerante.
Alternativamente, si se requieren presiones positivas, no se puede utilizar cristalería estándar, se debe utilizar energía para la presurización y hay una mayor probabilidad de que ocurran reacciones secundarias en la destilación, como la descomposición, debido a las temperaturas más altas requeridas para efectuar la ebullición.
Una destilación unidireccional dependerá de un cambio de presión en una dirección, ya sea positiva o negativa.
La destilación por cambio de presión es esencialmente la misma que la destilación unidireccional utilizada para romper mezclas azeotrópicas, pero aquí se pueden emplear presiones tanto positivas como negativas .
Esto mejora la selectividad de la destilación y permite que el químico optimice la destilación evitando los extremos de presión y temperatura que desperdician energía. Esto es particularmente importante en aplicaciones comerciales.
Un ejemplo de la aplicación de la destilación por cambio de presión es durante la purificación industrial del acetato de etilo después de su síntesis catalítica a partir de etanol .

Las aplicaciones de destilación industrial a gran escala incluyen tanto la destilación fraccionada continua como la discontinua, al vacío, azeotrópica, extractiva y al vapor. Las aplicaciones industriales más utilizadas de la destilación fraccionada continua y en estado estacionario son las refinerías de petróleo , las plantas petroquímicas y químicas y las plantas de procesamiento de gas natural .
Para controlar y optimizar dicha destilación industrial, se ha establecido un método de laboratorio estandarizado, ASTM D86. Este método de prueba se extiende a la destilación atmosférica de productos derivados del petróleo utilizando una unidad de destilación por lotes de laboratorio para determinar cuantitativamente las características del rango de ebullición de los productos derivados del petróleo.
La destilación industrial [39] [47] se realiza típicamente en grandes columnas cilíndricas verticales conocidas como torres de destilación o columnas de destilación con diámetros que van desde aproximadamente 0,65 a 16 metros (2 pies 2 pulgadas a 52 pies 6 pulgadas) y alturas que van desde aproximadamente 6 a 90 metros (20 a 295 pies) o más. Cuando la alimentación del proceso tiene una composición diversa, como en la destilación de petróleo crudo , las salidas de líquido a intervalos hacia arriba de la columna permiten la extracción de diferentes fracciones o productos que tienen diferentes puntos de ebullición o rangos de ebullición. Los productos "más ligeros" (aquellos con el punto de ebullición más bajo) salen de la parte superior de las columnas y los productos "más pesados" (aquellos con el punto de ebullición más alto) salen de la parte inferior de la columna y a menudo se denominan fondos.
Las torres industriales utilizan el reflujo para lograr una separación más completa de los productos. El reflujo se refiere a la porción del producto líquido condensado de la parte superior de una torre de destilación o fraccionamiento que se devuelve a la parte superior de la torre, como se muestra en el diagrama esquemático de una torre de destilación industrial típica a gran escala. Dentro de la torre, el líquido de reflujo que fluye hacia abajo proporciona enfriamiento y condensación de los vapores que fluyen hacia arriba, lo que aumenta la eficiencia de la torre de destilación. Cuanto mayor sea el reflujo que se proporcione para un número determinado de platos teóricos , mejor será la separación de la torre de los materiales de menor punto de ebullición de los materiales de mayor punto de ebullición. Alternativamente, cuanto mayor sea el reflujo que se proporcione para una separación deseada dada, menor será el número de platos teóricos necesarios. Los ingenieros químicos deben elegir qué combinación de tasa de reflujo y número de platos es factible tanto económica como físicamente para los productos purificados en la columna de destilación.
Estas torres de fraccionamiento industrial también se utilizan en la separación criogénica del aire , produciendo oxígeno líquido , nitrógeno líquido y argón de alta pureza . La destilación de clorosilanos también permite la producción de silicio de alta pureza para su uso como semiconductor .
El diseño y el funcionamiento de una torre de destilación dependen de la alimentación y de los productos deseados. Dada una alimentación de componentes binaria simple, se pueden utilizar métodos analíticos como el método McCabe-Thiele [39] [48] o la ecuación de Fenske [39] . Para una alimentación de componentes múltiples, se utilizan modelos de simulación tanto para el diseño como para el funcionamiento. Además, las eficiencias de los dispositivos de contacto vapor-líquido (denominados "placas" o "bandejas") utilizados en las torres de destilación son típicamente inferiores a las de una etapa de equilibrio teórica con una eficiencia del 100% . Por lo tanto, una torre de destilación necesita más bandejas que el número de etapas de equilibrio vapor-líquido teóricas. Se han postulado diversos modelos para estimar las eficiencias de las bandejas.
En los usos industriales modernos, se utiliza un material de relleno en la columna en lugar de bandejas cuando se requieren bajas caídas de presión a través de la columna. Otros factores que favorecen el relleno son: sistemas de vacío, columnas de diámetro más pequeño, sistemas corrosivos, sistemas propensos a la formación de espuma, sistemas que requieren una baja retención de líquido y destilación por lotes. Por el contrario, los factores que favorecen las columnas de platos son: presencia de sólidos en la alimentación, altas tasas de líquido, grandes diámetros de columna, columnas complejas, columnas con amplia variación de la composición de la alimentación, columnas con una reacción química, columnas de absorción, columnas limitadas por la tolerancia del peso de la cimentación, baja tasa de líquido, gran relación de reducción y aquellos procesos sujetos a picos de proceso.
Este material de relleno puede ser aleatorio o vertido (de 25 a 76 milímetros (1 a 3 pulgadas) de ancho), como anillos Raschig o chapa metálica estructurada . Los líquidos tienden a humedecer la superficie del relleno y los vapores pasan a través de esta superficie humedecida, donde tiene lugar la transferencia de masa . A diferencia de la destilación convencional de platos en la que cada plato representa un punto separado de equilibrio vapor-líquido, la curva de equilibrio vapor-líquido en una columna de relleno es continua. Sin embargo, al modelar columnas de relleno, es útil calcular una serie de "etapas teóricas" para indicar la eficiencia de separación de la columna de relleno con respecto a los platos más tradicionales. Los rellenos de diferentes formas tienen diferentes áreas de superficie y espacio vacío entre los rellenos. Ambos factores afectan el rendimiento del relleno.
Otro factor, además de la forma y el área de superficie del empaque, que afecta el desempeño del empaque aleatorio o estructurado es la distribución del líquido y del vapor que ingresa al lecho empacado. El número de etapas teóricas requeridas para lograr una separación dada se calcula utilizando una relación específica de vapor a líquido. Si el líquido y el vapor no se distribuyen uniformemente a través del área superficial de la torre a medida que ingresan al lecho empacado, la relación de líquido a vapor no será correcta en el lecho empacado y no se logrará la separación requerida. El empaque parecerá no estar funcionando correctamente. La altura equivalente a un plato teórico (HETP) será mayor que la esperada. El problema no es el empaque en sí, sino la mala distribución de los fluidos que ingresan al lecho empacado. La mala distribución del líquido es más frecuente que el vapor. El diseño de los distribuidores de líquido utilizados para introducir la alimentación y el reflujo a un lecho empacado es fundamental para que el empaque funcione con la máxima eficiencia. Se pueden encontrar métodos para evaluar la efectividad de un distribuidor de líquido para distribuir uniformemente el líquido que ingresa a un lecho empacado en las referencias. [50] [51] Fractionation Research, Inc. (comúnmente conocida como FRI) ha realizado un trabajo considerable sobre este tema. [52]
El objetivo de la destilación de múltiples efectos es aumentar la eficiencia energética del proceso, para su uso en la desalinización o, en algunos casos, en una etapa de la producción de agua ultrapura . El número de efectos es inversamente proporcional a la cifra de kW·h/m 3 de agua recuperada y se refiere al volumen de agua recuperada por unidad de energía en comparación con la destilación de un solo efecto. Un efecto es aproximadamente 636 kW·h/m 3 :
Existen muchos otros tipos de procesos de destilación de efecto múltiple, incluido uno conocido simplemente como destilación de efecto múltiple (MED), en el que se emplean múltiples cámaras con intercambiadores de calor intermedios.
Los materiales vegetales que contienen carbohidratos se dejan fermentar, produciendo una solución diluida de etanol en el proceso. Los licores como el whisky y el ron se preparan destilando estas soluciones diluidas de etanol. Los componentes distintos del etanol, incluidos el agua, los ésteres y otros alcoholes, se recogen en el condensado, lo que explica el sabor de la bebida. Algunas de estas bebidas se almacenan luego en barriles u otros recipientes para adquirir más compuestos aromáticos y sabores característicos.
Como ya se ha mencionado, la evidencia textual de la destilación sumerio-babilónica se revela en un grupo de tablillas acádicas que describen operaciones de perfumería, fechadas alrededor del año 1200 a. C.
parece ser la dinastía Han del Este... el período más probable para el comienzo de la verdadera destilación de bebidas espirituosas en China es durante las dinastías Jin y Song del Sur.