
En química orgánica , un alcano , o parafina (un nombre histórico trivial que también tiene otros significados ), es un hidrocarburo saturado acíclico . En otras palabras, un alcano consta de átomos de hidrógeno y carbono dispuestos en una estructura de árbol en la que todos los enlaces carbono-carbono son simples . [1] Los alcanos tienen la fórmula química general C n H 2 n +2 . Los alcanos varían en complejidad desde el caso más simple del metano ( CH 4 ), donde n = 1 (a veces llamado molécula madre), hasta moléculas arbitrariamente grandes y complejas, como el pentacontano ( C 50 H 102 ) o el 6-etil-2-. metil-5-(1-metiletil) octano, un isómero del tetradecano ( C 14 H 30 ).
La Unión Internacional de Química Pura y Aplicada ( IUPAC) define los alcanos como "hidrocarburos acíclicos ramificados o no ramificados que tienen la fórmula general CnH2n + 2 y , por lo tanto, están compuestos enteramente por átomos de hidrógeno y átomos de carbono saturados". Sin embargo, algunas fuentes utilizan el término para indicar cualquier hidrocarburo saturado, incluidos aquellos que son monocíclicos (es decir, los cicloalcanos ) o policíclicos , a pesar de tener una fórmula general distinta (es decir, los cicloalcanos son CnH2n ) .
En un alcano, cada átomo de carbono tiene hibridación sp 3 con 4 enlaces sigma (ya sea C – C o C – H ), y cada átomo de hidrógeno está unido a uno de los átomos de carbono (en un enlace C – H). La serie más larga de átomos de carbono unidos en una molécula se conoce como esqueleto de carbono o columna vertebral de carbono. El número de átomos de carbono puede considerarse como el tamaño del alcano.
Un grupo de los alcanos superiores son las ceras , sólidos a temperatura y presión ambiente estándar (SATP), para los cuales el número de átomos de carbono en la cadena principal de carbono es mayor que aproximadamente 17. Con sus unidades CH 2 repetidas , los alcanos constituyen un homólogo. Serie de compuestos orgánicos en los que los miembros difieren en masa molecular en múltiplos de 14,03 u (la masa total de cada unidad de puente de metileno , que comprende un único átomo de carbono con una masa de 12,01 u y dos átomos de hidrógeno con una masa de ~1,01 u cada uno). .
El metano es producido por bacterias metanogénicas y algunos alcanos de cadena larga funcionan como feromonas en determinadas especies animales o como ceras protectoras en plantas y hongos. Sin embargo, la mayoría de los alcanos no tienen mucha actividad biológica . Pueden verse como árboles moleculares de los que se pueden colgar los grupos funcionales más activos/reactivos de moléculas biológicas.
Los alcanos tienen dos fuentes comerciales principales: petróleo (petróleo crudo) y gas natural .
Un grupo alquilo es un fragmento molecular a base de alcano que tiene una valencia abierta para el enlace. Generalmente se abrevian con el símbolo de cualquier grupo organilo , R, aunque a veces se usa Alk para simbolizar específicamente un grupo alquilo (a diferencia de un grupo alquenilo o un grupo arilo).
Normalmente, la distancia del enlace simple CC es de 1,53 ångströms (1,53 × 10 −10 m). [2] Los hidrocarburos saturados pueden ser lineales, ramificados o cíclicos . El tercer grupo a veces se denomina cicloalcanos . [1] Son posibles estructuras muy complicadas combinando alcanos lineales, ramificados y cíclicos.

Los alcanos con más de tres átomos de carbono pueden disponerse de diversas formas, formando isómeros estructurales . El isómero más simple de un alcano es aquel en el que los átomos de carbono están dispuestos en una sola cadena sin ramificaciones. Este isómero a veces se denomina n -isómero ( n de "normal", aunque no es necesariamente el más común). Sin embargo, la cadena de átomos de carbono también puede estar ramificada en uno o varios puntos. El número de posibles isómeros aumenta rápidamente con el número de átomos de carbono. Por ejemplo, para alcanos acíclicos: [3]
Los alcanos ramificados pueden ser quirales . Por ejemplo, el 3-metilhexano y sus homólogos superiores son quirales debido a su centro estereogénico en el átomo de carbono número 3. La lista anterior sólo incluye diferencias de conectividad, no estereoquímica. Además de los isómeros de alcano, la cadena de átomos de carbono puede formar uno o más anillos. Estos compuestos se denominan cicloalcanos y también están excluidos de la lista anterior porque al cambiar el número de anillos cambia la fórmula molecular . Por ejemplo, el ciclobutano y el metilciclopropano son isómeros entre sí (C 4 H 8 ), pero no son isómeros del butano (C 4 H 10 ).
Los alcanos ramificados son más termodinámicamente estables que sus isómeros lineales (o menos ramificados). Por ejemplo, el 2,2,3,3-tetrametilbutano, altamente ramificado, es aproximadamente 1,9 kcal/mol más estable que su isómero lineal, el n -octano. [4]
La nomenclatura IUPAC (forma sistemática de nombrar compuestos) para los alcanos se basa en la identificación de cadenas de hidrocarburos. Las cadenas de hidrocarburos saturados y no ramificados se nombran sistemáticamente con un prefijo numérico griego que denota el número de carbonos y el sufijo "-ano". [5]
En 1866, August Wilhelm von Hofmann sugirió sistematizar la nomenclatura utilizando la secuencia completa de vocales a, e, i, o y u para crear los sufijos -ane, -ene, -ine (o -yne), -one, -une, para los hidrocarburos C n H 2 n +2 , C n H 2 n , C n H 2 n −2 , C n H 2 n −4 , C n H 2 n −6 . [6] En la nomenclatura moderna, los tres primeros nombran específicamente hidrocarburos con enlaces simples, dobles y triples; [7] mientras que "-one" ahora representa una cetona .
Los alcanos de cadena lineal a veces se indican con el prefijo "n-" o " n -" (para "normal") cuando existe un isómero no lineal . Aunque esto no es estrictamente necesario y no forma parte del sistema de denominación de la IUPAC, el uso sigue siendo común en los casos en los que se desea enfatizar o distinguir entre los isómeros de cadena lineal y de cadena ramificada, por ejemplo, " n -butano " en lugar de simplemente "butano" para diferenciarlo del isobutano . Los nombres alternativos para este grupo utilizados en la industria petrolera son parafinas lineales o n -parafinas .
Los primeros ocho miembros de la serie (en términos de número de átomos de carbono) se nombran de la siguiente manera:
Los primeros cuatro nombres se derivaron de metanol , éter , ácido propiónico y ácido butírico . Los alcanos con cinco o más átomos de carbono se nombran agregando el sufijo -ano al prefijo multiplicador numérico apropiado [8] con elisión de cualquier vocal terminal ( -a o -o ) del término numérico básico. Por tanto, pentano , C 5 H 12 ; hexano , C6H14 ; _ _ heptano , C7H16 ; _ _ octano , C8H18 ; _ _ etc. El prefijo numérico es generalmente griego; sin embargo, los alcanos con un número de átomos de carbono que termina en nueve, por ejemplo nonano , utilizan el prefijo latino no- .

Los alcanos ramificados simples suelen tener un nombre común que utiliza un prefijo para distinguirlos de los alcanos lineales, por ejemplo n -pentano , isopentano y neopentano .
Se pueden utilizar las convenciones de nomenclatura de la IUPAC para producir un nombre sistemático.
Los pasos clave en la denominación de alcanos ramificados más complicados son los siguientes: [9]
Aunque técnicamente es distinta de los alcanos, algunos se refieren a esta clase de hidrocarburos como "alcanos cíclicos". Como implica su descripción, contienen uno o más anillos.
Los cicloalcanos simples tienen el prefijo "ciclo-" para distinguirlos de los alcanos. Los cicloalcanos se nombran según sus contrapartes acíclicas con respecto al número de átomos de carbono en sus cadenas principales, por ejemplo, el ciclopentano (C 5 H 10 ) es un cicloalcano con 5 átomos de carbono al igual que el pentano (C 5 H 12 ), pero están unidos. formando un anillo de cinco miembros. De manera similar, propano y ciclopropano , butano y ciclobutano , etc.
Los cicloalcanos sustituidos se denominan de manera similar a los alcanos sustituidos: se indica el anillo de cicloalcano y los sustituyentes según su posición en el anillo, con la numeración decidida por las reglas de prioridad de Cahn-Ingold-Prelog . [8]
El nombre trivial (no sistemático ) de los alcanos es "parafinas". Juntos, los alcanos se conocen como la "serie de parafinas". Los nombres triviales de los compuestos suelen ser artefactos históricos. Fueron acuñados antes del desarrollo de nombres sistemáticos y se han conservado debido al uso familiar en la industria. Los cicloalcanos también se llaman naftenos. [11] [12]
Los alcanos de cadena ramificada se denominan isoparafinas . "Parafina" es un término general y a menudo no distingue entre compuestos puros y mezclas de isómeros , es decir, compuestos de la misma fórmula química , por ejemplo, pentano e isopentano .
Los siguientes nombres triviales se conservan en el sistema IUPAC:
Ocasionalmente se utilizan algunos nombres triviales que no pertenecen a la IUPAC:
Todos los alcanos son incoloros. [14] [15] Los alcanos con los pesos moleculares más bajos son gases, los de peso molecular intermedio son líquidos y los más pesados son sólidos cerosos. [16] [17]

Los alcanos experimentan fuerzas intermoleculares de van der Waals . Los efectos acumulativos de estas fuerzas intermoleculares dan lugar a mayores puntos de ebullición de los alcanos. [18]
Dos factores influyen en la fuerza de las fuerzas de van der Waals:
En condiciones estándar , los alcanos desde CH 4 hasta C 4 H 10 son gaseosos; de C 5 H 12 a C 17 H 36 son líquidos; y después de C 18 H 38 son sólidos. Como el punto de ebullición de los alcanos está determinado principalmente por el peso, no debería sorprender que el punto de ebullición tenga una relación casi lineal con el tamaño ( peso molecular ) de la molécula. Como regla general, el punto de ebullición aumenta entre 20 y 30 °C por cada carbono añadido a la cadena; esta regla se aplica a otras series homólogas. [18]
Un alcano de cadena lineal tendrá un punto de ebullición más alto que un alcano de cadena ramificada debido a la mayor superficie de contacto y, por tanto, a las mayores fuerzas de van der Waals, entre moléculas adyacentes. Por ejemplo, compare el isobutano (2-metilpropano) y el n-butano (butano), que hierven a -12 y 0 °C, y el 2,2-dimetilbutano y el 2,3-dimetilbutano, que hierven a 50 y 58 °C, respectivamente. . [18]
Por otro lado, los cicloalcanos tienden a tener puntos de ebullición más altos que sus homólogos lineales debido a las conformaciones bloqueadas de las moléculas, que dan un plano de contacto intermolecular.
Los puntos de fusión de los alcanos siguen una tendencia similar a los puntos de ebullición por la misma razón descrita anteriormente. Es decir, (en igualdad de condiciones) cuanto más grande es la molécula, mayor es el punto de fusión. Existe una diferencia significativa entre los puntos de ebullición y los puntos de fusión. Los sólidos tienen una estructura más rígida y fija que los líquidos. Esta estructura rígida requiere energía para romperse. Por lo tanto, las estructuras sólidas mejor unidas requerirán más energía para romperse. Para los alcanos, esto se puede ver en el gráfico anterior (es decir, la línea azul). Los alcanos impares tienen una tendencia más baja en los puntos de fusión que los alcanos pares. Esto se debe a que los alcanos pares se empaquetan bien en la fase sólida, formando una estructura bien organizada que requiere más energía para romperse. Los alcanos impares se empaquetan menos bien y, por lo tanto, la estructura de empaquetamiento sólido organizada "más suelta" requiere menos energía para romperse. [19] Para una visualización de las estructuras cristalinas, consulte. [20]
Los puntos de fusión de los alcanos de cadena ramificada pueden ser mayores o menores que los de los correspondientes alcanos de cadena lineal, dependiendo nuevamente de la capacidad del alcano en cuestión para compactarse bien en la fase sólida.
Los alcanos no conducen electricidad de ninguna manera ni están sustancialmente polarizados por un campo eléctrico . Por este motivo, no forman enlaces de hidrógeno y son insolubles en disolventes polares como el agua. Dado que los enlaces de hidrógeno entre las moléculas de agua individuales están alineados lejos de una molécula de alcano, la coexistencia de un alcano y agua conduce a un aumento en el orden molecular (una reducción de la entropía ). Como no existe un enlace significativo entre las moléculas de agua y las moléculas de alcano, la segunda ley de la termodinámica sugiere que esta reducción de entropía debe minimizarse minimizando el contacto entre el alcano y el agua: se dice que los alcanos son hidrófobos porque son insolubles en agua.
Su solubilidad en disolventes apolares es relativamente alta, propiedad que se denomina lipofilicidad . Los alcanos, por ejemplo, son miscibles entre sí en todas las proporciones.
La densidad de los alcanos suele aumentar con el número de átomos de carbono, pero sigue siendo menor que la del agua. Por tanto, los alcanos forman la capa superior en una mezcla de alcano y agua. [21]
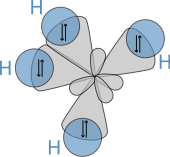
La estructura molecular de los alcanos afecta directamente a sus características físicas y químicas. Se deriva de la configuración electrónica del carbono , que tiene cuatro electrones de valencia . Los átomos de carbono de los alcanos se describen como híbridos sp 3 ; es decir, que, con buena aproximación, los electrones de valencia se encuentran en orbitales dirigidos hacia las esquinas de un tetraedro que se derivan de la combinación del orbital 2s y los tres orbitales 2p. Geométricamente, el ángulo entre los enlaces es cos −1 (−1/3) ≈ 109,47°. Esto es exacto para el caso del metano, mientras que los alcanos más grandes que contienen una combinación de enlaces C-H y C-C generalmente tienen enlaces que están dentro de varios grados de este valor idealizado.

Un alcano tiene sólo enlaces simples C-H y C-C. Los primeros resultan de la superposición de un orbital sp 3 del carbono con el orbital 1s del hidrógeno; este último por la superposición de dos orbitales sp 3 en átomos de carbono adyacentes. Las longitudes de los enlaces ascienden a 1,09 × 10 −10 m para un enlace C – H y 1,54 × 10 −10 m para un enlace C – C.
La disposición espacial de los enlaces es similar a la de los cuatro orbitales sp 3 : están dispuestos en forma tetraédrica, con un ángulo de 109,47° entre ellos. Las fórmulas estructurales que representan los enlaces en ángulo recto entre sí, aunque son comunes y útiles, no representan con precisión la geometría.


La disposición espacial de los enlaces CC y CH se describe mediante los ángulos de torsión de la molécula y se conoce como conformación . En el etano , el caso más simple para estudiar la conformación de los alcanos, hay una rotación casi libre alrededor de un enlace simple carbono-carbono. Dos conformaciones limitantes son importantes: la conformación eclipsada y la conformación escalonada . La conformación escalonada tiene 12,6 kJ/mol (3,0 kcal/mol) menos energía (más estable) que la conformación eclipsada (la menos estable). En alcanos altamente ramificados, el ángulo de enlace puede diferir del valor óptimo (109,5°) para acomodar grupos voluminosos. Tales distorsiones introducen una tensión en la molécula, conocida como impedimento estérico o tensión. La tensión aumenta sustancialmente la reactividad. [22]
Las firmas espectroscópicas de los alcanos se pueden obtener mediante las principales técnicas de caracterización. [23]
El modo de estiramiento CH proporciona fuertes absorciones entre 2850 y 2960 cm -1 y bandas más débiles para el modo de estiramiento CC absorbe entre 800 y 1300 cm -1 . Los modos de flexión carbono-hidrógeno dependen de la naturaleza del grupo: los grupos metilo muestran bandas a 1450 cm -1 y 1375 cm -1 , mientras que los grupos metileno muestran bandas a 1465 cm -1 y 1450 cm -1 . [24] Las cadenas de carbono con más de cuatro átomos de carbono muestran una absorción débil alrededor de 725 cm −1 .
Las resonancias de protones de los alcanos suelen encontrarse en δ H = 0,5–1,5. Las resonancias del carbono 13 dependen del número de átomos de hidrógeno unidos al carbono: δ C = 8–30 (primario, metilo, –CH 3 ), 15–55 (secundario, metileno, –CH 2 –), 20–60 (terciario, metino, C – H) y cuaternario. La resonancia del carbono-13 de los átomos de carbono cuaternarios es característicamente débil, debido a la falta del efecto Overhauser nuclear y al largo tiempo de relajación , y puede pasar desapercibida en muestras débiles o en muestras que no se han analizado durante un tiempo suficientemente largo.
Dado que los alcanos tienen altas energías de ionización , sus espectros de masas de impacto electrónico muestran corrientes débiles para sus iones moleculares. El patrón de fragmentación puede ser difícil de interpretar, pero en el caso de alcanos de cadena ramificada, la cadena de carbono se escinde preferentemente en carbonos terciarios o cuaternarios debido a la relativa estabilidad de los radicales libres resultantes . El espectro de masas de los alcanos de cadena lineal se ilustra con el del dodecano : el fragmento resultante de la pérdida de un único grupo metilo ( M − 15) está ausente, los fragmentos son más intensos que el ion molecular y están espaciados por intervalos de 14 masas. unidades, correspondientes a la pérdida de grupos CH 2 . [25]
Los alcanos reaccionan débilmente con la mayoría de los compuestos químicos. Solo reaccionan con los reactivos electrófilos más fuertes en virtud de sus fuertes enlaces C-H (~100 kcal/mol) y enlaces C-C (~90 kcal/mol). También son relativamente poco reactivos hacia los radicales libres. Esta inercia es la fuente del término parafinas (con el significado aquí de "falta de afinidad"). En el petróleo crudo, las moléculas de alcanos han permanecido químicamente sin cambios durante millones de años.
Se estima que los valores de la constante de disociación ácida (p K a ) de todos los alcanos oscilan entre 50 y 70, según el método de extrapolación, por lo que son ácidos extremadamente débiles que son prácticamente inertes a las bases (ver: ácidos carbónicos ). También son bases extremadamente débiles, que no sufren protonación observable en ácido sulfúrico puro ( H 0 ~ −12), aunque se sabe que superácidos que son al menos millones de veces más fuertes los protonan para dar iones de alcano hipercoordinados (ver: ion metanio ). . Así, una mezcla de pentafluoruro de antimonio (SbF 5 ) y ácido fluorosulfónico (HSO 3 F), llamado ácido mágico , puede protonar alcanos. [26]
Todos los alcanos reaccionan con el oxígeno en una reacción de combustión , aunque se vuelven cada vez más difíciles de encender a medida que aumenta el número de átomos de carbono. La ecuación general para la combustión completa es:
En ausencia de suficiente oxígeno, se puede formar monóxido de carbono o incluso hollín , como se muestra a continuación:
Por ejemplo, metano :
Consulte la tabla de calor de formación de alcanos para obtener datos detallados. El cambio de entalpía estándar de combustión , Δ c H ⊖ , para los alcanos aumenta en aproximadamente 650 kJ/mol por grupo CH 2 . Los alcanos de cadena ramificada tienen valores más bajos de Δ c H ⊖ que los alcanos de cadena lineal del mismo número de átomos de carbono, por lo que se puede considerar que son algo más estables.
Algunos organismos son capaces de metalbolizar alcanos. [27] [28] Las metanomonooxigenasas convierten el metano en metanol . Para los alcanos superiores, el citocromo P450 convierte los alcanos en alcoholes, que luego son susceptibles de degradación.
Los radicales libres , moléculas con electrones desapareados, desempeñan un papel importante en la mayoría de las reacciones de los alcanos. Las reacciones de halogenación de radicales libres ocurren con halógenos, dando lugar a la producción de haloalcanos . Los átomos de hidrógeno del alcano son sustituidos progresivamente por átomos de halógeno. La reacción de los alcanos y el flúor es muy exotérmica y puede provocar una explosión. [29] Estas reacciones son una ruta industrial importante para los hidrocarburos halogenados. Hay tres pasos:
Los experimentos han demostrado que toda halogenación produce una mezcla de todos los isómeros posibles, lo que indica que todos los átomos de hidrógeno son susceptibles de reaccionar. Sin embargo, la mezcla que se produce no es estadística: los átomos de hidrógeno secundarios y terciarios se reemplazan preferentemente debido a la mayor estabilidad de los radicales libres secundarios y terciarios. Un ejemplo se puede ver en la monobrominación del propano: [18]

En la reacción de Reed , el dióxido de azufre y el cloro convierten los hidrocarburos en cloruros de sulfonilo bajo la influencia de la luz .
En algunas condiciones, los alcanos sufrirán nitración .
Ciertos complejos de metales de transición promueven reacciones no radicales con alcanos, lo que resulta en reacciones de activación de enlaces C-H . [30]
El craqueo rompe moléculas más grandes en otras más pequeñas. Esta reacción requiere calor y catalizadores. El proceso de craqueo térmico sigue un mecanismo homolítico con formación de radicales libres . El proceso de craqueo catalítico implica la presencia de catalizadores ácidos (normalmente ácidos sólidos como sílice-alúmina y zeolitas ), que promueven una rotura heterolítica (asimétrica) de enlaces produciendo pares de iones de cargas opuestas, normalmente un carbocatión . Los radicales libres y cationes localizados en carbono son altamente inestables y sufren procesos de reordenamiento de cadenas, escisión C-C en posición beta (es decir, craqueo) y transferencia de hidrógeno o transferencia de hidruro intra e intermolecular . En ambos tipos de procesos, los correspondientes intermediarios reactivos (radicales, iones) se regeneran permanentemente y, por lo tanto, se desarrollan mediante un mecanismo de cadena autopropagante. La cadena de reacciones finaliza finalmente mediante recombinación de radicales o iones. [ cita necesaria ]
Dragan y su colega fueron los primeros en informar sobre la isomerización de los alcanos. [31] La isomerización y la reformación son procesos en los que los alcanos de cadena lineal se calientan en presencia de un catalizador de platino . En la isomerización, los alcanos se convierten en isómeros de cadena ramificada. Es decir, no pierde carbonos ni hidrógenos, manteniendo el mismo peso molecular. [31] En la reforma, los alcanos se convierten en cicloalcanos o hidrocarburos aromáticos , desprendiendo hidrógeno como subproducto. Ambos procesos aumentan el octanaje de la sustancia. El butano es el alcano más común que se somete al proceso de isomerización, ya que produce muchos alcanos ramificados con altos índices de octanaje. [31]
En el reformado con vapor , los alcanos reaccionan con el vapor en presencia de un catalizador de níquel para dar hidrógeno y monóxido de carbono.


Los alcanos forman una pequeña porción de las atmósferas de los planetas gaseosos exteriores como Júpiter (0,1% metano, 2 ppm de etano), Saturno (0,2% metano, 5 ppm de etano), Urano (1,99% metano, 2,5 ppm de etano) y Neptuno ( 1,5% metano, 1,5 ppm de etano). Titán (1,6% metano), un satélite de Saturno, fue examinado por la sonda Huygens , que indicó que la atmósfera de Titán llueve periódicamente metano líquido sobre la superficie de la luna. [32] También en Titán, la misión Cassini ha fotografiado lagos estacionales de metano/etano cerca de las regiones polares de Titán. También se han detectado metano y etano en la cola del cometa Hyakutake . El análisis químico mostró que las abundancias de etano y metano eran aproximadamente iguales, lo que se cree que implica que sus hielos se formaron en el espacio interestelar, lejos del Sol, lo que habría evaporado estas moléculas volátiles. [33] También se han detectado alcanos en meteoritos como las condritas carbonosas .
En la atmósfera terrestre se encuentran trazas de gas metano (aproximadamente 0,0002% o 1745 ppb), producidas principalmente por microorganismos metanogénicos , como Archaea , en el intestino de los rumiantes. [34]
Las fuentes comerciales más importantes de alcanos son el gas natural y el petróleo . [18] El gas natural contiene principalmente metano y etano, con algo de propano y butano : el petróleo es una mezcla de alcanos líquidos y otros hidrocarburos . Estos hidrocarburos se formaron cuando los animales y plantas marinos (zooplancton y fitoplancton) murieron y se hundieron en el fondo de mares antiguos y fueron cubiertos de sedimentos en un ambiente anóxico y convertidos durante muchos millones de años a altas temperaturas y alta presión a su forma actual. El gas natural resulta, por ejemplo, de la siguiente reacción:
Estos depósitos de hidrocarburos, recolectados en rocas porosas atrapadas debajo de rocas impermeables, comprenden campos petroleros comerciales . Se han formado a lo largo de millones de años y una vez agotados no pueden ser reemplazados fácilmente. El agotamiento de estas reservas de hidrocarburos es la base de lo que se conoce como crisis energética .
Los alcanos tienen baja solubilidad en agua, por lo que su contenido en los océanos es insignificante; sin embargo, a altas presiones y bajas temperaturas (como en el fondo de los océanos), el metano puede cocristalizar con agua para formar un clatrato de metano sólido (hidrato de metano). Aunque actualmente no se puede explotar comercialmente, la cantidad de energía combustible de los yacimientos de clatrato de metano conocidos supera el contenido energético de todos los yacimientos de gas natural y petróleo juntos. El metano extraído del clatrato de metano es, por tanto, un candidato para los combustibles del futuro.

Aparte del petróleo y el gas natural, los alcanos se encuentran significativamente en la naturaleza sólo como metano, que es producido por algunas arqueas mediante el proceso de metanogénesis . Estos organismos se encuentran en el intestino de las termitas [35] y las vacas. [36] El metano se produce a partir de dióxido de carbono u otros compuestos orgánicos. La energía se libera mediante la oxidación del hidrógeno :
Es probable que nuestros actuales depósitos de gas natural se formaran de manera similar. [37]
RCH2\sCH3}} (R = alquilo )
Otra ruta hacia los alcanos es la hidrogenólisis , que implica la ruptura de enlaces de heteroátomos de C utilizando hidrógeno. En la industria, los principales sustratos son las impurezas organonitrógenas y organosulfuradas, es decir, los heteroátomos son N y S. Los procesos específicos se denominan hidrodesnitrificación e hidrodesulfuración :
La hidrogenólisis se puede aplicar a la conversión de prácticamente cualquier grupo funcional en hidrocarburos. Los sustratos incluyen haloalcanos, alcoholes, aldehídos, cetonas, ácidos carboxílicos, etc. En las refinerías se practican tanto la hidrogenólisis como la hidrogenación. Esto se puede efectuar mediante el uso de hidruro de litio y aluminio , reducción de Clemmenson y otras rutas especializadas.
El carbón es un precursor más tradicional de los alcanos. Durante siglos se ha practicado intensamente una amplia gama de tecnologías. [38] Simplemente calentar carbón produce alcanos, dejando coque . Las tecnologías relevantes incluyen el proceso Bergius y la licuefacción del carbón . La combustión parcial de carbón y compuestos orgánicos sólidos relacionados genera monóxido de carbono , que puede hidrogenarse mediante el proceso de Fischer-Tropsch . Esta tecnología permite sintetizar hidrocarburos líquidos, incluidos los alcanos. Este método se utiliza para producir sustitutos de los destilados del petróleo .
Rara vez hay interés en la síntesis de alcanos, ya que normalmente están disponibles comercialmente y son menos valorados que prácticamente cualquier precursor. El método más conocido es la hidrogenación de alquenos . Muchos enlaces CX se pueden convertir en enlaces CH mediante hidruro de litio y aluminio , reducción de Clemmenson y otras rutas especializadas. [39] La hidrólisis de reactivos de alquil Grignard y compuestos de alquil litio da alcanos. [40]
El uso dominante de los alcanos es como combustibles. El propano y el butano , gases fácilmente licuables, se conocen comúnmente como gas licuado de petróleo (GLP). [41] Desde el pentano hasta el octano, los alcanos son líquidos muy volátiles. Se utilizan como combustible en los motores de combustión interna , ya que se vaporizan fácilmente al entrar en la cámara de combustión sin formar gotas que perjudiquen la uniformidad de la combustión. Se prefieren los alcanos de cadena ramificada porque son mucho menos propensos a la ignición prematura, lo que provoca golpes , que sus homólogos de cadena lineal. Esta propensión a la ignición prematura se mide por el octanaje del combustible, donde el 2,2,4-trimetilpentano ( isooctano ) tiene un valor arbitrario de 100 y el heptano tiene un valor de cero. Además de su uso como combustible, los alcanos medios también son buenos disolventes para sustancias apolares. Los alcanos, desde el nonano hasta, por ejemplo, el hexadecano (un alcano con dieciséis átomos de carbono) son líquidos de mayor viscosidad , cada vez menos adecuados para su uso en gasolina. En cambio, constituyen la mayor parte del diésel y del combustible de aviación . Los combustibles diésel se caracterizan por su índice de cetano , siendo cetano un nombre antiguo para el hexadecano. Sin embargo, los puntos de fusión más altos de estos alcanos pueden causar problemas a bajas temperaturas y en regiones polares, donde el combustible se vuelve demasiado espeso para fluir correctamente.
Mediante el proceso de craqueo , los alcanos pueden convertirse en alquenos . Los alquenos simples son precursores de polímeros, como el polietileno y el polipropileno . Cuando el craqueo se lleva al extremo, los alcanos pueden convertirse en negro de humo , que es un componente importante de los neumáticos.
La cloración del metano produce clorometanos, que se utilizan como disolventes y componentes básicos para compuestos complejos. De manera similar, el tratamiento del metano con azufre da disulfuro de carbono . Otros productos químicos más se preparan mediante reacción con trióxido de azufre y óxido nítrico.
Algunos hidrocarburos ligeros se utilizan como aerosoles .
Los alcanos, desde el hexadecano en adelante, constituyen los componentes más importantes del fueloil y del aceite lubricante . En esta última función actúan al mismo tiempo como agentes anticorrosivos, ya que su naturaleza hidrófoba impide que el agua pueda llegar a la superficie del metal. Muchos alcanos sólidos encuentran uso como cera de parafina , por ejemplo, en velas . Sin embargo, no debe confundirse con la cera verdadera , que se compone principalmente de ésteres .
Los alcanos con una longitud de cadena de aproximadamente 35 o más átomos de carbono se encuentran en el betún , utilizado, por ejemplo, en el revestimiento de carreteras. Sin embargo, los alcanos superiores tienen poco valor y normalmente se dividen en alcanos inferiores mediante craqueo .
Los alcanos son altamente inflamables, pero tienen baja toxicidad. El metano "es toxicológicamente prácticamente inerte". Los alcanos pueden ser asfixiantes y narcóticos. [38]
{{cite book}}: Mantenimiento CS1: falta el editor de la ubicación ( enlace )