La biogeoquímica de isótopos de hidrógeno (HIBGC) es el estudio científico de los procesos biológicos, geológicos y químicos en el medio ambiente utilizando la distribución y abundancia relativa de los isótopos de hidrógeno . El hidrógeno tiene dos isótopos estables, protio 1 H y deuterio 2 H, que varían en abundancia relativa en el orden de cientos de permil . La relación entre estas dos especies puede denominarse firma isotópica de hidrógeno de una sustancia. La comprensión de las huellas isotópicas y las fuentes de fraccionamiento que conducen a la variación entre ellas se puede aplicar para abordar una amplia gama de preguntas que van desde la ecología y la hidrología hasta la geoquímica y las reconstrucciones paleoclimáticas . Dado que se requieren técnicas especializadas para medir la composición isotópica del hidrógeno natural (HIC), la HIBGC proporciona herramientas especializadas únicas para campos más tradicionales como la ecología y la geoquímica.
El estudio de los isótopos estables del hidrógeno comenzó con el descubrimiento del deuterio por el químico Harold Urey . [1] Aunque el neutrón no se descubrió hasta 1932, [2] Urey comenzó a buscar "hidrógeno pesado" en 1931. Urey y su colega George Murphy calcularon el corrimiento al rojo del hidrógeno pesado a partir de la serie de Balmer y observaron líneas muy débiles en un estudio espectrográfico . Para intensificar las líneas espectroscópicas para obtener datos publicables, Murphy y Urey se asociaron con Ferdinand Brickwedde y destilaron un grupo más concentrado de hidrógeno pesado, ahora llamado deuterio . Este trabajo sobre los isótopos del hidrógeno le valió a Urey el Premio Nobel de Química de 1934. [3]

También en 1934, los científicos Ernest Rutherford , Mark Oliphant y Paul Harteck produjeron el radioisótopo tritio (hidrógeno-3, 3 H) al golpear deuterio con núcleos de alta energía. El deuterio utilizado en el experimento fue un generoso regalo de agua pesada del físico de la UC Berkeley Gilbert N. Lewis . [4] El bombardeo de deuterio produjo dos isótopos no detectados previamente, helio-3 ( 3 He) y 3 H. Rutherford y sus colegas crearon con éxito 3 H, pero asumieron incorrectamente que 3 He era el componente radiactivo. El trabajo de Luis Walter Alvarez y Robert Cornog [5] aisló por primera vez 3 H y revirtió la noción incorrecta de Rutherford. Alvarez razonó que el tritio era radiactivo, pero no midió la vida media, aunque los cálculos en ese momento sugerían >10 años. Al final de la Segunda Guerra Mundial , el químico físico Willard Libby detectó la radiactividad residual de una muestra de tritio con un contador Geiger , [4] proporcionando una comprensión más precisa de la vida media , ahora aceptada como 12,3 años. [6]
El descubrimiento de los isótopos de hidrógeno también impactó a la física en la década de 1940, cuando se inventó por primera vez la espectroscopia de resonancia magnética nuclear . Los químicos orgánicos ahora usan la resonancia magnética nuclear (RMN) para mapear las interacciones de las proteínas [7] o identificar compuestos pequeños, [8] pero la RMN fue primero un proyecto apasionante de los físicos. Se descubrió que los tres isótopos del hidrógeno tenían propiedades magnéticas adecuadas para la espectroscopia de RMN. El primer químico en expresar completamente una aplicación de la RMN fue George Pake , quien midió el yeso ( ) como cristal y polvo. [9] La señal observada, llamada doblete de Pake , provenía de los hidrógenos magnéticamente activos en el agua. Luego, Pake calculó la longitud del enlace protón-protón . Las mediciones de RMN se revolucionaron aún más cuando las máquinas comerciales estuvieron disponibles en la década de 1960. Antes de esto, los experimentos de RMN implicaban construir proyectos masivos, ubicar imanes grandes y cablear a mano kilómetros de bobinas de cobre. [10] La RMN de protones siguió siendo la técnica más popular a lo largo de los avances en las décadas siguientes, pero el 2H y el 3H se utilizaron en otras variantes de la espectroscopia de RMN. El 2H tiene un momento magnético y un espín diferentes a los del 1H , pero generalmente una señal mucho más pequeña. Históricamente, la RMN de deuterio es una alternativa pobre a la RMN de protones, pero se ha utilizado para estudiar el comportamiento de los lípidos en las membranas celulares . [11] Una variante de la RMN de 2H llamada 2H -SNIF ha demostrado potencial para comprender las composiciones de isótopos específicos de la posición y comprender las vías biosintéticas. [12] El tritio también se utiliza en RMN, [13] ya que es el único núcleo más sensible que el 1H , generando señales muy grandes. Sin embargo, la radiactividad del tritio desalentó muchos estudios de RMN de 3H .
Aunque la radiactividad del tritio desalienta su uso en espectroscopia , el tritio es esencial para las armas nucleares . Los científicos comenzaron a comprender la energía nuclear ya en el siglo XIX, pero los grandes avances en los estudios de la bomba atómica se produjeron a principios de la década de 1940. Las investigaciones en tiempos de guerra, especialmente el Proyecto Manhattan , hicieron avanzar enormemente la comprensión de la radiactividad . El 3H es un subproducto de los reactores , resultado de golpear el litio-6 con neutrones , lo que produce casi 5 MeV de energía.

En las armas de fisión potenciadas, se calienta una mezcla de 2 H y 3 H hasta que se produce una fusión termonuclear para producir helio y neutrones libres . [14] Estos neutrones rápidos provocan entonces una mayor fisión, creando un "impulso". En 1951, en la Operación Greenhouse , un prototipo llamado George, validó la prueba de concepto para tal arma. [15] Sin embargo, la primera bomba de fisión potenciada verdadera, Greenhouse Item , se probó con éxito en 1952, dando un rendimiento de 45,5 kilotones, casi el doble que una bomba sin potencia. [15] Estados Unidos dejó de producir tritio en reactores nucleares en 1988, [16] pero las pruebas nucleares en la década de 1950 añadieron grandes picos de radionucleidos al aire, especialmente carbono-14 y 3 H. [17] [18] Esto complicó las mediciones para los geólogos que utilizaban la datación por carbono . Sin embargo, algunos oceanógrafos se beneficiaron del aumento de 3 H, utilizando la señal en el agua para rastrear la mezcla física de masas de agua. [19]
En biogeoquímica, los científicos se centraron principalmente en el deuterio como trazador de procesos ambientales, especialmente el ciclo del agua . El geoquímico estadounidense Harmon Craig , una vez estudiante de posgrado de Urey, descubrió la relación entre las proporciones de isótopos de hidrógeno y oxígeno del agua de lluvia . La correlación lineal entre los dos isótopos pesados se produce en todo el mundo y se denomina línea de agua meteórica global . [20] A fines de la década de 1960, el enfoque de los isótopos de hidrógeno se alejó del agua y se dirigió hacia las moléculas orgánicas . Las plantas usan agua para formar biomasa , pero un estudio de 1967 de Zebrowski, Ponticorvo y Rittenberg descubrió que el material orgánico en las plantas tenía menos 2 H que la fuente de agua. [21] La investigación de Zebrowski midió la concentración de deuterio de los ácidos grasos y aminoácidos derivados de los sedimentos en el proyecto de perforación Mohole . Estudios posteriores de Bruce Smith y Samuel Epstein en 1970 confirmaron el agotamiento de 2 H en los orgánicos en comparación con el agua ambiental. [22] En 1970, otro dúo, Schiegl y Vogel, analizaron el HIC a medida que el agua se convertía en biomasa, la biomasa en carbón y petróleo , y el petróleo en gas natural . [23] En cada paso, encontraron que el 2H se reducía aún más. Un artículo fundamental de 1980 de Marilyn Epstep, ahora M. Fogel, y Thomas Hoering titulado "Biogeoquímica de los isótopos estables de hidrógeno" refinó los vínculos entre los materiales orgánicos y las fuentes. [24]
En esta etapa temprana del estudio de isótopos estables de hidrógeno, la mayoría de las composiciones o fraccionamientos de isótopos se informaron como mediciones a granel de toda la materia orgánica o inorgánica . Algunas excepciones incluyen celulosa [25] [26] y metano [27] , ya que estos compuestos se separan fácilmente. Otra ventaja del metano para mediciones específicas de compuestos es la falta de intercambio de hidrógeno. La celulosa tiene hidrógeno intercambiable, pero la derivatización química puede prevenir el intercambio de hidrógeno de celulosa con agua o fuentes de hidrógeno mineral. Los estudios de celulosa y metano en los años 1970 y 1980 establecieron el estándar para la geoquímica moderna de isótopos de hidrógeno.
La medición de compuestos individuales se hizo posible a fines de la década de 1990 y principios de la década de 2000 con los avances en espectrometría de masas . [28] El Thermo Delta+XL transformó las mediciones como el primer instrumento capaz de realizar análisis de isótopos específicos de compuestos. Entonces fue posible observar muestras más pequeñas con más precisión. Las aplicaciones de isótopos de hidrógeno surgieron rápidamente en la geoquímica del petróleo midiendo el petróleo, la paleoclimatología observando biomarcadores de lípidos y la ecología construyendo dinámicas tróficas . Se están realizando avances en la composición de isótopos agrupados del metano [29] después del desarrollo del termómetro de carbonato . [30] [31] Las mediciones precisas también están permitiendo centrarse en las vías biosintéticas microbianas que involucran hidrógeno. [32] Los ecólogos que estudian los niveles tróficos están especialmente interesados en mediciones específicas de compuestos para reconstruir dietas pasadas y rastrear relaciones depredador-presa. [33] Las máquinas altamente avanzadas ahora prometen análisis de isótopos de hidrógeno específicos de la posición de biomoléculas y gas natural . [34]
Todos los isótopos de un elemento tienen el mismo número de protones con un número variable de neutrones. El hidrógeno tiene tres isótopos naturales: 1 H, 2 H y 3 H; llamados protio (H), deuterio (D) y tritio (T), respectivamente. Tanto 1 H como 2 H son estables, mientras que 3 H es inestable y se desintegra en beta a 3 He. Si bien existen algunas aplicaciones importantes del 3 H en geoquímica (como su uso como trazador de la circulación oceánica ), no se analizarán más en profundidad aquí.
El estudio de la biogeoquímica de isótopos estables implica la descripción de las abundancias relativas de varios isótopos en un determinado grupo químico, así como la forma en que los procesos fisicoquímicos cambian la fracción de esos isótopos en un grupo en comparación con otro. Se han desarrollado varios tipos de notación para describir la abundancia y el cambio en la abundancia de isótopos en estos procesos, y estos se resumen a continuación. En la mayoría de los casos, solo las cantidades relativas de un isótopo son de interés; la concentración absoluta de cualquier isótopo tiene poca importancia.
La descripción más fundamental de los isótopos de hidrógeno en un sistema es la abundancia relativa de 2 H y 1 H. Este valor se puede expresar como relación isotópica 2 R o abundancia fraccional 2 F, definida como:
y
donde x H es la cantidad de isótopo x H. La abundancia fraccionaria es equivalente a la fracción molar y produce el porcentaje de átomos cuando se multiplica por 100. En algunos casos se utiliza el exceso de porcentaje de átomos, que informa el porcentaje de átomos de una muestra menos el porcentaje de átomos de un estándar.
Las proporciones isotópicas de una sustancia se suelen comunicar en comparación con un estándar con composición isotópica conocida, y las mediciones de masas relativas siempre se realizan junto con la medición de un estándar. Para el hidrógeno, se utiliza el estándar de agua oceánica media de Viena , que tiene una proporción isotópica de 155,76 ± 0,1 ppm. El valor delta en comparación con este estándar se define como:
Estos valores delta suelen ser bastante pequeños y normalmente se informan como valores por mil (‰) que surgen de multiplicar la ecuación anterior por un factor de 1000.
El estudio de HIBGC se basa en el hecho de que varios procesos fisicoquímicos enriquecen o agotan preferentemente 2 H en relación con 1 H (véase efecto isotópico cinético [EIC], etc.). Se han desarrollado varias medidas para describir el fraccionamiento de un isótopo entre dos depósitos, a menudo el producto y el reactivo de un proceso fisicoquímico. La notación α describe la diferencia entre dos depósitos de hidrógeno A y B con la ecuación:
donde δ 2 H A es el valor delta del pool A en relación con VSMOW. Como muchos valores delta no varían mucho entre sí, el valor α suele ser muy cercano a la unidad. A menudo se utiliza una medida relacionada llamada épsilon (ε), que se expresa simplemente mediante:
Estos valores suelen ser muy cercanos a cero y se expresan como valores por milímetro multiplicando α − 1 por 1000. Una medida final es Δ, que se pronuncia "cap delta", que es simplemente:
2 H y 1 H son isótopos estables. Por lo tanto, la relación 2 H/ 1 H de un depósito que contiene hidrógeno permanece constante mientras no se añada ni se elimine hidrógeno, una propiedad conocida como conservación de la masa . Cuando dos depósitos de hidrógeno A y B se mezclan con cantidades molares de hidrógeno m A y m B , cada uno con su propia abundancia fraccional inicial de deuterio ( F A y F B ), entonces la abundancia fraccional de la mezcla resultante viene dada por la siguiente ecuación exacta:
Los términos con Σ representan los valores de los depósitos combinados. La siguiente aproximación se utiliza a menudo para los cálculos relativos a la mezcla de dos depósitos con una composición isotópica conocida:
Esta aproximación es conveniente y aplicable con poco error en la mayoría de las aplicaciones que tienen que lidiar con depósitos de hidrógeno de procesos naturales. La diferencia máxima entre el valor delta ( δ ) calculado con las ecuaciones aproximadas y exactas viene dada por la siguiente ecuación:
Este error es bastante pequeño para casi todas las mezclas de valores isotópicos naturales, incluso para el hidrógeno, que puede tener variaciones naturales bastante grandes en los valores δ. [35] La estimación generalmente se evita cuando se encuentran valores δ anormalmente grandes, lo que es especialmente común en los experimentos de etiquetado isotópico .
Los procesos naturales dan lugar a amplias variaciones en la relación D/H (DHR) en diferentes depósitos de hidrógeno. Los KIE y los cambios físicos como la precipitación y la evaporación conducen a estas variaciones observadas. El agua de mar varía ligeramente, entre 0 y −10 por mil, mientras que el agua atmosférica puede variar entre aproximadamente −200‰ y +100‰. Las biomoléculas sintetizadas por los organismos conservan parte de la firma D/H del agua en la que crecieron, además de un gran factor de fraccionamiento que puede ser de varios cientos de ‰. Se pueden encontrar grandes diferencias D/H, de miles de ‰, entre la Tierra y otros cuerpos planetarios como Marte, probablemente debido a variaciones en el fraccionamiento de isótopos durante la formación de los planetas y la pérdida de hidrógeno en el espacio.
Una serie de procesos comunes fraccionan los isótopos de hidrógeno para producir las variaciones isotópicas que se encuentran en la naturaleza. Los procesos físicos comunes incluyen la precipitación y la evaporación. Las reacciones químicas también pueden influir en gran medida en la partición de isótopos pesados y ligeros entre grupos. La velocidad de una reacción química depende en parte de las energías de los enlaces químicos formados y rotos en la reacción. Dado que los diferentes isótopos tienen masas diferentes, las energías de enlace difieren entre los isotólogos de una especie química. Esto dará como resultado una diferencia en la velocidad de una reacción para los diferentes isotólogos, lo que dará como resultado un fraccionamiento de los diferentes isótopos entre el reactivo y el producto en una reacción química. Esto se conoce como el efecto isotópico cinético (EIC). Un ejemplo clásico de EIC es la diferencia de DHR en el equilibrio entre H 2 O y H 2 que puede tener un valor α de hasta 3-4. [36]
En muchas áreas de estudio, el origen de una sustancia química o un grupo de sustancias químicas es de importancia central. Cuestiones como la fuente de los contaminantes ambientales, el origen de las hormonas en el cuerpo de un atleta o la autenticidad de los alimentos y los aromas son ejemplos en los que es necesario identificar y obtener compuestos químicos. Los isótopos de hidrógeno se han utilizado en estas y otras muchas áreas de estudio. Dado que muchos procesos pueden afectar a la DHR de un compuesto determinado, esta relación puede ser una señal diagnóstica para los compuestos producidos en un lugar específico o mediante un proceso determinado. Una vez que se conocen las DHR de varias fuentes, la medición de esta relación para una muestra de origen desconocido a menudo se puede utilizar para vincularla a una determinada fuente o método de producción.
1 H, con un protón y ningún neutrón , es el nucleido más abundante en el Sistema Solar , formado en las primeras rondas de explosiones estelares después del Big Bang . [37] Después de que el universo explotó a la vida, la nube caliente y densa de partículas comenzó a enfriarse, primero formando partículas subatómicas como quarks y electrones , que luego se condensaron para formar protones y neutrones . Los elementos más grandes que el hidrógeno y el helio se produjeron con estrellas sucesivas, formándose a partir de la energía liberada durante las supernovas .
También se sabe que el deuterio , 2 H, con un protón y un neutrón, tiene origen cósmico. Al igual que el protio, el deuterio se produjo muy temprano en la historia del universo, durante la nucleosíntesis del Big Bang (BBN). A medida que los protones y los neutrones se combinaban, se produjo helio-4 con un intermediario deuterio. Las reacciones alfa con 4 He producen muchos de los elementos más grandes que dominan el Sistema Solar actual. Sin embargo, antes de que el universo se enfriara, los fotones de alta energía destruyeron todo el deuterio, impidiendo la formación de elementos más grandes. Esto se llama el cuello de botella del deuterio , una restricción en la línea de tiempo para la nucleosíntesis . Todo el deuterio actual se originó a partir de esta fusión protón-protón después de un enfriamiento suficiente. [38]
El tritio , 3 H, con un protón y dos neutrones, también se produjo por colisiones de protones y neutrones en el universo primitivo, pero desde entonces se ha desintegrado radiactivamente en helio-3 . El tritio actual no puede proceder de BBN, debido a su corta vida media , 12,3 años. La concentración actual de 3 H está gobernada por las reacciones nucleares y los rayos cósmicos . La desintegración beta del 3 H en 3 He libera un electrón y un antineutrino, y unos 18 keV de energía. Se trata de una desintegración de baja energía, por lo que la radiación no puede penetrar la piel. Por tanto, el tritio solo es peligroso si se ingiere o inhala directamente. [39]
1 H es una partícula subatómica de espín 1/2 y, por lo tanto, un fermión . Otros fermiones incluyen neutrones , electrones y tritio. Los fermiones se rigen por el principio de exclusión de Pauli , donde no pueden existir dos partículas con el mismo número cuántico . [40] [41] Sin embargo, los bosones como el deuterio y los fotones no están limitados por la exclusión y múltiples partículas pueden ocupar el mismo estado de energía. Esta diferencia fundamental entre 1 H y 2 H se manifiesta en muchas propiedades físicas. Las partículas con espín entero como el deuterio siguen la estadística de Bose-Einstein, mientras que los fermiones con espines semienteros siguen la estadística de Fermi-Dirac . Las funciones de onda que describen múltiples fermiones deben ser antisimétricas con respecto a las partículas que se intercambian, mientras que las funciones de onda de los bosones son simétricas. [42] Debido a que los bosones son indistinguibles y pueden ocupar el mismo estado, las colecciones de bosones se comportan de manera muy diferente a los fermiones a temperaturas más frías. A medida que los bosones se enfrían y se relajan hasta el estado de energía más bajo, ocurren fenómenos como la superfluidez y la superconductividad . [43]
Los isótopos difieren en el número de neutrones , lo que afecta directamente las propiedades físicas basadas en la masa y el tamaño. El hidrógeno normal (protio, 1 H) no tiene neutrón. El deuterio ( 2 H) tiene un neutrón y el tritio ( 3 H) tiene dos. Los neutrones agregan masa al átomo, lo que genera diferentes propiedades físicas químicas . Este efecto es especialmente fuerte para los isótopos de hidrógeno, ya que el neutrón agregado duplica la masa de 1 H a 2 H. Para elementos más pesados como el carbono , el nitrógeno , el oxígeno o el azufre , la diferencia de masa se diluye.
Los químicos físicos a menudo modelan el enlace químico con el oscilador armónico cuántico (QHO), simplificando un enlace hidrógeno-hidrógeno como dos bolas conectadas por un resorte. [41] [44] El QHO se basa en la ley de Hooke y es una buena aproximación del potencial de Morse que describe con precisión el enlace. Modelar H/ 2 H en una reacción química demuestra las distribuciones de energía de los isótopos en productos y reactivos. Los niveles de energía más bajos para el isótopo más pesado 2 H se pueden explicar matemáticamente por la dependencia del QHO de la inversa de la masa reducida μ. Por lo tanto, una masa reducida mayor es un denominador mayor y, por lo tanto, una energía de punto cero menor y un estado de energía menor en el pozo cuántico .

Calculando la masa reducida de un enlace 1H– 1H versus un enlace 2H– 2H obtenemos :
El oscilador armónico cuántico tiene niveles de energía de la siguiente forma, donde k es la constante del resorte y h es la constante de Planck. [41]
Los efectos de esta distribución de energía se manifiestan en el efecto isotópico cinético (KIE) y el efecto isotópico de equilibrio . [45] En una reacción reversible , en condiciones de equilibrio, la reacción avanza hacia adelante y hacia atrás, distribuyendo los isótopos para minimizar la energía libre termodinámica. Algún tiempo después, en el equilibrio, habrá más isótopos pesados en el lado del producto. La estabilidad de la energía más baja impulsa a los productos a enriquecerse en 2 H en relación con los reactivos. Por el contrario, en condiciones cinéticas, las reacciones son generalmente irreversibles. El paso limitante en la reacción es superar la barrera de energía de activación para alcanzar un estado intermedio. El isótopo más ligero tiene un estado de energía más alto en el pozo cuántico y, por lo tanto, se formará preferentemente en productos. Por lo tanto, en condiciones cinéticas, el producto estará relativamente empobrecido en 2 H.
Los KIE son comunes en los sistemas biológicos y son especialmente importantes para HIBGC. Los KIE suelen dar lugar a fraccionamientos mayores que las reacciones de equilibrio. En cualquier sistema isotópico, los KIE son más fuertes para diferencias de masa mayores. Los isótopos ligeros en la mayoría de los sistemas también tienden a moverse más rápido pero forman enlaces más débiles. A alta temperatura, la entropía explica una gran señal en la composición isotópica. Sin embargo, cuando la temperatura disminuye, los efectos isotópicos se expresan más y la aleatoriedad juega un papel menos importante. Estas tendencias generales se exponen para una mayor comprensión de la ruptura de enlaces, la difusión o efusión y las reacciones de condensación o evaporación .
Una de las principales complicaciones en el estudio de los isótopos de hidrógeno es la cuestión de la intercambiabilidad. En muchas escalas de tiempo, que van desde horas hasta épocas geológicas, los científicos tienen que considerar si las fracciones de hidrógeno en las moléculas estudiadas son las especies originales o si representan un intercambio con agua o hidrógeno mineral cercano. La investigación en esta área aún no es concluyente en lo que respecta a las tasas de intercambio, pero en general se entiende que el intercambio de hidrógeno complica la preservación de la información en los estudios de isótopos.
Los átomos de hidrógeno se separan fácilmente de los enlaces electronegativos , como los enlaces hidroxilo (O–H), los enlaces de nitrógeno (N–H) y los enlaces tiol / mercapto (S–H), en escalas de tiempo que van desde una hora hasta un día. Este intercambio rápido es particularmente problemático para las mediciones de materia orgánica a granel con estos grupos funcionales , porque las composiciones isotópicas tienen más probabilidades de reflejar el agua de origen y no el efecto isotópico. Por lo tanto, los registros del paleoclima que no miden aguas antiguas se basan en otros marcadores isotópicos. Los avances de la década de 1990 ofrecían un potencial prometedor para resolver este problema: se equilibraron las muestras con dos variaciones de agua pesada y se compararon. Sus proporciones representan un factor de intercambio que puede calibrar las mediciones para corregir el intercambio H/ 2H . [46]
Durante algún tiempo, los investigadores creyeron que las grandes moléculas de hidrocarburos eran inmunes al intercambio de hidrógeno, pero trabajos recientes han identificado muchas reacciones que permiten la reordenación de isótopos. El intercambio isotópico se vuelve relevante en escalas de tiempo geológicas y ha impactado el trabajo de los biólogos que estudian los biomarcadores lipídicos y los geólogos que estudian el petróleo antiguo. Las reacciones responsables del intercambio incluyen [46] [47]

No se ha determinado la cinética detallada de estas reacciones. Sin embargo, se sabe que los minerales arcillosos catalizan el intercambio de hidrógeno iónico más rápido que otros minerales. [48] Por lo tanto, los hidrocarburos formados en entornos clásticos intercambian más que los de entornos carbonatados . El hidrógeno aromático y terciario también tienen mayores tasas de intercambio que el hidrógeno primario. Esto se debe a la creciente estabilidad de los carbocationes asociados . [49] Los carbocationes primarios se consideran demasiado inestables para existir y nunca se han aislado en un espectrómetro FT-ICR . [50] Por otro lado, los carbocationes terciarios son relativamente estables y a menudo son intermediarios en las reacciones de química orgánica . Esta estabilidad, que aumenta la probabilidad de pérdida de protones, se debe a la donación de electrones de los átomos de carbono cercanos. La resonancia y los pares solitarios cercanos también pueden estabilizar los carbocationes a través de la donación de electrones . Los carbonos aromáticos son, por tanto, relativamente fáciles de intercambiar.
Muchas de estas reacciones tienen una fuerte dependencia de la temperatura; una temperatura más alta típicamente acelera el intercambio. Sin embargo, pueden prevalecer diferentes mecanismos en cada ventana de temperatura. El intercambio iónico , por ejemplo, es más significativo a baja temperatura. En tales entornos de baja temperatura, existe el potencial de preservar la señal isotópica original del hidrógeno durante cientos de millones de años. [51] Sin embargo, muchas rocas en el tiempo geológico han alcanzado una madurez térmica significativa . Incluso para el inicio de la ventana del petróleo, parece que gran parte del hidrógeno se ha intercambiado. Recientemente, los científicos han explorado un lado positivo: el intercambio de hidrógeno es una reacción cinética de orden cero (para el hidrógeno unido al carbono a 80-100 °C, los tiempos medios son probablemente 10 4 –10 5 años). [51] La aplicación de las matemáticas de las constantes de velocidad permitiría la extrapolación a las composiciones isotópicas originales. Si bien esta solución es prometedora, hay demasiado desacuerdo en la literatura para realizar calibraciones robustas.
Los efectos de los isótopos de vapor se producen para 1 H, 2 H y 3 H, ya que cada isótopo tiene diferentes propiedades termodinámicas en las fases líquida y gaseosa. [52] En el caso del agua, la fase condensada está más enriquecida, mientras que el vapor está más empobrecido. Por ejemplo, la lluvia que se condensa a partir de una nube es más pesada que el punto de partida del vapor. En general, las grandes variaciones en la concentración de deuterio en el agua se deben a fraccionamientos entre depósitos líquidos, de vapor y sólidos. En contraste con el patrón de fraccionamiento del agua, las moléculas no polares, como los aceites y los lípidos, tienen contrapartes gaseosas enriquecidas con deuterio en relación con el líquido. [28] Se cree que esto está asociado con la polaridad de los enlaces de hidrógeno en el agua que no interfieren en los hidrocarburos de cadena larga.

Debido a los procesos de fraccionamiento físico y químico, se informan las variaciones en las composiciones isotópicas de los elementos, y los pesos atómicos estándar de los isótopos de hidrógeno han sido publicados por la Comisión de Pesos Atómicos y Abundancias Isotópicas de la IUPAC . Los HIC se informan en relación con el agua de referencia del Organismo Internacional de Energía Atómica (OIEA). En las reacciones isotópicas de equilibrio de H/ 2 H en general, se observa un enriquecimiento del isótopo pesado en el compuesto con el estado de oxidación más alto . Sin embargo, en nuestro entorno natural, el HIC varía mucho dependiendo de las fuentes y los organismos debido a las complejidades de los elementos que interactúan en estados de desequilibrio. En esta sección, se describen las variaciones observadas en el HIC de las fuentes de agua (hidrosfera), los organismos vivos (biosfera), las sustancias orgánicas (geosfera) y los materiales extraterrestres en el sistema solar.

Se observan variaciones en δD de diferentes fuentes de agua y capas de hielo debido a los procesos de evaporación y condensación . (Ver sección 6 para más detalles.) Cuando el agua de mar está bien mezclada, el δD en equilibrio está cerca de 0‰ (‰ SMOW) con un DHR de 155,76 ppm. Sin embargo, las variaciones continuas en δD son causadas por procesos de evaporación o precipitación que conducen al desequilibrio en los procesos de fraccionamiento. Un gran gradiente de HIC ocurre en las aguas superficiales de los océanos, y el valor de fluctuación en el agua superficial del Atlántico Noroeste es de alrededor de 20‰. Según los datos que examinan el supersegmento sur del Océano Pacífico , a medida que la latitud disminuye de 65˚S a 40˚S, δD fluctúa entre alrededor de −50‰ y −70‰. [54]
El índice de convección hidrotermal (HIC) del agua de mar (no solo del agua superficial) se encuentra en su mayoría en el rango de 0‰ a -10‰. Las estimaciones de δD para diferentes partes del océano en todo el mundo se muestran en el mapa. [55]

Los valores típicos de δD para las capas de hielo en las regiones polares varían de alrededor de −400‰ a −300‰ (‰SMOW). [57] Los valores de δD de los casquetes polares se ven afectados por la distancia al océano abierto, la latitud, la circulación atmosférica y la cantidad de insolación y temperatura. El cambio de temperatura afecta el HIC de los casquetes polares, por lo que el HIC del hielo puede proporcionar estimaciones de los ciclos climáticos históricos, como las líneas de tiempo de los períodos interglaciares y glaciales . [Véase la sección 7.2. Paleo-reconstrucción para más detalles]
Los δD de los casquetes polares a 70 km al sur de la estación Vostok y en la Antártida Oriental son -453,7‰ y -448,4‰ respectivamente, y se muestran en el mapa. [58]

El análisis realizado a partir de datos de mediciones satelitales estima el δD del aire en varias partes del mundo. La tendencia general es que el δD es más negativo a mayor latitud, por lo que el aire sobre la Antártida y el Ártico presenta un nivel de D de entre -230‰ y -260‰ o incluso menos.
Los δD atmosféricos estimados se muestran en el mapa. [60]
Una gran parte del vapor de agua atmosférico global proviene del Pacífico occidental cerca de los trópicos (media 2009) y el HIC del aire depende de la temperatura y la humedad. Las regiones cálidas y húmedas generalmente tienen un δD más alto. [61] El vapor de agua en el aire está en general más agotado que las fuentes de agua terrestres, ya que el 1 H 2 16 O se evapora más rápido que el 1 H 2 H 16 O debido a una mayor presión de vapor. Por otro lado, el agua de lluvia está en general más enriquecida que el vapor de agua atmosférico. [62] [63]

En el mapa se muestran los valores de δD de la precipitación anual en diferentes regiones del mundo. [65] La precipitación es más rica en D cerca del ecuador en los trópicos . Los valores de δD generalmente se encuentran en el rango de alrededor de -30 ~ -150‰ en el hemisferio norte y -30~+30‰ en las áreas terrestres del hemisferio sur. En América del Norte, el δD de la precipitación mensual promedio en todas las regiones es menor en enero (hasta alrededor de -300‰ en Canadá) que en julio (hasta alrededor de -190‰). [65]
La precipitación media general está determinada por el equilibrio entre la evaporación del agua de los océanos y otras aguas superficiales y la condensación del vapor de agua en forma de lluvia. La evaporación neta debe ser igual a la precipitación neta, y el δD para la precipitación es de alrededor de −22‰ (promedio global). [66] La Red Global de Isótopos en Precipitación (GNIP) investiga y monitorea la composición isotópica de la precipitación en varios sitios en todo el mundo. La precipitación media puede estimarse mediante la ecuación, δ 2 H = 8,17(±0,07) δ 18 O + 11,27(±0,65)‰ VSMOW. (Rozanski et al., 1993) Esta ecuación es una versión ligeramente modificada de la ecuación general de la línea global de agua meteórica (GMWL), δ 2 H = 8,13δ 18 O + 10,8, que proporciona la relación promedio entre δ 2 H y δ 18 O de las aguas terrestres naturales. [66] [67]

En el mapa se muestran los δDs frente a VSMOW de lagos en diferentes regiones. [69] El patrón general observado indica que los δDs de las aguas superficiales, incluidos lagos y ríos, son similares a los de la precipitación local. [70]
La composición isotópica del suelo está controlada por la entrada de la precipitación . Por lo tanto, el δD del suelo es similar al de la precipitación local. Sin embargo, debido a la evaporación, el suelo tiende a estar más enriquecido con D que la precipitación. El grado de enriquecimiento varía mucho dependiendo de la humedad atmosférica, la temperatura local y la profundidad del suelo debajo de la superficie. Según el estudio de Meinzer et al. (1999), a medida que aumenta la profundidad del suelo, el δD del agua del suelo disminuye. [70]
Los factores que afectan el δD de los lípidos de las algas son: δD del agua, especie de alga (hasta 160%), tipo de lípido (hasta 170%), salinidad (+0,9 ± 0,2% por PSU), tasa de crecimiento (0 ~ −30% por día) y temperatura (−2 ~ −8% por °C).
En un estudio de Zhang et al. (2009), los δD de los ácidos grasos en cultivos quimiostatizados de Thalassiosira pseudonana fueron −197,3‰, −211,2‰ y −208,0‰ para los ácidos grasos C14, C16 y C18 respectivamente. El δD del ácido graso C16 en las algas A. e. unicocca a 25°C, se determinó utilizando la ecuación empírica y = 0,890 x − 91,730, donde x es el δD del agua en la cosecha. Para otra especie de alga, B. v. aureus , la ecuación fue y = 0,869 x − 74,651. [71]
El grado de fraccionamiento D/H en la mayoría de los lípidos de las algas aumenta con el aumento de la temperatura y disminuye con el aumento de la salinidad. Las tasas de crecimiento tienen diferentes impactos en el fraccionamiento D/H según los tipos de especies. [72]
El δD de los lípidos del fitoplancton se ve afectado en gran medida por el δD del agua, y parece haber una correlación lineal entre esos dos valores. El δD de la mayoría de los demás productos biosintéticos del fitoplancton o las cianobacterias es más negativo que el del agua circundante. [73] Los valores de δD de los ácidos grasos en los metanótrofos que viven en el agua de mar se encuentran entre −50 y −170‰, y los de los esteroles y hopanoles varían entre −150 y −270‰. [74] [75]
El HIC de los fotoautótrofos se puede estimar utilizando la ecuación,
donde R l , R w y R s son los DHR de lípidos, agua y sustratos, respectivamente. X w es la fracción molar del lípido H derivado del agua externa, mientras que α l/w y α l/s denotan los fraccionamientos isotópicos netos asociados con la captación y utilización de agua e hidrógeno del sustrato, respectivamente.
Para los fotótrofos , R l se calcula asumiendo que X w = 1. El fraccionamiento isotópico entre lípidos y metano ( α l/m ) es 0,94 para ácidos grasos y 0,79 para lípidos isoprenoides. El fraccionamiento isotópico entre lípidos y agua ( α l/w ) es 0,95 para ácidos grasos y 0,85 para lípidos isoprenoides. Para plantas y algas , el fraccionamiento isotópico entre lípidos y metano ( α l/m ) es 0,94 para ácidos grasos y 0,79 para lípidos isoprenoides. [74]
Fuente: [71]

Los δDs para el alcano nC 29 (‰) frente a VSMOW para diferentes grupos de plantas son los siguientes. Aquí, representa δDs para el alcano nC 29 (‰) frente a VSMOW, y representa δDs para la precipitación media anual (‰) frente a VSMOW). [76]
En el caso de la cera de las hojas de las plantas , la humedad relativa, el momento de formación de la cera de las hojas y las condiciones de crecimiento, incluidos los niveles de luz, afectan la fracción D/H de la cera de las plantas. A partir del modelo de Craig-Gordon, se puede entender que el agua de las hojas en los gases de la cámara de crecimiento está significativamente enriquecida con D debido a la transpiración. [77]
La abundancia global de 2 H en las plantas se encuentra en el siguiente orden: fenilpropanoides > carbohidratos > material a granel > lípidos hidrolizables > esteroides. [78] En las plantas, los δD de los carbohidratos, que normalmente oscilan entre −70‰ y −140‰, son buenos indicadores del metabolismo fotosintético. El hidrógeno producido fotosintéticamente que está unido a las cadenas principales de carbono está ~100‰–170‰ más empobrecido en D que el agua en los tejidos vegetales.
El procesamiento heterotrófico de carbohidratos implica la isomerización de triosas fosfatos y la interconversión entre fructosa-6-fosfato y glucosa-6-fosfato . Estos procesos celulares promueven el intercambio entre H orgánico y H 2 O dentro de los tejidos vegetales, lo que lleva a un enriquecimiento de D de alrededor del 158‰ de esos sitios intercambiados. [79] El δD de plantas C 3 como la remolacha azucarera , la naranja y la uva varía de −132‰ a −117‰, y el de plantas C 4 como la caña de azúcar y el maíz varía de −91‰ a −75‰. El δD del metabolismo ácido de las crasuláceas (CAM) como la piña se estima en alrededor de −75‰. [78] La remolacha azucarera y la caña de azúcar contienen sacarosa, y el maíz contiene glucosa. La naranja y la piña son fuentes de glucosa y fructosa .
El contenido de deuterio de los azúcares de las especies vegetales mencionadas anteriormente no es distintivo. En las plantas C3 , el hidrógeno unido a los carbonos en las posiciones 4 y 5 de la glucosa proviene típicamente del NADPH en la vía fotosintética, y se ha descubierto que está más enriquecido con D. Mientras que en las plantas C4 , el hidrógeno unido a los carbonos en las posiciones 1 y 6 está más enriquecido con D. Los patrones de enriquecimiento de D en las especies CAM tienden a ser más cercanos a los de las especies C3 . [ 80]
El HIC del agua de la hoja es variable durante la biosíntesis, y el enriquecimiento en toda la hoja se puede describir mediante la ecuación, △D hoja = △D e × ([1 − e −p ]/P) [81] [76]
El δD típico de la planta a granel es de alrededor de -160‰, mientras que los δD para la celulosa y la lignina son -110‰ y -70‰ respectivamente. [78]
La HIC en los tejidos animales es difícil de estimar debido a las complejidades de la ingesta dietética y la composición isotópica de las fuentes de agua circundantes. Cuando se investigaron las especies de peces, la HIC promedio de las proteínas se encontraba en un amplio rango de −128‰ ~ +203‰. En el tejido en masa de los organismos, se encontró que todos los lípidos estaban depletados de D, y los valores de δD para los lípidos tienden a ser más bajos que para las proteínas. Se estimó que el δD promedio para las proteínas de quironómidos y peces se encontraba en el rango de −128‰ a +203‰. [82]
La mayor parte del hidrógeno presente en los tejidos heterotróficos proviene del agua, no de fuentes dietéticas, pero la proporción que proviene del agua varía. En general, el hidrógeno del agua se transfiere al NADPH y luego se lleva hasta los tejidos. Se puede observar un efecto trófico aparente (efecto de composición) para δD en los heterótrofos, por lo que se producen enriquecimientos significativos de D a partir de la ingesta de agua circundante en las redes alimentarias acuáticas. En algunos casos, la δD de las proteínas en los tejidos animales se ve afectada más por las fuentes dietéticas que por el agua circundante. [82]
Aunque pueden surgir diferentes δD para la misma clase de compuestos en diferentes organismos que crecen en agua con el mismo δD, esos compuestos generalmente tienen el mismo δD dentro de cada organismo. [Ver Sección 7.5. Ecología para más detalles]
Los δD de los ácidos grasos en los organismos vivos suelen ser de −73‰ a −237‰. Los δD de los ácidos grasos individuales varían ampliamente entre cultivos (−362‰ a +331‰), pero normalmente en menos de alrededor del 30‰ entre diferentes ácidos grasos de la misma especie. [71]
Las diferencias en δD para los compuestos dentro de la misma clase de lípidos son generalmente menores al 50‰, mientras que la diferencia cae en el rango de 50‰–150‰ para los compuestos en diferentes clases de lípidos. [71]
Los δD para grupos lipídicos típicos se determinan utilizando la siguiente ecuación:
Los lípidos poliisoprenoides están más agotados que los lípidos acetogénicos (n-alquilo) con δD más negativos.
Fuente: [83]

La composición isotópica de las alquenonas a menudo refleja el enriquecimiento o agotamiento isotópico del entorno circundante, y los δD de las alquenonas en diferentes regiones se muestran en el mapa. [87] [88]

Fuente: [90]
Según los estudios de Reddings et al., los δDs para carbones de diversas fuentes varían entre aproximadamente −90‰ y −170‰. [91]
Los δD de los carbones en diferentes regiones se muestran en el mapa. [92] [93]
Fuente: [94]
El metano producido por metanógenos marinos suele estar más enriquecido con D que el metano producido por metanógenos cultivados en agua dulce. Los δD para el metano termogénico varían de -275‰ a -100‰, y de -400‰ a -150‰ para el metano microbiano . [95]
El δD del H 2 atmosférico es de alrededor de +180‰, el δD más alto conocido para los materiales terrestres naturales (fracción molar de 2 H: 183,8 ppm). El δD del gas natural de un pozo de Kansas es de alrededor de −836‰ (fracción molar de 2 H: 25,5 ppm) [96]
En la electrólisis del agua , se produce gas hidrógeno en el cátodo, pero la electrólisis incompleta del agua puede causar un fraccionamiento isotópico que conduce al enriquecimiento de 2 H en la muestra de agua y a la producción de gas hidrógeno con componentes de deuterio.

Los δDs de los minerales que contienen hidroxilo del manto se estimaron en -80‰ ~ -40‰ mediante el análisis de la composición isotópica del agua juvenil. Los minerales de hidrógeno generalmente tienen grandes efectos isotópicos y la composición isotópica a menudo sigue el patrón observado para la precipitación.
Las fraccionaciones D/H en arcillas como caolinita, illita y esmectita son en la mayoría de los casos consistentes cuando no se aplican fuerzas externas significativas bajo temperatura y presión constantes.
La siguiente es una ecuación determinada empíricamente para estimar el factor de fraccionamiento D/H: 1000 In α caolinita-agua = −2,2 × 10 6 × T −2 − 7,7. [98]
En la tabla se muestran los δDs frente a ‰SMOW para los minerales de hidrógeno que se encuentran en el manto , rocas metamórficas , pizarras , arcillas marinas , carbonatos marinos y rocas sedimentarias . [57]
Variaciones de DHR en el Sistema Solar [99]

Las DHR de Júpiter y Saturno son casi del orden de 10 −5 , y las DHR de Urano y Neptuno están más cerca de 10 −4 . [102]
El hidrógeno es el elemento más abundante en el universo. Las variaciones en la composición isotópica de los materiales extraterrestres se deben a la acreción planetaria u otros procesos planetarios como el escape atmosférico , y son mayores para el H y el N que para el C y el O. La preservación del enriquecimiento de D se observa en meteoritos condríticos , partículas de polvo interplanetarias y volátiles cometarios .
A partir de los datos de abundancia de isótopos de helio , se estima que la DHR cósmica es de alrededor de 20 ppm: mucho menor que la DHR terrestre de 150 ppm. El enriquecimiento de D/H a partir del reservorio protosolar ocurre en la mayoría de los planetas, excepto en Júpiter y Saturno, los planetas gaseosos masivos. Las DHR de las atmósferas de Venus y Marte son ~2 × 10 −2 y ~8 × 10 −4 respectivamente. Las DHR de Urano y Neptuno son mayores que las del reservorio protosolar por un factor de ~3 debido a sus núcleos helados ricos en deuterio. Las DHR de los cometas son mucho mayores que los valores de los planetas del Sistema Solar con δD de alrededor de 1000‰. [103]
Los HIC en la galaxia y el Sistema Solar se muestran en la tabla.
La DHR se puede determinar con una combinación de diferentes técnicas de preparación e instrumentos para diferentes propósitos. Existen varios tipos de medición de HIC: (i) primero se convierte el hidrógeno orgánico o el agua en H 2 , seguido de una medición de alta precisión por espectrometría de masas de relación isotópica (IRMS); (ii) 2 H/ 1 H y 18 O/ 16 O se miden directamente como H 2 O mediante espectroscopia láser también con alta precisión; (iii) las moléculas intactas se miden directamente por RMN o espectrometría de masas con menor precisión que la IRMS.
Se requiere la conversión a moléculas simples (es decir, H 2 para hidrógeno) antes de la IRMS para isótopos estables. Esto se debe a varias razones con respecto al hidrógeno:
La preparación clásica fuera de línea para la conversión es la combustión sobre CuO a >800 °C en tubos de cuarzo sellados, seguida del aislamiento del agua resultante y la reducción a H2 sobre metal caliente a 400 ~1000 °C en una línea de vacío. [105] Luego, el gas producido se inyecta directamente en el espectrómetro de masas de doble entrada para su medición. [104] Los metales utilizados para la reducción a H2 incluyen U, Zn, Cr, Mg y Mn, etc. U y Zn se han utilizado ampliamente desde la década de 1950 [25] [106] [107] [108] [109] [110] hasta que Cr [111] se empleó con éxito a fines de la década de 1990.
La combustión/reducción fuera de línea tiene la mayor exactitud y precisión para la medición de HIC sin límites para los tipos de muestra. La incertidumbre analítica es típicamente de 1~2‰ en δD. Por lo tanto, todavía se utiliza hoy en día cuando se requieren los niveles más altos de precisión. Sin embargo, el procedimiento de preparación fuera de línea requiere mucho tiempo y es complicado. También requiere una muestra grande (varios 100 mg). Por lo tanto, la preparación en línea basada en combustión/reducción acoplada con el posterior sistema de flujo continuo-IRMS (CF-IRMS) se ha utilizado con más frecuencia en la actualidad. La reducción de cromo o la conversión a alta temperatura son los métodos de preparación en línea dominantes para la detección de HIC por IRMS.

TC/EA (o HTC, conversión a alta temperatura; HTP, pirólisis a alta temperatura ; HTCR, reducción de carbono a alta temperatura) es un método de preparación "en línea" o de "flujo continuo" seguido típicamente de detección IRMS. Esta es una técnica "a granel" que mide todo el hidrógeno en una muestra y proporciona la señal isotópica promedio. La muestra pesada se coloca en una cápsula de estaño o plata y se deja caer en un tubo de pirólisis de TC/EA. El tubo está hecho de carbono vítreo con relleno de carbono vítreo, por lo que los isótopos de oxígeno se pueden medir simultáneamente sin intercambio de oxígeno con la superficie de cerámica (Al2O3 ) . [ 113 ] Las moléculas luego se reducen a CO y H2 a alta temperatura (>1400 °C) en el reactor. Los productos gaseosos se separan a través de cromatografía de gases (GC) utilizando helio como gas portador, seguido de una interfaz de flujo dividido y finalmente se detectan por IRMS. El método TC/EA puede ser problemático para compuestos orgánicos con halógeno o nitrógeno debido a la competencia entre los subproductos de la pirólisis (por ejemplo, HCl y HCN) y la formación de H 2 . [114] [115] Además, es susceptible a la contaminación con agua, por lo que las muestras deben secarse escrupulosamente.
Una adaptación de este método consiste en determinar el hidrógeno no intercambiable (CH) y el hidrógeno intercambiable (enlaces a otros elementos, p. ej. O, S y N) en materia orgánica. Las muestras se equilibran con agua en carruseles de muestreadores automáticos sellados a 115 °C y luego se transfieren a un EA de pirólisis seguido de una medición IRMS. [116]
El método TC/EA es rápido y tiene una precisión bastante alta (~1‰). Estaba limitado a muestras sólidas; sin embargo, recientemente también se pueden medir muestras líquidas en el sistema TC/EA-IRMS adaptando un muestreador automático para líquidos. El inconveniente de TC/EA es el tamaño relativamente grande de la muestra (~ mg), que es menor que la combustión/reducción fuera de línea pero mayor que la GC/pirólisis. No puede separar diferentes compuestos como lo hace la GC/pirólisis y, por lo tanto, solo se puede proporcionar el promedio de toda la muestra, lo que también es un inconveniente para algunas investigaciones.
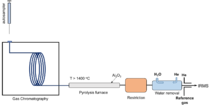
La interfase de GC (combustión o pirólisis) también es un método de preparación en línea seguido de detección IRMS. Este es un método "específico del compuesto", que permite la separación de analitos antes de la medición y, por lo tanto, proporciona información sobre la composición isotópica de cada compuesto individual. Después de la separación por GC, las muestras se convierten en moléculas gaseosas más pequeñas para las mediciones de isótopos. La GC/pirólisis utiliza la interfase de pirólisis entre GC e IRMS para la conversión de H y O en las moléculas en H 2 y CO. La GC-IRMS fue introducida por primera vez por Matthews y Hayes a fines de la década de 1970, [117] y luego se utilizó para δ 13 C, δ 15 N, δ 18 O y δ 34 S. El helio se utiliza como gas portador en los sistemas GC. Sin embargo, la separación de la señal DH (m/z = 3) de la cola del haz de 4 He + fue problemática debido a la intensa señal de 4 He + . [118] A principios de los años 1990, se realizaron intensos esfuerzos para resolver las dificultades de medir δD mediante GC/pirólisis-IRMS. En 1999, Hilkert et al. desarrollaron un método robusto integrando la conversión de alta temperatura (TC) en GC-IRMS y añadiendo un sector electrostático de precopa y una lente de retardo delante del colector de copa m/z=3. Varios grupos diferentes estaban trabajando en esto al mismo tiempo. [118] [119] [120] [121] Este GC/pirólisis-IRMS basado en TC se ha utilizado ampliamente para la medición de δD en la actualidad. Los productos comerciales de GC-IRMS incluyen interfaces de combustión y pirólisis para que δ 13 C y δD se puedan medir simultáneamente.
La ventaja significativa del método de GC/pirólisis para la medición de HIC es que puede separar diferentes compuestos en las muestras. Requiere el tamaño de muestra más pequeño (normalmente ~200 ng [119] ) en relación con otros métodos y tiene una alta precisión de 1~5 ‰. Pero este método es relativamente lento y está limitado a las muestras que se pueden aplicar en el sistema de GC.

La espectroscopia láser (o espectroscopia de cavidad ring-down , CRDS) es capaz de medir directamente la composición isotópica de 2 H/ 1 H, 17 O/ 16 O y 18 O/ 16 O en agua o metano. El uso de la espectroscopia láser en isótopos de hidrógeno fue reportado por primera vez por Bergamaschi et al. en 1994. [122] Midieron directamente 12 CH 3 D/ 12 CH 4 en metano atmosférico usando una espectroscopia láser de diodo sintonizable de sal de plomo. El desarrollo de CRDS fue reportado por primera vez por O'Keefe et al. en 1988. [123] En 1999, Kerstel et al. aplicaron con éxito esta técnica para determinar HIC en agua. [124] El sistema consta de un láser y una cavidad equipada con espejos de reflectividad de alta finura. La luz láser se inyecta en la cavidad, donde se produce la resonancia debido a la interferencia constructiva. Luego, el láser se apaga. Se mide la disminución de la intensidad de la luz. En presencia de una muestra de agua, la fotoabsorción por isotopólogos del agua sigue la ley cinética. El espectro óptico se obtiene registrando el tiempo de reducción de las características espectrales de interés del H2O a una determinada longitud de onda láser. La concentración de cada isotopólogo es proporcional al área bajo cada característica espectral del isotopólogo medida. [125]
La espectroscopia láser es rápida, sencilla y relativamente barata; y el equipo es portátil. Por lo tanto, se puede utilizar en el campo para medir muestras de agua. 2 H/ 1 H y 18 O/ 16 O se pueden determinar simultáneamente a partir de una única inyección. Requiere un tamaño de muestra pequeño, < 1 μL para agua. La precisión típica es ~ 1‰. Sin embargo, este es un instrumento específico para un compuesto, es decir, solo se puede medir un compuesto específico. Y los compuestos orgánicos coexistentes (es decir, el etanol ) podrían interferir con las características de absorción óptica de la luz del agua, lo que daría lugar a una contaminación cruzada.
2 H-Site-specific Natural Isotope Fractionation-Nuclear Magnetic Resonance ( 2 H-SNIF-NMR ) es un tipo de RMN especializada en medir la concentración de 2 H de moléculas orgánicas en abundancias naturales. Los espectros de RMN distinguen átomos de hidrógeno en diferentes entornos químicos (por ejemplo, el orden de carbono al que se une el hidrógeno, grupos funcionales adyacentes e incluso posiciones geminales de grupos metileno), lo que lo convierte en una herramienta poderosa para el análisis de isótopos de posición específica . El desplazamiento químico (en unidades de frecuencia) de 2 H es 6,5 veces menor que el de 1 H. Por lo tanto, es difícil resolver picos de 2 H. Para proporcionar suficiente resolución para separar picos de 2 H, se aplican instrumentos de campo magnético de alta resistencia (~11,4 T) [126] . El uso de RMN para estudiar isótopos de hidrógeno de productos naturales fue iniciado por Gerard Martin y sus colaboradores en la década de 1980. [127] Durante varias décadas se ha desarrollado y ampliado. La medición de RMN D/H a veces se combina con la medición de IR-MS para crear un estándar de referencia. [128] La sensibilidad de la RMN SNIF es relativamente baja, y normalmente requiere ~1 mmol de muestras para cada medición. [129] La precisión con respecto a la relación isotópica también es pobre en comparación con la espectrometría de masas. Incluso los instrumentos de última generación solo pueden medir DHR con un error de alrededor del 50~200‰ dependiendo del compuesto. [130] [131] [132] Por lo tanto, hasta ahora la técnica solo puede distinguir las grandes variaciones de D/H en materiales preservados. En 2007, Philippe Lesot y sus colegas avanzaron esta técnica con una RMN bidimensional utilizando cristales líquidos quirales (CLC) en lugar de solventes isotrópicos para disolver moléculas orgánicas. [133] Esto permite las mediciones de dobletes cuadrupolares para cada átomo de deuterio no equivalente. Por lo tanto, reduce las superposiciones de picos y proporciona información más detallada del entorno químico del hidrógeno. [131]
Los usos principales de 2 H-SNIF-NMR han sido en la atribución de fuentes, la ciencia forense y los estudios de vías biosintéticas . (Véase también la sección de Gray "Atribución de fuentes y ciencia forense"). Al medir compuestos de azúcar , una estrategia que ahorra tiempo es convertirlos en etanol a través de la fermentación porque la 2 H-SNIF NMR para etanol está bien establecida. [128] Varios estudios [128] [134] han demostrado que los isótopos de hidrógeno en la posición de metilo y metileno del etanol resultante no se ven afectados ni por la velocidad de fermentación ni por el medio. Otro ejemplo es el estudio de los monoterpenos. Desde la década de 1980, el estudio SNIF-NMR del α-pineno ha encontrado grandes variaciones en DHR entre sus sitios. En particular, la posición ex-C 2 tiene un fuerte agotamiento (~-750‰), que estaba en desacuerdo con el mecanismo biosintético aceptado (mecanismo de mevalonato) en ese momento, y condujo a un nuevo desarrollo de vías. Más recientemente, Ina Ehlers publicó su trabajo sobre las proporciones D6 S /D6 R de las moléculas de glucosa. Se descubrió que la distribución estereoquímica del diteterio se correlacionaba con las proporciones de fotorrespiración/fotosíntesis. Las proporciones de fotorrespiración/fotosíntesis están impulsadas por la fertilización con CO2 , [ 132] por lo que esto podría conducir a nuevos indicadores para reconstruir la concentración paleo-CO2 . También se ha trabajado con ácidos grasos de cadena larga y se ha descubierto que los sitios pares, que se cree que se derivan de la posición C2 del grupo acetilo, están más enriquecidos en 2 H que los hidrógenos impares que provienen de la posición C1 del grupo acetilo. [129] Duan et al. informaron de una fuerte KIE durante la desaturación del ácido oleico al ácido linoleico. [135]
En resumen, la física subyacente de la SNIF-RMN le permite medir isotopómeros . Otra ventaja de la medición de RMN sobre la espectrometría de masas es que analiza las muestras de forma no destructiva. La 2 H SNIF-RMN se ha industrializado bien en la identificación de fuentes y la ciencia forense, y ha contribuido mucho a los estudios de vías bioquímicas. La aplicación de la 2 H SNIF-RMN a los registros geológicos es esporádica y aún necesita ser explorada.
Convencionalmente, la espectrometría de masas, como la cromatografía de gases-espectrometría de masas ( GC-MS ) y la cromatografía de gases-tiempo de vuelo ( GC-TOF ), es una técnica común para analizar moléculas marcadas isotópicamente . [136] [137] Este método implica ionizar y analizar isotópicos de una molécula orgánica intacta de interés en lugar de sus productos de pirólisis o conversión. Sin embargo, no funciona para isótopos de hidrógeno de abundancia natural porque los espectrómetros de masas convencionales no tienen suficiente poder de resolución de masa para medir los isotópicos 13 C/D de moléculas orgánicas intactas o fragmentos moleculares en abundancia natural. Por ejemplo, para resolver el pico isotópico D sustituido único de cualquier hidrocarburo, uno tendrá que ser capaz de al menos excluir el pico isotópico 13 C sustituido único, que se encuentra en la misma masa cardinal pero 0,0029 uma más ligero y es órdenes de magnitud más abundante.
Los recientes avances en instrumentos analíticos permiten la medición directa de la abundancia natural de DHR en moléculas orgánicas. Los nuevos instrumentos tienen el mismo marco que cualquier IRMS de fuente de gas convencional , pero incorporan nuevas características como un sector magnético más grande, sectores de enfoque doble, filtro de masa cuadrupolo y colectores múltiples. Dos ejemplos comerciales son el Nu Panorama [138] y el Thermo Scientific 253 Ultra. [139] Estos instrumentos generalmente tienen buena sensibilidad y precisión. Usando solo decenas de nanomoles de metano, el Ultra puede lograr una alta precisión estable de ~0,1‰ de error en δD. [140] Uno de los primeros ejemplos de este tipo de medición han sido los isótopos agrupados de metano. (Ver la sección de "gas natural" en Combustibles fósiles) Otra fortaleza de este tipo de instrumentos es la capacidad de hacer mediciones de relación isotópica específicas del sitio. Esta técnica se basa en la medición de DHR de fragmentos de la fuente de iones (por ejemplo, CH 3 CH+
2de la molécula de propano) que toma muestras de átomos de hidrógeno de diferentes partes de la molécula. [141]
En resumen, la espectrometría de masas molecular directa se ha utilizado comúnmente para medir trazadores isotópicos enriquecidos en laboratorio. Los espectrómetros de masas de relación isotópica de fuente de gas de alta resolución avanzados recientemente pueden medir isótopos de hidrógeno de moléculas orgánicas directamente. Estos espectrómetros de masas pueden proporcionar alta precisión y alta sensibilidad. La desventaja de este tipo de instrumentos incluye el alto costo y la dificultad de estandarización. Además, estudiar isótopos específicos del sitio con espectrometría de masas es menos sencillo y necesita más restricciones que el método SNIF-NMR, y solo puede distinguir isotopólogos pero no isotopómeros .

El agua es la principal fuente de hidrógeno para todos los seres vivos, por lo que la composición isotópica del agua ambiental es un control de primer orden sobre la de la biosfera. El ciclo del agua (hidrológico) mueve el agua alrededor de la superficie de la Tierra, fraccionando significativamente los isótopos de hidrógeno en el agua. [142] Como principal fuente de humedad de la atmósfera, el océano tiene un HIC bastante uniforme en todo el mundo alrededor de 0‰ (VSMOW). [143] Las variaciones de δD mayores de 10‰ en el océano generalmente se limitan al agua superficial debido a la evaporación, la formación de hielo marino y la adición de agua meteórica por precipitación, ríos o icebergs. [142] En el ciclo del agua, los dos procesos principales que fraccionan los isótopos de hidrógeno del agua de mar son la evaporación y la condensación. La composición isotópica del oxígeno ( 18O / 16O ) del agua también es un trazador importante en el ciclo del agua, y no se puede separar de los isótopos de hidrógeno cuando hablamos de procesos de fraccionamiento de isótopos asociados con el agua.
Cuando el agua se evapora del océano al aire, se producen efectos isotópicos tanto de equilibrio como cinéticos para determinar la composición isotópica de hidrógeno y oxígeno del vapor de agua resultante. En la interfaz agua-aire, una capa límite estancada está saturada con vapor de agua ( humedad relativa del 100 % ), y la composición isotópica del vapor de agua en la capa límite refleja un fraccionamiento de equilibrio con agua líquida. Los fraccionamientos de equilibrio líquido-vapor para los isótopos de hidrógeno y oxígeno dependen de la temperatura: [144]
La cantidad de fraccionamiento de equilibrio líquido-vapor para los isótopos de hidrógeno es aproximadamente 8 veces mayor que la de los isótopos de oxígeno a temperaturas de la superficie de la Tierra, lo que refleja las diferencias de masa relativa de los dos sistemas isotópicos: 2 H es 100% más pesado que 1 H, 18 O es 12,5% más pesado que 16 O. Por encima de la capa límite, hay una zona de transición con una humedad relativa menor al 100%, y hay un fraccionamiento isotópico cinético asociado con la difusión del vapor de agua desde la capa límite a la zona de transición, que está relacionada empíricamente con la humedad relativa (h): [145]
La KIE asociada con la difusión refleja la diferencia de masa de las moléculas de agua de isótopos pesados H 2 H 16 O y H 2 18 O en relación con el isotopólogo normal (H 2 16 O).
Después de que el agua se evapora al aire, la condensación y la precipitación la transportan y la devuelven a la superficie. El vapor de agua se condensa en masas de aire ascendentes que desarrollan una temperatura y una presión de vapor de saturación más bajas. Dado que el enfriamiento y la condensación ocurren de forma relativamente lenta, es un proceso con efectos isotópicos de equilibrio. Sin embargo, a medida que el vapor de agua se condensa progresivamente y se pierde del aire durante el transporte de humedad, la composición isotópica del vapor restante, así como la precipitación resultante, pueden agotarse en gran medida debido al proceso de destilación de Rayleigh . La ecuación para la destilación de Rayleigh es: [146]

donde R 0 es la relación de isótopos en el vapor de agua inicial, R r es la relación de isótopos en el vapor de agua restante después de cierta condensación, f es la fracción de vapor de agua que queda en el aire y α es el factor de fraccionamiento de equilibrio líquido-vapor (α=1+ε). La composición isotópica de la precipitación resultante (R p ) se puede derivar de la composición del vapor restante:
A medida que f disminuye progresivamente durante la condensación, el vapor restante se va quedando cada vez más desprovisto de isótopos pesados, y la disminución se hace mayor a medida que f se acerca a cero. La destilación de Rayleigh puede explicar algunos patrones espaciales de primer orden observados en la composición isotópica de la precipitación en todo el mundo, incluido el agotamiento isotópico desde los trópicos hasta los polos, el agotamiento isotópico desde las regiones costeras hasta las del interior y el agotamiento isotópico con la elevación sobre una cadena montañosa,[1] todos los cuales están asociados con la pérdida progresiva de humedad durante el transporte. El modelo de destilación de Rayleigh también se puede utilizar para explicar la fuerte correlación entre δD y δ 18 O en la precipitación global, expresada como la línea de agua meteórica global (GMWL): δD = 8δ 18 O+10 [147] (posteriormente actualizada a δD = 8,17 ± 0,07 δ 18 O+11,27 ± 0,65 [41] ) La pendiente de la GMWL refleja la magnitud relativa del fraccionamiento de isótopos de hidrógeno y oxígeno durante la condensación. La intersección de la GMWL es distinta de cero (llamada exceso de deuterio o exceso d), lo que significa que el agua del océano cae sobre la GMWL. Esto está asociado con el KIE durante la evaporación cuando el vapor de agua se difunde desde la capa límite saturada a la zona de transición no saturada, y no se puede explicar mediante el modelo de Rayleigh. Sin embargo, el patrón robusto en la GMWL sugiere firmemente una única fuente de humedad dominante para la atmósfera global, que es el Pacífico occidental tropical. También debe señalarse que una línea de agua meteórica local puede tener una pendiente e intersección diferentes de la GMWL, debido a las diferencias en la humedad y la intensidad de la evaporación en diferentes lugares. [145] Los isótopos de hidrógeno y oxígeno en el agua sirven así como un excelente trazador del ciclo hidrológico tanto a nivel global como local.
Basándose en los procesos que fraccionan los isótopos en el ciclo del agua, la composición isotópica del agua meteórica se puede utilizar para inferir variables ambientales relacionadas, como la temperatura del aire, la cantidad de precipitaciones, las elevaciones anteriores, los niveles de los lagos, así como para rastrear las fuentes de humedad. Estos estudios forman el campo de la hidrología isotópica. Algunos ejemplos de aplicaciones de la hidrología isotópica incluyen:
La composición isotópica de la precipitación se puede utilizar para inferir cambios en la temperatura del aire basándose en el proceso de Rayleigh. Una temperatura más baja corresponde a una presión de vapor de saturación más baja, lo que conduce a una mayor condensación que impulsa el vapor residual hacia el agotamiento de isótopos. La precipitación resultante tiene, por tanto, un valor δD y δ 18 O más negativo a una temperatura más baja. Este termómetro isotópico de precipitación es más sensible a temperaturas más bajas y se aplica ampliamente en latitudes altas. Por ejemplo, se encontró que δD y δ 18 O tenían una sensibilidad de temperatura de 8‰/°C y 0,9‰/°C en la nieve antártica, y una sensibilidad de 5,6‰/°C y 0,69‰/°C en los sitios árticos. [148] δD y δ 18 O de los núcleos de hielo en Groenlandia, la Antártida y los glaciares alpinos son archivos importantes del cambio de temperatura en el pasado geológico.
A diferencia del control de temperatura en latitudes altas, la composición isotópica de la precipitación en los trópicos está principalmente influenciada por la cantidad de lluvia (correlación negativa). Este "efecto de cantidad" también se observa para la precipitación de verano en los subtrópicos. [41] [148] Willi Dansgaard, quien propuso por primera vez el término "efecto de cantidad", sugirió varias razones posibles para la correlación: (1) A medida que avanza el enfriamiento y la condensación, la composición isotópica de la lluvia refleja un agotamiento isotópico integrado por el proceso de Rayleigh; (2) Es más probable que una pequeña cantidad de lluvia esté influenciada por la evaporación y el intercambio con la humedad circundante, que tienden a enriquecerla más isotópicamente. En latitudes bajas, el efecto de cantidad para δ 18 O es de alrededor de −1,6‰/100 mm de aumento de precipitación en las estaciones insulares y −2,0‰/100 mm en las estaciones continentales. [148] También se observó que el efecto de la cantidad era más pronunciado al comparar la composición isotópica de la precipitación mensual en diferentes lugares de los trópicos. [148] También se espera el efecto de la cantidad para HIC, pero no hay tantos estudios de calibración. En el sudeste asiático, la sensibilidad de δD a la cantidad de precipitación mensual varía entre −15 y −25‰/100 mm según la ubicación. [149] En las regiones templadas, la composición isotópica de la precipitación está dominada por la cantidad de lluvia en verano, pero más controlada por la temperatura en el invierno. [148] El efecto de la cantidad también puede complicarse por los cambios en las fuentes de humedad regionales. [150] Las reconstrucciones de la cantidad de lluvia en los trópicos en el pasado geológico se basan principalmente en δ 18 O de espeleotemas [151] [152] o δD de lípidos biogénicos, [153] [154] ambos considerados como indicadores de la composición isotópica de la precipitación.
Los isótopos de hidrógeno y oxígeno también funcionan como trazadores del balance hídrico en los reservorios terrestres, incluidos lagos, ríos, aguas subterráneas y agua del suelo. Para un lago, tanto la cantidad de agua en el lago como la composición isotópica del agua están determinadas por un equilibrio entre las entradas (precipitación, entrada de agua de arroyos y subterránea) y las salidas (evaporación, salida de agua de arroyos y subterránea). [142] La composición isotópica del agua del lago a menudo se puede utilizar para rastrear la evaporación, que causa enriquecimiento isotópico en el agua del lago, así como una pendiente δD-δ 18 O que es más superficial que la línea de agua meteórica. [155] La composición isotópica del agua del río es muy variable y tiene fuentes complicadas en diferentes escalas de tiempo, pero generalmente se puede tratar como un problema de mezcla de dos miembros finales, un miembro final de flujo base (principalmente recarga de agua subterránea) y un miembro final de flujo superficial (principalmente eventos de tormenta). Los datos isotópicos sugieren que el extremo de flujo base integrado a largo plazo es más importante en la mayoría de los ríos, incluso durante los flujos máximos en verano. [142] La Red Global de Isótopos en Ríos (GNIR) recopiló datos isotópicos sistemáticos de los ríos en todo el mundo [2]. La composición isotópica del agua subterránea también se puede utilizar para rastrear sus fuentes y rutas de flujo. Un ejemplo es un estudio de mapeo isotópico de agua subterránea en Sacramento, California , que mostró un flujo lateral de agua de río con una composición isotópica distinta en el agua subterránea que desarrolló una depresión significativa del nivel freático debido al bombeo para uso humano. [156] El mismo estudio también mostró una señal isotópica de agua agrícola que se recarga en el acuífero aluvial gigante en el Valle Central de California . [156] Finalmente, la composición isotópica del agua del suelo es importante para el estudio de las plantas. Por debajo del nivel freático, el suelo tiene una fuente relativamente constante de agua con una cierta composición isotópica. Por encima del nivel freático, la composición isotópica del agua del suelo se enriquece por evaporación hasta alcanzar un máximo en la superficie. El perfil vertical de la composición isotópica del agua del suelo se mantiene por la difusión tanto del agua líquida como del vapor. [157] Se puede utilizar una comparación del agua del suelo y del agua del xilema de las plantas δD para inferir la profundidad a la que las raíces de las plantas obtienen agua del suelo. [158]

Las composiciones isotópicas de los núcleos de hielo de las capas de hielo continentales y los glaciares alpinos se han desarrollado como indicadores de temperatura desde la década de 1950. Samuel Epstein fue uno de los primeros en demostrar la aplicabilidad de este indicador midiendo los isótopos de oxígeno en la nieve antártica, y también señaló complicaciones en la correlación isótopo estable-temperatura causada por la historia de las masas de aire a partir de las cuales se formó la nieve. [160] Los núcleos de hielo en Groenlandia y la Antártida pueden tener miles de metros de espesor y registrar la composición isotópica de la nieve de los últimos ciclos glaciales-interglaciales. Los núcleos de hielo se pueden fechar contando las capas en la parte superior y modelando el flujo de hielo en profundidad, con restricciones de edad adicionales a partir de las cenizas volcánicas. [161] Los núcleos de Groenlandia y la Antártida se pueden alinear en edad a alta resolución comparando las concentraciones de gases traza bien mezclados globalmente (por ejemplo, CH 4 ) en las burbujas de aire atrapadas en los núcleos. [162] Algunos de los primeros registros de núcleos de hielo de Groenlandia y la Antártida con estimaciones de edad se remontan a los últimos 10 5 años, y mostraron un agotamiento de δD y δ 18 O en la última edad de hielo. [163] [164] El registro de núcleos de hielo se ha extendido desde entonces a los últimos 800.000 años en la Antártida, [165] y al menos 250.000 años en Groenlandia. [166] Uno de los mejores registros de temperatura de núcleos de hielo basados en δD es del núcleo de hielo de Vostok en la Antártida, que se remonta a 420.000 años. [159] La conversión de temperatura δD (de la capa de inversión donde se forma la nieve) en la Antártida oriental basada en el gradiente espacial moderno de δD (9‰/°C) es ΔT I =(ΔδD ice -8Δδ 18 O sw )/9, que tiene en cuenta las variaciones en la composición isotópica del agua de mar causadas por los cambios globales en el volumen de hielo. [159] Muchos efectos locales pueden influir en el δD del hielo además de la temperatura. Estos efectos incluyen el origen de la humedad y las vías de transporte, las condiciones de evaporación y la estacionalidad de las precipitaciones, que se pueden tener en cuenta en modelos más complicados. [167] Sin embargo, el registro del núcleo de hielo de Vostok muestra algunos resultados muy importantes: (1) Un agotamiento constante de δD de ~70‰ durante los últimos cuatro períodos glaciares en comparación con los tiempos interglaciares, lo que corresponde a un enfriamiento de 8 °C en la Antártida; (2) Una caída constante de la concentración atmosférica de CO 2 en 100 ppmv y de CH 4caída de ~300 ppbv durante las épocas glaciales en relación con las interglaciales, lo que sugiere un papel de los gases de efecto invernadero en la regulación del clima global; (3) los cambios en la temperatura del aire antártico y en la concentración de gases de efecto invernadero preceden a los cambios en el volumen de hielo global y en la temperatura del aire de Groenlandia durante las terminaciones glaciales, y los gases de efecto invernadero pueden ser un amplificador del forzamiento de la insolación durante los ciclos glaciales-interglaciales. [159] Los registros isotópicos de los núcleos de hielo de Groenlandia, además de mostrar ciclos glaciales-interglaciales, también muestran oscilaciones climáticas a escala milenaria que pueden reflejar una reorganización en la circulación oceánica causada por cargas de derretimiento del hielo. [166] [168] [169] [170] También ha habido registros de núcleos de hielo generados en glaciares alpinos en diferentes continentes. Un registro de la Cordillera de los Andes en Perú muestra una disminución de la temperatura de 5-6 °C en los trópicos durante la última edad de hielo. [171] Un registro de la meseta tibetana muestra un cambio isotópico similar y un enfriamiento durante la última edad de hielo. [172] Otros registros isotópicos glaciares alpinos existentes incluyen el Monte Kilimanjaro en Tanzania, el Monte Altai y la meseta occidental de Belukha en Rusia, el Monte Logan en Canadá, el Glaciar Fremont en Wyoming, EE. UU., y el núcleo de hielo Illimani en Bolivia, la mayoría de los cuales cubren un intervalo de la época del Holoceno .[3]
La composición isotópica de las biomoléculas preservadas en el registro sedimentario se puede utilizar como un indicador para las reconstrucciones del paleoambiente. Dado que el agua es la principal fuente de hidrógeno para los fotoautótrofos , el HIC de su biomasa se puede relacionar con la composición del agua de su crecimiento y, por lo tanto, se puede utilizar para obtener información sobre algunas propiedades de los entornos antiguos. [173] El estudio de los isótopos de hidrógeno puede ser muy valioso, ya que el hidrógeno está más directamente relacionado con el clima que otros sistemas de isótopos estables relevantes. Sin embargo, los átomos de hidrógeno unidos al oxígeno, nitrógeno o azufre son intercambiables con el hidrógeno ambiental, lo que hace que este sistema sea menos sencillo [174] [ref. a la sección anterior sobre intercambio de H]. Para estudiar el HIC de las biomoléculas, es preferible utilizar compuestos en los que el hidrógeno está en gran parte unido al carbono y, por lo tanto, no es intercambiable en escalas de tiempo experimentales. Según este criterio, los lípidos son un tema mucho mejor para los estudios de isótopos de hidrógeno que los azúcares o los aminoácidos.
El fraccionamiento neto entre el agua de origen y los lípidos se denota ε l/w :
donde w se refiere al agua y l se refiere a los lípidos.
Si bien el δD del agua de origen es la mayor influencia en el δD de los lípidos, [175] las discrepancias entre los valores del factor de fraccionamiento obtenidos de la pendiente y de la intersección de la regresión sugieren que la relación es más compleja que un fraccionamiento de dos grupos. [176] En otras palabras, hay múltiples pasos de fraccionamiento que deben tenerse en cuenta para comprender la composición isotópica de los lípidos.
El HIC unido al carbono de la celulosa , tal como se hereda del agua de las hojas, tiene el potencial de preservar la señal original del agua meteórica. Esto se demostró por primera vez en la década de 1970. [25] [177] En un estudio sistemático en América del Norte, se encontró que la δD de la celulosa de los árboles tenía una sensibilidad a la temperatura de 5,8‰/°C, similar a la sensibilidad δD de la precipitación de 5,6‰/°C. [178] Esta correlación espacial puede complicarse por los efectos locales de la evaporación del suelo y la transpiración de las hojas, [178] y el gradiente espacial puede no ser representativo de los cambios temporales en la celulosa de los anillos de los árboles en un solo lugar. El mecanismo que genera la señal δD en la celulosa a partir del agua meteórica no se entiende completamente, pero al menos incluye la transpiración del agua de las hojas, la síntesis de carbohidratos, la síntesis de celulosa a partir de azúcares fotosintéticos y el intercambio de azúcares con agua del xilema. [179] Los estudios de modelado muestran que la celulosa δD observada en los anillos de los árboles se puede producir cuando el 36% del hidrógeno en los azúcares puede intercambiarse con el agua del xilema, y los efectos como la humedad y la estacionalidad de las precipitaciones pueden complicar el proxy de la celulosa δD. [179] A pesar de estas complicaciones, la celulosa δD de los anillos de los árboles se ha utilizado para reconstrucciones paleoclimáticas de los últimos milenios. Por ejemplo, un registro de celulosa δD de anillos de árboles de pinos en las Montañas Blancas , California, muestra un agotamiento del 50‰ desde hace 6800 años hasta el presente. La tendencia al enfriamiento desde el máximo térmico del Holoceno medio es consistente con los registros de núcleos de hielo y polen, pero la magnitud correspondiente del enfriamiento es esquiva debido a influencias complicadas de efectos locales como la humedad y la composición del agua del suelo. [180] El significado de los isótopos en la celulosa y sus aplicaciones sigue siendo un área de estudio activo.

Las plantas terrestres producen ceras para recubrir la superficie de sus hojas y minimizar la pérdida de agua. Estas ceras son en gran parte lípidos n- alquilo de cadena lineal. Son insolubles, no volátiles, químicamente inertes y resistentes a la degradación, lo que hace que se conserven fácilmente en el registro sedimentario y, por lo tanto, sean buenos objetivos como biomarcadores . [181]
La principal fuente de agua para las plantas terrestres es el agua del suelo, que se asemeja en gran medida al HIC del agua de lluvia, pero varía entre entornos y con el enriquecimiento por precipitación , el agotamiento por evaporación y el intercambio con el vapor de agua atmosférico. Puede haber una compensación significativa entre el valor δD del agua de la fuente y el valor δD del agua de las hojas en el sitio de la biosíntesis de lípidos. No hay fraccionamiento asociado con la absorción de agua por las raíces, un proceso generalmente impulsado por la tensión capilar, con la única excepción de los xerófitos que queman ATP para bombear agua en entornos extremadamente áridos (con un agotamiento de aproximadamente el 10‰). [182] Sin embargo, el agua de las hojas puede enriquecerse sustancialmente en relación con el agua del suelo debido a la transpiración , un proceso evaporativo que está influenciado por la temperatura, la humedad y la composición del vapor de agua circundante. El HIC del agua de la hoja se puede describir con un modelo de Craig-Gordon modificado, [183] donde ΔD e es el enriquecimiento en estado estable del agua de la hoja, ε eq es el fraccionamiento de equilibrio dependiente de la temperatura entre agua líquida y vapor, ε k es el KIE de la difusión entre el espacio aéreo interno de la hoja y la atmósfera, ΔD v es el desequilibrio hoja/aire, e a es la presión de vapor atmosférica y e i es la presión de vapor interna de la hoja.
El efecto Péclet , que describe las fuerzas opuestas de advección y difusión, se puede agregar al modelo como
donde E es la tasa de transpiración, L es la escala de longitud del transporte, C es la concentración de agua y D es el coeficiente de difusión.
Si bien el papel del δD del agua de lluvia como control fundamental del δD final de los lípidos está bien documentado, [184] se aprecia la importancia de los efectos de fraccionamiento del agua de lluvia al agua del suelo y al agua de las hojas en ε l/w , pero sigue siendo poco comprendido. [173] [185]
Las biomoléculas orgánicas generalmente se agotan en relación con el δD del agua de la hoja. [173] Sin embargo, las diferencias entre organismos, vías biosintéticas y funciones biológicas de diferentes moléculas pueden conducir a una enorme variabilidad en el fraccionamiento; la diversidad de biomarcadores lipídicos abarca un rango de 600‰ de valores de δD. [186] La biosíntesis de lípidos es bioquímicamente compleja, involucrando múltiples pasos dependientes de enzimas que pueden conducir a fraccionamientos de isótopos. Hay tres vías principales de biosíntesis de lípidos, conocidas como la vía del mevalonato , la vía acetogénica y la vía de 1-desoxiD-xilulosa-5-fosfato/2-metileritroil-4-fosfato . [187] La vía acetogénica es responsable de la producción de lípidos n -alquilo como ceras de hojas, y está asociada con un agotamiento de δD menor en relación con el agua de origen que las otras dos vías de biosíntesis de lípidos. [32] [188] Si bien el agua de las hojas es la principal fuente de hidrógeno en las biomoléculas de las hojas, durante la biosíntesis se suele añadir hidrógeno relativamente reducido proveniente del acetato o del NADPH, lo que contribuye a la HIC de la molécula final. Las reacciones de intercambio de hidrógeno secundario, es decir, las reacciones de hidrogenación y deshidrogenación fuera de la vía biosintética primaria, también contribuyen sustancialmente a la variabilidad de la HIC de los lípidos. [189]
Es importante señalar que las diferencias biológicas en el fraccionamiento no sólo surgen de diferencias bioquímicas entre diferentes moléculas, sino también de diferencias fisiológicas entre diferentes organismos. Por ejemplo, los δD de múltiples moléculas de cera de las hojas están enriquecidos en arbustos (mediana ~ -90‰) en relación con los árboles (mediana ~ -135‰), que a su vez están enriquecidos en relación con las gramíneas C 3 (mediana ~ -160‰) y C 4 (mediana ~ -140‰). [173] Entre especies individuales, se ha documentado una variación sustancial en δD. [190] [191] [192] [193] Otros factores fisiológicos que contribuyen a los valores variables de δD de la cera de las hojas incluyen el momento estacional del desarrollo de las hojas, [194] la respuesta al estrés externo o la variabilidad ambiental, [195] y la presencia o ausencia de estomas [184]
Puede ser difícil distinguir entre factores fisiológicos y factores ambientales, cuando muchas adaptaciones fisiológicas están directamente relacionadas con el medio ambiente.
Se ha demostrado que varios factores ambientales contribuyen a la variabilidad del δD de la cera de las hojas, además de los efectos ambientales en el δD de la fuente de agua. Se sabe que la humedad afecta el δD de los lípidos a niveles de humedad moderados, pero no a niveles de humedad particularmente altos (>80%) o bajos (<40%), y se observa una amplia tendencia de δD enriquecidos, lo que significa ε l/w más pequeños , en regiones áridas. [173] [175] [190] La temperatura y la intensidad de la luz solar, ambas correlacionadas con la latitud, tienen fuertes efectos en las tasas de metabolismo y transpiración, y por extensión en ε l/w . [196] Además, la longitud de cadena promedio de las moléculas de cera de las hojas varía con la latitud geográfica, y se ha demostrado que ε l/w aumenta con el aumento de la longitud de la cadena. [184]
Al utilizar biomarcadores como sustitutos para reconstruir ambientes antiguos, es importante tener en cuenta los sesgos inherentes al registro sedimentario. La materia foliar incorporada al sedimento se deposita en gran medida en otoño, por lo que las variaciones estacionales en las ceras de las hojas deben considerarse en consecuencia. [184] Además, los sedimentos promedian las ceras de las hojas en muchas plantas diferentes tanto en el espacio como en el tiempo, lo que dificulta la calibración de las restricciones biológicas en ε l/w . [173] Finalmente, la preservación de biomoléculas en el registro geológico no representa fielmente ecosistemas completos, y siempre existe la amenaza del intercambio de hidrógeno, particularmente si los sedimentos están sujetos a altas temperaturas.
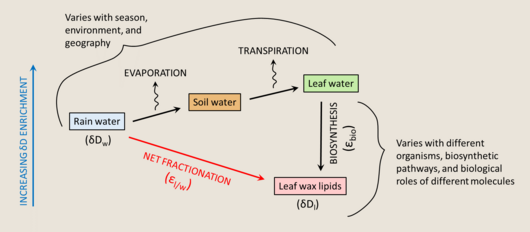
El HIC de las ceras de las hojas se puede resumir como el δD del agua de lluvia, con tres pasos principales de fraccionamiento: evaporación del agua del suelo, transpiración del agua de las hojas y biosíntesis de lípidos, que se pueden combinar y medir como el fraccionamiento neto, ε l/w . [173] Con técnicas de medición cada vez mejores para moléculas individuales y la correlación con otros indicadores independientes en el registro geológico que pueden ayudar a limitar algunas variables, investigar el HIC de las ceras de las hojas puede ser extremadamente productivo. Los datos de δD de la cera de las hojas se han aplicado con éxito para mejorar nuestra comprensión de los cambios impulsados por el clima en la hidrología terrestre, al mostrar que la circulación oceánica y la temperatura de la superficie tienen un efecto significativo en la precipitación continental. [197] [198] Los valores de δD de la cera de las hojas también se han utilizado como registros de paleoaltimetría para reconstruir los gradientes de elevación en antiguas cadenas montañosas basadas en el efecto de la altitud en el δD del agua de lluvia. [199] [200]
Otro grupo de moléculas que se utilizan a menudo en las paleoreconstrucciones son las alquenonas , lípidos de cadena larga en gran parte insaturados producidos exclusivamente por cocolitóforos . Los cocolitóforos son algas haptofitas marinas e incluyen la especie mundialmente icónica Emiliania huxleyi , uno de los principales productores de CaCO 3 en el océano. Los δD de las alquenonas están altamente correlacionados con los δD del agua de mar, por lo que se pueden utilizar para reconstruir las propiedades paleoambientales que limitan la composición isotópica del agua de mar. La reconstrucción más notable a la que se aplican los valores δD de las alquenonas es la salinidad de los océanos antiguos.

Tanto los δDs del agua de mar como los fraccionamientos asociados con la bioquímica de los hiptófitos (ε bio ) se entienden bastante bien, por lo que las alquenonas se pueden utilizar fácilmente para observar el efecto secundario de la salinidad en δD. [201] Existe una correlación lineal positiva bien establecida entre la salinidad y ε l/w , del orden de un cambio de ~3‰ en el fraccionamiento por unidad de salinidad. [202] Los mecanismos hipotéticos para este efecto incluyen el enriquecimiento de D en el agua intracelular debido al intercambio reducido con el agua extracelular a mayor salinidad, [203] la eliminación de H del agua intracelular debido al aumento de la producción de solutos para mantener la presión osmótica a mayor salinidad, [204] y menores tasas de crecimiento de los haptofitos a mayor salinidad [173]
Las alquenonas δD se han utilizado con éxito para reconstruir cambios pasados de salinidad en el mar Mediterráneo, [205] el mar Negro, [206] [207] la cuenca de Panamá, [208] y el canal de Mozambique. [201] Como una extensión de la salinidad, estos datos también se utilizaron para extraer conclusiones adicionales sobre entornos antiguos, como antiguos eventos de inundaciones de agua dulce, [205] [206] y la evolución del plancton en respuesta a cambios ambientales [207].
La posibilidad de utilizar el agotamiento de isótopos de agua con la elevación para reconstruir la paleoaltimetría se demostró ya a fines de la década de 1960, cuando el geoquímico de Caltech Samuel Epstein intentó recolectar agua de lluvia a diferentes elevaciones en una sola tormenta. [209] Las tasas de disminución de δ 18 O y δD varían entre -1 y -5 ‰ / km y -10 a -40 ‰ / km respectivamente, pero pueden variar con las ubicaciones y las estaciones, y no son exactamente lineales con la altitud. [210] [211] [212] Uno de los primeros estudios en paleoaltimetría de isótopos estables demostró una firma de δD de agua meteórica de -90 a -139 ‰ en inclusiones de fluidos en cuarzo y adularia en un depósito epitermal de oro y plata en Nevada, y sugirió la aplicabilidad de isótopos estables en la reconstrucción de la topografía antigua en la Gran Cuenca . [213] Los isótopos de hidrógeno y oxígeno de los minerales de silicato hidratado se han utilizado desde entonces para reconstruir historias topográficas en cadenas montañosas de todo el mundo, incluidas la Cordillera de América del Norte, las Montañas Rocosas, el Himalaya, los Alpes europeos y los Alpes del Sur en Nueva Zelanda. [209] Los experimentos de laboratorio con minerales arcillosos han demostrado que las composiciones de isótopos de hidrógeno y oxígeno son relativamente resistentes a la alteración a temperatura moderada (<100 °C) y pueden preservar la señal original del agua meteórica. [214] Un efecto importante de las cadenas montañosas en los isótopos estables de la lluvia es el efecto de sombra de lluvia, en el que se produce un agotamiento isotópico en la precipitación en el lado de sotavento en comparación con el lado de barlovento. Un cambio en la diferencia en la composición isotópica de la precipitación en los dos lados de una montaña se puede utilizar para inferir la magnitud del efecto de sombra de lluvia. [209] En uno de estos estudios, se observó un enriquecimiento isotópico en esmectita en el lado este de Sierra Nevada en California desde mediados del Mioceno hasta finales del Plioceno , lo que sugiere una disminución en la elevación durante este período. [215] Otro estudio encontró δDs alrededor de -140‰ en moscovita en la Cordillera de América del Norte durante el Eoceno temprano , lo que sugeriría una elevación 1 km más alta que la actual en ese momento. [216] Además de minerales hidratados, también se han desarrollado isótopos de hidrógeno en biomarcadores como ceras de hojas para estudios de paleoaltimetría. La tasa de disminución de δD en ceras de hojas (-21‰/km) cae en el rango de observaciones de agua meteórica. [212] [217] Como estudio de ejemplo, los datos de δD de cera de hojas se han utilizado para confirmar la paleoaltimetría de minerales hidratados para la gran elevación de Sierra Nevada durante el Eoceno.[200]
El HIC del petróleo , el gas y el carbón es una herramienta geoquímica importante para estudiar la formación, el almacenamiento, la migración y muchos otros procesos. La señal HIC de los combustibles fósiles resulta tanto de la herencia del material de origen y del agua como de los fraccionamientos durante la generación de hidrocarburos y la posterior alteración por procesos como el intercambio isotópico o la biodegradación . Al interpretar los datos HIC de la materia orgánica sedimentaria, se deben tener en cuenta todos los procesos que podrían tener un efecto isotópico.
Casi todo el hidrógeno orgánico es intercambiable hasta cierto punto. El intercambio isotópico de hidrógeno orgánico reordenará la distribución de deuterio y a menudo incorporará hidrógeno externo. Generalmente, los materiales más maduros se intercambian más intensamente. Con un intercambio efectivo, el hidrógeno alifático puede finalmente alcanzar el equilibrio isotópico en la etapa final. El factor de fraccionamiento de equilibrio varía entre los sitios de hidrógeno. Por ejemplo, el fraccionamiento del isótopo de hidrógeno alifático depende del átomo de carbono con el que se une el átomo de hidrógeno. Para el primer orden , el HIC de alquilo sigue esta tendencia: δD Carbono primario < δD Carbono secundario < δD Carbono terciario . [218] Los factores de fraccionamiento entre los sitios de carbono también disminuyen con el aumento de la temperatura. Esto puede usarse potencialmente como un indicador de historia térmica. [141] El fraccionamiento entre la molécula completa y el agua puede estimarse promediando todas las posiciones de hidrógeno, y esto conduce a una variación relativamente pequeña del fraccionamiento de equilibrio entre diferentes grupos de hidrocarburos y agua. Una predicción teórica estimó que esto sería de -80‰ a -95‰ para esteranos , de -90‰ a -95‰ para hopanos y de -70‰ a -95‰ para cicloparafinas típicas a 0−100 °C. [219] A la temperatura de la ventana de petróleo y la ventana de gas, el fraccionamiento de equilibrio entre diferentes grupos de moléculas orgánicas es relativamente pequeño, en comparación con las grandes señales primarias.
El estudio de los isótopos de hidrógeno de los combustibles fósiles se ha aplicado como indicadores y herramientas en los siguientes aspectos:
La primera etapa que experimenta la materia orgánica sedimentaria (MOS) después de la deposición es la diagénesis . Durante la diagénesis, la descomposición biológica puede alterar la DHR de los compuestos orgánicos. Varios estudios experimentales han demostrado que algunos materiales biodegradados se enriquecen ligeramente en D (menos del 50‰). La mayoría de los compuestos orgánicos se convierten en kerógenos al final de la diagénesis. En general, la δD del kerógeno abarca un amplio rango. Muchos factores contribuyen al kerógeno que observamos en los registros geológicos , entre ellos:
Las investigaciones sobre las cuencas australianas mostraron que el δD del kerógeno de origen algal lacustre con contribuciones terrestres varía de −105‰ a −200‰, y el δD del kerógeno del entorno deposicional cercano a la costa tiene un rango más estrecho, de −75‰ a −120‰. [224] Se cree que el menor intervalo en las DHR del kerógeno costero refleja el clima regional relativamente estable. Pedentchouk y sus colegas informaron valores de δD de -70‰ a -120‰ en kerógeno inmaduro a poco maduro de sedimentos lacustres del Cretácico temprano en África Occidental. [221]
Los carbones son de kerógeno tipo III derivado principalmente de plantas terrestres, que deberían tener una señal primaria D/H sensible al agua meteórica local. Reddings et al. analizaron carbones de varios orígenes y los encontraron dispersos aleatoriamente en el rango de −90‰ a −170‰. [225] Rigby et al. encontraron que los contenidos de D disminuyen de −70‰ a −100‰ con el aumento de la madurez en el carbón de Bass Basin y atribuyeron esto al último intercambio con agua baja en D. [226] Smith et al. estudiaron los isótopos H de muestras de carbón de la Antártida y Australia. Encontraron una fuerte correlación negativa entre δD y la paleolatitud inferida. Para las muestras de carbón originadas cerca del Ecuador , δD es alrededor de −50‰, mientras que para las originadas en regiones polares, δD es alrededor de −150‰. [227] Esta tendencia δD a lo largo de la latitud es una tendencia consistente del agua meteórica y, por lo tanto, es una evidencia de que los carbones pueden preservar gran parte de las señales originales.
Existen dos tipos de enfoque para estudiar la alteración de las DHR del kerógeno durante la catagénesis: (1) incubación de materia orgánica en laboratorio que permite un estudio mecanicista con experimentos controlados; (2) medición de muestras naturales que proporciona información de los efectos combinados en escalas de tiempo geológicas. La compleja composición y química del kerógeno complica los resultados. Sin embargo, la mayoría de las investigaciones sobre la HIC del kerógeno muestran un enriquecimiento de D con el aumento de la madurez. Se informa que el kerógeno tipo II (derivado marino) de New Albany Shale tiene un aumento de δD de −120‰ a −70‰ a medida que la reflectancia de la vitrinita aumenta de 0,3% a 1,5%. [228] Se han propuesto dos mecanismos principales para el enriquecimiento. Uno de ellos es el fraccionamiento cinético durante la generación de hidrocarburos, mientras que el otro es el intercambio isotópico con el agua circundante. Los experimentos de incubación anhidra han demostrado que los productos generalmente están más empobrecidos en D que sus precursores, lo que provoca un enriquecimiento en el kerógeno residual. Schimmelmann et al. Estudiaron la relación entre el petróleo de origen terrestre y los kerógenos de sus rocas madre de cuatro cuencas australianas. Encontraron que, en promedio, el petróleo se agota hasta el kerógeno correspondiente en un 23‰. [224] Los experimentos de incubación hidratada sugieren que entre el 36 y el 79 % del hidrógeno orgánico a granel puede provenir del agua en una madurez moderada. Si bien aún se debate, parece probable que la incorporación de isótopos de hidrógeno del agua sea el proceso más dominante para el enriquecimiento de D-kerógeno durante la catagénesis. [46]
En resumen, el contenido de D del kerógeno y del carbón es complicado y difícil de resolver debido a la compleja química. No obstante, los estudios han encontrado la posible correlación entre el δD del carbón y la paleolatitud.
Comúnmente, la HIC del gas natural del mismo pozo tiene una tendencia de δD metano < δD etano < δD propano < δD C4+ . Esto se debe a que se cree que la mayor parte del gas natural se genera mediante craqueo térmico escalonado que es en su mayoría irreversible y, por lo tanto, está regido por efectos isotópicos cinéticos normales (KIE) que favorecen a los isótopos ligeros. La misma tendencia, conocida como "el orden normal", [229] se aplica a los isótopos de carbono en el gas natural. Por ejemplo, se informa que el gas de Angola tiene un rango de δD de metano de -190‰ a -140‰, un δD de etano de -146‰ a -107‰, un δD de propano de -116‰ a -90‰ y un δD de butano de -118‰ a -85‰. [230] Sin embargo, algunos estudios recientes muestran que también podrían existir patrones opuestos, es decir, δD metano > δD etano > δD propano . Este fenómeno a menudo se denomina "inversión isotópica" o "rollover isotópico". El orden isotópico también podría estar parcialmente invertido, como δD metano > δD etano < δD propano o δD metano < δD etano > δD propano . [229] Burruss et al. encontraron que en las muestras más profundas de la cuenca norte de los Apalaches, el orden isotópico del hidrógeno para el metano y el etano está invertido. [231] Liu et al., también encontraron una inversión parcial en el gas relacionado con el petróleo de la cuenca del Tarim. [229] El mecanismo que causa esta inversión aún se desconoce. Las posibles explicaciones incluyen la mezcla entre gases de diferentes madurez y fuentes, la oxidación del metano, etc. Jon Telling et al., sintetizaron alcanos de bajo peso molecular isotópicamente invertidos (tanto en C como en H) utilizando reacciones de recombinación de radicales en fase gaseosa en experimentos de descarga eléctrica , lo que proporcionó otro mecanismo posible. [232]
El metano es el componente principal del gas natural. El metano de la geosfera es intrigante por la gran entrada de metanogénesis microbiana . Este proceso exhibe un fuerte KIE, lo que resulta en un mayor agotamiento de D en el metano en relación con otros hidrocarburos . δD varía de −275‰ a −100‰ en metano termogénico, y de −400‰ a −150‰ en metano microbiano. [95] Además, el metano formado por metanógenos marinos generalmente está enriquecido en D en relación con el metano de metanógenos de agua dulce . δD del metano se ha trazado junto con otras herramientas geoquímicas (como δ 13 C, humedad del gas) para categorizar e identificar el gas natural. Un diagrama δD-δ 13 C (a veces llamado diagrama CD, diagrama de Whiticar o diagrama de Schoell) se usa ampliamente para colocar al metano en uno de los tres grupos distintos: metano termogénico que tiene mayor contenido de δ 13 C y δD; metano microbiano marino que tiene mayor contenido de 13 C y metano microbiano de agua dulce que tiene mayor contenido de D. La metanogénesis hidrogenotrófica produce menos metano con menor contenido de D en relación con la metanogénesis acetoclástica. La ubicación donde vive el organismo y la concentración de sustrato también afectan la composición isotópica: la metanogénesis del rumen , que ocurre en un sistema más cerrado y con presiones parciales de hidrógeno más altas, exhibe un fraccionamiento mayor (−300 a −400‰) que la metanogénesis de humedales (−250 a −170‰). [233] [234]
Los avances recientes en química analítica han permitido mediciones de alta precisión de isotópogos sustituidos de forma múltiple (o "agrupados") como el 13 CH 3 2 H. Esta es una herramienta novedosa para estudiar la formación de metano. Este proxy se basa en la abundancia de isotópogos agrupados de metano, que deberían estar enriquecidos en comparación con la distribución estocástica en equilibrio termodinámico porque la energía de punto cero reducida para el enlace de isótopos pesados-pesados es más del doble de la energía de punto cero reducida del enlace de isótopos pesados-ligeros. [235] El grado de enriquecimiento disminuye con el aumento de la temperatura, ya que una mayor entropía tiende a aleatorizar la distribución de isótopos. Stolper et al. establecieron esta calibración de temperatura utilizando metano equilibrado en laboratorio y metano de campo a partir de una temperatura de formación conocida, y lo aplicaron a varios yacimientos de gas para estudiar la formación y mezcla de gas natural. [236] Wang et al. También se ha informado de un fuerte efecto isotópico de desequilibrio en los isótopos agrupados de metano de metanógenos cultivados en laboratorio y muestras de campo. [237] Estas muestras de metano tienen una abundancia relativamente baja de isotopólogos agrupados, a veces incluso inferior a la distribución estocástica. Esto indica que hay pasos irreversibles en las reacciones enzimáticas durante la metanogénesis [237] que fraccionan contra los isotopólogos agrupados para crear la señal agotada. La agrupación de isótopos en el metano ha demostrado ser un indicador sólido, y los científicos ahora están avanzando hacia moléculas de alcano de orden superior como el etano para seguir investigando. [238]
El petróleo es generalmente un producto de la descomposición térmica del kerógeno tipo I y tipo II durante la catagénesis . El HIC debe reflejar la señal de kerógeno fuente, fraccionamiento de generación, intercambio isotópico y otros efectos de maduración. La maduración térmica en la ventana del petróleo puede borrar gran parte de las señales primarias del HIC. La formación de petróleo implica romper enlaces CC y CH, lo que resulta en el agotamiento de 13 C y 2 H en los productos y enriquecimiento en los reactivos residuales debido a los KIE. Yongchun Tang y sus colegas modelaron este proceso basándose en datos cinéticos calibrados en laboratorio y encontraron que la relación del factor de frecuencia para D/H es 1,07. [239] Además, el petróleo también se ve afectado por el fraccionamiento de isótopos a partir de cambios de fase . Sin embargo, el comportamiento del fraccionamiento de gas-líquido de petróleo difiere del agua ya que la fase de vapor del petróleo está enriquecida con 2 H. [51] Esto agota el petróleo residual a medida que se evapora. También se espera que la biodegradación del petróleo fraccione los isótopos de hidrógeno, ya que la ruptura enzimática del enlace CH tiene un KIE normal. Varios experimentos de degradación muestran que este fraccionamiento es generalmente leve, y varía de −11‰ a −79‰. [51] Este proceso también debería enriquecer el petróleo parcialmente degradado. Finalmente, el petróleo almacenado en un yacimiento a menudo había migrado a través del subsuelo (también conocido como geocromatografía) desde otra región de origen, interactuando con el agua. No se han publicado datos que confirmen el fraccionamiento asociado con la migración, pero la predicción teórica muestra que es probable que sea muy pequeña. [51]
Muchos estudios de muestras naturales han mostrado ligeros aumentos en δD con la madurez térmica. Amane Waseda informó que el δD de las muestras de petróleo en el noreste de Japón aumenta de alrededor de −130‰ a alrededor de −110‰ con una mayor madurez. [240] A baja madurez térmica , dos Santos Neto y Hayes informaron que el δD de la fracción saturada de petróleo en la cuenca de Portiguar derivado de un entorno lacustre es de -90‰, y de un entorno marino-evaporítico es de -120‰ a −135‰. [46] [85]
El análisis a granel del petróleo, que produce una mezcla compleja de compuestos orgánicos , oscurece gran parte de la información valiosa. Cambiar al estudio específico de compuestos amplió enormemente nuestra comprensión de los isótopos de hidrógeno del petróleo. Analizar HIC a nivel de compuesto evita problemas por diferencias en los tipos de cambio, simplifica las relaciones entre fuentes y productos y dibuja una imagen mucho más detallada. [51] En general, se piensa que los δD de los n - alcanos son representativos del petróleo, ya que son los componentes principales. Schimmelmann et al. confirmaron que las fracciones de alcanos tienen casi los mismos DHR que los aceites completos . [224] Dependiendo del tipo de material de origen y la madurez, el δD de los n -alcanos puede variar de −100‰ a −180‰. Un fenómeno común de varios n-alcanos derivados del petróleo y de rocas maduras es una tendencia a aumentar el δD con la longitud de la cadena. Por ejemplo, Li et al. Se analizaron los aceites de la cuenca sedimentaria del oeste de Canadá y se encontró que δD aumentó entre 20‰ y 40‰ de C 13 a C 27 . [241] Esta "pendiente isotópica" es un artefacto de fraccionamiento cinético asociado con el craqueo térmico de las cadenas de carbono. Esta tendencia ha sido reproducida experimentalmente y modelada teóricamente por Tang et al. [223]
También se sabe que los N-alcanos preservan información detallada del material de origen. Li et al. estudiaron aceites de esquisto moteado blanco del segundo Cretácico superior de origen marino y encontraron una fuerte señal agotada alrededor de −180‰ en C 12 -C 18 . El bajo δD de estas muestras marinas se explicó por la descarga de un gran río de alta latitud . [241] Schimmelmann et al. encontraron que el δD del aceite muestreado de facies carbonosas del grupo Crayfish llega hasta −230‰, mientras que los muestreados de facies de algas del mismo grupo están alrededor de −100‰. Una variación tan enorme es difícil de explicar por otras causas que no sean la separación de Australia de la Antártida a finales del Cretácico. [51] Otro caso especial informado por Xiong et al. [242] estudió los carbonatos del Ordovícico de la cuenca de la bahía de Bohai. Encontraron grandes diferencias entre δD de n-alcanos, lo que refleja que la señal original se conserva en lugar de homogeneizarse. El resultado no es obvio ya que la muestra es muy madura ( reflectancia de vitrinita inferida R 0 hasta 2,3). Por lo tanto, esta es una evidencia sólida de que los sistemas de carbonato tienen una eficiencia catalítica mucho menor de intercambio de hidrógeno en hidrocarburos. También se encuentra un fuerte enriquecimiento (~40‰) en alcanos de número de carbono impar a alcanos de número de carbono par en algún subconjunto de muestras y la razón no está clara en este momento. Este efecto impar-par también se observa en sedimentos clásticos inmaduros . [243]
La ecohidrología se ocupa de la interacción entre los ecosistemas y el ciclo del agua, desde la medición del drenaje a pequeña escala del agua en el suelo hasta el seguimiento de los amplios movimientos del agua que se evapora de los árboles. Debido a que el deuterio actúa como un trazador conservador , funciona bien para rastrear el movimiento del agua a través de las plantas y los ecosistemas . Aunque el movimiento del agua en fenómenos de un solo proceso como la evaporación es relativamente simple de rastrear, muchos sistemas (por ejemplo, los bosques nubosos ) en el medio ambiente tienen múltiples fuentes, y el seguimiento del movimiento del agua se vuelve más complicado. [244] La adición de isótopos también se puede realizar para determinar el transporte de agua a través del suelo y hacia las plantas inyectando agua deuterada directamente en el suelo. [245]
El análisis de isótopos estables del agua del xilema se puede utilizar para seguir el movimiento del agua desde el suelo hasta las plantas y, por lo tanto, proporcionar un registro de la profundidad de adquisición de agua. Una ventaja de utilizar agua del xilema es que, en teoría, el HIC debería reflejar directamente el agua de entrada sin verse afectado por la transpiración de las hojas. Por ejemplo, Dawson y Ehleringer utilizaron este enfoque para determinar si los árboles que crecen junto a arroyos están utilizando las aguas superficiales de ese arroyo. [246] El agua de la superficie tendría la misma composición isotópica que el arroyo, mientras que el agua de más abajo en el suelo sería de entradas de precipitaciones pasadas. En este caso, los árboles más jóvenes tenían una composición isotópica del agua del xilema muy similar al arroyo adyacente y probablemente utilizaron aguas superficiales para establecerse. Los árboles más viejos habían agotado el agua del xilema en relación con el arroyo, lo que refleja que obtienen su agua de una profundidad subterránea. [246] Otros estudios de isótopos estables también han determinado que las plantas en los bosques de secuoyas no sólo absorben agua de sus raíces, sino que adquieren una proporción significativa de agua a través de la absorción estomática en las hojas. [247]
El agua de las plantas se puede utilizar para caracterizar otros procesos fisiológicos de las plantas que afectan el ciclo del agua ; por ejemplo, el agua de las hojas se utiliza ampliamente para modelar la transpiración [248] y la eficiencia del uso del agua (WUE). [249] En la transpiración, se ha descubierto experimentalmente que el modelo de Craig-Gordon para el enriquecimiento del agua del lago a través de la evaporación [250] se ajusta bien para modelar el enriquecimiento del agua de las hojas. [251] La transpiración se puede medir mediante la inyección directa de agua deuterada en la base del árbol, atrapando todo el vapor de agua transpirado de las hojas y midiendo el condensado posterior. [252] El uso del agua también se puede medir y se calcula a partir de una inyección de agua pesada de la siguiente manera:
donde WU es el uso de agua en kg/día, M es la masa de agua deuterada inyectada en gramos, T es el último día del experimento, C i es la concentración de deuterio en el intervalo de tiempo i en gramos/kilogramo y Δt i es la longitud del intervalo de tiempo i en días. Aunque el uso de agua calculado a través del sondeo de disipación térmica de algunas plantas tropicales como los bambúes, se correlaciona fuertemente con el uso de agua medido encontrado al rastrear el movimiento de D 2 O, los valores exactos no son los mismos. [253] De hecho, con el árbol leguminoso Gliricidia sepium , que produce un duramen, el agua transpirada ni siquiera se correlacionó fuertemente con las concentraciones de 2 H 2 O inyectadas, lo que complicaría aún más las mediciones del uso de agua a partir de inyecciones directas. Esto posiblemente ocurrió porque los duramen podrían acumular agua pesada en lugar de mover el agua directamente a través del xilema y hacia las hojas. [253]
La WUE, la relación entre la fijación de carbono y la transpiración, se ha asociado previamente con las relaciones 13 C/ 12 C utilizando la ecuación:
dónde
La HIC puede ser útil para rastrear la migración animal . [254] Los animales con tejido metabólicamente inerte (por ejemplo, plumas o pelo) sintetizan ese tejido usando hidrógeno del agua de origen y los alimentos, pero idealmente no incorporan agua posterior durante la migración. Debido a que δD varía geográficamente, la diferencia entre el δD del tejido animal y el δD del agua posterior a la migración, después de tener en cuenta el fraccionamiento biológico de la asimilación, puede proporcionar información sobre el movimiento animal. En las mariposas monarca , por ejemplo, la quitina del ala es metabólicamente inerte después de su construcción, por lo que puede reflejar la composición isotópica del agua ambiental en el momento y el lugar del crecimiento del ala. Esto crea un registro del origen de la mariposa y se puede utilizar para determinar la distancia de migración. [255] Este enfoque también se puede utilizar en murciélagos y pájaros, utilizando pelo y plumas, respectivamente. [256] [257] Dado que el agua de lluvia se agota a medida que aumenta la altitud, este método también puede rastrear la migración altitudinal. Sin embargo, esto es técnicamente difícil de hacer y la resolución parece ser demasiado pobre para rastrear pequeños cambios altitudinales. [257] El 2H es más útil para rastrear el movimiento de especies entre áreas con una gran variación de agua continental, ya que el movimiento de especies puede complicarse por la similitud de la δD del agua local entre lugares. Por ejemplo, el agua de origen de Baja California puede tener la misma δD que el agua de Maine. [258] Además, una proporción del HIC en el tejido puede intercambiarse con el agua y complicar la interpretación de las mediciones. Para determinar este porcentaje de intercambio isotópico, que varía según los niveles de humedad locales, se pueden construir estándares de tejido metabólicamente inerte de las especies de interés y equilibrarlos con las condiciones locales. Esto permite comparar la δD medida de diferentes regiones entre sí. [259]
La asimilación de la dieta en el tejido tiene un fraccionamiento específico del tejido conocido como el factor de discriminación trófica. Las fuentes de dieta se pueden rastrear a través de una red alimentaria mediante perfiles de isótopos de deuterio, aunque esto se complica porque el deuterio tiene dos fuentes potenciales: agua y alimento. Los alimentos impactan más fuertemente en δD que el intercambio con el agua circundante, y esa señal se ve en todos los niveles tróficos. [260] Sin embargo, diferentes organismos derivan hidrógeno orgánico en proporciones variables de agua a alimento: por ejemplo, en la codorniz, el 20-30% del hidrógeno orgánico era del agua y el resto del alimento. El porcentaje preciso de hidrógeno del agua dependía de la fuente del tejido y la actividad metabólica. [261] En los quironómidos , el 31-47% del hidrógeno de la biomasa derivaba del agua, [260] y en los microbios hasta el 100% del hidrógeno de los ácidos grasos puede derivarse del agua dependiendo del sustrato. [186] En las orugas, el δD de la dieta de la materia orgánica se correlaciona linealmente con el δD del tejido. Sin embargo, la misma relación no parece mantenerse consistentemente para la dieta δD del agua: el agua derivada de la oruga o de la planta de su presa está más enriquecida con 2 H que su material orgánico. Subir niveles tróficos desde la presa (planta) al depredador (oruga) resulta en un enriquecimiento isotópico. [262] Esta misma tendencia de enriquecimiento se observa en muchos otros animales (carnívoros, omnívoros y herbívoros) y parece seguir abundancias relativas de 15 N. Los carnívoros en el mismo nivel trófico tienden a exhibir el mismo nivel de enriquecimiento de 2 H. [263] Debido a que, como se mencionó anteriormente, la cantidad de hidrógeno orgánico producido a partir del agua varía entre especies, es difícil hacer un modelo de nivel trófico relacionado con el fraccionamiento absoluto si no se conocen las especies participantes. La consistencia en la medición de los mismos tejidos también es importante, ya que los diferentes tejidos fraccionan el deuterio de manera diferente. En los sistemas acuáticos, el seguimiento de las interacciones tróficas es valioso no solo para comprender la ecología del sistema, sino también para determinar el grado de aporte terrestre. [33] [264] Los patrones de enriquecimiento de deuterio consistentes dentro de los niveles tróficos son una herramienta útil para evaluar la naturaleza de estas interacciones en el medio ambiente. [33]
El fraccionamiento biológico del deuterio a través del metabolismo depende en gran medida del organismo y de la vía, lo que da como resultado una amplia variabilidad en los fraccionamientos. [186] [265] A pesar de esto, algunas tendencias aún se mantienen. Los isótopos de hidrógeno tienden a fraccionarse muy fuertemente en los autótrofos en relación con los heterótrofos durante la biosíntesis de lípidos: los quimioautótrofos producen lípidos extremadamente agotados, con un fraccionamiento que varía de aproximadamente −200 a −400‰. [266] Esto se ha observado tanto en cultivos cultivados en laboratorio alimentados con una cantidad conocida de agua deuterada como en el medio ambiente. [186] [267] Sin embargo, las proteínas no siguen una tendencia tan significativa, ya que tanto los heterótrofos como los autótrofos son capaces de generar fraccionamientos grandes y variables. [266] En parte, el fraccionamiento cinético del isótopo más ligero durante la formación de equivalentes reductores NADH y NADPH da como resultado lípidos y proteínas que son isotópicamente más ligeros.
La salinidad también parece desempeñar un papel en el grado de fraccionamiento del deuterio; las aguas más salinas afectan la tasa de crecimiento, la tasa de intercambio de hidrógeno y la tasa de evaporación. Todos estos factores influyen en el lípido δD cuando el hidrógeno se incorpora a la biomasa. En los cocolitóforos Emiliania huxleyi y Gephyrocapsa oceanica , se ha descubierto que la alquenona δD se correlaciona fuertemente con la tasa de crecimiento del organismo dividida por la salinidad. [202] La relación entre el fraccionamiento del deuterio y la salinidad podría utilizarse potencialmente en la reconstrucción del paleoambiente con lípidos preservados en el registro de rocas para determinar, por ejemplo, la salinidad del océano en el momento del crecimiento del organismo. Sin embargo, el grado de fraccionamiento no es necesariamente consistente entre organismos, lo que complica la determinación de la paleosalinidad con este método. [202] También parece haber una correlación negativa entre la tasa de crecimiento y el fraccionamiento en estos cocolitóforos. Experimentos posteriores con algas unicelulares Eudorina unicocca y Volvox aureus no muestran ningún efecto de la tasa de crecimiento (controlada por la limitación de nitrógeno) sobre el δD de los ácidos grasos. Sin embargo, los esteroles se vuelven más pobres en D a medida que aumenta la tasa de crecimiento, [268] de acuerdo con la composición isotópica de alquenonas en los cocolitóforos. En general, aunque existen algunas tendencias fuertes con el δD de los lípidos, los fraccionamientos específicos son específicos de cada compuesto. Como resultado, cualquier intento de crear un salinómetro a través de mediciones de δD será necesariamente específico para un solo tipo de compuesto.
Un objetivo importante de la química ambiental es rastrear la fuente y degradación de contaminantes. Se han utilizado varios métodos para identificar depósitos de contaminantes ambientales, como la composición química a granel de un derrame, [269] las proporciones isotópicas de la mezcla química a granel, [270] o las proporciones isotópicas de compuestos constituyentes individuales. Los isótopos estables de carbono e hidrógeno se pueden utilizar como técnicas complementarias de identificación para el gas natural. [271] La DHR de hidrocarburos del derrame de petróleo de Deepwater Horizon se utilizó para verificar que probablemente provenían del pozo Macondo. [272] Los HIC también se han utilizado como una medida de la cantidad relativa de biodegradación que se ha producido en los yacimientos de petróleo en China, [273] y los estudios sobre cultivos puros de organismos degradadores de n-alcanos han demostrado una dependencia de la longitud de la cadena en la cantidad de fraccionamiento de isótopos de hidrógeno durante la degradación. [274] Estudios adicionales también han mostrado efectos de isótopos de hidrógeno en la degradación de metil tert-butil éter [275] y tolueno [276] [277] que se han sugerido como útiles en la evaluación del nivel de degradación de estos compuestos contaminantes en el medio ambiente. En ambos casos, los compuestos residuales que no reaccionaron se enriquecieron con 2 H a unas pocas decenas de ‰, con variaciones exhibidas entre diferentes organismos y grado de completitud de la reacción. Estas observaciones de compuestos residuales pesados se han aplicado a observaciones de campo de reacciones de biodegradación tales como la eliminación de benceno y etilbenceno, [278] que impartieron un fraccionamiento D/H de 27 y 50 ‰, respectivamente. Además, el análisis de o-xileno en un sitio contaminado mostró altas DHR residuales después de la biodegradación, en consonancia con la activación de enlaces CH como un paso limitante de la velocidad en este proceso [279]
Las proporciones de isótopos estables se han utilizado en diversas situaciones en las que se cuestiona la autenticidad o el origen de un compuesto químico. Entre estas situaciones se incluyen la evaluación de la autenticidad de alimentos, vinos y sabores naturales; el control de drogas en el deporte (véase dopaje en el deporte ); productos farmacéuticos; drogas ilícitas; e incluso la ayuda para identificar restos humanos. En estos casos, a menudo no basta con detectar o cuantificar un determinado compuesto, ya que la cuestión es el origen del compuesto. La fortaleza del análisis de isótopos de hidrógeno para responder a estas preguntas es que la DHR de un producto natural a menudo está relacionada con las DHR del agua natural en el área donde se formó el producto (véase: Ciclo hidrológico). Dado que las DHR varían significativamente entre diferentes áreas, esta puede ser una herramienta poderosa para localizar la fuente original de muchas sustancias diferentes.
Los alimentos, los aromas y los sabores se venden a menudo con la garantía de que los aditivos químicos proceden de fuentes naturales. Esta afirmación se vuelve difícil de comprobar cuando el compuesto químico tiene una estructura conocida y se sintetiza fácilmente en un laboratorio. La autenticación de las afirmaciones sobre los orígenes de estos productos químicos ha hecho un buen uso de varios isótopos estables, incluidos los del hidrógeno. El análisis combinado de isótopos de carbono e hidrógeno se ha utilizado para comprobar la autenticidad del (E)-metil cinamato , [280] γ-decalactona y δ-decalactona . [281] Las proporciones de isótopos de hidrógeno y nitrógeno se han utilizado para la autenticación de las alquilpirazinas utilizadas como aromas "naturales" del café . [282]
La proporción de isótopos de carbono en los esteroides de los atletas se ha utilizado para determinar si estos esteroides provienen del cuerpo del atleta o de una fuente externa. Esta prueba se ha utilizado en varios casos antidopaje de alto perfil y tiene varias ventajas sobre la simple caracterización de la concentración de varios compuestos. Se están realizando intentos para crear pruebas similares basadas en isótopos de hidrógeno estables [283] que podrían usarse para complementar los métodos de prueba existentes. Una preocupación con este método era que los esteroides naturales producidos por el cuerpo humano pueden variar significativamente en función del contenido de 2 H del agua potable, lo que conduce a una detección falsa de dopaje basada en diferencias de HIC. Esta preocupación se ha abordado en un estudio reciente que concluyó que el efecto de la DHR del agua potable no representa una fuente insalvable de error para esta estrategia de prueba antidopaje. [284]
La industria farmacéutica tiene ingresos de cientos de miles de millones de dólares al año a nivel mundial . Con una industria tan grande, la falsificación y la violación de derechos de autor son problemas graves, y la huella isotópica de hidrógeno se ha convertido en una herramienta útil para verificar la autenticidad de varios medicamentos. Como se describe en las secciones anteriores, la utilidad de las DHR es mayor cuando se combinan con mediciones de otras proporciones isotópicas. En un estudio temprano sobre las composiciones isotópicas estables de tropicamida , hidrocortisona , quinina y triptófano ; se analizaron los isótopos estables de carbono, nitrógeno, oxígeno e hidrógeno mediante EA-IRMS; se pudieron hacer distinciones claras entre fabricantes e incluso lotes de los medicamentos en función de sus firmas isotópicas. [285] En este estudio se determinó que las proporciones isotópicas de hidrógeno y oxígeno eran las dos mejores huellas para distinguir entre diferentes fuentes de medicamentos. Un estudio de seguimiento que analizó el naproxeno de varios lotes y fabricantes también mostró una capacidad similar para distinguir entre las fuentes de los medicamentos. [286] El uso de estas firmas isotópicas no sólo podría utilizarse para distinguir entre diferentes fabricantes, sino también entre diferentes vías sintéticas para el mismo compuesto. [287] Estos estudios se basaron en las variaciones naturales que se produjeron en la síntesis de estos fármacos, pero otros estudios han utilizado ingredientes de partida que están etiquetados intencionadamente como D y 13 C, y han demostrado que estas etiquetas podrían rastrearse hasta el producto farmacéutico final. [288] Los DHR también pueden determinarse para sitios específicos en un fármaco mediante RMN de 2 H, y se han utilizado para distinguir entre diferentes métodos sintéticos para ibuprofeno y naproxeno en un estudio, [289] y prozac y fluoxetina en otro. [290] Estos estudios muestran que la información de DHR a granel para EA-IRMS y los DHR específicos del sitio de RMN de 2 H tienen una gran utilidad para las pruebas de autenticidad de fármacos farmacéuticos.
Las fuentes y mecanismos de producción de drogas ilegales han sido otra área en la que se ha visto una aplicación exitosa de la caracterización de isótopos de hidrógeno. Por lo general, como con otras aplicaciones de técnicas de isótopos estables, los resultados son mejores cuando se comparan entre sí los datos de múltiples isótopos estables. δ 2 H, δ 13 C y δ 15 N se han utilizado juntos para analizar tabletas de MDA y MDMA y se han identificado con éxito diferencias que podrían usarse para diferenciar entre diferentes fuentes o mecanismos de producción. [291] La misma combinación de isótopos estables con la adición de δ 18 O se aplicó a la heroína y el empaque asociado y pudo distinguir con éxito entre diferentes muestras. [292] El análisis mediante RMN de deuterio también pudo arrojar luz sobre el origen y el procesamiento tanto de la cocaína como de la heroína . [293] En el caso de la heroína, esta fracción isotópica natural de sitio específico medida por el método de RMN de deuterio (SNIF-RMN) podría usarse para determinar el origen geográfico de la molécula mediante el análisis de los llamados sitios naturales (que estaban presentes en la morfina de la que se fabrica la heroína), así como para obtener información sobre el proceso de síntesis mediante el análisis de los sitios artificiales (agregados durante el procesamiento de la droga).
La variación geográfica de la DHR en el agua potable para consumo humano se registra en el cabello. Los estudios han demostrado una relación muy fuerte entre el cabello de un individuo y la DHR del agua potable. [294]
Dado que la DHR del agua del grifo depende en gran medida de la geografía, la DHR del cabello de una persona se puede utilizar para determinar las regiones en las que es más probable que haya vivido durante el período de crecimiento del cabello. Esta idea se ha utilizado en investigaciones criminales para intentar limitar los movimientos de una persona antes de su muerte, de forma muy similar a como se han utilizado las DHR para rastrear la migración de los animales. Al analizar secciones de cabello de distintas edades, se puede determinar en qué regiones D/H vivía una persona en un momento específico antes de su muerte. [295]
{{cite web}}: CS1 maint: multiple names: authors list (link){{cite book}}: |journal=ignorado ( ayuda ){{cite book}}: |journal= ignored (help){{cite book}}: |journal= ignored (help){{cite book}}: |journal= ignored (help){{cite book}}: |journal= ignored (help){{cite book}}: |journal= ignored (help)