En bioquímica , la síntesis de ácidos grasos es la creación de ácidos grasos a partir de acetil-CoA y NADPH mediante la acción de enzimas llamadas sintasas de ácidos grasos . Este proceso tiene lugar en el citoplasma de la célula . La mayor parte del acetil-CoA que se convierte en ácidos grasos se deriva de los carbohidratos a través de la vía glucolítica . La vía glucolítica también proporciona el glicerol con el que tres ácidos grasos pueden combinarse (por medio de enlaces éster ) para formar triglicéridos (también conocidos como "triacilgliceroles" -para distinguirlos de los "ácidos" grasos- o simplemente como "grasa"), el producto final del proceso lipogénico . Cuando solo dos ácidos grasos se combinan con el glicerol y el tercer grupo alcohol se fosforila con un grupo como la fosfatidilcolina , se forma un fosfolípido . Los fosfolípidos forman la mayor parte de las bicapas lipídicas que forman las membranas celulares y rodean los orgánulos dentro de las células (como el núcleo celular , las mitocondrias , el retículo endoplasmático , el aparato de Golgi , etc.). Además de la síntesis de ácidos grasos citosólicos, también existe la síntesis de ácidos grasos mitocondriales (mtFASII), en la que se forma malonil-CoA a partir de ácido malónico con la ayuda de la malonil-CoA sintetasa ( ACSF3 ), que luego se convierte en el producto final octanoil-ACP (C8) a través de pasos intermedios adicionales. [1]
Los ácidos grasos de cadena lineal se presentan en dos tipos: saturados e insaturados. Estos últimos se producen a partir de los primeros.

La síntesis de ácidos grasos de cadena lineal se produce a través de las seis reacciones recurrentes que se muestran a continuación, hasta que se produce el ácido palmítico de 16 carbonos. [2] [3]
Los diagramas presentados muestran cómo se sintetizan los ácidos grasos en los microorganismos y enumeran las enzimas que se encuentran en Escherichia coli . [2] Estas reacciones son realizadas por la sintetasa de ácidos grasos II (FASII), que en general contiene múltiples enzimas que actúan como un solo complejo. La FASII está presente en procariotas , plantas, hongos y parásitos, así como en las mitocondrias . [4]
En los animales, así como en algunos hongos como la levadura, estas mismas reacciones ocurren en la sintetasa de ácidos grasos I (FASI), una proteína dimérica grande que tiene todas las actividades enzimáticas necesarias para crear un ácido graso. La FASII es menos eficiente que la FASI; sin embargo, permite la formación de más moléculas, incluidos los ácidos grasos de "cadena media" a través de la terminación temprana de la cadena. [4]
Una vez formado, el ácido graso de carbono 16:0 puede sufrir una serie de modificaciones, lo que da como resultado la desaturación y/o elongación . La elongación a estearato (18:0) se produce principalmente en el RE por varias enzimas unidas a la membrana. Los pasos involucrados en el proceso de elongación son principalmente los mismos que los llevados a cabo por FAS, pero los cuatro pasos sucesivos principales de la elongación son realizados por proteínas individuales, que pueden estar asociadas físicamente. [5] [6]
En la síntesis de grasas, el agente reductor es el NADPH , mientras que el NAD es el agente oxidante en la beta-oxidación (la descomposición de los ácidos grasos en acetil-CoA). Esta diferencia ejemplifica un principio general de que el NADPH se consume durante las reacciones biosintéticas, mientras que el NADH se genera en las reacciones que producen energía. [7] (Por lo tanto, el NADPH también es necesario para la síntesis de colesterol a partir de acetil-CoA; mientras que el NADH se genera durante la glucólisis ). La fuente del NADPH es doble. Cuando el malato se descarboxila oxidativamente mediante la " enzima málica unida a NADP + " para formar piruvato , se forman CO2 y NADPH. El NADPH también se forma mediante la vía de las pentosas fosfato , que convierte la glucosa en ribosa, que se puede utilizar en la síntesis de nucleótidos y ácidos nucleicos , o se puede catabolizar a piruvato. [7]
En los humanos, los ácidos grasos se forman a partir de carbohidratos predominantemente en el hígado y el tejido adiposo , así como en las glándulas mamarias durante la lactancia.
El piruvato producido por la glucólisis es un intermediario importante en la conversión de carbohidratos en ácidos grasos y colesterol. [7] Esto ocurre a través de la conversión de piruvato en acetil-CoA en la mitocondria. Sin embargo, este acetil-CoA necesita ser transportado al citosol, donde ocurre la síntesis de ácidos grasos y colesterol. Esto no puede ocurrir directamente. Para obtener acetil-CoA citosólico, el citrato (producido por la condensación de acetil-CoA con oxaloacetato) se elimina del ciclo del ácido cítrico y se transporta a través de la membrana mitocondrial interna hasta el citosol. [7] Allí, la ATP citrato liasa lo escinde en acetil-CoA y oxaloacetato. El oxaloacetato se puede utilizar para la gluconeogénesis (en el hígado) o se puede devolver a la mitocondria como malato. [8] La acetil-CoA citosólica es carboxilada por la acetil-CoA carboxilasa en malonil-CoA , el primer paso comprometido en la síntesis de ácidos grasos. [8] [9]
El principal combustible almacenado en los cuerpos de los animales es la grasa. Las reservas de grasa de un ser humano adulto joven promedian entre 15 y 20 kg (33-44 lb), pero varían mucho según la edad, el sexo y la disposición individual. [10] En contraste, el cuerpo humano almacena solo unos 400 g (0,9 lb) de glucógeno , de los cuales 300 g (0,7 lb) están bloqueados dentro de los músculos esqueléticos y no están disponibles para el cuerpo en su conjunto. Los 100 g (0,2 lb) aproximadamente de glucógeno almacenados en el hígado se agotan en el plazo de un día después de la inanición. [11] A partir de entonces, la glucosa que el hígado libera en la sangre para uso general de los tejidos corporales tiene que sintetizarse a partir de los aminoácidos glucogénicos y algunos otros sustratos gluconeogénicos , que no incluyen los ácidos grasos. [12]
Los ácidos grasos se descomponen en acetil-CoA mediante beta oxidación dentro de las mitocondrias, mientras que los ácidos grasos se sintetizan a partir de acetil-CoA fuera de la mitocondria, en el citosol. Las dos vías son distintas, no solo en donde ocurren, sino también en las reacciones que ocurren y los sustratos que se utilizan. Las dos vías son mutuamente inhibidoras, evitando que el acetil-CoA producido por beta-oxidación entre en la vía sintética a través de la reacción de la acetil-CoA carboxilasa . [12] Tampoco se puede convertir en piruvato ya que la reacción de descarboxilación del piruvato es irreversible. [11] En cambio, se condensa con oxaloacetato , para entrar en el ciclo del ácido cítrico . Durante cada vuelta del ciclo, dos átomos de carbono salen del ciclo como CO 2 en las reacciones de descarboxilación catalizadas por la isocitrato deshidrogenasa y la alfa-cetoglutarato deshidrogenasa . Por lo tanto, cada vuelta del ciclo del ácido cítrico oxida una unidad de acetil-CoA mientras se regenera la molécula de oxaloacetato con la que el acetil-CoA se había combinado originalmente para formar ácido cítrico . Las reacciones de descarboxilación ocurren antes de que se forme el malato en el ciclo. El malato es la única sustancia que puede eliminarse de la mitocondria para ingresar a la vía gluconeogénica para formar glucosa o glucógeno en el hígado o cualquier otro tejido. [12] Por lo tanto, no puede haber una conversión neta de ácidos grasos en glucosa.
Sólo las plantas poseen las enzimas para convertir el acetil-CoA en oxalacetato, a partir del cual se puede formar malato para finalmente convertirse en glucosa. [12]
El acetil-CoA se transforma en malonil-CoA por acción de la acetil-CoA carboxilasa , momento en el que la malonil-CoA se destina a alimentar la vía de síntesis de ácidos grasos. La acetil-CoA carboxilasa es el punto de regulación en la síntesis de ácidos grasos saturados de cadena lineal y está sujeta tanto a la fosforilación como a la regulación alostérica . La regulación por fosforilación ocurre principalmente en mamíferos, mientras que la regulación alostérica ocurre en la mayoría de los organismos. El control alostérico ocurre como inhibición por retroalimentación por parte del palmitoil-CoA y activación por citrato. Cuando hay altos niveles de palmitoil-CoA, el producto final de la síntesis de ácidos grasos saturados, inactiva alostéricamente la acetil-CoA carboxilasa para evitar una acumulación de ácidos grasos en las células. El citrato actúa para activar la acetil-CoA carboxilasa en niveles altos, porque los niveles altos indican que hay suficiente acetil-CoA para alimentar el ciclo de Krebs y conservar energía. [13]
Los altos niveles plasmáticos de insulina en el plasma sanguíneo (por ejemplo, después de las comidas) provocan la desfosforilación de la acetil-CoA carboxilasa, promoviendo así la formación de malonil-CoA a partir de acetil-CoA y, en consecuencia, la conversión de carbohidratos en ácidos grasos, mientras que la epinefrina y el glucagón (liberados en la sangre durante la inanición y el ejercicio) provocan la fosforilación de esta enzima, inhibiendo la lipogénesis a favor de la oxidación de ácidos grasos a través de la beta-oxidación . [7] [9]
Muchas bacterias utilizan la vía anaeróbica para sintetizar ácidos grasos insaturados. Esta vía no utiliza oxígeno y depende de enzimas para insertar el doble enlace antes de la elongación utilizando la maquinaria normal de síntesis de ácidos grasos. En Escherichia coli , esta vía es bien conocida.

La mayoría de las bacterias que sufren desaturación anaeróbica contienen homólogos de FabA y FabB. [16] Los clostridios son la principal excepción; tienen una enzima nueva, aún por identificar, que cataliza la formación del doble enlace cis. [15]
Esta vía está regulada transcripcionalmente por FadR y FabR. FadR es la proteína más estudiada y se le han atribuido características bifuncionales. Actúa como activador de la transcripción de fabA y fabB y como represor del regulón de β-oxidación . Por el contrario, FabR actúa como represor de la transcripción de fabA y fabB. [14]
La desaturación aeróbica es la vía más extendida para la síntesis de ácidos grasos insaturados. Se utiliza en todos los eucariotas y algunos procariotas. Esta vía utiliza desaturasas para sintetizar ácidos grasos insaturados a partir de sustratos de ácidos grasos saturados de longitud completa. [17] Todas las desaturasas requieren oxígeno y, en última instancia, consumen NADH, aunque la desaturación es un proceso oxidativo. Las desaturasas son específicas para el doble enlace que inducen en el sustrato. En Bacillus subtilis , la desaturasa, Δ 5 -Des, es específica para inducir un doble enlace cis en la posición Δ 5. [8] [17] Saccharomyces cerevisiae contiene una desaturasa, Ole1p, que induce el doble enlace cis en Δ 9. [8 ]
En los mamíferos, la desaturación aeróbica está catalizada por un complejo de tres enzimas unidas a la membrana ( NADH-citocromo b 5 reductasa, citocromo b 5 y una desaturasa ). Estas enzimas permiten que el oxígeno molecular, O
2, para interactuar con la cadena de acil-CoA graso saturado, formando un doble enlace y dos moléculas de agua, H
2O. Dos electrones provienen del NADH + H+
y dos del enlace simple en la cadena de ácidos grasos. [7] Sin embargo, estas enzimas de mamíferos son incapaces de introducir enlaces dobles en átomos de carbono más allá de C-9 en la cadena de ácidos grasos. [nb 1] .) Por lo tanto, los mamíferos no pueden sintetizar linoleato o linolenato (que tienen enlaces dobles en las posiciones C-12 (= Δ 12 ), o C-12 y C-15 (= Δ 12 y Δ 15 ), respectivamente, así como en la posición Δ 9 ), ni el ácido araquidónico poliinsaturado de 20 carbonos que se deriva del linoleato. Todos estos se denominan ácidos grasos esenciales , lo que significa que son necesarios para el organismo, pero solo se pueden suministrar a través de la dieta. (El ácido araquidónico es el precursor de las prostaglandinas que cumplen una amplia variedad de funciones como hormonas locales .) [7]
Los ácidos grasos de cadena impar (OCFAs) son aquellos ácidos grasos que contienen un número impar de átomos de carbono. Los OCFAs más comunes son los derivados saturados C15 y C17, respectivamente ácido pentadecanoico y ácido heptadecanoico . [18] La síntesis de ácidos grasos de cadena par se realiza mediante el ensamblaje de precursores de acetil-CoA , sin embargo, se utiliza propionil-CoA en lugar de acetil-CoA como cebador para la biosíntesis de ácidos grasos de cadena larga con un número impar de átomos de carbono. [19]
En B. subtilis , esta vía está regulada por un sistema de dos componentes : DesK y DesR. DesK es una quinasa asociada a la membrana y DesR es un regulador transcripcional del gen des . [8] [17] La regulación responde a la temperatura; cuando hay una caída de temperatura, este gen se regula al alza. Los ácidos grasos insaturados aumentan la fluidez de la membrana y la estabilizan a temperaturas más bajas. DesK es la proteína sensora que, cuando hay una disminución de la temperatura, se autofosforilará. DesK-P transferirá su grupo fosforilo a DesR. Dos proteínas DesR-P se dimerizarán y se unirán a los promotores de ADN del gen des y reclutarán a la ARN polimerasa para comenzar la transcripción. [8] [17]
Pseudomonas aeruginosa
En general, la síntesis de ácidos grasos insaturados anaeróbicos y aeróbicos no se produce dentro del mismo sistema, aunque Pseudomonas aeruginosa y Vibrio ABE-1 son excepciones. [20] [21] [22] Aunque P. aeruginosa sufre principalmente una desaturación anaeróbica, también sufre dos vías aeróbicas. Una vía utiliza una Δ 9 -desaturasa (DesA) que cataliza la formación de un doble enlace en los lípidos de la membrana. Otra vía utiliza dos proteínas, DesC y DesB, juntas para actuar como una Δ 9 -desaturasa, que inserta un doble enlace en una molécula de ácido graso saturado-CoA. Esta segunda vía está regulada por la proteína represora DesT. DesT también es un represor de la expresión de fabAB para la desaturación anaeróbica cuando está en presencia de ácidos grasos insaturados exógenos. Esto funciona para coordinar la expresión de las dos vías dentro del organismo. [21] [23]
Los ácidos grasos de cadena ramificada suelen ser saturados y se encuentran en dos familias distintas: la serie iso y la serie anteiso. Se ha descubierto que los Actinomycetales contienen mecanismos únicos de síntesis de ácidos grasos de cadena ramificada, incluido el que forma el ácido tuberculostérico.
El sistema de síntesis de ácidos grasos de cadena ramificada utiliza α-cetoácidos como cebadores. Este sistema es distinto de la sintetasa de ácidos grasos de cadena ramificada que utiliza ésteres de acil-CoA de cadena corta como cebadores. [24] Los cebadores de α-cetoácidos se derivan de la transaminación y descarboxilación de valina , leucina e isoleucina para formar 2-metilpropanil-CoA, 3-metilbutiril-CoA y 2-metilbutiril-CoA, respectivamente. [25] Los cebadores de 2-metilpropanil-CoA derivados de valina se alargan para producir ácidos grasos de isoserie de número par, como el ácido 14-metil-pentadecanoico (isopalmítico), y los cebadores de 3-metilbutiril-CoA de leucina se pueden utilizar para formar ácidos grasos de isoserie de número impar, como el ácido 13-metil-tetradecanoico. Los iniciadores de 2-metilbutiril-CoA de la isoleucina se alargan para formar ácidos grasos de la serie anteiso que contienen un número impar de átomos de carbono, como el ácido 12-metiltetradecanoico. [26] La descarboxilación de los precursores de los iniciadores se produce a través de la enzima descarboxilasa de α-cetoácido de cadena ramificada (BCKA). La alargación del ácido graso sigue la misma vía biosintética que se utiliza en Escherichia coli para producir ácidos grasos de cadena lineal, donde se utiliza malonil-CoA como extensor de cadena. [27] Los principales productos finales son ácidos grasos de cadena ramificada de 12 a 17 carbonos y su composición tiende a ser uniforme y característica de muchas especies bacterianas. [26]
Descarboxilasa BCKA y actividades relativas de los sustratos de α-cetoácidos
La enzima BCKA descarboxilasa está compuesta por dos subunidades en una estructura tetramérica (A 2 B 2 ) y es esencial para la síntesis de ácidos grasos de cadena ramificada. Es responsable de la descarboxilación de α-cetoácidos formados por la transaminación de valina, leucina e isoleucina y produce los cebadores utilizados para la síntesis de ácidos grasos de cadena ramificada. La actividad de esta enzima es mucho mayor con sustratos de α-cetoácidos de cadena ramificada que con sustratos de cadena lineal, y en las especies de Bacillus su especificidad es más alta para el ácido α-ceto-β-metilvalérico derivado de la isoleucina, seguido del α-cetoisocaproato y el α-cetoisovalerato. [26] [27] La alta afinidad de la enzima hacia los α-cetoácidos de cadena ramificada le permite funcionar como el sistema donador de cebadores para la sintetasa de ácidos grasos de cadena ramificada. [27]
Factores que afectan la longitud de la cadena y la distribución del patrón
Los iniciadores de α-cetoácidos se utilizan para producir ácidos grasos de cadena ramificada que, en general, tienen entre 12 y 17 carbonos de longitud. Las proporciones de estos ácidos grasos de cadena ramificada tienden a ser uniformes y consistentes entre una especie bacteriana particular, pero pueden alterarse debido a cambios en la concentración de malonil-CoA, la temperatura o los factores termoestables (HSF) presentes. [26] Todos estos factores pueden afectar la longitud de la cadena, y se ha demostrado que los HSF alteran la especificidad de la descarboxilasa BCKA para un sustrato de α-cetoácido particular, modificando así la proporción de ácidos grasos de cadena ramificada producidos. [26] Se ha demostrado que un aumento en la concentración de malonil-CoA da como resultado una mayor proporción de ácidos grasos C17 producidos, hasta que se alcanza la concentración óptima (≈20 μM) de malonil-CoA. La disminución de las temperaturas también tiende a modificar ligeramente la distribución de ácidos grasos hacia los ácidos grasos C17 en las especies de Bacillus . [24] [26]
Este sistema funciona de manera similar al sistema de síntesis de ácidos grasos de cadena ramificada, sin embargo, utiliza ácidos carboxílicos de cadena corta como iniciadores en lugar de alfa-cetoácidos. En general, este método lo utilizan las bacterias que no tienen la capacidad de realizar el sistema de ácidos grasos de cadena ramificada utilizando iniciadores alfa-ceto. Los iniciadores de cadena corta típicos incluyen isovalerato, isobutirato y 2-metilbutirato. En general, los ácidos necesarios para estos iniciadores se absorben del medio ambiente; esto se observa a menudo en las bacterias ruminales. [28]
La reacción general es:
La diferencia entre la sintasa de ácidos grasos (de cadena lineal) y la sintasa de ácidos grasos de cadena ramificada es la especificidad del sustrato de la enzima que cataliza la reacción de acil-CoA a acil-ACP. [24]
Los ácidos grasos omega-alicíclicos contienen típicamente un grupo cíclico propilo o butirilo en el extremo omega y son algunos de los principales ácidos grasos de membrana que se encuentran en varias especies de bacterias. La sintetasa de ácidos grasos utilizada para producir ácidos grasos omega-alicíclicos también se utiliza para producir ácidos grasos de cadena ramificada de membrana. En bacterias con membranas compuestas principalmente de ácidos grasos omega-alicíclicos, el suministro de ésteres de ácido carboxílico cíclico-CoA es mucho mayor que el de cebadores de cadena ramificada. [24] La síntesis de cebadores cíclicos no se entiende bien, pero se ha sugerido que el mecanismo implica la conversión de azúcares en ácido shikímico que luego se convierte en ésteres de ácido ciclohexilcarboxílico-CoA que sirven como cebadores para la síntesis de ácidos grasos omega-alicíclicos [28].
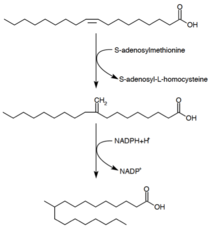
El ácido tuberculoesteárico (ácido D-10-metilesteárico) es un ácido graso saturado que se sabe que es producido por Mycobacterium spp. y dos especies de Streptomyces . Se forma a partir del precursor ácido oleico (un ácido graso monoinsaturado). [29] Después de que el ácido oleico se esterifica a un fosfolípido, la S-adenosil-metionina dona un grupo metilo al doble enlace del ácido oleico. [30] Esta reacción de metilación forma el intermedio 10-metilen-octadecanoil. La reducción sucesiva del residuo, con NADPH como cofactor, da como resultado ácido 10-metilesteárico [25]
Además de la síntesis de ácidos grasos en el citosol, las mitocondrias también tienen su propia síntesis de ácidos grasos (mtFASII). La síntesis de ácidos grasos mitocondriales es esencial para la respiración celular y la biogénesis mitocondrial . [31] También se supone que desempeña un papel como mediador en la transducción de señales intracelulares , ya que los niveles de lípidos bioactivos, como los lisofosfolípidos y los esfingolípidos , se correlacionan con mtFASII. [32]
En el primer paso de mtFASII, el malonil-CoA se forma a partir del ácido malónico por ACSF3 . [33] Esto ocurre en tándem con una isoforma mitocondrial de ACC1 (mtACC1), que todavía puede proporcionar malonil-CoA a partir de acetil-CoA. [34] Los ácidos grasos, como el octanoil-ACP (C8), que forma el sustrato inicial de la biosíntesis del ácido lipoico , se forman a través de pasos intermedios adicionales y extensiones de cadena. [32] A través del ácido lipoico como cofactor respectivamente el grado de lipoilación , mtFASII tiene una influencia en los complejos enzimáticos mitocondriales en el metabolismo energético, como el complejo de piruvato deshidrogenasa , el complejo de α-cetoglutarato deshidrogenasa , el complejo BCKDH y el sistema de escisión de glicina (GCS), entre otros. [1]
Los trastornos del mtFASII conducen a las siguientes enfermedades metabólicas:

Por lo tanto, las posiciones de los dobles enlaces en una cadena de ácidos grasos se pueden indicar de dos maneras, utilizando la notación Cn o ω-n. Así, en un ácido graso de 18 carbonos, un doble enlace entre C-12 (o ω-7) y C-13 (o ω-6) se informa como Δ 12 si se cuenta desde el extremo –COOH (lo que indica solo el "inicio" del doble enlace), o como ω-6 (u omega-6) si se cuenta desde el extremo -CH
3fin. El "Δ" es la letra griega "delta", que se traduce como "D" (por doble enlace) en el alfabeto romano. Omega (ω) es la última letra del alfabeto griego y, por lo tanto, se utiliza para indicar el "último" átomo de carbono en la cadena de ácidos grasos. Dado que la notación ω-n se utiliza casi exclusivamente para indicar las posiciones de los dobles enlaces cercanos al -CH
3En los ácidos grasos esenciales , no es necesaria una notación equivalente tipo "Δ": el uso de la notación "ω-n" siempre se refiere a la posición de un doble enlace.