_(6982162417).jpg/440px-Inspecting_a_Drug_Manufacturer_(FDA034)_(6982162417).jpg)
La industria farmacéutica es una industria relacionada con la medicina que descubre, desarrolla, produce y comercializa productos farmacéuticos para su uso como medicamentos que funcionan al ser administrados a (o autoadministrados por ) pacientes que usan dichos medicamentos con el objetivo de curar y/o prevenir enfermedades (así como posiblemente aliviar los síntomas de enfermedades y/o lesiones ). [1] [2] Las compañías farmacéuticas pueden tratar con medicamentos " genéricos " y dispositivos médicos sin la participación de la propiedad intelectual , con materiales de " marca " específicamente vinculados a la historia de una empresa determinada, o con ambos dentro de diferentes contextos. La industria tiene varias subdivisiones (que incluyen áreas distintas como la fabricación de productos biológicos ) y todas están sujetas a una variedad de leyes y regulaciones que rigen procesos financieros completos, incluidas las patentes , las pruebas de eficacia, la evaluación de seguridad y la comercialización de estos medicamentos. El mercado farmacéutico mundial produjo tratamientos por un valor total de 1.228.450 millones de dólares en 2020, y esto mostró una tasa de crecimiento anual compuesta (CAGR) del 1,8% dados los resultados de los eventos recientes (que incluyen la pandemia de COVID-19 ). [3]
En términos históricos, la industria farmacéutica como concepto intelectual surgió a mediados y finales del siglo XIX en ciertos estados-nación con economías desarrolladas como Alemania , Suiza y los Estados Unidos, dado que múltiples empresas dedicadas a la química orgánica sintética , como varias empresas que generaban colorantes derivados del alquitrán de hulla a gran escala, buscaron nuevas aplicaciones de sus materiales artificiales en términos de salud humana . Esta tendencia a una mayor inversión de capital se produjo en tándem con el estudio académico de la patología como un campo que avanzaba significativamente, y una variedad de empresas establecieron relaciones de cooperación con laboratorios académicos que evaluaban lesiones y enfermedades humanas. Ejemplos de empresas industriales con un enfoque farmacéutico que han perdurado hasta el día de hoy después de unos comienzos tan distantes incluyen Bayer (con sede en Alemania) y Pfizer (con sede en los EE. UU.). [4]
La era moderna de la industria farmacéutica comenzó con los boticarios locales que ampliaron su papel tradicional de distribución de medicamentos botánicos como la morfina y la quinina a la fabricación al por mayor a mediados del siglo XIX, y a partir de descubrimientos resultantes de la investigación aplicada. El descubrimiento intencional de fármacos a partir de plantas comenzó con el aislamiento entre 1803 y 1805 de la morfina , un agente analgésico e inductor del sueño, del opio por parte del asistente del boticario alemán Friedrich Sertürner , quien nombró a este compuesto en honor al dios griego de los sueños, Morfeo . [5] A fines de la década de 1880, los fabricantes de tintes alemanes habían perfeccionado la purificación de compuestos orgánicos individuales a partir del alquitrán y otras fuentes minerales y también habían establecido métodos rudimentarios en la síntesis química orgánica . [4] El desarrollo de métodos químicos sintéticos permitió a los científicos variar sistemáticamente la estructura de las sustancias químicas, y el crecimiento de la ciencia emergente de la farmacología amplió su capacidad para evaluar los efectos biológicos de estos cambios estructurales. [ cita requerida ]
En la década de 1890, se había descubierto el profundo efecto de los extractos suprarrenales en muchos tipos de tejidos diferentes, lo que desencadenó una búsqueda tanto del mecanismo de señalización química como de esfuerzos para explotar estas observaciones para el desarrollo de nuevos fármacos. Los efectos vasoconstrictores y de elevación de la presión arterial de los extractos suprarrenales eran de particular interés para los cirujanos como agentes hemostáticos y como tratamiento para el shock, y varias empresas desarrollaron productos basados en extractos suprarrenales que contenían purezas variables de la sustancia activa. En 1897, John Abel de la Universidad Johns Hopkins identificó el principio activo como epinefrina , que aisló en un estado impuro como la sal de sulfato. El químico industrial Jōkichi Takamine desarrolló más tarde un método para obtener epinefrina en estado puro y licenció la tecnología a Parke-Davis . Parke-Davis comercializó la epinefrina bajo el nombre comercial Adrenalin . La epinefrina inyectada resultó ser especialmente eficaz para el tratamiento agudo de los ataques de asma , y se vendió una versión inhalada en los Estados Unidos hasta 2011 ( Primatene Mist ). [6] [7] En 1929, la epinefrina se había formulado en un inhalador para su uso en el tratamiento de la congestión nasal.
Aunque era muy eficaz, el requisito de la inyección limitaba el uso de epinefrina [ aclaración necesaria ] y se buscaron derivados activos por vía oral. Los químicos japoneses identificaron un compuesto estructuralmente similar, la efedrina , en la planta de Ma Huang y Eli Lilly lo comercializó como tratamiento oral para el asma. Siguiendo el trabajo de Henry Dale y George Barger en Burroughs-Wellcome , el químico académico Gordon Alles sintetizó la anfetamina y la probó en pacientes con asma en 1929. La droga demostró tener solo efectos antiasmáticos modestos, pero produjo sensaciones de euforia y palpitaciones. La anfetamina fue desarrollada por Smith, Kline y French como descongestionante nasal bajo el nombre comercial Benzedrine Inhaler. La anfetamina finalmente se desarrolló para el tratamiento de la narcolepsia , el parkinsonismo posencefalítico y la elevación del estado de ánimo en la depresión y otras indicaciones psiquiátricas. Recibió la aprobación como un remedio nuevo y no oficial de la Asociación Médica Estadounidense para estos usos en 1937, [8] y siguió siendo de uso común para la depresión hasta el desarrollo de los antidepresivos tricíclicos en la década de 1960. [7]

En 1903, Hermann Emil Fischer y Joseph von Mering revelaron su descubrimiento de que el ácido dietilbarbitúrico, formado a partir de la reacción de ácido dietilmalónico, oxicloruro de fósforo y urea, induce el sueño en los perros. El descubrimiento fue patentado y licenciado a la empresa farmacéutica Bayer , que comercializó el compuesto bajo el nombre comercial Veronal como ayuda para dormir a partir de 1904. Las investigaciones sistemáticas del efecto de los cambios estructurales en la potencia y la duración de la acción llevaron al descubrimiento del fenobarbital en Bayer en 1911 y al descubrimiento de su potente actividad antiepiléptica en 1912. El fenobarbital fue uno de los fármacos más utilizados para el tratamiento de la epilepsia durante la década de 1970 y, a partir de 2014, sigue estando en la lista de medicamentos esenciales de la Organización Mundial de la Salud. [9] [10] En los decenios de 1950 y 1960 se produjo una mayor concienciación sobre las propiedades adictivas y el potencial de abuso de los barbitúricos y las anfetaminas, lo que dio lugar a mayores restricciones sobre su uso y a una mayor supervisión gubernamental de los prescriptores. En la actualidad, el uso de anfetaminas se limita en gran medida al tratamiento del trastorno por déficit de atención y el de fenobarbital al tratamiento de la epilepsia . [11] [12]
En 1958, Leo Sternbach descubrió la primera benzodiazepina , el clordiazepóxido (Librium). Se han desarrollado y utilizado decenas de otras benzodiazepinas, siendo algunas de las más populares el diazepam (Valium), el alprazolam (Xanax), el clonazepam (Klonopin) y el lorazepam (Ativan). Debido a su seguridad y propiedades terapéuticas muy superiores, las benzodiazepinas han sustituido en gran medida el uso de barbitúricos en medicina, excepto en ciertos casos especiales. Cuando más tarde se descubrió que las benzodiazepinas, al igual que los barbitúricos, pierden significativamente su eficacia y pueden tener efectos secundarios graves cuando se toman a largo plazo, Heather Ashton investigó la dependencia de las benzodiazepinas y desarrolló un protocolo para interrumpir su uso. [ cita requerida ]
Una serie de experimentos realizados desde finales del siglo XIX hasta principios del XX revelaron que la diabetes es causada por la ausencia de una sustancia que normalmente produce el páncreas. En 1869, Oskar Minkowski y Joseph von Mering descubrieron que la diabetes podía inducirse en perros mediante la extirpación quirúrgica del páncreas. En 1921, el profesor canadiense Frederick Banting y su alumno Charles Best repitieron este estudio y descubrieron que las inyecciones de extracto pancreático revertían los síntomas producidos por la extirpación del páncreas. Pronto se demostró que el extracto funcionaba en personas, pero el desarrollo de la terapia con insulina como procedimiento médico de rutina se retrasó por las dificultades para producir el material en cantidad suficiente y con una pureza reproducible. Los investigadores buscaron la ayuda de colaboradores industriales de Eli Lilly and Co. basándose en la experiencia de la empresa con la purificación a gran escala de materiales biológicos. El químico George B. Walden de Eli Lilly and Company descubrió que un ajuste cuidadoso del pH del extracto permitía producir un grado relativamente puro de insulina. Bajo la presión de la Universidad de Toronto y ante la posibilidad de que científicos académicos que habían desarrollado de forma independiente un método de purificación similar impugnaran la patente, se llegó a un acuerdo para que varias empresas produjeran insulina de forma no exclusiva. Antes del descubrimiento y la disponibilidad generalizada de la terapia con insulina, la expectativa de vida de los diabéticos era de apenas unos meses. [13]
El desarrollo de medicamentos para el tratamiento de enfermedades infecciosas fue un objetivo principal de los primeros esfuerzos de investigación y desarrollo; en 1900, la neumonía, la tuberculosis y la diarrea eran las tres principales causas de muerte en los Estados Unidos y la mortalidad en el primer año de vida superaba el 10%. [14] [15] [ verificación fallida ]
En 1911, Paul Ehrlich y el químico Alfred Bertheim del Instituto de Terapia Experimental de Berlín desarrollaron la arsfenamina , el primer fármaco antiinfeccioso sintético. El fármaco recibió el nombre comercial de Salvarsan. [16] Ehrlich, al observar tanto la toxicidad general del arsénico como la absorción selectiva de ciertos colorantes por las bacterias, planteó la hipótesis de que un colorante que contuviera arsénico con propiedades de absorción selectiva similares podría usarse para tratar infecciones bacterianas. La arsfenamina se preparó como parte de una campaña para sintetizar una serie de dichos compuestos y se descubrió que presentaba una toxicidad parcialmente selectiva. La arsfenamina resultó ser el primer tratamiento eficaz para la sífilis , una enfermedad que hasta entonces había sido incurable y que conducía inexorablemente a ulceraciones graves de la piel, daño neurológico y muerte. [17]
El enfoque de Ehrlich de variar sistemáticamente la estructura química de los compuestos sintéticos y medir los efectos de estos cambios en la actividad biológica fue ampliamente aplicado por científicos industriales, incluidos los científicos de Bayer Josef Klarer, Fritz Mietzsch y Gerhard Domagk . Este trabajo, también basado en la prueba de compuestos disponibles en la industria alemana de tintes, condujo al desarrollo de Prontosil , el primer representante de la clase de antibióticos sulfonamida . En comparación con la arsfenamina, las sulfonamidas tenían un espectro de actividad más amplio y eran mucho menos tóxicas, lo que las hacía útiles para infecciones causadas por patógenos como los estreptococos . [18] En 1939, Domagk recibió el Premio Nobel de Medicina por este descubrimiento. [19] [20] No obstante, la dramática disminución de las muertes por enfermedades infecciosas que se produjo antes de la Segunda Guerra Mundial fue principalmente el resultado de mejores medidas de salud pública, como agua potable y viviendas menos hacinadas, y el impacto de los medicamentos antiinfecciosos y las vacunas fue significativo principalmente después de la Segunda Guerra Mundial. [21] [22]
En 1928, Alexander Fleming descubrió los efectos antibacterianos de la penicilina , pero su explotación para el tratamiento de enfermedades humanas aguardó el desarrollo de métodos para su producción y purificación a gran escala. Estos fueron desarrollados por un consorcio de compañías farmacéuticas liderado por los gobiernos de Estados Unidos y Gran Bretaña durante la Segunda Guerra Mundial. [23]
Durante este período se produjeron avances tempranos en el desarrollo de vacunas, principalmente en forma de investigación básica académica y financiada por el gobierno dirigida a la identificación de los patógenos responsables de enfermedades transmisibles comunes. En 1885, Louis Pasteur y Pierre Paul Émile Roux crearon la primera vacuna contra la rabia . Las primeras vacunas contra la difteria se produjeron en 1914 a partir de una mezcla de toxina diftérica y antitoxina (producida a partir del suero de un animal inoculado), pero la seguridad de la inoculación era marginal y no se utilizó ampliamente. Estados Unidos registró 206.000 casos de difteria en 1921, lo que resultó en 15.520 muertes. En 1923, los esfuerzos paralelos de Gaston Ramon en el Instituto Pasteur y Alexander Glenny en los Laboratorios de Investigación Wellcome (más tarde parte de GlaxoSmithKline ) llevaron al descubrimiento de que se podía producir una vacuna más segura tratando la toxina diftérica con formaldehído . [24] En 1944, Maurice Hilleman de Squibb Pharmaceuticals desarrolló la primera vacuna contra la encefalitis japonesa . [25] Hilleman luego se trasladó a Merck , donde desempeñó un papel clave en el desarrollo de vacunas contra el sarampión , las paperas , la varicela , la rubéola , la hepatitis A , la hepatitis B y la meningitis .

Antes del siglo XX, los medicamentos eran producidos generalmente por fabricantes de pequeña escala con poco control regulatorio sobre la fabricación o las afirmaciones de seguridad y eficacia. En la medida en que existían tales leyes, su aplicación era laxa. En los Estados Unidos, el aumento de la regulación de las vacunas y otros medicamentos biológicos fue estimulado por los brotes de tétanos y las muertes causadas por la distribución de la vacuna contra la viruela y la antitoxina diftérica contaminadas. [26] La Ley de Control de Productos Biológicos de 1902 exigía que el gobierno federal otorgara la aprobación previa a la comercialización para cada medicamento biológico y para el proceso y la instalación de producción de dichos medicamentos. A esto le siguió en 1906 la Ley de Alimentos y Medicamentos Puros , que prohibía la distribución interestatal de alimentos y medicamentos adulterados o mal etiquetados. Un medicamento se consideraba mal etiquetado si contenía alcohol, morfina, opio, cocaína o cualquiera de varias otras drogas potencialmente peligrosas o adictivas, y si su etiqueta no indicaba la cantidad o proporción de dichas drogas. Los intentos del gobierno de utilizar la ley para procesar a los fabricantes por hacer afirmaciones infundadas sobre la eficacia de los medicamentos se vieron socavados por un fallo de la Corte Suprema que restringió los poderes de aplicación del gobierno federal a los casos de especificación incorrecta de los ingredientes del medicamento. [27]
En 1937, más de 100 personas murieron tras ingerir " Elixir Sulfanilamide ", fabricado por SE Massengill Company de Tennessee. El producto estaba formulado en dietilenglicol , un disolvente altamente tóxico que ahora se usa ampliamente como anticongelante. [28] Según las leyes vigentes en ese momento, el procesamiento del fabricante solo era posible bajo el tecnicismo de que el producto se había llamado "elixir", lo que literalmente implicaba una solución en etanol. En respuesta a este episodio, el Congreso de los EE. UU. aprobó la Ley Federal de Alimentos, Medicamentos y Cosméticos de 1938 , que por primera vez exigía una demostración previa a la comercialización de la seguridad antes de que se pudiera vender un medicamento, y prohibía explícitamente las afirmaciones terapéuticas falsas. [29]
Las secuelas de la Segunda Guerra Mundial vieron una explosión en el descubrimiento de nuevas clases de medicamentos antibacterianos [30] incluyendo las cefalosporinas (desarrolladas por Eli Lilly basándose en el trabajo seminal de Giuseppe Brotzu y Edward Abraham ), [31] [32] estreptomicina (descubierta durante un programa de investigación financiado por Merck en el laboratorio de Selman Waksman [33] ), las tetraciclinas [34] (descubiertas en Lederle Laboratories, ahora parte de Pfizer ), eritromicina (descubierta en Eli Lilly and Co.) [35] y su extensión a una gama cada vez más amplia de patógenos bacterianos. La estreptomicina, descubierta durante un programa de investigación financiado por Merck en el laboratorio de Selman Waksman en Rutgers en 1943, se convirtió en el primer tratamiento efectivo para la tuberculosis. En el momento de su descubrimiento, los sanatorios para el aislamiento de personas infectadas con tuberculosis eran una característica omnipresente en las ciudades de los países desarrollados, y el 50% de ellas moría dentro de los cinco años siguientes a su ingreso. [33] [36]
En 1958, la Comisión Federal de Comercio de Estados Unidos publicó un informe que intentaba cuantificar el efecto del desarrollo de antibióticos en la salud pública estadounidense. El informe concluyó que, durante el período 1946-1955, hubo una caída del 42% en la incidencia de enfermedades para las que los antibióticos eran eficaces y sólo una caída del 20% en aquellas para las que los antibióticos no eran eficaces. El informe concluyó que "parece que el uso de antibióticos, el diagnóstico temprano y otros factores han limitado la propagación de la epidemia y, por lo tanto, el número de estas enfermedades que han ocurrido". El estudio examinó además las tasas de mortalidad de ocho enfermedades comunes para las que los antibióticos ofrecían una terapia eficaz (sífilis, tuberculosis, disentería, escarlatina, tos ferina, infecciones meningocócicas y neumonía), y descubrió una disminución del 56% durante el mismo período. [37] Entre estos, se destaca una disminución del 75% en las muertes por tuberculosis. [38]
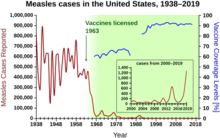

Durante los años 1940-1955, la tasa de disminución de la tasa de mortalidad de los EE. UU . se aceleró del 2 % anual al 8 % anual, para luego volver a la tasa histórica del 2 % anual. La dramática disminución en los años inmediatamente posteriores a la guerra se ha atribuido al rápido desarrollo de nuevos tratamientos y vacunas para enfermedades infecciosas que se produjo durante estos años. [40] [22] El desarrollo de vacunas continuó acelerándose, y el logro más notable del período fue el desarrollo de la vacuna contra la polio por parte de Jonas Salk en 1954 con la financiación de la Fundación Nacional para la Parálisis Infantil sin fines de lucro . El proceso de la vacuna nunca se patentó, sino que se entregó a las compañías farmacéuticas para que lo fabricaran como un genérico de bajo costo . En 1960, Maurice Hilleman de Merck Sharp & Dohme identificó el virus SV40 , que más tarde se demostró que causaba tumores en muchas especies de mamíferos. Más tarde se determinó que el SV40 estaba presente como contaminante en lotes de vacunas contra la polio que se habían administrado al 90% de los niños en los Estados Unidos. [41] [42] La contaminación parece haberse originado tanto en el stock de células original como en el tejido de mono utilizado para la producción. En 2004, el Instituto Nacional del Cáncer anunció que había llegado a la conclusión de que el SV40 no está asociado con el cáncer en las personas. [43]
Otras vacunas nuevas notables de la época incluyen aquellas para el sarampión (1962, John Franklin Enders del Centro Médico Infantil de Boston, luego refinada por Maurice Hilleman en Merck), la rubéola (1969, Hilleman, Merck) y las paperas (1967, Hilleman, Merck) [44] Las incidencias de rubéola, síndrome de rubéola congénita, sarampión y paperas en los Estados Unidos cayeron en >95% inmediatamente después de la vacunación generalizada. [45] Los primeros 20 años de vacunación autorizada contra el sarampión en los EE. UU. evitaron aproximadamente 52 millones de casos de la enfermedad, 17.400 casos de retraso mental y 5.200 muertes. [46]
La hipertensión es un factor de riesgo para la aterosclerosis, [47] insuficiencia cardíaca , [48] enfermedad de la arteria coronaria , [49] [50] accidente cerebrovascular , [51] enfermedad renal , [52] [53] y enfermedad arterial periférica , [54] [55] y es el factor de riesgo más importante para la morbilidad y mortalidad cardiovascular , en los países industrializados . [56] Antes de 1940 aproximadamente el 23% de todas las muertes entre personas mayores de 50 años se atribuían a la hipertensión. Los casos graves de hipertensión se trataban mediante cirugía. [57]
Los primeros avances en el campo del tratamiento de la hipertensión incluyeron agentes bloqueadores del sistema nervioso simpático a base de iones de amonio cuaternario, pero estos compuestos nunca se usaron ampliamente debido a sus graves efectos secundarios, porque aún no se habían establecido las consecuencias a largo plazo de la presión arterial alta para la salud y porque debían administrarse mediante inyección.
En 1952, investigadores de Ciba descubrieron el primer vasodilatador disponible por vía oral, la hidralazina . [58] Una deficiencia importante de la monoterapia con hidralazina era que perdía su eficacia con el tiempo ( taquifilaxia ). A mediados de la década de 1950, Karl H. Beyer, James M. Sprague, John E. Baer y Frederick C. Novello de Merck and Co. descubrieron y desarrollaron la clorotiazida , que sigue siendo el fármaco antihipertensivo más utilizado en la actualidad. [59] Este desarrollo se asoció con una disminución sustancial de la tasa de mortalidad entre las personas con hipertensión. [60] Los inventores fueron reconocidos con un Premio Lasker de Salud Pública en 1975 por "salvar miles de vidas incalculables y aliviar el sufrimiento de millones de víctimas de la hipertensión". [61]
Una revisión Cochrane de 2009 concluyó que los fármacos antihipertensivos tiazídicos reducen el riesgo de muerte ( RR 0,89), accidente cerebrovascular (RR 0,63), enfermedad cardíaca coronaria (RR 0,84) y eventos cardiovasculares (RR 0,70) en personas con presión arterial alta. [62] En los años siguientes se desarrollaron otras clases de fármacos antihipertensivos y encontraron una amplia aceptación en la terapia combinada, incluidos los diuréticos de asa (Lasix/ furosemida , Hoechst Pharmaceuticals , 1963), [63] betabloqueantes ( ICI Pharmaceuticals , 1964), [64] inhibidores de la ECA y bloqueadores del receptor de angiotensina . Los inhibidores de la ECA reducen el riesgo de enfermedad renal de nueva aparición [RR 0,71] y muerte [RR 0,84] en pacientes diabéticos, independientemente de si tienen hipertensión. [65]
Antes de la Segunda Guerra Mundial, el control de la natalidad estaba prohibido en muchos países, y en los Estados Unidos incluso la discusión de métodos anticonceptivos a veces conducía a un procesamiento bajo las leyes Comstock . La historia del desarrollo de los anticonceptivos orales está, por tanto, estrechamente ligada al movimiento de control de la natalidad y a los esfuerzos de las activistas Margaret Sanger , Mary Dennett y Emma Goldman . Basándose en la investigación fundamental realizada por Gregory Pincus y en los métodos sintéticos para la progesterona desarrollados por Carl Djerassi en Syntex y por Frank Colton en GD Searle & Co. , el primer anticonceptivo oral, Enovid , fue desarrollado por GD Searle & Co. y aprobado por la FDA en 1960. La fórmula original incorporaba dosis enormemente excesivas de hormonas y causaba graves efectos secundarios. No obstante, en 1962, 1,2 millones de mujeres estadounidenses tomaban la píldora, y en 1965 el número había aumentado a 6,5 millones. [66] [67] [68] [69] La disponibilidad de una forma conveniente de anticonceptivo temporal condujo a cambios dramáticos en las costumbres sociales, incluyendo la expansión de la gama de opciones de estilo de vida disponibles para las mujeres, la reducción de la dependencia de las mujeres de los hombres para la práctica anticonceptiva, el fomento de la postergación del matrimonio y el aumento de la cohabitación prematrimonial. [70]

En Estados Unidos, en 1959, durante las audiencias del Congreso encabezadas por el senador Estes Kefauver de Tennessee , se promovió la revisión de la Ley FD&C. En las audiencias se trataron una amplia gama de cuestiones políticas, como los abusos publicitarios, la eficacia cuestionable de los medicamentos y la necesidad de una mayor regulación de la industria. Si bien el impulso a favor de una nueva legislación decayó temporalmente debido a un debate prolongado, surgió una nueva tragedia que subrayó la necesidad de una regulación más integral y proporcionó la fuerza impulsora para la aprobación de nuevas leyes.
El 12 de septiembre de 1960, una empresa estadounidense con licencia, la William S. Merrell Company de Cincinnati, presentó una solicitud de autorización de comercialización de Kevadon ( talidomida ), un sedante que se comercializaba en Europa desde 1956. La médica de la FDA encargada de revisar el compuesto, Frances Kelsey , creía que los datos que respaldaban la seguridad de la talidomida eran incompletos. La empresa siguió presionando a Kelsey y a la FDA para que aprobaran la solicitud hasta noviembre de 1961, cuando el fármaco fue retirado del mercado alemán debido a su asociación con graves anomalías congénitas. Varios miles de recién nacidos en Europa y otros lugares sufrieron los efectos teratogénicos de la talidomida. Sin la aprobación de la FDA, la empresa distribuyó Kevadon a más de 1.000 médicos allí bajo la apariencia de un uso experimental. Más de 20.000 estadounidenses recibieron talidomida en este "estudio", incluidas 624 pacientes embarazadas, y unos 17 recién nacidos conocidos sufrieron los efectos del fármaco. [ cita requerida ]
La tragedia de la talidomida resucitó el proyecto de ley de Kefauver para mejorar la regulación de los medicamentos que se había estancado en el Congreso, y la Enmienda Kefauver-Harris se convirtió en ley el 10 de octubre de 1962. A partir de entonces, los fabricantes tuvieron que demostrar a la FDA que sus medicamentos eran eficaces y seguros antes de poder comercializarlos en el mercado estadounidense. La FDA recibió autoridad para regular la publicidad de medicamentos con receta y establecer buenas prácticas de fabricación . La ley exigía que todos los medicamentos introducidos entre 1938 y 1962 tuvieran que ser eficaces. Un estudio colaborativo de la FDA y la Academia Nacional de Ciencias mostró que casi el 40 por ciento de estos productos no eran eficaces. Un estudio igualmente exhaustivo de productos de venta libre comenzó diez años después. [71]
En 1971, Akira Endo , un bioquímico japonés que trabajaba para la compañía farmacéutica Sankyo, identificó la mevastatina (ML-236B), una molécula producida por el hongo Penicillium citrinum , como un inhibidor de la HMG-CoA reductasa, una enzima crítica que utiliza el cuerpo para producir colesterol. Los ensayos con animales mostraron un efecto inhibidor muy bueno al igual que en los ensayos clínicos , sin embargo, un estudio a largo plazo en perros encontró efectos tóxicos a dosis más altas y, como resultado, se creyó que la mevastatina era demasiado tóxica para el uso humano. La mevastatina nunca se comercializó, debido a sus efectos adversos de tumores, deterioro muscular y, a veces, muerte en perros de laboratorio.
P. Roy Vagelos , científico jefe y más tarde director ejecutivo de Merck & Co , se interesó y realizó varios viajes a Japón a partir de 1975. En 1978, Merck había aislado la lovastatina (mevinolina, MK803) del hongo Aspergillus terreus , comercializado por primera vez en 1987 como Mevacor. [72] [73] [74]
En abril de 1994 se anunciaron los resultados de un estudio patrocinado por Merck, el Scandinavian Simvastatin Survival Study . Los investigadores probaron la simvastatina , posteriormente vendida por Merck como Zocor, en 4.444 pacientes con colesterol alto y enfermedad cardíaca. Después de cinco años, el estudio concluyó que los pacientes vieron una reducción del 35% en su colesterol y sus probabilidades de morir de un ataque cardíaco se redujeron en un 42%. [75] En 1995, Zocor y Mevacor le hicieron ganar a Merck más de mil millones de dólares. Endo recibió el Premio Japón 2006 y el Premio de Investigación Médica Clínica Lasker-DeBakey en 2008. Por su "investigación pionera en una nueva clase de moléculas" para "reducir el colesterol", [ fragmento de oración ] [76] [77]
Desde hace varias décadas, los productos biológicos han ido ganando importancia en comparación con los tratamientos a base de moléculas pequeñas. El subsector biotecnológico , la salud animal y el sector farmacéutico chino también han crecido sustancialmente. En el aspecto organizativo, las grandes corporaciones farmacéuticas internacionales han experimentado una disminución sustancial de su participación en el valor. Además, el sector principal de los genéricos (sustitutos de marcas sin patente) se ha devaluado debido a la competencia. [78]
Torreya estimó que la industria farmacéutica tenía una valoración de mercado de US$7,03 billones para febrero de 2021, de los cuales US$6,1 billones son el valor de las empresas que cotizan en bolsa. La modalidad de moléculas pequeñas tuvo el 58,2% de la participación en la valoración, frente al 84,6% en 2003. Los productos biológicos aumentaron al 30,5% desde el 14,5%. La participación en la valoración de la industria farmacéutica china creció de 2003 a 2021 del 1% al 12%, superando a Suiza, que ahora ocupa el puesto número 3 con el 7,7%. Estados Unidos seguía siendo, con diferencia, la industria farmacéutica más valorada, con el 40% de la valoración mundial. [79] 2023 fue un año de despidos para al menos 10.000 personas en 129 empresas de biotecnología públicas a nivel mundial, aunque la mayoría eran pequeñas empresas; Este aumento significativo de las reducciones en comparación con 2022 se debió en parte al empeoramiento de las condiciones financieras mundiales y a una reducción de la inversión por parte de los "inversores generalistas". [80] Las empresas privadas también vieron una reducción significativa de la inversión de capital de riesgo en 2023, continuando una tendencia a la baja iniciada en 2021, que también llevó a una reducción de las ofertas públicas iniciales que se lanzaron. [80]
Un artículo de 2022 articuló esta noción sucintamente al decir "En el negocio del desarrollo de medicamentos, los acuerdos pueden ser tan importantes como los avances científicos", generalmente denominados fusiones y adquisiciones farmacéuticas. [81] Destacó que algunos de los remedios más impactantes de principios del siglo XXI solo fueron posibles gracias a las actividades de fusiones y adquisiciones, y destacó específicamente Keytruda y Humira . [81]
El descubrimiento de fármacos es el proceso mediante el cual se descubren o diseñan fármacos potenciales . En el pasado, la mayoría de los fármacos se han descubierto aislando el ingrediente activo de remedios tradicionales o por descubrimiento fortuito . La biotecnología moderna a menudo se centra en comprender las vías metabólicas relacionadas con una enfermedad o un patógeno y manipular estas vías mediante biología molecular o bioquímica . Una gran parte del descubrimiento de fármacos en etapa temprana ha sido llevado a cabo tradicionalmente por universidades e instituciones de investigación.
El desarrollo de fármacos se refiere a las actividades que se llevan a cabo después de que un compuesto se identifica como un fármaco potencial para establecer su idoneidad como medicamento. Los objetivos del desarrollo de fármacos son determinar la formulación y la dosificación adecuadas , así como establecer la seguridad . La investigación en estas áreas generalmente incluye una combinación de estudios in vitro , estudios in vivo y ensayos clínicos . El costo del desarrollo en etapa avanzada ha significado que generalmente lo realizan las compañías farmacéuticas más grandes. [82] La industria farmacéutica y biotecnológica gasta más del 15% de sus ventas netas en Investigación y Desarrollo, que en comparación con otras industrias es, con diferencia, la proporción más alta. [83]
A menudo, las grandes corporaciones multinacionales exhiben una integración vertical , participando en una amplia gama de descubrimiento y desarrollo de fármacos, fabricación y control de calidad, marketing, ventas y distribución. Las organizaciones más pequeñas, por otro lado, a menudo se centran en un aspecto específico, como el descubrimiento de candidatos a fármacos o el desarrollo de formulaciones. A menudo, se forman acuerdos de colaboración entre organizaciones de investigación y grandes compañías farmacéuticas para explorar el potencial de nuevas sustancias farmacológicas. Más recientemente, las multinacionales dependen cada vez más de organizaciones de investigación por contrato para gestionar el desarrollo de fármacos. [84]
El descubrimiento y desarrollo de fármacos son muy costosos; de todos los compuestos investigados para su uso en seres humanos, sólo una pequeña fracción son finalmente aprobados en la mayoría de las naciones por instituciones médicas designadas por el gobierno o juntas, que tienen que aprobar nuevos fármacos antes de que puedan comercializarse en esos países. En 2010, la FDA aprobó 18 NME (Nuevas Entidades Moleculares) y tres productos biológicos , o 21 en total, lo que representa una disminución respecto de las 26 de 2009 y las 24 de 2008. Por otro lado, sólo hubo 18 aprobaciones en total en 2007 y 22 en 2006. Desde 2001, el Centro de Evaluación e Investigación de Medicamentos ha tenido un promedio de 22,9 aprobaciones al año. [85] Esta aprobación se produce sólo después de una fuerte inversión en el desarrollo preclínico y los ensayos clínicos , así como de un compromiso con el seguimiento continuo de la seguridad . Los fármacos que fallan a mitad de este proceso a menudo incurren en grandes costos, sin generar ingresos a cambio. Si se tiene en cuenta el coste de estos fármacos fallidos, se ha estimado que el coste de desarrollar un nuevo fármaco exitoso ( nueva entidad química o NCE) es de 1.300 millones de dólares [86] (sin incluir los gastos de marketing ). Sin embargo, los profesores Light y Lexchin informaron en 2012 que la tasa de aprobación de nuevos fármacos ha sido una tasa media relativamente estable de 15 a 25 durante décadas. [87]
La investigación y la inversión en toda la industria alcanzaron un récord de 65.300 millones de dólares en 2009. [88] Si bien el costo de la investigación en los EE. UU. fue de aproximadamente 34.200 millones de dólares entre 1995 y 2010, los ingresos aumentaron más rápido (los ingresos aumentaron en 200.400 millones de dólares en ese período). [87]
Un estudio de la consultora Bain & Company informó que el costo de descubrir, desarrollar y lanzar (que incluye el marketing y otros gastos comerciales) un nuevo fármaco (junto con los posibles fármacos que fracasan) aumentó en un período de cinco años a casi 1.700 millones de dólares en 2003. [89] Según Forbes, en 2010 los costos de desarrollo estaban entre 4.000 y 11.000 millones de dólares por fármaco. [90]
Algunas de estas estimaciones también tienen en cuenta el costo de oportunidad de invertir capital muchos años antes de que se realicen los ingresos (véase Valor temporal del dinero ). Debido al largo tiempo necesario para el descubrimiento, desarrollo y aprobación de productos farmacéuticos, estos costos pueden acumularse hasta casi la mitad del gasto total. Una consecuencia directa dentro de la cadena de valor de la industria farmacéutica es que las grandes multinacionales farmacéuticas tienden a externalizar cada vez más los riesgos relacionados con la investigación fundamental, lo que de alguna manera reconfigura el ecosistema de la industria, ya que las empresas de biotecnología desempeñan un papel cada vez más importante y las estrategias generales se redefinen en consecuencia. [91] Algunos medicamentos aprobados, como los basados en la reformulación de un ingrediente activo existente (también conocidos como extensiones de línea), son mucho menos costosos de desarrollar.
En los Estados Unidos, los nuevos productos farmacéuticos deben ser aprobados por la Administración de Alimentos y Medicamentos (FDA) como seguros y eficaces. Este proceso generalmente implica la presentación de una solicitud de nuevo fármaco en investigación con suficientes datos preclínicos para respaldar la realización de ensayos en humanos. Después de la aprobación de la IND, pueden realizarse tres fases de ensayos clínicos en humanos progresivamente más amplios. La fase I generalmente estudia la toxicidad utilizando voluntarios sanos. La fase II puede incluir farmacocinética y dosificación en pacientes, y la fase III es un estudio muy amplio de eficacia en la población de pacientes prevista. Después de completar con éxito las pruebas de la fase III, se presenta una solicitud de nuevo fármaco a la FDA. La FDA revisa los datos y, si se considera que el producto tiene una evaluación positiva de beneficio-riesgo, se otorga la aprobación para comercializarlo en los EE. UU. [92]
A menudo también se requiere una cuarta fase de vigilancia posterior a la aprobación, debido a que ni siquiera los ensayos clínicos más amplios pueden predecir con eficacia la prevalencia de efectos secundarios poco frecuentes. La vigilancia posterior a la comercialización garantiza que, después de su comercialización, se controle de cerca la seguridad de un medicamento. En algunos casos, puede ser necesario limitar su indicación a grupos de pacientes concretos y, en otros, retirar la sustancia del mercado por completo.
La FDA proporciona información sobre medicamentos aprobados en el sitio Orange Book. [93]
En el Reino Unido, la Agencia Reguladora de Medicamentos y Productos Sanitarios aprueba y evalúa los medicamentos para su uso. Normalmente, la aprobación en el Reino Unido y otros países europeos llega más tarde que en los Estados Unidos. En ese caso, es el Instituto Nacional para la Excelencia Sanitaria y Asistencial (NICE), para Inglaterra y Gales, quien decide si el Servicio Nacional de Salud (NHS) permitirá (en el sentido de pagar por) su uso y de qué manera. El Formulario Nacional Británico es la guía básica para farmacéuticos y médicos.
En muchos países occidentales no estadounidenses, se ha desarrollado un "cuarto obstáculo" de análisis de costo-efectividad antes de que se puedan proporcionar nuevas tecnologías. Este se centra en el "precio de eficacia" (en términos, por ejemplo, del costo por AVAC ) de las tecnologías en cuestión. En Inglaterra y Gales, el NICE decide si el NHS pondrá a disposición medicamentos y tecnologías y en qué circunstancias, mientras que existen acuerdos similares con el Consorcio Escocés de Medicamentos en Escocia y el Comité Asesor sobre Beneficios Farmacéuticos en Australia. Un producto debe superar el umbral de costo-efectividad para ser aprobado. Los tratamientos deben representar una "buena relación calidad-precio" y un beneficio neto para la sociedad.
Existen normas especiales para determinadas enfermedades raras ("enfermedades huérfanas") en varios territorios importantes de regulación de medicamentos. Por ejemplo, las enfermedades que afectan a menos de 200.000 pacientes en los Estados Unidos, o a poblaciones más grandes en determinadas circunstancias, están sujetas a la Ley de Medicamentos Huérfanos. [94] Dado que la investigación médica y el desarrollo de medicamentos para tratar dichas enfermedades son económicamente desventajosos, las empresas que lo hacen son recompensadas con reducciones de impuestos, exenciones de tasas y exclusividad en el mercado de ese medicamento durante un tiempo limitado (siete años), independientemente de si el medicamento está protegido por patentes.
En 2011, el gasto mundial en medicamentos de venta con receta superó los 954.000 millones de dólares, aunque el crecimiento se desaceleró un poco en Europa y América del Norte. Estados Unidos representa más de un tercio del mercado farmacéutico mundial, con 340.000 millones de dólares en ventas anuales, seguido de la UE y Japón. [96] Mercados emergentes como China, Rusia, Corea del Sur y México superaron ese mercado, creciendo un enorme 81 por ciento. [97] [98]
Los diez medicamentos más vendidos en 2013 totalizaron 75.600 millones de dólares en ventas, siendo el antiinflamatorio Humira el más vendido en todo el mundo con 10.700 millones de dólares en ventas. El segundo y tercer medicamento más vendido fueron Enbrel y Remicade, respectivamente. [99] Los tres medicamentos más vendidos en los Estados Unidos en 2013 fueron Abilify (6.300 millones de dólares), Nexium (6.000 millones de dólares) y Humira (5.400 millones de dólares). [100] El medicamento más vendido de la historia, Lipitor , promedió 13.000 millones de dólares anuales y generó un total de 141.000 millones de dólares durante su vida útil antes de que la patente de Pfizer expirara en noviembre de 2011.
IMS Health publica un análisis de las tendencias esperadas en la industria farmacéutica en 2007, incluyendo el aumento de las ganancias en la mayoría de los sectores a pesar de la pérdida de algunas patentes y nuevos medicamentos "de gran éxito" en el horizonte. [101]
Dependiendo de una serie de consideraciones, una empresa puede solicitar y obtener una patente para el medicamento, o el proceso de producción del medicamento, concediendo derechos de exclusividad normalmente por unos 20 años. [102] Sin embargo, sólo después de un estudio y una prueba rigurosos, que tardan de 10 a 15 años en promedio, las autoridades gubernamentales concederán permiso para que la empresa comercialice y venda el medicamento. [103] La protección de la patente permite al propietario de la patente recuperar los costos de investigación y desarrollo a través de altos márgenes de beneficio para el medicamento de marca . Cuando la protección de la patente para el medicamento expira, normalmente una empresa competidora desarrolla y vende un medicamento genérico . El desarrollo y la aprobación de los genéricos es menos costoso, lo que permite venderlos a un precio más bajo. A menudo, el propietario del medicamento de marca lanzará una versión genérica antes de que expire la patente para obtener una ventaja en el mercado de genéricos. [104] Por lo tanto, la reestructuración se ha vuelto rutinaria, impulsada por la expiración de las patentes de productos lanzados durante la "época dorada" de la industria en los años 1990 y el fracaso de las empresas en desarrollar suficientes nuevos productos exitosos para reemplazar los ingresos perdidos. [105]
En Estados Unidos, el valor de las recetas aumentó entre 1995 y 2005 en 3.400 millones anuales, un aumento del 61%. Las ventas minoristas de medicamentos con receta aumentaron un 250%, de 72.000 millones de dólares a 250.000 millones, mientras que el precio medio de las recetas aumentó más del doble, de 30 a 68 dólares. [106]
La publicidad es común en las revistas de salud, así como a través de los medios de comunicación más convencionales. En algunos países, en particular los EE. UU., se les permite anunciar directamente al público en general. Las compañías farmacéuticas generalmente emplean vendedores (a menudo llamados "representantes de medicamentos" o, un término más antiguo, "hombres de detalle") para comercializar directa y personalmente a los médicos y otros proveedores de atención médica. En algunos países, en particular los EE. UU., las compañías farmacéuticas también emplean a lobistas para influir en los políticos. La comercialización de medicamentos con receta en los EE. UU. está regulada por la Ley federal de comercialización de medicamentos con receta de 1987. El plan de marketing farmacéutico incorpora los planes de gasto, los canales y las ideas que llevarán a la asociación farmacéutica, y sus productos y servicios, hacia adelante en el escenario actual.
El libro Bad Pharma también analiza la influencia de los representantes de los medicamentos, cómo las compañías farmacéuticas emplean a escritores fantasmas para escribir artículos para que los académicos los publiquen, cuán independientes son realmente las revistas académicas, cómo las compañías farmacéuticas financian la educación continua de los médicos y cómo los grupos de pacientes a menudo son financiados por la industria. [107]
Desde la década de 1980, han cobrado importancia nuevos métodos de comercialización de medicamentos con receta dirigidos a los consumidores. La publicidad directa en los medios de comunicación se legalizó en la Guía de la FDA para la industria sobre anuncios publicitarios dirigidos a los consumidores.
Cada vez hay más controversias en torno al marketing y la influencia de las empresas farmacéuticas. Se han formulado acusaciones y se han encontrado casos de influencia sobre los médicos y otros profesionales sanitarios a través de representantes de los medicamentos, que incluyen el suministro constante de "regalos" de marketing e información sesgada a los profesionales sanitarios; [108] la publicidad muy extendida en revistas y conferencias; la financiación de organizaciones sanitarias independientes y campañas de promoción de la salud; el cabildeo ante médicos y políticos (más que en cualquier otra industria de los EE. UU. [109] ); el patrocinio de escuelas de medicina o de formación de enfermeras; el patrocinio de eventos educativos continuos, con influencia en el plan de estudios; [110] y la contratación de médicos como consultores pagos en juntas asesoras médicas.
Algunos grupos de defensa, como No Free Lunch y AllTrials , han criticado el efecto de la comercialización de medicamentos dirigida a los médicos porque dicen que los predispone a recetar los medicamentos comercializados incluso cuando otros podrían ser más baratos o mejores para el paciente. [111]
Se han formulado acusaciones relacionadas con la promoción de enfermedades [112] (medicalización excesiva) para ampliar el mercado de medicamentos. En 2006 se celebró en Australia una conferencia inaugural sobre ese tema. [113] En 2009, el Servicio Nacional de Prescripción financiado por el Gobierno puso en marcha el programa "Encontrar pruebas: reconocer la propaganda", destinado a educar a los médicos de cabecera sobre los métodos de análisis independiente de medicamentos. [114]
Los metaanálisis han demostrado que los estudios psiquiátricos patrocinados por compañías farmacéuticas tienen varias veces más probabilidades de informar resultados positivos, y si está involucrado un empleado de la compañía farmacéutica, el efecto es aún mayor. [115] [116] [117] La influencia también se ha extendido a la formación de médicos y enfermeras en las escuelas de medicina, que está siendo combatida.
Se ha argumentado que el diseño del Manual Diagnóstico y Estadístico de los Trastornos Mentales y la expansión de los criterios representan una creciente medicalización de la naturaleza humana, o " propaganda de enfermedades ", impulsada por la influencia de las compañías farmacéuticas en la psiquiatría. [118] Se ha planteado la posibilidad de un conflicto de intereses directo , en parte porque aproximadamente la mitad de los autores que seleccionaron y definieron los trastornos psiquiátricos del DSM-IV tenían o habían tenido previamente relaciones financieras con la industria farmacéutica. [119]
En los Estados Unidos, a partir de 2013, en virtud de los Informes de Transparencia Financiera de los Médicos (parte de la Ley Sunshine), los Centros de Servicios de Medicare y Medicaid deben recopilar información de los fabricantes y organizaciones de compras en grupo correspondientes para informar sobre sus relaciones financieras con los médicos y los hospitales. Los datos se publican en el sitio web de los Centros de Servicios de Medicare y Medicaid. La expectativa es que la relación entre los médicos y la industria farmacéutica se vuelva completamente transparente. [120]
En un informe realizado por OpenSecrets , había más de 1.100 lobistas trabajando en alguna capacidad para la industria farmacéutica en 2017. En el primer trimestre de 2017, la industria farmacéutica y de productos de salud gastó 78 millones de dólares en presionar a miembros del Congreso de los Estados Unidos. [121]
El precio de los productos farmacéuticos se está convirtiendo en un gran desafío para los sistemas de salud. [122] Un estudio de noviembre de 2020 del West Health Policy Center afirmó que se espera que más de 1,1 millones de personas mayores en el programa Medicare de EE. UU . mueran prematuramente durante la próxima década porque no podrán pagar sus medicamentos recetados, lo que requerirá un gasto adicional de $ 17.7 mil millones anuales en costos médicos evitables debido a complicaciones de salud. [123]
Ben Goldacre ha sostenido que los reguladores –como la Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) en el Reino Unido, o la Administración de Alimentos y Medicamentos (FDA) en los Estados Unidos– promueven los intereses de las compañías farmacéuticas en lugar de los intereses del público debido al intercambio rotatorio de empleados entre el regulador y las compañías y a las amistades que se desarrollan entre el regulador y los empleados de las compañías. [124] Sostiene que los reguladores no exigen que los nuevos medicamentos ofrezcan una mejora respecto de lo que ya está disponible, o incluso que sean particularmente eficaces. [124]
Otros han argumentado que la regulación excesiva suprime la innovación terapéutica y que el costo actual de los ensayos clínicos exigidos por los reguladores impide la plena explotación de los nuevos conocimientos genéticos y biológicos para el tratamiento de enfermedades humanas. Un informe de 2012 del Consejo de Asesores del Presidente sobre Ciencia y Tecnología formuló varias recomendaciones clave para reducir las cargas regulatorias para el desarrollo de nuevos medicamentos, entre ellas 1) ampliar el uso de la FDA de procesos de aprobación acelerada, 2) crear una vía de aprobación acelerada para medicamentos destinados a ser utilizados en poblaciones estrechamente definidas, y 3) emprender proyectos piloto diseñados para evaluar la viabilidad de un nuevo proceso de aprobación de medicamentos adaptativo. [125]
El fraude farmacéutico implica engaños que aportan beneficios económicos a una empresa farmacéutica. Afecta a personas y a aseguradoras públicas y privadas. Existen varios esquemas diferentes [126] utilizados para defraudar al sistema de atención sanitaria que son específicos de la industria farmacéutica. Estos incluyen: violaciones de las Buenas Prácticas de Manufactura (BPM), marketing fuera de etiqueta, fraude de mejor precio, fraude de CME, informes de precios de Medicaid y medicamentos compuestos manufacturados. [127] De esta cantidad, $2.5 mil millones se recuperaron a través de casos de la Ley de Reclamaciones Falsas en el año fiscal 2010. Ejemplos de casos de fraude incluyen el acuerdo de $3 mil millones de GlaxoSmithKline , el acuerdo de $2.3 mil millones de Pfizer y el acuerdo de $650 millones de Merck & Co. Los daños causados por el fraude se pueden recuperar mediante el uso de la Ley de Reclamaciones Falsas , más comúnmente bajo las disposiciones qui tam que recompensan a una persona por ser un " denunciante " o relator (ley) . [128]
Todas las grandes empresas que venden antipsicóticos atípicos ( Bristol-Myers Squibb , Eli Lilly and Company , Pfizer , AstraZeneca y Johnson & Johnson ) han llegado a acuerdos en casos gubernamentales recientes, en virtud de la Ley de Reclamaciones Falsas, por cientos de millones de dólares o están actualmente bajo investigación por posible fraude en la atención médica. Tras los cargos de comercialización ilegal, dos de los acuerdos establecieron récords en 2009 por las multas penales más altas jamás impuestas a las corporaciones. Uno involucraba al antipsicótico Zyprexa de Eli Lilly , y el otro involucraba a Bextra , un medicamento antiinflamatorio utilizado para la artritis. En el caso de Bextra, el gobierno también acusó a Pfizer de comercializar ilegalmente otro antipsicótico, Geodon ; Pfizer resolvió esa parte de la reclamación por $301 millones, sin admitir ninguna irregularidad. [129]
El 2 de julio de 2012, GlaxoSmithKline se declaró culpable de cargos criminales y aceptó un acuerdo de $3 mil millones por el mayor caso de fraude en el sistema de salud en los EE. UU. y el pago más grande por parte de una compañía farmacéutica. [130] El acuerdo está relacionado con la promoción ilegal de medicamentos recetados por parte de la compañía, su falta de reporte de datos de seguridad, [131] sobornos a médicos y promoción de medicamentos para usos para los que no estaban autorizados. Los medicamentos involucrados fueron Paxil , Wellbutrin , Advair , Lamictal y Zofran para usos no aprobados y no cubiertos. Éstos y los medicamentos Imitrex , Lotronex , Flovent y Valtrex estuvieron involucrados en el esquema de sobornos . [132] [133] [134]
A continuación se presenta una lista de los cuatro acuerdos más importantes alcanzados con compañías farmacéuticas entre 1991 y 2012, ordenados por orden de importancia. Las demandas legales contra la industria farmacéutica han variado ampliamente durante las últimas dos décadas, incluyendo fraude a Medicare y Medicaid , promoción no autorizada y prácticas de fabricación inadecuadas. [135] [136]
En mayo de 2015, el New England Journal of Medicine destacó la importancia de las interacciones entre la industria farmacéutica y los médicos para el desarrollo de nuevos tratamientos y sostuvo que la indignación moral por las malas prácticas de la industria había llevado injustificadamente a muchos a exagerar los problemas creados por los conflictos de intereses financieros. El artículo señaló que las principales organizaciones de atención médica, como el Centro Nacional para el Avance de las Ciencias Traslacionales de los Institutos Nacionales de Salud, el Consejo Presidencial de Asesores en Ciencia y Tecnología, el Foro Económico Mundial, la Fundación Gates, el Wellcome Trust y la Administración de Alimentos y Medicamentos habían alentado una mayor interacción entre los médicos y la industria con el fin de mejorar los beneficios para los pacientes. [141] [142]
En noviembre de 2020, varias compañías farmacéuticas anunciaron ensayos exitosos de vacunas contra la COVID-19, con una eficacia del 90 al 95 % en la prevención de la infección. Según anuncios de las compañías y datos revisados por analistas externos, estas vacunas tienen un precio de entre 3 y 37 dólares por dosis. [143] El Wall Street Journal publicó un editorial en el que pedía que se reconociera este logro con un Premio Nobel de la Paz. [144]
Médicos Sin Fronteras advirtió que los altos precios y los monopolios sobre medicamentos, pruebas y vacunas prolongarían la pandemia y costarían vidas. Instaron a los gobiernos a evitar la especulación, utilizando licencias obligatorias según fuera necesario, como ya lo habían hecho Canadá, Chile, Ecuador, Alemania e Israel. [145]
El 20 de febrero, 46 legisladores estadounidenses pidieron al gobierno de ese país no conceder derechos monopolísticos al entregar dinero de los contribuyentes para el desarrollo de vacunas y tratamientos contra el coronavirus, para evitar dar control exclusivo de los precios y la disponibilidad a fabricantes privados. [146]
En Estados Unidos, el gobierno firmó acuerdos en los que se subvencionaba la investigación y el desarrollo y/o la construcción de plantas de fabricación de posibles terapias contra la COVID-19. Por lo general, el acuerdo implicaba que el gobierno asumía la propiedad de una determinada cantidad de dosis del producto sin pago adicional. Por ejemplo, bajo los auspicios de la Operación Warp Speed en Estados Unidos, el gobierno subvencionó la investigación relacionada con las vacunas y terapias contra la COVID-19 en Regeneron, [147] Johnson and Johnson, Moderna, AstraZeneca, Novavax, Pfizer y GSK. Los términos típicos implicaban subsidios para la investigación de entre 400 y 2 mil millones de dólares, e incluían la propiedad gubernamental de los primeros 100 millones de dosis de cualquier vacuna contra la COVID-19 que se desarrollara con éxito. [148]
El 23 de marzo de 2020, la empresa farmacéutica estadounidense Gilead solicitó y obtuvo el estatus de medicamento huérfano para el remdesivir de la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). Esta disposición tiene por objeto fomentar el desarrollo de medicamentos que afecten a menos de 200.000 estadounidenses otorgando derechos de monopolio legal reforzados y ampliados al fabricante, junto con exenciones de impuestos y tasas gubernamentales. [149] [150] El remdesivir es un candidato para el tratamiento de la COVID-19; en el momento en que se otorgó el estatus, menos de 200.000 estadounidenses tenían COVID-19, pero las cifras estaban aumentando rápidamente a medida que la pandemia de COVID-19 llegaba a los EE. UU., y cruzar el umbral pronto se consideró inevitable. [149] [150] Gilead desarrolló el remdesivir con más de 79 millones de dólares de financiación del gobierno de los EE. UU. [150] En mayo de 2020, Gilead anunció que proporcionaría las primeras 940.000 dosis de remdesivir al gobierno federal de forma gratuita. [151] Tras enfrentarse a fuertes reacciones públicas, Gilead renunció al estatus de "medicamento huérfano" para el remdesivir el 25 de marzo. [152] Gilead conserva patentes de remdesivir por 20 años en más de 70 países. [145] En mayo de 2020, la empresa anunció además que estaba en conversaciones con varias empresas de genéricos para otorgar derechos de producción de remdesivir para países en desarrollo, y con el Medicines Patent Pool para proporcionar un acceso genérico más amplio. [153]
Las patentes han sido criticadas en el mundo en desarrollo, ya que se cree que reducen el acceso a los medicamentos existentes. [154] Reconciliar las patentes y el acceso universal a los medicamentos requeriría una política internacional eficiente de discriminación de precios . Además, según el acuerdo sobre los ADPIC de la Organización Mundial del Comercio , los países deben permitir que se patenten los productos farmacéuticos. En 2001, la OMC adoptó la Declaración de Doha , que indica que el acuerdo sobre los ADPIC debe interpretarse teniendo en cuenta los objetivos de la salud pública y permite algunos métodos para eludir los monopolios farmacéuticos: mediante licencias obligatorias o importaciones paralelas , incluso antes de que expire la patente. [155]
En marzo de 2001, 40 compañías farmacéuticas multinacionales presentaron una demanda contra Sudáfrica por su Ley de Medicamentos , que permitía la producción genérica de medicamentos antirretrovirales (ARV) para tratar el VIH, a pesar de que estos medicamentos estaban patentados. [156] El VIH era y es una epidemia en Sudáfrica, y los ARV en ese momento costaban entre 10.000 y 15.000 dólares estadounidenses por paciente por año. Esto era inasequible para la mayoría de los ciudadanos sudafricanos, por lo que el gobierno sudafricano se comprometió a proporcionar ARV a precios más cercanos a lo que la gente podía pagar. Para hacerlo, tendrían que ignorar las patentes de los medicamentos y producir genéricos dentro del país (utilizando una licencia obligatoria), o importarlos del extranjero. Después de una protesta internacional a favor de los derechos de salud pública (incluida la recogida de 250.000 firmas por parte de Médicos Sin Fronteras ), los gobiernos de varios países desarrollados (incluidos los Países Bajos, Alemania, Francia y más tarde los EE. UU.) respaldaron al gobierno sudafricano, y el caso fue desestimado en abril de ese año. [157]
En 2016, GlaxoSmithKline (la sexta compañía farmacéutica más grande del mundo) anunció que abandonaría sus patentes en los países pobres para permitir que compañías independientes fabricaran y vendieran versiones de sus medicamentos en esas áreas, ampliando así el acceso público a ellos. [158] GlaxoSmithKline publicó una lista de 50 países en los que ya no tendría patentes, lo que afectaría a mil millones de personas en todo el mundo.
En 2011, cuatro de las 20 principales donaciones caritativas corporativas y ocho de las 30 principales donaciones caritativas corporativas procedieron de fabricantes farmacéuticos. La mayor parte de las donaciones caritativas corporativas (69% en 2012) proceden de donaciones caritativas no monetarias, la mayoría de las cuales fueron donaciones aportadas por empresas farmacéuticas. [159]
Los programas de beneficencia y los esfuerzos de descubrimiento y desarrollo de fármacos por parte de las compañías farmacéuticas incluyen:
La misión principal de la industria farmacéutica es fabricar productos para pacientes con el fin de curarlos, vacunarlos o aliviar un síntoma, a menudo mediante la fabricación de un inyectable líquido o un sólido oral, entre otras terapias.
Los funcionarios de la Administración de Alimentos y Medicamentos, conscientes de la gravedad del problema, estiman que aproximadamente la mitad de los 9.000.000.000 de cápsulas y tabletas de barbitúricos y anfetaminas que se fabrican anualmente en este país se desvían hacia el uso ilegal. Las ganancias que se obtienen de la venta ilegal de estas drogas han demostrado ser un atractivo para el crimen organizado, ya que la anfetamina se puede comprar al por mayor por menos de un dólar por 1000 cápsulas, pero cuando se vende en el mercado ilegal, se vende a entre 30 y 50 dólares por 1000 y cuando se vende al por menor al comprador individual, una tableta puede costar entre 10 y 25 centavos.
Los barbitúricos, introducidos en la medicina por E. Fischer y J. von Mering en 1903, se encuentran sin duda entre los fármacos más utilizados y abusados en medicina. Se fabrican aproximadamente 400 toneladas de estos agentes cada año; esto es suficiente para hacer dormir a aproximadamente 9.000.000 de personas cada noche durante ese período si a cada uno se le administrara una dosis de 0,1 g.
{{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite web}}: CS1 maint: copia archivada como título ( enlace )