
En química orgánica , un alcano , o parafina (un nombre trivial histórico que también tiene otros significados ), es un hidrocarburo saturado acíclico . En otras palabras, un alcano consiste en átomos de hidrógeno y carbono dispuestos en una estructura de árbol en la que todos los enlaces carbono-carbono son simples . [1] Los alcanos tienen la fórmula química general C n H 2 n +2 . Los alcanos varían en complejidad desde el caso más simple de metano ( CH 4 ), donde n = 1 (a veces llamado la molécula original), hasta moléculas arbitrariamente grandes y complejas, como el pentacontano ( C 50 H 102 ) o el 6-etil-2-metil-5-(1-metiletil) octano, un isómero del tetradecano ( C 14 H 30 ).
La Unión Internacional de Química Pura y Aplicada (IUPAC) define los alcanos como "hidrocarburos acíclicos ramificados o no ramificados que tienen la fórmula general C n H 2 n +2 , y por lo tanto consisten enteramente de átomos de hidrógeno y átomos de carbono saturados". Sin embargo, algunas fuentes usan el término para denotar cualquier hidrocarburo saturado, incluidos aquellos que son monocíclicos (es decir, los cicloalcanos ) o policíclicos , a pesar de tener una fórmula general distinta (por ejemplo, los cicloalcanos son C n H 2 n ).
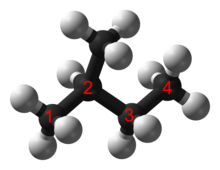
En un alcano, cada átomo de carbono presenta hibridación sp3 con 4 enlaces sigma (ya sea C–C o C–H ), y cada átomo de hidrógeno está unido a uno de los átomos de carbono (en un enlace C–H). La serie más larga de átomos de carbono unidos en una molécula se conoce como esqueleto carbonado o cadena principal carbonada. La cantidad de átomos de carbono puede considerarse como el tamaño del alcano.
Un grupo de alcanos superiores son las ceras , sólidos a temperatura y presión ambiente estándar (SATP), para los cuales el número de átomos de carbono en la cadena principal de carbono es mayor que aproximadamente 17. Con sus unidades – CH 2 repetidas, los alcanos constituyen una serie homóloga de compuestos orgánicos en los que los miembros difieren en masa molecular en múltiplos de 14,03 u (la masa total de cada una de estas unidades de puente de metileno , que comprende un solo átomo de carbono de masa 12,01 u y dos átomos de hidrógeno de masa ~1,01 u cada uno).
El metano es producido por bacterias metanogénicas y algunos alcanos de cadena larga funcionan como feromonas en ciertas especies animales o como ceras protectoras en plantas y hongos. Sin embargo, la mayoría de los alcanos no tienen mucha actividad biológica . Se los puede considerar como árboles moleculares en los que se pueden colgar los grupos funcionales más activos/reactivos de las moléculas biológicas.
Los alcanos tienen dos fuentes comerciales principales: el petróleo (crudo) y el gas natural .
Un grupo alquilo es un fragmento molecular basado en alcanos que tiene una valencia abierta para la unión. Generalmente se abrevian con el símbolo de cualquier grupo organilo , R, aunque a veces se usa Alk para simbolizar específicamente un grupo alquilo (en oposición a un grupo alquenilo o un grupo arilo).
Por lo general, la distancia de enlace simple CC es de 1,53 ångströms (1,53 × 10 −10 m). [2] Los hidrocarburos saturados pueden ser lineales, ramificados o cíclicos . El tercer grupo a veces se denomina cicloalcanos . [1] Es posible obtener estructuras muy complicadas combinando alcanos lineales, ramificados y cíclicos .

Los alcanos con más de tres átomos de carbono pueden organizarse de diversas maneras, formando isómeros estructurales . El isómero más simple de un alcano es aquel en el que los átomos de carbono están dispuestos en una sola cadena sin ramificaciones. Este isómero a veces se denomina isómero n ( n de "normal", aunque no es necesariamente el más común). Sin embargo, la cadena de átomos de carbono también puede estar ramificada en uno o más puntos. El número de isómeros posibles aumenta rápidamente con el número de átomos de carbono. Por ejemplo, para los alcanos acíclicos: [3]
Los alcanos ramificados pueden ser quirales . Por ejemplo, el 3-metilhexano y sus homólogos superiores son quirales debido a su centro estereogénico en el átomo de carbono número 3. La lista anterior solo incluye diferencias de conectividad, no estereoquímica. Además de los isómeros de los alcanos, la cadena de átomos de carbono puede formar uno o más anillos. Dichos compuestos se denominan cicloalcanos y también se excluyen de la lista anterior porque al cambiar el número de anillos se modifica la fórmula molecular . Por ejemplo, el ciclobutano y el metilciclopropano son isómeros entre sí (C 4 H 8 ), pero no son isómeros del butano (C 4 H 10 ).
Los alcanos ramificados son termodinámicamente más estables que sus isómeros lineales (o menos ramificados). Por ejemplo, el 2,2,3,3-tetrametilbutano, altamente ramificado, es aproximadamente 1,9 kcal/mol más estable que su isómero lineal, el n -octano. [4]
La nomenclatura de la IUPAC (forma sistemática de nombrar compuestos) para los alcanos se basa en la identificación de cadenas de hidrocarburos. Las cadenas de hidrocarburos saturadas y no ramificadas se nombran sistemáticamente con un prefijo numérico griego que indica el número de carbonos y el sufijo "-ano". [5]
En 1866, August Wilhelm von Hofmann sugirió sistematizar la nomenclatura utilizando toda la secuencia de vocales a, e, i, o y u para crear los sufijos -ano, -eno, -ina (o -ino), -ona, -uno, para los hidrocarburos C n H 2 n +2 , C n H 2 n , C n H 2 n −2 , C n H 2 n −4 , C n H 2 n −6 . [6] En la nomenclatura moderna, los tres primeros nombran específicamente hidrocarburos con enlaces simples, dobles y triples; [7] mientras que "-ona" ahora representa una cetona .
Los alcanos de cadena lineal a veces se indican con el prefijo "n-" o " n -" (para "normal") cuando existe un isómero no lineal . Aunque esto no es estrictamente necesario y no forma parte del sistema de nomenclatura de la IUPAC, su uso sigue siendo común en los casos en los que se desea enfatizar o distinguir entre los isómeros de cadena lineal y de cadena ramificada, por ejemplo, " n -butano " en lugar de simplemente "butano" para diferenciarlo del isobutano . Los nombres alternativos para este grupo utilizados en la industria petrolera son parafinas lineales o n -parafinas .
Los primeros ocho miembros de la serie (en términos de número de átomos de carbono) se nombran de la siguiente manera:
Los primeros cuatro nombres se derivaron de metanol , éter , ácido propiónico y ácido butírico . Los alcanos con cinco o más átomos de carbono se nombran añadiendo el sufijo -ano al prefijo multiplicador numérico apropiado [8] con la elisión de cualquier vocal terminal ( -a o -o ) del término numérico básico. Por lo tanto, pentano, C5H12; hexano, C6H14; heptano, C7H16 ; octano , C8H18 ; etc. El prefijo numérico es generalmente griego ; sin embargo , los alcanos con un recuento de átomos de carbono que termina en nueve, por ejemplo nonano , usan el prefijo latino non- .
Los alcanos ramificados simples a menudo tienen un nombre común que utiliza un prefijo para distinguirlos de los alcanos lineales, por ejemplo, n -pentano , isopentano y neopentano .
Las convenciones de nomenclatura de la IUPAC se pueden utilizar para producir un nombre sistemático.
Los pasos clave en la denominación de alcanos ramificados más complicados son los siguientes: [9]
Aunque técnicamente son distintos de los alcanos, algunos denominan a esta clase de hidrocarburos "alcanos cíclicos". Como su descripción implica, contienen uno o más anillos.
Los cicloalcanos simples tienen un prefijo "ciclo-" para distinguirlos de los alcanos. Los cicloalcanos se nombran según sus contrapartes acíclicas con respecto al número de átomos de carbono en sus cadenas principales, por ejemplo, el ciclopentano (C 5 H 10 ) es un cicloalcano con 5 átomos de carbono al igual que el pentano (C 5 H 12 ), pero están unidos en un anillo de cinco miembros. De manera similar, el propano y el ciclopropano , el butano y el ciclobutano , etc.
Los cicloalcanos sustituidos se nombran de manera similar a los alcanos sustituidos: se indica el anillo de cicloalcano y los sustituyentes están de acuerdo con su posición en el anillo, con la numeración decidida por las reglas de prioridad de Cahn-Ingold-Prelog . [8]
El nombre trivial (no sistemático ) de los alcanos es "parafinas". En conjunto, los alcanos se conocen como la "serie de las parafinas". Los nombres triviales de los compuestos suelen ser artefactos históricos. Se acuñaron antes del desarrollo de los nombres sistemáticos y se han conservado debido a su uso habitual en la industria. Los cicloalcanos también se denominan naftenos. [11] [12]
Los alcanos de cadena ramificada se denominan isoparafinas . "Parafina" es un término general y a menudo no distingue entre compuestos puros y mezclas de isómeros , es decir, compuestos de la misma fórmula química , por ejemplo, pentano e isopentano .
Los siguientes nombres triviales se conservan en el sistema IUPAC:
Ocasionalmente se utilizan algunos nombres triviales no IUPAC:
Todos los alcanos son incoloros. [14] [15] Los alcanos con los pesos moleculares más bajos son gases, los de peso molecular intermedio son líquidos y los más pesados son sólidos cerosos. [16] [17]

Los alcanos experimentan fuerzas intermoleculares de van der Waals . Los efectos acumulativos de estas fuerzas intermoleculares dan lugar a puntos de ebullición más elevados de los alcanos. [18]
Dos factores influyen en la fuerza de las fuerzas de van der Waals:
En condiciones estándar , los alcanos de CH4 a C4H10 son gaseosos; de C5H12 a C17H36 son líquidos; y después de C18H38 son sólidos . Como el punto de ebullición de los alcanos está determinado principalmente por el peso, no debería sorprender que el punto de ebullición tenga una relación casi lineal con el tamaño ( peso molecular ) de la molécula. Como regla general, el punto de ebullición aumenta 20–30 °C por cada carbono añadido a la cadena; esta regla se aplica a otras series homólogas. [18]
Un alcano de cadena lineal tendrá un punto de ebullición más alto que un alcano de cadena ramificada debido a la mayor área de superficie en contacto y, por lo tanto, a las mayores fuerzas de van der Waals, entre moléculas adyacentes. Por ejemplo, compare el isobutano (2-metilpropano) y el n-butano (butano), que hierven a -12 y 0 °C, y el 2,2-dimetilbutano y el 2,3-dimetilbutano, que hierven a 50 y 58 °C, respectivamente. [18]
Por otro lado, los cicloalcanos tienden a tener puntos de ebullición más altos que sus contrapartes lineales debido a las conformaciones bloqueadas de las moléculas, que dan un plano de contacto intermolecular.
Los puntos de fusión de los alcanos siguen una tendencia similar a los puntos de ebullición por la misma razón que se ha explicado anteriormente. Es decir, (en igualdad de condiciones) cuanto mayor sea la molécula, mayor será el punto de fusión. Existe una diferencia significativa entre los puntos de ebullición y de fusión. Los sólidos tienen una estructura más rígida y fija que los líquidos. Esta estructura rígida requiere energía para descomponerse. Por lo tanto, las estructuras sólidas mejor ensambladas requerirán más energía para desintegrarse. En el caso de los alcanos, esto se puede ver en el gráfico anterior (es decir, la línea azul). Los alcanos de número impar tienen una tendencia más baja en los puntos de fusión que los de número par. Esto se debe a que los alcanos de número par se compactan bien en la fase sólida, formando una estructura bien organizada que requiere más energía para desintegrarse. Los alcanos de número impar se compactan menos bien y, por lo tanto, la estructura de empaquetamiento sólido, organizada de forma "más suelta", requiere menos energía para desintegrarse. [19] Para una visualización de las estructuras cristalinas, consulte. [20]
Los puntos de fusión de los alcanos de cadena ramificada pueden ser más altos o más bajos que los de los alcanos de cadena lineal correspondientes, dependiendo nuevamente de la capacidad del alcano en cuestión para compactarse bien en la fase sólida.
Los alcanos no conducen electricidad de ninguna manera, ni están sustancialmente polarizados por un campo eléctrico . Por esta razón, no forman enlaces de hidrógeno y son insolubles en disolventes polares como el agua. Dado que los enlaces de hidrógeno entre las moléculas de agua individuales están alineados lejos de una molécula de alcano, la coexistencia de un alcano y agua conduce a un aumento en el orden molecular (una reducción de la entropía ). Como no hay un enlace significativo entre las moléculas de agua y las moléculas de alcano, la segunda ley de la termodinámica sugiere que esta reducción de la entropía debe minimizarse minimizando el contacto entre el alcano y el agua: Se dice que los alcanos son hidrófobos ya que son insolubles en agua.
Su solubilidad en disolventes no polares es relativamente alta, propiedad que se denomina lipofilicidad . Los alcanos, por ejemplo, son miscibles entre sí en todas las proporciones.
La densidad de los alcanos suele aumentar con el número de átomos de carbono, pero sigue siendo menor que la del agua. Por lo tanto, los alcanos forman la capa superior en una mezcla de alcanos y agua. [21]
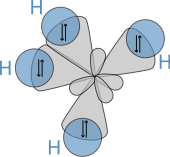
La estructura molecular de los alcanos afecta directamente a sus características físicas y químicas. Se deriva de la configuración electrónica del carbono , que tiene cuatro electrones de valencia . Los átomos de carbono en los alcanos se describen como híbridos sp 3 ; es decir que, en una buena aproximación, los electrones de valencia están en orbitales dirigidos hacia las esquinas de un tetraedro que se derivan de la combinación del orbital 2s y los tres orbitales 2p. Geométricamente, el ángulo entre los enlaces es cos −1 (− 1/3 ) ≈ 109,47°. Esto es exacto para el caso del metano, mientras que los alcanos más grandes que contienen una combinación de enlaces C–H y C–C generalmente tienen enlaces que están dentro de varios grados de este valor idealizado.

Un alcano tiene solo enlaces sencillos C–H y C–C. El primero resulta de la superposición de un orbital sp3 del carbono con el orbital 1s de un hidrógeno; el segundo, de la superposición de dos orbitales sp3 en átomos de carbono adyacentes. Las longitudes de enlace ascienden a 1,09 × 10 −10 m para un enlace C–H y 1,54 × 10 −10 m para un enlace C–C.
La disposición espacial de los enlaces es similar a la de los cuatro orbitales sp3 : están dispuestos tetraédricamente, con un ángulo de 109,47° entre ellos. Las fórmulas estructurales que representan los enlaces como si estuvieran en ángulos rectos entre sí, aunque son comunes y útiles, no representan con precisión la geometría.


La disposición espacial de los enlaces CC y CH se describe mediante los ángulos de torsión de la molécula y se conoce como su conformación . En el etano , el caso más simple para estudiar la conformación de los alcanos, hay una rotación casi libre alrededor de un enlace simple carbono-carbono. Dos conformaciones limitantes son importantes: la conformación eclipsada y la conformación escalonada . La conformación escalonada es 12,6 kJ/mol (3,0 kcal/mol) más baja en energía (más estable) que la conformación eclipsada (la menos estable). En alcanos altamente ramificados, el ángulo de enlace puede diferir del valor óptimo (109,5°) para acomodar grupos voluminosos. Tales distorsiones introducen una tensión en la molécula, conocida como impedimento estérico o deformación. La deformación aumenta sustancialmente la reactividad. [22]
Las firmas espectroscópicas de los alcanos se pueden obtener mediante las principales técnicas de caracterización. [23]
El modo de estiramiento CH da una fuerte absorción entre 2850 y 2960 cm −1 y bandas más débiles para el modo de estiramiento CC absorbe entre 800 y 1300 cm −1 . Los modos de flexión carbono-hidrógeno dependen de la naturaleza del grupo: los grupos metilo muestran bandas a 1450 cm −1 y 1375 cm −1 , mientras que los grupos metileno muestran bandas a 1465 cm −1 y 1450 cm −1 . [24] Las cadenas de carbono con más de cuatro átomos de carbono muestran una absorción débil alrededor de 725 cm −1 .
Las resonancias de protones de los alcanos se encuentran generalmente en δ H = 0,5–1,5. Las resonancias de carbono-13 dependen del número de átomos de hidrógeno unidos al carbono: δ C = 8–30 (primario, metilo, –CH 3 ), 15–55 (secundario, metileno, –CH 2 –), 20–60 (terciario, metino, C–H) y cuaternario. La resonancia de carbono-13 de los átomos de carbono cuaternario es característicamente débil, debido a la falta de efecto Overhauser nuclear y al largo tiempo de relajación , y puede pasarse por alto en muestras débiles o muestras que no se han analizado durante un tiempo suficientemente largo.
Dado que los alcanos tienen altas energías de ionización , sus espectros de masas de impacto electrónico muestran corrientes débiles para sus iones moleculares. El patrón de fragmentación puede ser difícil de interpretar, pero en el caso de alcanos de cadena ramificada, la cadena de carbono se escinde preferentemente en carbonos terciarios o cuaternarios debido a la relativa estabilidad de los radicales libres resultantes . Los espectros de masas para alcanos de cadena lineal se ilustran con los del dodecano : el fragmento resultante de la pérdida de un solo grupo metilo ( M − 15) está ausente, los fragmentos son más intensos que el ion molecular y están espaciados por intervalos de 14 unidades de masa, correspondientes a la pérdida de grupos CH 2 . [25]
Los alcanos reaccionan débilmente con la mayoría de los compuestos químicos. Reaccionan únicamente con los reactivos electrofílicos más fuertes gracias a sus fuertes enlaces C–H (~100 kcal/mol) y C–C (~90 kcal/mol). También son relativamente poco reactivos frente a los radicales libres. Esta inercia es la fuente del término parafinas (que aquí significa "falta de afinidad"). En el petróleo crudo, las moléculas de alcanos han permanecido químicamente inalteradas durante millones de años.
Se estima que los valores de la constante de disociación ácida (p K a ) de todos los alcanos varían de 50 a 70, dependiendo del método de extrapolación, por lo tanto, son ácidos extremadamente débiles que son prácticamente inertes a las bases (ver: ácidos carbonados ). También son bases extremadamente débiles, que no experimentan protonación observable en ácido sulfúrico puro ( H 0 ~ −12 ), aunque se sabe que los superácidos que son al menos millones de veces más fuertes los protonan para dar iones alcanonio hipercoordinados (ver: ion metanio ). Por lo tanto, una mezcla de pentafluoruro de antimonio (SbF 5 ) y ácido fluorosulfónico (HSO 3 F), llamada ácido mágico , puede protonar alcanos. [26]
Todos los alcanos reaccionan con el oxígeno en una reacción de combustión , aunque se vuelven cada vez más difíciles de encender a medida que aumenta el número de átomos de carbono. La ecuación general para la combustión completa es:
En ausencia de suficiente oxígeno, se puede formar monóxido de carbono o incluso hollín , como se muestra a continuación:
Por ejemplo, el metano :
Consulte la tabla de calores de formación de alcanos para obtener datos detallados. El cambio de entalpía estándar de combustión , Δ c H ⊖ , para los alcanos aumenta aproximadamente en 650 kJ/mol por grupo CH 2 . Los alcanos de cadena ramificada tienen valores más bajos de Δ c H ⊖ que los alcanos de cadena lineal del mismo número de átomos de carbono, por lo que se puede observar que son algo más estables.
Algunos organismos son capaces de metalizar alcanos. [27] [28] Las metano monooxigenasas convierten el metano en metanol . En el caso de los alcanos superiores, el citocromo P450 convierte los alcanos en alcoholes, que luego son susceptibles de degradación.
Los radicales libres , moléculas con electrones desapareados, desempeñan un papel importante en la mayoría de las reacciones de los alcanos. Las reacciones de halogenación de radicales libres ocurren con halógenos, lo que lleva a la producción de haloalcanos . Los átomos de hidrógeno del alcano son reemplazados progresivamente por átomos de halógeno. La reacción de los alcanos y el flúor es altamente exotérmica y puede provocar una explosión. [29] Estas reacciones son una ruta industrial importante para los hidrocarburos halogenados. Hay tres pasos:
Los experimentos han demostrado que toda halogenación produce una mezcla de todos los isómeros posibles, lo que indica que todos los átomos de hidrógeno son susceptibles de reacción. Sin embargo, la mezcla producida no es estadística: los átomos de hidrógeno secundarios y terciarios se reemplazan preferentemente debido a la mayor estabilidad de los radicales libres secundarios y terciarios. Un ejemplo puede verse en la monobromación del propano: [18]

En la reacción de Reed , el dióxido de azufre y el cloro convierten los hidrocarburos en cloruros de sulfonilo bajo la influencia de la luz .
Bajo ciertas condiciones, los alcanos sufrirán nitración .
Ciertos complejos de metales de transición promueven reacciones no radicales con alcanos, lo que resulta en reacciones de activación del enlace C–H . [30]
El craqueo rompe moléculas más grandes en otras más pequeñas. Esta reacción requiere calor y catalizadores. El proceso de craqueo térmico sigue un mecanismo homolítico con formación de radicales libres . El proceso de craqueo catalítico implica la presencia de catalizadores ácidos (generalmente ácidos sólidos como sílice-alúmina y zeolitas ), que promueven una ruptura heterolítica (asimétrica) de enlaces produciendo pares de iones de cargas opuestas, generalmente un carbocatión . Los radicales libres y cationes localizados en el carbono son altamente inestables y experimentan procesos de reordenamiento de la cadena, escisión C–C en la posición beta (es decir, craqueo) y transferencia de hidrógeno intra e intermolecular o transferencia de hidruro . En ambos tipos de procesos, los intermediarios reactivos correspondientes (radicales, iones) se regeneran permanentemente y, por lo tanto, proceden por un mecanismo de cadena de autopropagación. La cadena de reacciones finalmente termina por recombinación de radicales o iones. [ cita requerida ]
Dragan y su colega fueron los primeros en informar sobre la isomerización en alcanos. [31] La isomerización y la reformación son procesos en los que los alcanos de cadena lineal se calientan en presencia de un catalizador de platino . En la isomerización, los alcanos se convierten en isómeros de cadena ramificada. En otras palabras, no pierden carbonos ni hidrógenos, manteniendo el mismo peso molecular. [31] En la reformación, los alcanos se convierten en cicloalcanos o hidrocarburos aromáticos , desprendiendo hidrógeno como subproducto. Ambos procesos aumentan el número de octano de la sustancia. El butano es el alcano más común que se somete al proceso de isomerización, ya que produce muchos alcanos ramificados con altos números de octano. [31]
En el reformado con vapor , los alcanos reaccionan con vapor en presencia de un catalizador de níquel para producir hidrógeno y monóxido de carbono.


Los alcanos forman una pequeña porción de las atmósferas de los planetas gaseosos exteriores como Júpiter (0,1 % de metano, 2 ppm de etano), Saturno (0,2 % de metano, 5 ppm de etano), Urano (1,99 % de metano, 2,5 ppm de etano) y Neptuno (1,5 % de metano, 1,5 ppm de etano). Titán (1,6 % de metano), un satélite de Saturno, fue examinado por la sonda Huygens , que indicó que la atmósfera de Titán llueve periódicamente metano líquido sobre la superficie de la luna. [32] También en Titán, la misión Cassini ha fotografiado lagos estacionales de metano/etano cerca de las regiones polares de Titán. También se ha detectado metano y etano en la cola del cometa Hyakutake . El análisis químico mostró que las abundancias de etano y metano eran aproximadamente iguales, lo que se cree que implica que sus hielos se formaron en el espacio interestelar, lejos del Sol, lo que habría evaporado estas moléculas volátiles. [33] También se han detectado alcanos en meteoritos como las condritas carbonáceas .
En la atmósfera de la Tierra se encuentran trazas de gas metano (aproximadamente 0,0002% o 1745 ppb), producidos principalmente por microorganismos metanogénicos , como Archaea en el intestino de los rumiantes. [34]
Las fuentes comerciales más importantes de alcanos son el gas natural y el petróleo . [18] El gas natural contiene principalmente metano y etano, con algo de propano y butano : el petróleo es una mezcla de alcanos líquidos y otros hidrocarburos . Estos hidrocarburos se formaron cuando los animales y plantas marinos (zooplancton y fitoplancton) murieron y se hundieron en el fondo de mares antiguos y se cubrieron con sedimentos en un entorno anóxico y se convirtieron durante muchos millones de años a altas temperaturas y alta presión en su forma actual. El gas natural resultó, por ejemplo, de la siguiente reacción:
Estos depósitos de hidrocarburos, reunidos en rocas porosas atrapadas bajo rocas impermeables, constituyen yacimientos petrolíferos comerciales . Se han formado a lo largo de millones de años y, una vez agotados, no se pueden reemplazar fácilmente. El agotamiento de estas reservas de hidrocarburos es la base de lo que se conoce como la crisis energética .
Los alcanos tienen una baja solubilidad en agua, por lo que su contenido en los océanos es insignificante; sin embargo, a altas presiones y bajas temperaturas (como en el fondo de los océanos), el metano puede cocristalizarse con agua para formar un clatrato de metano sólido (hidrato de metano). Aunque esto no se puede explotar comercialmente en la actualidad, la cantidad de energía combustible de los yacimientos de clatrato de metano conocidos supera el contenido energético de todos los depósitos de gas natural y petróleo juntos. El metano extraído del clatrato de metano es, por lo tanto, un candidato para los combustibles del futuro.

Aparte del petróleo y el gas natural, los alcanos se encuentran en la naturaleza en forma de metano, que es producido por algunas arqueas mediante el proceso de metanogénesis . Estos organismos se encuentran en el intestino de las termitas [35] y las vacas. [36] El metano se produce a partir del dióxido de carbono u otros compuestos orgánicos. La energía se libera mediante la oxidación del hidrógeno :
Es probable que nuestros actuales depósitos de gas natural se hayan formado de manera similar. [37]
RCH2\sCH3}} (R = alquilo )
Otra vía para la obtención de alcanos es la hidrogenólisis , que implica la ruptura de enlaces C-heteroátomo utilizando hidrógeno. En la industria, los principales sustratos son impurezas organonitrógenas y organosulfuradas, es decir, los heteroátomos son N y S. Los procesos específicos se denominan hidrodesnitrificación e hidrodesulfuración :
La hidrogenólisis se puede aplicar a la conversión de prácticamente cualquier grupo funcional en hidrocarburos. Los sustratos incluyen haloalcanos, alcoholes, aldehídos, cetonas, ácidos carboxílicos, etc. Tanto la hidrogenólisis como la hidrogenación se practican en las refinerías. Se pueden llevar a cabo mediante hidruro de litio y aluminio , reducción de Clemmenson y otras rutas especializadas.
El carbón es un precursor más tradicional de los alcanos. Durante siglos se ha practicado intensamente una amplia gama de tecnologías. [38] Simplemente calentando el carbón se obtienen alcanos, dejando atrás el coque . Las tecnologías relevantes incluyen el proceso Bergius y la licuefacción del carbón . La combustión parcial del carbón y los compuestos orgánicos sólidos relacionados genera monóxido de carbono , que puede hidrogenarse utilizando el proceso Fischer-Tropsch . Esta tecnología permite sintetizar hidrocarburos líquidos, incluidos los alcanos. Este método se utiliza para producir sustitutos de los destilados del petróleo .
Rara vez existe interés en la síntesis de alcanos, ya que suelen estar disponibles comercialmente y son menos valorados que prácticamente cualquier precursor. El método más conocido es la hidrogenación de alquenos . Muchos enlaces CX se pueden convertir en enlaces CH utilizando hidruro de litio y aluminio , reducción de Clemmenson y otras rutas especializadas. [39] La hidrólisis de reactivos de Grignard de alquilo y compuestos de alquil litio da alcanos. [40]
El uso dominante de los alcanos es como combustibles. El propano y el butano , gases fácilmente licuables, se conocen comúnmente como gas licuado de petróleo (GLP). [41] Desde el pentano hasta el octano , los alcanos son líquidos altamente volátiles. Se utilizan como combustibles en motores de combustión interna , ya que se vaporizan fácilmente al entrar en la cámara de combustión sin formar gotitas, lo que perjudicaría la uniformidad de la combustión. Se prefieren los alcanos de cadena ramificada, ya que son mucho menos propensos a la ignición prematura, que causa detonación , que sus homólogos de cadena lineal. Esta propensión a la ignición prematura se mide por el índice de octano del combustible, donde el 2,2,4-trimetilpentano ( isooctano ) tiene un valor arbitrario de 100 y el heptano tiene un valor de cero. Aparte de su uso como combustibles, los alcanos medios también son buenos disolventes para sustancias no polares. Los alcanos, desde el nonano hasta, por ejemplo, el hexadecano (un alcano con dieciséis átomos de carbono), son líquidos de mayor viscosidad , cada vez menos adecuados para su uso en gasolina. En cambio, forman la mayor parte del combustible diésel y de aviación . Los combustibles diésel se caracterizan por su índice de cetano , siendo el cetano un antiguo nombre para el hexadecano. Sin embargo, los puntos de fusión más elevados de estos alcanos pueden causar problemas a bajas temperaturas y en las regiones polares, donde el combustible se vuelve demasiado espeso para fluir correctamente.
Mediante el proceso de craqueo , los alcanos pueden convertirse en alquenos . Los alquenos simples son precursores de polímeros, como el polietileno y el polipropileno . Cuando el craqueo se lleva al extremo, los alcanos pueden convertirse en negro de carbono , que es un componente importante de los neumáticos.
La cloración del metano produce clorometanos, que se utilizan como disolventes y componentes básicos de compuestos complejos. De manera similar, el tratamiento del metano con azufre produce disulfuro de carbono . También se preparan otros productos químicos mediante la reacción con trióxido de azufre y óxido nítrico.
Algunos hidrocarburos ligeros se utilizan como aerosoles .
Los alcanos a partir del hexadecano forman los componentes más importantes del fueloil y del aceite lubricante . En esta última función, actúan al mismo tiempo como agentes anticorrosivos, ya que su naturaleza hidrófoba hace que el agua no pueda alcanzar la superficie del metal. Muchos alcanos sólidos se utilizan como cera de parafina , por ejemplo, en las velas . Sin embargo, no debe confundirse con la cera verdadera , que se compone principalmente de ésteres .
Los alcanos con una longitud de cadena de aproximadamente 35 átomos de carbono o más se encuentran en el betún , que se utiliza, por ejemplo, en el revestimiento de carreteras. Sin embargo, los alcanos superiores tienen poco valor y, por lo general, se dividen en alcanos inferiores mediante craqueo .
Los alcanos son muy inflamables, pero tienen baja toxicidad. El metano "es prácticamente inerte desde el punto de vista toxicológico". Los alcanos pueden ser asfixiantes y narcóticos. [38]