
Un cloroplasto ( / ˈ k l ɔːr ə ˌ p l æ s t , - p l ɑː s t / ) [1] [2] es un tipo de orgánulo unido a una membrana conocido como plastidio que conduce la fotosíntesis principalmente en plantas y algas. células . El pigmento fotosintético clorofila captura la energía de la luz solar , la convierte y la almacena en las moléculas de almacenamiento de energía ATP y NADPH mientras libera oxígeno del agua en las células. Luego, el ATP y el NADPH se utilizan para producir moléculas orgánicas a partir de dióxido de carbono en un proceso conocido como ciclo de Calvin . Los cloroplastos llevan a cabo otras funciones, incluida la síntesis de ácidos grasos , la síntesis de aminoácidos y la respuesta inmune en las plantas. El número de cloroplastos por célula varía desde uno, en las algas unicelulares, hasta 100 en plantas como Arabidopsis y trigo .
Un cloroplasto se caracteriza por sus dos membranas y una alta concentración de clorofila . Otros tipos de plastidios , como los leucoplastos y los cromoplastos , contienen poca clorofila y no realizan la fotosíntesis.
Los cloroplastos son muy dinámicos: circulan y se mueven dentro de las células vegetales y, en ocasiones, se dividen en dos para reproducirse. Su comportamiento está fuertemente influenciado por factores ambientales como el color y la intensidad de la luz. Los cloroplastos, al igual que las mitocondrias , contienen su propio ADN , que se cree que se hereda de su antepasado: una cianobacteria fotosintética que fue fagocitada por una célula eucariota temprana . [3] Los cloroplastos no pueden ser producidos por la célula vegetal y deben ser heredados por cada célula hija durante la división celular.
Con una excepción (la ameboide Paulinella chromatophora ), todos los cloroplastos probablemente se remontan a un único evento endosimbiótico , cuando una cianobacteria fue fagocitada por un eucariota. A pesar de esto, los cloroplastos se pueden encontrar en un conjunto extremadamente amplio de organismos, algunos de los cuales no están directamente relacionados entre sí, como consecuencia de muchos eventos endosimbióticos secundarios e incluso terciarios .
La palabra cloroplasto se deriva de las palabras griegas cloros (χλωρός), que significa verde, y plastes (πλάστης), que significa "el que forma". [4]
La primera descripción definitiva de un cloroplasto ( Chlorophyllkörnen , "grano de clorofila") fue dada por Hugo von Mohl en 1837 como cuerpos discretos dentro de la célula vegetal verde. [5] En 1883, Andreas Franz Wilhelm Schimper denominó estos cuerpos "cloroplastidos" ( Chloroplastiden ). [6] En 1884, Eduard Strasburger adoptó el término "cloroplastos" ( Chloroplasten ). [7] [8] [9]
Los cloroplastos son uno de los muchos tipos de orgánulos de la célula vegetal. Se considera que evolucionaron a partir de cianobacterias endosimbióticas . Se cree que las mitocondrias provienen de un evento de endosimbiosis similar , en el que un procariota aeróbico quedó engullido. [10] Este origen de los cloroplastos fue sugerido por primera vez por el biólogo ruso Konstantin Mereschkowski en 1905 [11] después de que Andreas Franz Wilhelm Schimper observara en 1883 que los cloroplastos se parecen mucho a las cianobacterias . [6] Los cloroplastos solo se encuentran en plantas , algas , [12] y tres especies de amebas : Paulinella chromatophora , P. micropora y P. longicromatophora marina . [13]
Los cloroplastos se consideran cianobacterias endosimbióticas. [14] Las cianobacterias a veces se denominan algas verdiazules a pesar de que son procariotas . Son un filo diverso de bacterias gramnegativas capaces de realizar la fotosíntesis . Las cianobacterias también contienen una pared celular de peptidoglicano , que es más gruesa que en otras bacterias gramnegativas y que se encuentra entre sus dos membranas celulares. [15] Al igual que los cloroplastos, tienen tilacoides en su interior. [16] En las membranas tilacoides se encuentran pigmentos fotosintéticos , incluida la clorofila a . [17] Las ficobilinas también son pigmentos cianobacterianos comunes, generalmente organizados en ficobilisomas hemisféricos adheridos al exterior de las membranas tilacoides (aunque las ficobilinas no se comparten con todos los cloroplastos). [17] [18]
![Endosimbiosis primaria Un eucariota con mitocondrias envolvió una cianobacteria en un evento de endosimbiosis primaria en serie, creando un linaje de células con ambos orgánulos.[10] Es importante señalar que el endosimbionte de la cianobacteria ya tenía una doble membrana: la membrana derivada de la vacuola fagosómica se perdió.[19]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b8/Chloroplast_endosymbiosis_simple.svg/440px-Chloroplast_endosymbiosis_simple.svg.png)
Hace entre 1.000 y 2.000 millones de años, [20] [21] [22] una cianobacteria de vida libre entró en una célula eucariota temprana , ya sea como alimento o como parásito interno , [10] pero logró escapar de la vacuola fagocítica que era. [17] Las dos membranas de bicapa lipídica más internas [23] que rodean todos los cloroplastos corresponden a las membranas externa e interna de la pared celular gramnegativa de la cianobacteria ancestral , [19] [24] [25] y no a la membrana fagosómica . del host, que probablemente se perdió. [19] El nuevo residente celular se convirtió rápidamente en una ventaja, ya que proporcionaba alimento al huésped eucariota, lo que le permitía vivir dentro de él. [10] Con el tiempo, la cianobacteria fue asimilada y muchos de sus genes se perdieron o se transfirieron al núcleo del huésped. [26] De los genomas que probablemente contenían originalmente más de 3000 genes, sólo quedan unos 130 genes en los cloroplastos de las plantas contemporáneas. [21] Algunas de sus proteínas luego se sintetizaron en el citoplasma de la célula huésped y se importaron nuevamente al cloroplasto (anteriormente la cianobacteria). [26] [27] Por otra parte, hace unos 90-140 millones de años, volvió a suceder y dio lugar al ameboide Paulinella chromatophora . [22]
Este evento se llama endosimbiosis , o "célula que vive dentro de otra célula con beneficio mutuo para ambas". La célula externa se denomina comúnmente huésped, mientras que la célula interna se denomina endosimbionte . [10]
Se cree que los cloroplastos surgieron después de las mitocondrias , ya que todos los eucariotas contienen mitocondrias, pero no todos tienen cloroplastos. [10] [28] Esto se llama endosimbiosis en serie : un eucariota primitivo envuelve al ancestro de la mitocondria , y algunos descendientes de él luego envuelven al ancestro del cloroplasto, creando una célula con cloroplastos y mitocondrias. [10]
Durante mucho tiempo se ha debatido si los cloroplastos primarios provinieron o no de un único evento endosimbiótico o de muchas fusiones independientes entre varios linajes eucariotas. Actualmente se considera generalmente que los organismos con cloroplastos primarios comparten un único ancestro que adoptó una cianobacteria hace entre 600 y 2.000 millones de años. [20] [22] Se ha propuesto que el pariente vivo más cercano de esta bacteria es Gloeomargarita lithophora . [29] [30] [31] La excepción es el ameboide Paulinella chromatophora , que desciende de un ancestro que adoptó una cianobacteria Proclorococo hace 90 a 500 millones de años. [32] [31] [22]
Estos cloroplastos, que se remontan directamente a un ancestro cianobacteriano, se conocen como plastidios primarios [33] ( " plastidio " en este contexto significa casi lo mismo que cloroplasto [10] ). Todos los cloroplastos primarios pertenecen a uno de los cuatro linajes de cloroplastos: el linaje de cloroplastos glaucofitos , el linaje de cloroplastos ameboide Paulinella chromatophora , el linaje de cloroplastos rodófitos (algas rojas) o el linaje de cloroplastos cloroplastidos (verdes). [34] Los linajes rodofito y cloroplastidano son los más grandes, [19] siendo el cloroplastidano (verde) el que contiene las plantas terrestres . [19]
Por lo general, se considera que el evento de endosimbiosis ocurrió en Archaeplastida , dentro de los cuales los glaucophyta son el posible linaje divergente más antiguo. [27] [14] El grupo de cloroplastos glaucofitos es el más pequeño de los tres linajes primarios de cloroplastos, y se encuentra en sólo 13 especies, [19] y se cree que es el que se ramificó más temprano. [19] [20] [35] Los glaucofitos tienen cloroplastos que retienen una pared de peptidoglicano entre sus membranas dobles, [33] como su padre cianobacteriano . [15] Por esta razón, los cloroplastos de glaucofitos también se conocen como 'muroplastos' [33] (además de 'cianoplastos' o 'cianelas'). Los cloroplastos de glaucofitos también contienen tilacoides concéntricos no apilados , que rodean un carboxisoma , una estructura icosaédrica en la que los cloroplastos de glaucofitos y las cianobacterias mantienen su enzima de fijación de carbono RuBisCO . El almidón que sintetizan se acumula fuera del cloroplasto. [17] Al igual que las cianobacterias, los tilacoides del cloroplasto de glaucofitos y rodófitos están plagados de estructuras colectoras de luz llamadas ficobilisomas . [17] [33] Por estas razones, los cloroplastos de glaucofitos se consideran un intermediario primitivo entre las cianobacterias y los cloroplastos más evolucionados en las algas rojas y las plantas . [33]
El grupo de cloroplastos de las rodofitas , o algas rojas, es otro linaje de cloroplastos grande y diverso. [19] Los cloroplastos rodófitos también se llaman rodoplastos , [33] literalmente "cloroplastos rojos". [37]
Los rodoplastos tienen una doble membrana con un espacio intermembrana y pigmentos de ficobilina organizados en ficobilisomas en las membranas de tilacoides, evitando que sus tilacoides se apilen. [17] Algunos contienen pirenoides . [33] Los rodoplastos tienen clorofila a y ficobilinas [35] para pigmentos fotosintéticos; La ficobilina ficoeritrina es responsable de dar a muchas algas rojas su distintivo color rojo . [36] Sin embargo, dado que también contienen clorofila a azul verdosa y otros pigmentos, muchos son de color rojizo a púrpura debido a la combinación. [33] [ dudoso ] El pigmento rojo de ficoeritrina es una adaptación para ayudar a las algas rojas a captar más luz solar en aguas profundas [33] ; como tal, algunas algas rojas que viven en aguas poco profundas tienen menos ficoeritrina en sus rodoplastos y pueden aparecer más verdoso. [36] Los rodoplastos sintetizan una forma de almidón llamado almidón de Florida , [33] que se acumula en gránulos fuera del rodoplasto, en el citoplasma del alga roja. [17]
Los cloroplastos cloroplastidos , o cloroplastos verdes , son otro linaje de cloroplastos primarios grande y muy diverso. Sus organismos huéspedes se conocen comúnmente como algas verdes y plantas terrestres . [38] Se diferencian de los cloroplastos de algas rojas y glaucofitos en que han perdido sus ficobilisomas y en su lugar contienen clorofila b . [17] La mayoría de los cloroplastos verdes son (obviamente) verdes , aunque algunos no lo son, como algunas formas de Hæmatococcus pluvialis , debido a pigmentos accesorios que anulan los colores verdes de las clorofilas. Los cloroplastos de cloroplastida han perdido la pared de peptidoglicano entre su doble membrana, dejando un espacio intermembrana. [17] Algunas plantas parecen haber conservado los genes para la síntesis de la capa de peptidoglicano, aunque en su lugar han sido reutilizados para su uso en la división del cloroplasto. [39]
La mayoría de los cloroplastos descritos en este artículo son cloroplastos verdes.
Las algas verdes y las plantas mantienen su almidón dentro de sus cloroplastos, [17] [35] [38] y en las plantas y algunas algas, los tilacoides de los cloroplastos están dispuestos en pilas de grana. Algunos cloroplastos de algas verdes contienen una estructura llamada pirenoide , [17] que es funcionalmente similar al carboxisoma del glaucofito en el sentido de que es donde se concentran RuBisCO y CO 2 en el cloroplasto. [40]

Helicosporidium es un género de algas verdes parásitas no fotosintéticas que se cree que contiene un cloroplasto vestigial. [35] Se han encontrado genes de un cloroplasto [41] y genes nucleares que indican la presencia de un cloroplasto en Helicosporidium [35] incluso si nadie ha visto el cloroplasto en sí. [35]
Si bien la mayoría de los cloroplastos se originan a partir de ese primer conjunto de eventos endosimbióticos, Paulinella chromatophora es una excepción que adquirió un endosimbionte cianobacteriano fotosintético más recientemente. No está claro si ese simbionte está estrechamente relacionado con el cloroplasto ancestral de otros eucariotas. [19] Al estar en las primeras etapas de la endosimbiosis, Paulinella chromatophora puede ofrecer algunas ideas sobre cómo evolucionaron los cloroplastos. [26] [42] Las células de Paulinella contienen una o dos estructuras fotosintetizadoras de color azul verdoso en forma de salchicha llamadas cromatóforos, [26] [42] que descienden de la cianobacteria Synechococcus . Los cromatóforos no pueden sobrevivir fuera de su huésped. [26] El ADN del cromatóforo tiene aproximadamente un millón de pares de bases de largo y contiene alrededor de 850 genes que codifican proteínas , mucho menos que los tres millones de pares de bases del genoma de Synechococcus , [26] pero mucho más grande que el genoma de aproximadamente 150.000 pares de bases del cloroplasto más asimilado. . [43] [44] [45] Los cromatóforos han transferido mucho menos ADN al núcleo de su huésped. Alrededor del 0,3 al 0,8% del ADN nuclear de Paulinella proviene del cromatóforo, en comparación con el 11 al 14% del cloroplasto en las plantas. [42]
Muchos otros organismos obtuvieron cloroplastos de los linajes primarios de cloroplastos a través de endosimbiosis secundaria, envolviendo un alga roja o verde que contenía un cloroplasto. Estos cloroplastos se conocen como plastidios secundarios. [33]
Mientras que los cloroplastos primarios tienen una doble membrana de su ancestro cianobacteriano , los cloroplastos secundarios tienen membranas adicionales además de las dos originales, como resultado del evento endosimbiótico secundario, cuando un eucariota no fotosintético engulló un alga que contenía cloroplasto pero no logró digerirla, de manera muy similar a la cianobacteria al comienzo de esta historia. [19] El alga engullida se descompuso, dejando solo su cloroplasto y, a veces, su membrana celular y su núcleo , formando un cloroplasto con tres o cuatro membranas [46] : las dos membranas de las cianobacterias, a veces la membrana celular del alga ingerida y la membrana fagosómica. vacuola de la membrana celular del huésped. [19]

Los genes del núcleo del eucariota fagocitado a menudo se transfieren al núcleo del huésped secundario. [19] Las criptomonas y los cloraracniofitos retienen el núcleo del eucariota fagocitado, un objeto llamado nucleomorfo , [ 19] ubicado entre la segunda y tercera membranas del cloroplasto. [17] [27]
Todos los cloroplastos secundarios provienen de algas verdes y rojas ; no se han observado cloroplastos secundarios de glaucofitos , probablemente porque los glaucofitos son relativamente raros en la naturaleza, lo que hace que sea menos probable que hayan sido absorbidos por otro eucariota. [19]
Las algas verdes han sido absorbidas por los euglénidos , cloraracniófitos , un linaje de dinoflagelados , [35] y posiblemente el ancestro del linaje CASH ( criptomonas , alveolados , estramenopiles y haptofitos ) [47] en tres o cuatro fagocitaciones separadas. [48] Muchos cloroplastos derivados de algas verdes contienen pirenoides , pero a diferencia de los cloroplastos de sus ancestros de algas verdes, el producto de almacenamiento se acumula en gránulos fuera del cloroplasto. [17]

Los euglenófitos son un grupo de protistas flagelados comunes que contienen cloroplastos derivados de un alga verde. [19] Los cloroplastos de euglenófitos tienen tres membranas; se cree que la membrana del endosimbionte primario se perdió, dejando las membranas de cianobacterias y la membrana fagosómica del huésped secundario. [19] Los cloroplastos euglenófitos tienen un pirenoide y tilacoides apilados en grupos de tres. El producto fotosintético se almacena en forma de paramilón , que está contenido en gránulos unidos a una membrana en el citoplasma del euglenófito. [17] [35]

Los cloraracniofitos / ˌ k l ɔːr ə ˈ r æ k n i oʊ ˌ f aɪ t s / son un grupo raro de organismos que también contienen cloroplastos derivados de algas verdes, [19] aunque su historia es más complicada que la de los euglenófitos. Se cree que el antepasado de los cloraracniofitos fue un eucariota con un cloroplasto derivado de algas rojas . Luego se cree que perdió su primer cloroplasto de alga roja y luego engulló un alga verde, dándole su segundo cloroplasto derivado de algas verdes. [35]
Los cloroplastos de cloraracniofitos están delimitados por cuatro membranas, excepto cerca de la membrana celular, donde las membranas de los cloroplastos se fusionan en una doble membrana. [17] Sus tilacoides están dispuestos en pilas sueltas de tres. [17] Los cloraracniófitos tienen una forma de polisacárido llamado crisolaminarina , que almacenan en el citoplasma, [35] a menudo se acumula alrededor del pirenoide del cloroplasto , que sobresale en el citoplasma. [17]
Los cloroplastos de cloraracniofitos son notables porque el alga verde de la que derivan no se ha descompuesto por completo; su núcleo aún persiste como un nucleomorfo [19] que se encuentra entre la segunda y tercera membranas del cloroplasto [17] ; el espacio periplastidio, que corresponde al verde citoplasma del alga. [35]
Lepidodinium viride y sus parientes cercanos son dinófitos (ver más abajo) que perdieron su cloroplasto de peridinina original y lo reemplazaron con un cloroplasto derivado de algas verdes (más específicamente, un prasinofito ). [17] [49] Lepidodinium es el único dinófito que tiene un cloroplasto que no es del linaje de los rodoplastos . El cloroplasto está rodeado por dos membranas y no tiene nucleomorfo; todos los genes del nucleomorfo se han transferido al núcleo dinófito . [49] El evento endosimbiótico que condujo a este cloroplasto fue una endosimbiosis secundaria en serie en lugar de una endosimbiosis terciaria: el endosimbionte era un alga verde que contenía un cloroplasto primario (que formaba un cloroplasto secundario). [35]
Las criptofitas o criptomonas son un grupo de algas que contienen un cloroplasto derivado de algas rojas. Los cloroplastos criptofitos contienen un nucleomorfo que superficialmente se parece al de los cloraracniofitos . [19] Los cloroplastos criptofitos tienen cuatro membranas, la más externa de las cuales se continúa con el retículo endoplásmico rugoso . Sintetizan almidón ordinario , que se almacena en gránulos que se encuentran en el espacio periplastidio, fuera de la doble membrana original, en el lugar que corresponde al citoplasma del alga roja. Dentro de los cloroplastos criptofitos hay un pirenoide y tilacoides en pilas de dos. [17]
Sus cloroplastos no tienen ficobilisomas , [17] pero sí tienen pigmentos de ficobilina que mantienen en su espacio tilacoide, en lugar de anclarlos en el exterior de sus membranas tilacoides. [17] [19]
Las criptofitas pueden haber desempeñado un papel clave en la propagación de cloroplastos a base de algas rojas. [50] [51]

Los haptofitos son similares y están estrechamente relacionados con los criptofitos o heterokontofitos. [35] Sus cloroplastos carecen de un nucleomorfo, [17] [19] sus tilacoides están en pilas de tres y sintetizan azúcar crisolaminarina , que almacenan completamente fuera del cloroplasto, en el citoplasma del haptofito. [17]

Los heterocontofitos , también conocidos como estramenopilos, son un grupo muy grande y diverso de eucariotas. El linaje fotoautótrofo, Ochrophyta , que incluye las diatomeas y las algas pardas , las algas doradas , [36] y las algas verdeamarillas , también contiene cloroplastos derivados de algas rojas. [35]
Los cloroplastos heterokont son muy similares a los cloroplastos haptofitos, contienen un pirenoide , un triplete de tilacoides y, con algunas excepciones, [17] tienen una envoltura plastídica de cuatro capas, la membrana epiplástida más externa conectada al retículo endoplásmico . Al igual que los haptofitos, los heterocontofitos almacenan azúcar en gránulos de crisolaminarina en el citoplasma. [17] Los cloroplastos heterocontofitos contienen clorofila a y, con algunas excepciones, [17] clorofila c , [19] pero también tienen carotenoides que les dan sus muchos colores. [36]
Los alveolados son un clado importante de eucariotas unicelulares de miembros tanto autótrofos como heterótrofos. La característica compartida más notable es la presencia de alvéolos (sacos) corticales (región externa). Se trata de vesículas aplanadas (sacos) empaquetadas en una capa continua justo debajo de la membrana y que la sostienen, formando normalmente una película flexible (piel fina). En los dinoflagelados suelen formar placas de armadura. Muchos miembros contienen un plastidio derivado de algas rojas. Una característica notable de este grupo diverso es la frecuente pérdida de la fotosíntesis. Sin embargo, la mayoría de estos heterótrofos continúan procesando un plastidio no fotosintético. [52]
Los apicomplejos son un grupo de alveolados. Al igual que los helicosproidios , son parásitos y tienen un cloroplasto no fotosintético. [35] Alguna vez se pensó que estaban relacionados con los helicosproidia, pero ahora se sabe que los helicosproida son algas verdes en lugar de ser parte del linaje CASH. [35] Los apicomplejos incluyen Plasmodium , el parásito de la malaria . Muchos apicomplejos mantienen un cloroplasto residual derivado de algas rojas [53] [35] llamado apicoplasto , que heredaron de sus antepasados. Otros apicomplejos como Cryptosporidium han perdido completamente el cloroplasto. [53] Los apicomplejos almacenan su energía en gránulos de amilopectina que se encuentran en su citoplasma, aunque no son fotosintéticos. [17]
Los apicoplastos han perdido toda función fotosintética y no contienen pigmentos fotosintéticos ni tilacoides verdaderos. Están delimitados por cuatro membranas, pero las membranas no están conectadas al retículo endoplásmico . [17] El hecho de que los apicomplejos aún mantengan su cloroplasto no fotosintético demuestra cómo el cloroplasto lleva a cabo funciones importantes además de la fotosíntesis . Los cloroplastos vegetales proporcionan a las células vegetales muchas cosas importantes además del azúcar, y los apicoplastos no son diferentes: sintetizan ácidos grasos , pirofosfato de isopentenilo , grupos de hierro y azufre y llevan a cabo parte de la vía del hemo . [53] Esto hace que el apicoplasto sea un objetivo atractivo para medicamentos destinados a curar enfermedades relacionadas con el apicomplejo. [33] La función apicoplasta más importante es la síntesis de pirofosfato de isopentenilo ; de hecho, los apicomplejos mueren cuando algo interfiere con esta función apicoplasta, y cuando los apicomplejos se cultivan en un medio rico en pirofosfato de isopentenilo, desechan el orgánulo. [53]
Chromerida es un grupo de algas recientemente descubierto de los corales australianos que comprende algunos parientes fotosintéticos cercanos de los apicomplejos . El primer miembro, Chromera velia , fue descubierto y aislado por primera vez en 2001. El descubrimiento de Chromera velia con una estructura similar a la de los apicomplejos, proporciona un vínculo importante en la historia evolutiva de los apicomplejos y dinófitos. Sus plastidios tienen cuatro membranas, carecen de clorofila cy utilizan la forma tipo II de RuBisCO obtenida de un evento de transferencia horizontal. [54]
Los dinoflagelados son otro grupo muy grande y diverso de protistas , de los cuales aproximadamente la mitad son (al menos parcialmente ) fotosintéticos . [36] [49]
La mayoría de los cloroplastos dinófitos son cloroplastos secundarios derivados de algas rojas . Muchos otros dinófitos han perdido el cloroplasto (convirtiéndose en un tipo de dinoflagelado no fotosintético) o lo han reemplazado a través de una endosimbiosis terciaria [55] , la absorción de otra alga eucariota que contiene un cloroplasto derivado de una alga roja. Otros reemplazaron su cloroplasto original por uno derivado de algas verdes . [19] [35] [49]
La mayoría de los cloroplastos dinófitos contienen la forma II RuBisCO, al menos los pigmentos fotosintéticos clorofila a , clorofila c 2 , betacaroteno y al menos una xantofila exclusiva de los dinófitos ( peridinina , dinoxantina o diadinoxantina ), lo que da a muchos un color marrón dorado. [52] [49] Todos los dinófitos almacenan almidón en su citoplasma y la mayoría tiene cloroplastos con tilacoides dispuestos en pilas de tres. [17]

El cloroplasto dinófito más común es el cloroplasto de tipo peridinina , caracterizado por el pigmento carotenoide peridinina en sus cloroplastos, junto con la clorofila a y la clorofila c 2 . [19] [49] La peridinina no se encuentra en ningún otro grupo de cloroplastos. [49] El cloroplasto de peridinina está limitado por tres membranas (ocasionalmente dos), [17] habiendo perdido la membrana celular original del endosimbionte de algas rojas. [19] [35] La membrana más externa no está conectada al retículo endoplásmico. [17] [49] Contienen un pirenoide y tienen tilacoides apilados en tripletes. El almidón se encuentra fuera del cloroplasto. [17] Una característica importante de estos cloroplastos es que su ADN de cloroplasto está muy reducido y fragmentado en muchos círculos pequeños. La mayor parte del genoma ha migrado al núcleo y sólo quedan en el cloroplasto genes críticos relacionados con la fotosíntesis. [49]
Se cree que el cloroplasto de peridinina es el cloroplasto "original" de los dinófitos, [49] que se ha perdido, reducido, reemplazado o tiene compañía en varios otros linajes de dinófitos. [35]

Los linajes de dinófitos de fucoxantina (incluidos Karlodinium y Karenia ) [35] perdieron su cloroplasto original derivado de algas rojas y lo reemplazaron con un nuevo cloroplasto derivado de un endosimbionte haptofito . Karlodinium y Karenia probablemente adoptaron heterocontofitos diferentes. [35] Debido a que el cloroplasto del haptofito tiene cuatro membranas, se esperaría que la endosimbiosis terciaria creara un cloroplasto de seis membranas, agregando la membrana celular del haptofito y la vacuola fagosómica del dinófito . [57] Sin embargo, el haptofito fue muy reducido, despojado de algunas membranas y su núcleo, dejando solo su cloroplasto (con su doble membrana original), y posiblemente una o dos membranas adicionales a su alrededor. [35] [57]
Los cloroplastos que contienen fucoxantina se caracterizan por tener el pigmento fucoxantina (en realidad 19′-hexanoiloxi-fucoxantina y/o 19′-butanoiloxi-fucoxantina) y no tener peridinina. La fucoxantina también se encuentra en los cloroplastos haptofitos, lo que proporciona evidencia de ascendencia. [49]

Algunos dinófitos, como Kryptoperidinium y Durinskia , [35] tienen un cloroplasto derivado de diatomeas ( heterocontofitos ). [19] Estos cloroplastos están delimitados por hasta cinco membranas, [19] (dependiendo de si todo el endosimbionte de diatomeas se cuenta como cloroplasto, o solo el cloroplasto derivado de algas rojas que se encuentra dentro de él). El endosimbionte de la diatomea se ha reducido relativamente poco: aún conserva sus mitocondrias originales [ 35 ] y tiene retículo endoplasmático , ribosomas , un núcleo y, por supuesto, cloroplastos derivados de algas rojas; prácticamente una célula completa , [58] todo dentro del cuerpo del huésped. Luz del retículo endoplásmico . [35] Sin embargo, el endosimbionte de diatomeas no puede almacenar su propio alimento; su polisacárido de almacenamiento se encuentra en gránulos en el citoplasma del huésped dinófito. [17] [58] El núcleo del endosimbionte de diatomeas está presente, pero probablemente no pueda llamarse nucleomorfo porque no muestra signos de reducción del genoma , e incluso podría haberse expandido . [35] Las diatomeas han sido engullidas por dinoflagelados al menos tres veces. [35]
El endosimbionte de diatomeas está limitado por una sola membrana, [49] en su interior hay cloroplastos con cuatro membranas. Al igual que el ancestro de diatomeas del endosimbionte de diatomeas, los cloroplastos tienen tripletes de tilacoides y pirenoides . [58]
En algunos de estos géneros , los cloroplastos del endosimbionte de diatomeas no son los únicos cloroplastos del dinófito. El cloroplasto de peridinina de tres membranas original todavía existe, convertido en una mancha ocular . [19] [35]
En algunos grupos de protistas mixotróficos , como algunos dinoflagelados (por ejemplo, Dinophysis ), los cloroplastos se separan de un alga capturada y se utilizan temporalmente. Estos cleptocloroplastos pueden tener sólo una vida útil de unos pocos días y luego son reemplazados. [59] [60]
Los miembros del género Dinophysis tienen un cloroplasto que contiene ficobilina [57] extraído de una criptofita . [19] Sin embargo, el criptofito no es un endosimbionte; solo parece que se ha tomado el cloroplasto, y al cloroplasto se le ha despojado de su nucleomorfo y de sus dos membranas más externas, dejando solo un cloroplasto de dos membranas. Los cloroplastos criptofitos requieren su nucleomorfo para mantenerse, y las especies de Dinophysis cultivadas en cultivos celulares por sí solas no pueden sobrevivir, por lo que es posible (pero no confirmado) que el cloroplasto de Dinophysis sea un cleptoplasto ; de ser así, los cloroplastos de Dinophysis se desgastan y las especies de Dinophysis deben engullir continuamente criptofitas para obtener nuevos cloroplastos que reemplacen a los antiguos. [49]
Los cloroplastos, al igual que otros tipos de plastidios , contienen un genoma separado del del núcleo celular . La existencia de ADN del cloroplasto (cpDNA) fue identificada bioquímicamente en 1959, [61] y confirmada por microscopía electrónica en 1962. [62] Los descubrimientos de que el cloroplasto contiene ribosomas [63] y realiza síntesis de proteínas [64] revelaron que el cloroplasto es genéticamente semiautónoma. El ADN de los cloroplastos se secuenció por primera vez en 1986. [65] Desde entonces, se han secuenciado cientos de ADN de cloroplastos de diversas especies , pero en su mayoría son de plantas terrestres y algas verdes : los glaucofitos , las algas rojas y otros grupos de algas están extremadamente subrepresentados. potencialmente introduciendo algún sesgo en las opiniones sobre la estructura y el contenido "típicos" del ADN del cloroplasto. [66]

Con pocas excepciones, la mayoría de los cloroplastos tienen todo su genoma de cloroplasto combinado en una sola molécula de ADN circular grande, [66] típicamente de 120 000 a 170 000 pares de bases de largo. [43] [44] [45] [21] Pueden tener una longitud de contorno de alrededor de 30 a 60 micrómetros y una masa de alrededor de 80 a 130 millones de daltons . [67]
Si bien generalmente se la considera una molécula circular, existe cierta evidencia de que las moléculas de ADN del cloroplasto suelen adoptar una forma lineal . [66] [68]
Muchos ADN de cloroplasto contienen dos repeticiones invertidas , que separan una sección larga de una sola copia (LSC) de una sección corta de una sola copia (SSC). [45] Si bien un par dado de repeticiones invertidas rara vez son completamente idénticos, siempre son muy similares entre sí, aparentemente como resultado de una evolución concertada . [66]
Las repeticiones invertidas varían enormemente en longitud, oscilando entre 4.000 y 25.000 pares de bases de longitud cada una y contienen desde cuatro hasta más de 150 genes. [66] Las repeticiones invertidas en las plantas tienden a estar en el extremo superior de este rango, y cada una tiene entre 20.000 y 25.000 pares de bases de largo. [45] [69]
Las regiones de repetición invertida están altamente conservadas entre las plantas terrestres y acumulan pocas mutaciones. [45] [69] Existen repeticiones invertidas similares en los genomas de las cianobacterias y los otros dos linajes de cloroplastos ( glaucophyta y rhodophyceae ), lo que sugiere que son anteriores al cloroplasto, [66] aunque algunos ADN de cloroplastos se han perdido desde entonces [69] [70] o volteó las repeticiones invertidas (convirtiéndolas en repeticiones directas). [66] Es posible que las repeticiones invertidas ayuden a estabilizar el resto del genoma del cloroplasto, ya que los ADN del cloroplasto que han perdido algunos de los segmentos de repetición invertida tienden a reorganizarse más. [70]
Los nuevos cloroplastos pueden contener hasta 100 copias de su ADN, [43] aunque el número de copias de ADN de los cloroplastos disminuye a aproximadamente 15 a 20 a medida que los cloroplastos envejecen. [71] Por lo general, están empaquetados en nucleoides , que pueden contener varios anillos de ADN de cloroplasto idénticos. En cada cloroplasto se pueden encontrar muchos nucleoides. [67] En las algas rojas primitivas , los nucleoides del ADN del cloroplasto están agrupados en el centro del cloroplasto, mientras que en las plantas verdes y las algas verdes , los nucleoides están dispersos por todo el estroma . [72]
Aunque el ADN del cloroplasto no está asociado con histonas verdaderas , [10] en las algas rojas se han encontrado proteínas similares que empaquetan firmemente cada anillo de ADN del cloroplasto en un nucleoide . [72]
En los cloroplastos del musgo Physcomitrella patens , la proteína de reparación de errores de coincidencia de ADN Msh1 interactúa con las proteínas de reparación recombinacionales RecA y RecG para mantener la estabilidad del genoma del cloroplasto . [73] En los cloroplastos de la planta Arabidopsis thaliana, la proteína RecA mantiene la integridad del ADN del cloroplasto mediante un proceso que probablemente implica la reparación recombinacional del daño del ADN . [74]

El mecanismo de replicación del ADN del cloroplasto (cpDNA) no se ha determinado de manera concluyente, pero se han propuesto dos modelos principales. Los científicos han intentado observar la replicación de los cloroplastos mediante microscopía electrónica desde la década de 1970. [75] [76] Los resultados de los experimentos de microscopía llevaron a la idea de que el ADN del cloroplasto se replica utilizando un bucle de doble desplazamiento (bucle D). A medida que el bucle D se mueve a través del ADN circular, adopta una forma intermedia theta, también conocida como intermediario de replicación de Cairns, y completa la replicación con un mecanismo de círculo rodante. [75] [68] La transcripción comienza en puntos de origen específicos. Se abren múltiples horquillas de replicación, lo que permite que la maquinaria de replicación transcriba el ADN. A medida que continúa la replicación, las bifurcaciones crecen y eventualmente convergen. Las nuevas estructuras de cpDNA se separan, creando cromosomas hijos de cpDNA.
Además de los primeros experimentos de microscopía, este modelo también está respaldado por las cantidades de desaminación observadas en el cpDNA. [75] La desaminación ocurre cuando se pierde un grupo amino y es una mutación que a menudo resulta en cambios de bases. Cuando la adenina se desamina, se convierte en hipoxantina . La hipoxantina puede unirse a la citosina y, cuando el par de bases XC se replica, se convierte en un GC (por lo tanto, un cambio de base A → G). [77]

En cpDNA, hay varios gradientes de desaminación A → G. El ADN se vuelve susceptible a eventos de desaminación cuando es monocatenario. Cuando se forman horquillas de replicación, la hebra que no se copia es monocatenaria y, por lo tanto, corre el riesgo de desaminación A → G. Por lo tanto, los gradientes en la desaminación indican que lo más probable es que estuvieran presentes horquillas de replicación y la dirección en la que se abrieron inicialmente (el gradiente más alto probablemente sea el más cercano al sitio de inicio porque fue monocatenario durante la mayor cantidad de tiempo). [75] Este mecanismo sigue siendo la teoría principal en la actualidad; sin embargo, una segunda teoría sugiere que la mayor parte del ADNc es en realidad lineal y se replica mediante recombinación homóloga. Sostiene además que sólo una minoría del material genético se mantiene en cromosomas circulares, mientras que el resto se encuentra en estructuras ramificadas, lineales u otras estructuras complejas. [75] [68]
Uno de los modelos competitivos para la replicación del cpDNA afirma que la mayor parte del cpDNA es lineal y participa en estructuras de recombinación y replicación homólogas similares a las estructuras de ADN lineales y circulares del bacteriófago T4 . [68] [78] Se ha establecido que algunas plantas tienen cpDNA lineal, como el maíz, y que más especies aún contienen estructuras complejas que los científicos aún no comprenden. [68] Cuando se realizaron los experimentos originales con cpDNA, los científicos notaron estructuras lineales; sin embargo, atribuyeron estas formas lineales a círculos discontinuos. [68] Si las estructuras ramificadas y complejas observadas en los experimentos de cpDNA son reales y no artefactos de ADN circular concatenado o círculos rotos, entonces un mecanismo de replicación de bucle D es insuficiente para explicar cómo se replicarían esas estructuras. [68] Al mismo tiempo, la recombinación homóloga no expande los múltiples gradientes A --> G observados en los plastomas. [75] Debido a que no se ha podido explicar el gradiente de desaminación, así como las numerosas especies de plantas que han demostrado tener ADNcp circular, la teoría predominante continúa sosteniendo que la mayor parte del ADNcp es circular y muy probablemente se replica mediante un mecanismo de bucle D.
El genoma del cloroplasto incluye más comúnmente alrededor de 100 genes [27] [44] que codifican una variedad de cosas, principalmente relacionadas con la tubería de proteínas y la fotosíntesis . Como en los procariotas , los genes del ADN del cloroplasto están organizados en operones . [27] A diferencia de las moléculas de ADN procariotas , las moléculas de ADN del cloroplasto contienen intrones ( el ADN mitocondrial de las plantas también los contiene, pero no el ADNmt humano). [79]
Entre las plantas terrestres, el contenido del genoma del cloroplasto es bastante similar. [45]
Con el tiempo, muchas partes del genoma del cloroplasto se transfirieron al genoma nuclear del huésped, [43] [44] [80] un proceso llamado transferencia endosimbiótica de genes . Como resultado, el genoma del cloroplasto está muy reducido en comparación con el de las cianobacterias de vida libre. Los cloroplastos pueden contener entre 60 y 100 genes, mientras que las cianobacterias suelen tener más de 1.500 genes en su genoma. [81] Recientemente, se encontró un plastidio sin genoma, lo que demuestra que los cloroplastos pueden perder su genoma durante el proceso endosimbiótico de transferencia de genes. [82]
La transferencia endosimbiótica de genes es la forma en que conocemos los cloroplastos perdidos en muchos linajes CASH. Incluso si un cloroplasto finalmente se pierde, los genes que donó al núcleo del antiguo huésped persisten, proporcionando evidencia de la existencia del cloroplasto perdido. Por ejemplo, mientras que las diatomeas (una heterocontofita ) ahora tienen un cloroplasto derivado de algas rojas , la presencia de muchos genes de algas verdes en el núcleo de la diatomea proporciona evidencia de que el ancestro de las diatomeas tuvo un cloroplasto derivado de algas verdes en algún momento, que posteriormente fue reemplazado por el cloroplasto rojo. [47]
En las plantas terrestres, entre el 11% y el 14% del ADN de sus núcleos se remonta al cloroplasto, [42] hasta el 18% en Arabidopsis , lo que corresponde a unos 4.500 genes codificadores de proteínas. [83] Ha habido algunas transferencias recientes de genes del ADN del cloroplasto al genoma nuclear en plantas terrestres. [44]
De las aproximadamente 3.000 proteínas que se encuentran en los cloroplastos, alrededor del 95% están codificadas por genes nucleares. Muchos de los complejos proteicos del cloroplasto constan de subunidades tanto del genoma del cloroplasto como del genoma nuclear del huésped. Como resultado, la síntesis de proteínas debe coordinarse entre el cloroplasto y el núcleo. El cloroplasto está principalmente bajo control nuclear, aunque los cloroplastos también pueden emitir señales que regulan la expresión genética en el núcleo, lo que se denomina señalización retrógrada . [84] Investigaciones recientes indican que partes de la red de señalización retrógrada que alguna vez se consideraron características de las plantas terrestres ya surgieron en un progenitor de algas, [85] [86] [87] integrándose en cohortes de genes coexpresados en los parientes de algas terrestres más cercanos. plantas. [88]
La síntesis de proteínas dentro de los cloroplastos se basa en dos ARN polimerasas . Uno está codificado por el ADN del cloroplasto, el otro es de origen nuclear . Las dos ARN polimerasas pueden reconocer y unirse a diferentes tipos de promotores dentro del genoma del cloroplasto. [89] Los ribosomas de los cloroplastos son similares a los ribosomas bacterianos. [90]
Debido a que tantos genes del cloroplasto se han trasladado al núcleo, muchas proteínas que originalmente se habrían traducido en el cloroplasto ahora se sintetizan en el citoplasma de la célula vegetal. Estas proteínas deben dirigirse de regreso al cloroplasto e importarse a través de al menos dos membranas del cloroplasto. [91]
Curiosamente, alrededor de la mitad de los productos proteicos de los genes transferidos ni siquiera regresan al cloroplasto. Muchos se convirtieron en exaptaciones , asumiendo nuevas funciones como participar en la división celular , el transporte de proteínas e incluso la resistencia a enfermedades . Unos pocos genes del cloroplasto encontraron nuevos hogares en el genoma mitocondrial ; la mayoría se convirtieron en pseudogenes no funcionales , aunque algunos genes de ARNt todavía funcionan en la mitocondria . [81] Algunos productos proteicos del ADN del cloroplasto transferidos se dirigen a la vía secretora , [81] aunque muchos plastidios secundarios están limitados por una membrana más externa derivada de la membrana celular del huésped y, por lo tanto, topológicamente fuera de la célula para llegar al cloroplasto desde el citosol , se debe atravesar la membrana celular , lo que significa la entrada al espacio extracelular . En esos casos, las proteínas dirigidas al cloroplasto viajan inicialmente a lo largo de la vía secretora. [35]
Debido a que la célula que adquiría un cloroplasto ya tenía mitocondrias (y peroxisomas y una membrana celular para la secreción), el nuevo huésped del cloroplasto tuvo que desarrollar un sistema único de direccionamiento de proteínas para evitar que las proteínas del cloroplasto se enviaran al orgánulo equivocado . [91]
![Los dos extremos de un polipéptido se denominan extremo N o extremo amino y extremo C o extremo carboxilo.[92] Este polipéptido tiene cuatro aminoácidos unidos entre sí. A la izquierda está el extremo N, con su grupo amino (H2N) en verde. El extremo C azul, con su grupo carboxilo (CO2H), está a la derecha.](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c0/Tetrapeptide_structural_formulae.svg/370px-Tetrapeptide_structural_formulae.svg.png)
En la mayoría de los casos, pero no en todos, las proteínas del cloroplasto codificadas en el núcleo se traducen con un péptido de tránsito escindible que se agrega al extremo N del precursor de la proteína. A veces, la secuencia de tránsito se encuentra en el extremo C de la proteína [93] o dentro de la parte funcional de la proteína. [91]
Después de que un polipéptido del cloroplasto se sintetiza en un ribosoma en el citosol , una enzima específica de las proteínas del cloroplasto [94] fosforila o agrega un grupo fosfato a muchas (pero no a todas) de ellas en sus secuencias de tránsito. [91] La fosforilación ayuda a que muchas proteínas se unan al polipéptido, evitando que se pliegue prematuramente. [91] Esto es importante porque evita que las proteínas del cloroplasto asuman su forma activa y lleven a cabo sus funciones de cloroplasto en el lugar equivocado: el citosol . [95] [96] Al mismo tiempo, deben mantener la forma suficiente para que puedan ser reconocidos por el cloroplasto. [95] Estas proteínas también ayudan a que el polipéptido se importe al cloroplasto. [91]
Desde aquí, las proteínas del cloroplasto unidas al estroma deben pasar a través de dos complejos proteicos: el complejo TOC , o translocón en la membrana externa del cloroplasto , y el translocón TIC , o translocón en la membrana interna del cloroplasto . [91] Las cadenas polipeptídicas del cloroplasto probablemente a menudo viajan a través de los dos complejos al mismo tiempo, pero el complejo TIC también puede recuperar preproteínas perdidas en el espacio intermembrana . [91]
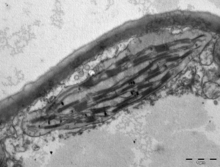
En las plantas terrestres , los cloroplastos generalmente tienen forma de lente, de 3 a 10 μm de diámetro y de 1 a 3 μm de espesor. [97] [21] Los cloroplastos de las plántulas de maíz tienen un volumen de ≈20 µm 3 . [21] Existe una mayor diversidad en las formas de los cloroplastos entre las algas , que a menudo contienen un solo cloroplasto [17] que puede tener la forma de una red (p. ej., Oedogonium ), [98] una copa (p. ej., Chlamydomonas ), [99] una espiral en forma de cinta alrededor de los bordes de la célula (p. ej., Spirogyra ), [100] o bandas ligeramente retorcidas en los bordes de la célula (p. ej., Sirogonium ). [101] Algunas algas tienen dos cloroplastos en cada célula; tienen forma de estrella en Zygnema , [102] o pueden seguir la forma de la mitad de la célula en el orden Desmidiales . [103] En algunas algas, el cloroplasto ocupa la mayor parte de la célula, con bolsas para el núcleo y otros orgánulos; [17] por ejemplo, algunas especies de Chlorella tienen un cloroplasto en forma de copa que ocupa gran parte de la célula. [104]
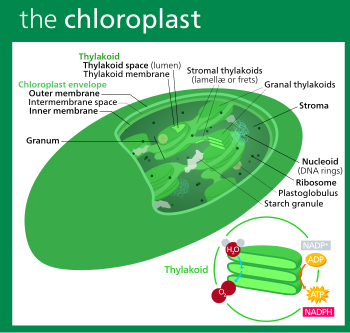
Todos los cloroplastos tienen al menos tres sistemas de membranas: la membrana externa del cloroplasto, la membrana interna del cloroplasto y el sistema tilacoide . Los cloroplastos que son producto de una endosimbiosis secundaria pueden tener membranas adicionales que rodean a estos tres. [46] Dentro de las membranas externa e interna del cloroplasto se encuentra el estroma del cloroplasto , un líquido semigel [33] que constituye gran parte del volumen de un cloroplasto y en el que flota el sistema tilacoide.
Existen algunos conceptos erróneos comunes sobre las membranas externa e interna del cloroplasto. El hecho de que los cloroplastos estén rodeados por una doble membrana se cita a menudo como prueba de que son descendientes de cianobacterias endosimbióticas . Esto a menudo se interpreta en el sentido de que la membrana externa del cloroplasto es el producto del plegamiento de la membrana celular del huésped para formar una vesícula que rodea a la cianobacteria ancestral ; lo cual no es cierto: ambas membranas del cloroplasto son homólogas a las membranas dobles originales de la cianobacteria. [19]
La doble membrana del cloroplasto también se compara a menudo con la doble membrana mitocondrial . Esta no es una comparación válida: la membrana interna de las mitocondrias se utiliza para hacer funcionar bombas de protones y llevar a cabo la fosforilación oxidativa para generar energía ATP . La única estructura del cloroplasto que puede considerarse análoga es el sistema tilacoide interno. Aun así, en términos de "entrada-salida", la dirección del flujo de iones H + del cloroplasto es opuesta a la fosforilación oxidativa en las mitocondrias. [33] [105] Además, en términos de función, la membrana interna del cloroplasto, que regula el paso de metabolitos y sintetiza algunos materiales, no tiene contraparte en la mitocondria. [33]
La membrana exterior del cloroplasto es una membrana semiporosa a través de la cual pequeñas moléculas e iones pueden difundir fácilmente. [106] Sin embargo, no es permeable a proteínas más grandes , por lo que los polipéptidos del cloroplasto que se sintetizan en el citoplasma celular deben ser transportados a través de la membrana externa del cloroplasto por el complejo TOC , o translocón en la membrana externa del cloroplasto . [91]
Las membranas del cloroplasto a veces sobresalen hacia el citoplasma, formando un estrómulo o un túbulo que contiene un estrómulo . Los estrómulos son muy raros en los cloroplastos y son mucho más comunes en otros plastidios como los cromoplastos y los amiloplastos en los pétalos y las raíces, respectivamente. [107] [108] Pueden existir para aumentar el área de superficie del cloroplasto para el transporte a través de la membrana, porque a menudo están ramificados y enredados con el retículo endoplásmico . [109] Cuando se observaron por primera vez en 1962, algunos biólogos vegetales descartaron las estructuras como artefactos, afirmando que los estrómulos eran simplemente cloroplastos de formas extrañas con regiones constreñidas o cloroplastos divididos . [110] Sin embargo, existe un creciente cuerpo de evidencia de que los estrómulos son características funcionales e integrales de los plastidios de las células vegetales, no simplemente artefactos. [111]

Por lo general, existe un espacio intermembrana delgado de aproximadamente 10 a 20 nanómetros de espesor entre las membranas externa e interna del cloroplasto. [112]
Los cloroplastos de algas glaucofitas tienen una capa de peptidoglicano entre las membranas del cloroplasto. Corresponde a la pared celular de peptidoglicano de sus ancestros cianobacterianos , que se encuentra entre sus dos membranas celulares. Estos cloroplastos se llaman muroplastos (del latín "mura" , que significa "pared"). Se suponía que otros cloroplastos habían perdido la pared cianobacteriana, dejando un espacio intermembrana entre las dos membranas de la envoltura del cloroplasto, [33] pero desde entonces se ha encontrado también en musgos, licófitos y helechos. [113]
La membrana interna del cloroplasto bordea el estroma y regula el paso de materiales dentro y fuera del cloroplasto. Después de pasar a través del complejo TOC en la membrana externa del cloroplasto, los polipéptidos deben pasar a través del complejo TIC ( translocón en la membrana interna del cloroplasto ) que se encuentra en la membrana interna del cloroplasto. [91]
Además de regular el paso de materiales, la membrana interna del cloroplasto es donde se sintetizan los ácidos grasos , lípidos y carotenoides . [33]
Algunos cloroplastos contienen una estructura llamada retículo periférico de cloroplasto . [112] A menudo se encuentra en los cloroplastos de las plantas C 4 , aunque también se ha encontrado en algunas angiospermas C 3 , [33] e incluso en algunas gimnospermas . [114] El retículo periférico del cloroplasto consiste en un laberinto de tubos membranosos y vesículas continuas con la membrana interna del cloroplasto que se extiende hacia el líquido estromal interno del cloroplasto. Se cree que su propósito es aumentar la superficie del cloroplasto para el transporte a través de la membrana entre su estroma y el citoplasma celular . Las pequeñas vesículas que a veces se observan pueden servir como vesículas de transporte para transportar material entre los tilacoides y el espacio intermembrana. [115]
El líquido acuoso, [33] alcalino y [105] rico en proteínas que se encuentra dentro de la membrana interna del cloroplasto y fuera del espacio tilacoide se llama estroma, [33] que corresponde al citosol de la cianobacteria original . En él se pueden encontrar nucleoides del ADN del cloroplasto , ribosomas del cloroplasto , el sistema tilacoide con plastoglóbulos , gránulos de almidón y muchas proteínas . En el estroma tiene lugar el ciclo de Calvin , que fija el CO 2 en G3P .
Los cloroplastos tienen sus propios ribosomas, que utilizan para sintetizar una pequeña fracción de sus proteínas. Los ribosomas de cloroplasto tienen aproximadamente dos tercios del tamaño de los ribosomas citoplasmáticos (alrededor de 17 nm frente a 25 nm ). [112] Toman ARNm transcritos del ADN del cloroplasto y los traducen en proteínas. Si bien es similar a los ribosomas bacterianos , [10] la traducción del cloroplasto es más compleja que en las bacterias, por lo que los ribosomas del cloroplasto incluyen algunas características únicas del cloroplasto. [116] [117]
Los ARN ribosómicos de subunidades pequeñas en varios cloroplastos de Chlorophyta y euglénidos carecen de motivos para el reconocimiento de la secuencia de Shine-Dalgarno , [118] que se considera esencial para el inicio de la traducción en la mayoría de los cloroplastos y procariotas . [119] [120] Esta pérdida también se observa raramente en otros plastidios y procariotas. [118] [121] Un ARNr 4.5S adicional con homología con la cola 3' de 23S se encuentra en plantas "superiores". [117]
Plastoglobuli ( plastoglobulus singular , a veces escrito plastoglóbulo(s) ), son burbujas esféricas de lípidos y proteínas [33] de aproximadamente 45 a 60 nanómetros de ancho. [122] Están rodeados por una monocapa lipídica. [122] Los plastoglobuli se encuentran en todos los cloroplastos, [112] pero se vuelven más comunes cuando el cloroplasto está bajo estrés oxidativo , [122] o cuando envejece y se convierte en gerontoplasto . [33] Los plastoglóbulos también exhiben una mayor variación de tamaño en estas condiciones. [122] También son comunes en los etioplastos , pero su número disminuye a medida que los etioplastos maduran y se convierten en cloroplastos. [122]
Los plastoglobuli contienen proteínas estructurales y enzimas implicadas en la síntesis y el metabolismo de los lípidos . Contienen muchos tipos de lípidos, incluidos plastoquinona , vitamina E , carotenoides y clorofilas . [122]
Alguna vez se pensó que los plastoglobulos flotaban libremente en el estroma , pero ahora se cree que están unidos permanentemente a un tilacoide o a otro plastoglobulo unido a un tilacoide, una configuración que permite que un plastoglobulo intercambie su contenido con la red de tilacoide. . [122] En los cloroplastos verdes normales, la gran mayoría de los plastoglóbulos se presentan de forma singular, unidos directamente a su tilacoide original. En los cloroplastos viejos o estresados, los plastoglobuli tienden a presentarse en grupos o cadenas enlazadas, todavía siempre ancladas a un tilacoide. [122]
Los plastoglóbulos se forman cuando aparece una burbuja entre las capas de la bicapa lipídica de la membrana tilacoide, o brotan de los plastoglóbulos existentes, aunque nunca se desprenden ni flotan hacia el estroma. [122] Prácticamente todos los plastoglóbulos se forman en o cerca de los bordes muy curvados de los discos o láminas de tilacoides . También son más comunes en los tilacoides del estroma que en los granales . [122]
Los gránulos de almidón son muy comunes en los cloroplastos y normalmente ocupan el 15% del volumen del orgánulo, [123] aunque en algunos otros plastidios, como los amiloplastos , pueden ser lo suficientemente grandes como para distorsionar la forma del orgánulo. [112] Los gránulos de almidón son simplemente acumulaciones de almidón en el estroma y no están limitados por una membrana. [112]
Los gránulos de almidón aparecen y crecen a lo largo del día, a medida que el cloroplasto sintetiza azúcares , y se consumen por la noche para alimentar la respiración y continuar la exportación de azúcar al floema , [124] aunque en los cloroplastos maduros, es raro que un gránulo de almidón se consuma por completo. o que se acumule un nuevo gránulo. [123]
Los gránulos de almidón varían en composición y ubicación entre diferentes linajes de cloroplastos. En las algas rojas , los gránulos de almidón se encuentran en el citoplasma y no en el cloroplasto. [125] En las plantas C 4 , los cloroplastos mesófilos , que no sintetizan azúcares, carecen de gránulos de almidón. [33]
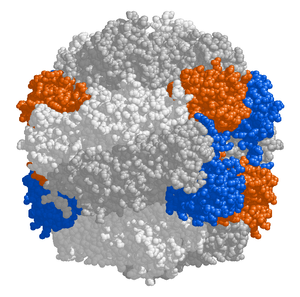
El estroma del cloroplasto contiene muchas proteínas, aunque la más común e importante es RuBisCO , que probablemente también sea la proteína más abundante del planeta. [105] RuBisCO es la enzima que fija el CO 2 en moléculas de azúcar. En las plantas C 3 , RuBisCO es abundante en todos los cloroplastos, aunque en las plantas C 4 está confinado a los cloroplastos de la vaina del haz , donde se lleva a cabo el ciclo de Calvin en las plantas C 4 . [126]
Los cloroplastos de algunos hornworts [127] y algas contienen estructuras llamadas pirenoides . No se encuentran en plantas superiores. [128] Los pirenoides son cuerpos aproximadamente esféricos y altamente refractivos que son un sitio de acumulación de almidón en las plantas que los contienen. Consisten en una matriz opaca a los electrones, rodeada por dos placas hemisféricas de almidón. El almidón se acumula a medida que maduran los pirenoides. [129] En las algas con mecanismos de concentración de carbono , la enzima RuBisCO se encuentra en los pirenoides. El almidón también puede acumularse alrededor de los pirenoides cuando el CO 2 es escaso. [128] Los pirenoides pueden dividirse para formar nuevos pirenoides o producirse "de novo" . [129] [130]

Los tilacoides (a veces escritos tilacoides ), [132] son pequeños sacos interconectados que contienen las membranas en las que tienen lugar las reacciones luminosas de la fotosíntesis. La palabra tilacoide proviene del griego thylakos que significa "saco". [133]
Suspendido dentro del estroma del cloroplasto está el sistema tilacoide , una colección altamente dinámica de sacos membranosos llamados tilacoides donde se encuentra la clorofila y ocurren las reacciones luminosas de la fotosíntesis . [16] En la mayoría de los cloroplastos de plantas vasculares , los tilacoides están dispuestos en pilas llamadas grana, [134] aunque en ciertos cloroplastos de plantas C 4 [126] y en algunos cloroplastos de algas , los tilacoides flotan libremente. [17]

Usando un microscopio óptico , apenas es posible ver pequeños gránulos verdes, que recibieron el nombre de grana . [112] Con microscopía electrónica , fue posible ver el sistema de tilacoides con más detalle, revelando que consiste en pilas de tilacoides planos que formaban el grana, y largos tilacoides estromales interconectados que unían diferentes grana. [112] En el microscopio electrónico de transmisión , las membranas tilacoides aparecen como bandas alternas de luz y oscuridad, de 8,5 nanómetros de espesor. [112]
Se ha cuestionado la estructura tridimensional del sistema de membrana tilacoide. Se han propuesto muchos modelos, siendo el más frecuente el modelo helicoidal , en el que las pilas de tilacoides granum están envueltas por tilacoides estromales helicoidales. [135] Otro modelo conocido como el 'modelo de bifurcación', que se basó en el primer estudio de tomografía electrónica de las membranas tilacoides de las plantas, representa las membranas estromales como amplias láminas laminares perpendiculares a las columnas de grana que se bifurcan en múltiples discos paralelos que forman el granum- ensamblaje del estroma. [136] El modelo helicoidal fue respaldado por varios trabajos adicionales, [134] [137] pero finalmente se determinó en 2019 que las características de los modelos helicoidales y de bifurcación se consolidan mediante uniones de membranas helicoidales izquierdas recientemente descubiertas. [131] Probablemente por facilidad, el sistema tilacoide todavía se representa comúnmente en modelos más antiguos de "eje y radios" donde los grana están conectados entre sí mediante tubos de tilacoides estromales. [138]
Grana consiste en pilas de tilacoides granales circulares aplanados que se asemejan a panqueques. Cada granum puede contener entre dos y cien tilacoides, [112] aunque los grana con 10 a 20 tilacoides son los más comunes. [134] Envueltos alrededor de la grana hay múltiples tilacoides estromales helicoidales derechos paralelos, también conocidos como trastes o tilacoides laminares. Las hélices ascienden en un ángulo de aproximadamente 20° y se conectan a cada tilacoide granal en una unión de hendidura en forma de puente. [134] [137] [131]
Las laminillas del estroma se extienden como grandes láminas perpendiculares a las columnas de grana. Estas láminas están conectadas a las hélices derechas directamente o mediante bifurcaciones que forman superficies de membrana helicoidales izquierdas. [131] Las superficies helicoidales izquierdas tienen un ángulo de inclinación similar al de las hélices derechas (~20°), pero ¼ del paso. Aproximadamente 4 uniones helicoidales a izquierdas están presentes por granum, lo que da como resultado una matriz de tono equilibrado de superficies de membrana helicoidales a derechas e izquierdas de diferentes radios y pasos que consolidan la red con energías superficiales y de flexión mínimas. [131] Si bien diferentes partes del sistema tilacoide contienen diferentes proteínas de membrana, las membranas tilacoides son continuas y el espacio tilacoide que encierran forma un único laberinto continuo. [134]
Incrustados en las membranas de los tilacoides se encuentran importantes complejos proteicos que llevan a cabo las reacciones luminosas de la fotosíntesis . El fotosistema II y el fotosistema I contienen complejos captadores de luz con clorofila y carotenoides que absorben la energía luminosa y la utilizan para energizar los electrones. Las moléculas de la membrana tilacoide utilizan los electrones energizados para bombear iones de hidrógeno al espacio tilacoide, disminuyendo el pH y volviéndolo ácido. La ATP sintasa es un gran complejo proteico que aprovecha el gradiente de concentración de los iones de hidrógeno en el espacio tilacoide para generar energía ATP a medida que los iones de hidrógeno regresan al estroma, de forma muy similar a una turbina de presa. [105]
Hay dos tipos de tilacoides: los tilacoides granales, que están dispuestos en la grana, y los tilacoides estromales, que están en contacto con el estroma . Los tilacoides granales son discos circulares en forma de panqueque de unos 300 a 600 nanómetros de diámetro. Los tilacoides del estroma son láminas helicoidales que giran en espiral alrededor de la grana. [134] Las partes superiores e inferiores planas de los tilacoides granales contienen sólo el complejo proteico del fotosistema II, relativamente plano. Esto les permite apilarse firmemente, formando grana con muchas capas de membrana fuertemente adprimida, llamada membrana granal, lo que aumenta la estabilidad y la superficie para capturar la luz. [134]
Por el contrario, el fotosistema I y la ATP sintasa son grandes complejos proteicos que sobresalen del estroma. No pueden caber en las membranas granales adpresas, por lo que se encuentran en la membrana tilacoide estromal (los bordes de los discos tilacoides granales y los tilacoides estromales). Estos grandes complejos proteicos pueden actuar como espaciadores entre las láminas de tilacoides del estroma. [134]
La exposición a la luz influye en el número de tilacoides y en el área total de tilacoides de un cloroplasto. Los cloroplastos sombreados contienen más grana y más grande con más área de membrana tilacoide que los cloroplastos expuestos a luz brillante, que tienen menos grana y menos área de tilacoide. La extensión de los tilacoides puede cambiar a los pocos minutos de la exposición a la luz o de su eliminación. [115]
Dentro de los fotosistemas incrustados en las membranas tilacoides del cloroplasto se encuentran varios pigmentos fotosintéticos que absorben y transfieren energía luminosa . Los tipos de pigmentos que se encuentran son diferentes en varios grupos de cloroplastos y son responsables de una amplia variedad de coloraciones de cloroplastos.
La clorofila a se encuentra en todos los cloroplastos, así como en sus ancestros cianobacterianos . La clorofila a es un pigmento azul verdoso [139] parcialmente responsable de dar su color a la mayoría de las cianobacterias y cloroplastos. Existen otras formas de clorofila, como los pigmentos accesorios clorofila b , clorofila c , clorofila d , [17] y clorofila f .
La clorofila b es un pigmento verde oliva que se encuentra únicamente en los cloroplastos de las plantas , las algas verdes , cualquier cloroplasto secundario obtenido a través de la endosimbiosis secundaria de un alga verde y algunas cianobacterias . [17] Son las clorofilas a y b juntas las que hacen que la mayoría de los cloroplastos de plantas y algas verdes sean verdes. [139]
La clorofila c se encuentra principalmente en cloroplastos endosimbióticos secundarios que se originaron a partir de un alga roja , aunque no se encuentra en los cloroplastos de las algas rojas propiamente dichas. La clorofila c también se encuentra en algunas algas verdes y cianobacterias . [17]
Las clorofilas d y f son pigmentos que se encuentran sólo en algunas cianobacterias. [17] [140]
![Delesseria sanguinea, un alga roja, tiene cloroplastos que contienen pigmentos rojos como la ficoeriterina que enmascaran su clorofila a azul verdosa.[36]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/19/Delesseria_sanguinea_Helgoland.JPG/440px-Delesseria_sanguinea_Helgoland.JPG)
Además de las clorofilas , en los fotosistemas también se encuentra otro grupo de pigmentos amarillo - naranja [139] llamados carotenoides . Hay una treintena de carotenoides fotosintéticos. [141] Ayudan a transferir y disipar el exceso de energía, [17] y sus colores brillantes a veces anulan el verde de la clorofila, como durante el otoño , cuando las hojas de algunas plantas terrestres cambian de color. [142] El β-caroteno es un carotenoide de color rojo anaranjado brillante que se encuentra en casi todos los cloroplastos, como la clorofila a . [17] Las xantofilas , especialmente la zeaxantina de color rojo anaranjado , también son comunes. [141] Existen muchas otras formas de carotenoides que solo se encuentran en ciertos grupos de cloroplastos. [17]
Las ficobilinas son un tercer grupo de pigmentos que se encuentran en las cianobacterias y en los cloroplastos de glaucofitos , algas rojas y criptofitos . [17] [143] Las ficobilinas vienen en todos los colores, aunque la ficoeriterina es uno de los pigmentos que hace que muchas algas rojas sean rojas. [144] Las ficobilinas a menudo se organizan en complejos proteicos relativamente grandes de unos 40 nanómetros de diámetro llamados ficobilisomas . [17] Al igual que el fotosistema I y la ATP sintasa , los ficobilisomas sobresalen del estroma, impidiendo el apilamiento de tilacoides en los cloroplastos de las algas rojas. [17] Los cloroplastos criptofitos y algunas cianobacterias no tienen sus pigmentos de ficobilina organizados en ficobilisomas y, en cambio, los mantienen en su espacio tilacoide. [17]
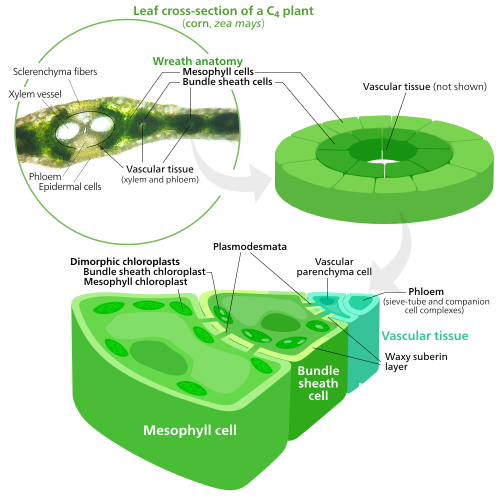
Para fijar dióxido de carbono en moléculas de azúcar en el proceso de fotosíntesis , los cloroplastos utilizan una enzima llamada RuBisCO . RuBisCO tiene problemas para distinguir entre dióxido de carbono y oxígeno , por lo que en altas concentraciones de oxígeno, RuBisCO comienza a agregar oxígeno accidentalmente a los precursores del azúcar. Esto tiene como resultado el desperdicio de energía ATP y la liberación de CO 2 , todo ello sin que se produzca azúcar. Este es un gran problema, ya que el O 2 se produce por las reacciones luminosas iniciales de la fotosíntesis, lo que provoca problemas en el futuro en el ciclo de Calvin que utiliza RuBisCO. [145]
Las plantas C 4 desarrollaron una manera de resolver esto: separando espacialmente las reacciones luminosas y el ciclo de Calvin. Las reacciones luminosas, que almacenan energía luminosa en ATP y NADPH , se realizan en las células del mesófilo de una hoja C 4 . El ciclo de Calvin, que utiliza la energía almacenada para producir azúcar usando RuBisCO, se realiza en el haz de células de la vaina , una capa de células que rodea una vena de una hoja . [145]
Como resultado, los cloroplastos de las células del mesófilo C 4 y de las células de la vaina del haz están especializados para cada etapa de la fotosíntesis. En las células del mesófilo, los cloroplastos están especializados en las reacciones luminosas, por lo que carecen de RuBisCO y tienen grana y tilacoides normales , [126] que utilizan para producir ATP y NADPH, así como oxígeno. Almacenan CO 2 en un compuesto de cuatro carbonos, por lo que el proceso se llama fotosíntesis C 4 . Luego, el compuesto de cuatro carbonos se transporta a los cloroplastos de la vaina del haz, donde desprende CO 2 y regresa al mesófilo. Los cloroplastos de la vaina del haz no llevan a cabo reacciones luminosas, lo que impide que se acumule oxígeno en ellos y se interrumpa la actividad de RuBisCO. [145] Debido a esto, carecen de tilacoides organizados en pilas de grana , aunque los cloroplastos de la vaina del haz todavía tienen tilacoides que flotan libremente en el estroma donde todavía llevan a cabo el flujo cíclico de electrones , un método impulsado por la luz para sintetizar ATP para impulsar el ciclo de Calvin. sin generar oxígeno. Carecen del fotosistema II y solo tienen el fotosistema I , el único complejo proteico necesario para el flujo cíclico de electrones. [126] [145] Debido a que el trabajo de los cloroplastos de la vaina del haz es llevar a cabo el ciclo de Calvin y producir azúcar, a menudo contienen grandes granos de almidón . [126]
Ambos tipos de cloroplasto contienen grandes cantidades de retículo periférico de cloroplasto , [126] que utilizan para obtener más superficie para transportar cosas dentro y fuera de ellos. [114] [115] Los cloroplastos del mesófilo tienen un retículo un poco más periférico que los cloroplastos de la vaina del haz. [146]
No todas las células de una planta multicelular contienen cloroplastos. Todas las partes verdes de una planta contienen cloroplastos; los cloroplastos, o más específicamente, la clorofila que contienen, son los que hacen que las partes fotosintéticas de una planta sean verdes. [16] Las células vegetales que contienen cloroplastos suelen ser células de parénquima , aunque los cloroplastos también se pueden encontrar en el tejido del colénquima . [147] Una célula vegetal que contiene cloroplastos se conoce como célula de clorénquima . Una célula de clorénquima típica de una planta terrestre contiene entre 10 y 100 cloroplastos.

En algunas plantas, como los cactus , los cloroplastos se encuentran en los tallos , [148] aunque en la mayoría de las plantas, los cloroplastos se concentran en las hojas . Un milímetro cuadrado de tejido foliar puede contener medio millón de cloroplastos. [16] Dentro de una hoja, los cloroplastos se encuentran principalmente en las capas del mesófilo de una hoja y en las células protectoras de los estomas . Las células del mesófilo en empalizada pueden contener entre 30 y 70 cloroplastos por célula, mientras que las células protectoras estomáticas contienen sólo entre 8 y 15 por célula, así como mucha menos clorofila . Los cloroplastos también se pueden encontrar en las células de la vaina del haz de una hoja, especialmente en las plantas C 4 , que llevan a cabo el ciclo de Calvin en sus células de la vaina del haz. A menudo están ausentes de la epidermis de una hoja. [149]
Los cloroplastos de las células de plantas y algas pueden orientarse para adaptarse mejor a la luz disponible. En condiciones de poca luz, se extenderán formando una lámina, maximizando la superficie para absorber la luz. Bajo una luz intensa, buscarán refugio alineándose en columnas verticales a lo largo de la pared celular de la célula vegetal o girando hacia los lados para que la luz los golpee de canto. Esto reduce la exposición y los protege del daño fotooxidativo. [150] Esta capacidad de distribuir cloroplastos para que puedan refugiarse uno detrás del otro o extenderse puede ser la razón por la cual las plantas terrestres evolucionaron para tener muchos cloroplastos pequeños en lugar de unos pocos grandes. [151] El movimiento de los cloroplastos se considera uno de los sistemas de estímulo-respuesta más estrechamente regulados que se pueden encontrar en las plantas. [152] También se ha observado que las mitocondrias siguen a los cloroplastos a medida que se mueven. [153]
En las plantas superiores, el movimiento de los cloroplastos está dirigido por las fototropinas , fotorreceptores de luz azul también responsables del fototropismo de las plantas . En algunas algas, musgos , helechos y plantas con flores , el movimiento de los cloroplastos está influenciado por la luz roja además de la luz azul, [150] aunque longitudes de onda rojas muy largas inhiben el movimiento en lugar de acelerarlo. La luz azul generalmente hace que los cloroplastos busquen refugio, mientras que la luz roja los atrae para maximizar la absorción de la luz. [153]
Los estudios de Vallisneria gigantea , una planta acuática con flores , han demostrado que los cloroplastos pueden ponerse en movimiento cinco minutos después de la exposición a la luz, aunque inicialmente no muestran ninguna direccionalidad neta. Pueden moverse a lo largo de pistas de microfilamentos , y el hecho de que la malla de microfilamentos cambie de forma para formar una estructura de panal que rodea los cloroplastos después de que se hayan movido sugiere que los microfilamentos pueden ayudar a anclar los cloroplastos en su lugar. [152] [153]
A diferencia de la mayoría de las células epidérmicas, las células protectoras de los estomas de las plantas contienen cloroplastos relativamente bien desarrollados. [149] Sin embargo, lo que hacen exactamente es controvertido. [154]
Las plantas carecen de células inmunitarias especializadas : todas las células vegetales participan en la respuesta inmunitaria de la planta . Los cloroplastos, junto con el núcleo , la membrana celular y el retículo endoplasmático , [155] son actores clave en la defensa contra patógenos . Debido a su papel en la respuesta inmune de las células vegetales, los patógenos con frecuencia se dirigen al cloroplasto. [155]
Las plantas tienen dos respuestas inmunes principales: la respuesta hipersensible , en la que las células infectadas se sellan y sufren una muerte celular programada , y la resistencia sistémica adquirida , donde las células infectadas liberan señales que advierten al resto de la planta de la presencia de un patógeno. Los cloroplastos estimulan ambas respuestas dañando intencionalmente su sistema fotosintético, produciendo especies reactivas de oxígeno . Los altos niveles de especies reactivas de oxígeno causarán la respuesta hipersensible . Las especies reactivas de oxígeno también matan directamente cualquier patógeno dentro de la célula. Los niveles más bajos de especies reactivas de oxígeno inician una resistencia sistémica adquirida , lo que desencadena la producción de moléculas de defensa en el resto de la planta. [155]
En algunas plantas, se sabe que los cloroplastos se acercan al sitio de la infección y al núcleo durante una infección. [155]
Los cloroplastos pueden servir como sensores celulares. Después de detectar estrés en una célula, que podría deberse a un patógeno, los cloroplastos comienzan a producir moléculas como ácido salicílico , ácido jasmónico , óxido nítrico y especies reactivas de oxígeno que pueden servir como señales de defensa. Como señales celulares, las especies reactivas de oxígeno son moléculas inestables, por lo que probablemente no abandonan el cloroplasto, sino que transmiten su señal a una molécula segunda mensajera desconocida. Todas estas moléculas inician señales retrógradas : señales del cloroplasto que regulan la expresión genética en el núcleo. [155]
Además de la señalización de defensa, los cloroplastos, con la ayuda de los peroxisomas , [156] ayudan a sintetizar una importante molécula de defensa, el jasmonato . Los cloroplastos sintetizan todos los ácidos grasos de una célula vegetal [155] [157] ; el ácido linoleico , un ácido graso, es un precursor del jasmonato. [155]
Una de las principales funciones del cloroplasto es su papel en la fotosíntesis , el proceso por el cual la luz se transforma en energía química, para posteriormente producir alimentos en forma de azúcares . En la fotosíntesis se utilizan agua (H 2 O) y dióxido de carbono (CO 2 ), y se produce azúcar y oxígeno (O 2 ) utilizando energía luminosa . La fotosíntesis se divide en dos etapas: las reacciones luminosas , en las que el agua se divide para producir oxígeno, y las reacciones oscuras , o ciclo de Calvin , en las que se forman moléculas de azúcar a partir de dióxido de carbono. Las dos fases están unidas por los transportadores de energía trifosfato de adenosina (ATP) y fosfato de dinucleótido de nicotinamida y adenina (NADP + ). [158] [159]

Las reacciones luminosas tienen lugar en las membranas de tilacoides. Toman energía luminosa y la almacenan en NADPH , una forma de NADP + , y ATP para alimentar las reacciones oscuras .
El ATP es la versión fosforilada del difosfato de adenosina (ADP), que almacena energía en una célula y potencia la mayoría de las actividades celulares. El ATP es la forma energizada, mientras que el ADP es la forma (parcialmente) agotada. NADP + es un transportador de electrones que transporta electrones de alta energía. En las reacciones luminosas, se reduce , lo que significa que capta electrones y se convierte en NADPH .
Al igual que las mitocondrias, los cloroplastos utilizan la energía potencial almacenada en un gradiente de H + , o ion hidrógeno, para generar energía ATP. Los dos fotosistemas capturan energía luminosa para energizar electrones tomados del agua y los liberan a lo largo de una cadena de transporte de electrones . Las moléculas entre los fotosistemas aprovechan la energía de los electrones para bombear iones de hidrógeno al espacio tilacoide, creando un gradiente de concentración , con más iones de hidrógeno (hasta mil veces más) [105] dentro del sistema tilacoide que en el estroma. Los iones de hidrógeno en el espacio tilacoide luego se difunden nuevamente según su gradiente de concentración y regresan al estroma a través de la ATP sintasa . La ATP sintasa utiliza la energía de los iones de hidrógeno que fluyen para fosforilar el difosfato de adenosina en trifosfato de adenosina o ATP. [105] [160] Debido a que la ATP sintasa del cloroplasto se proyecta hacia el estroma, el ATP se sintetiza allí, en posición para ser utilizado en las reacciones oscuras. [161]
A menudo se eliminan electrones de las cadenas de transporte de electrones para cargar el NADP + con electrones, reduciéndolo a NADPH . Al igual que la ATP sintasa, la ferredoxina-NADP + reductasa , la enzima que reduce la NADP + , libera el NADPH que produce en el estroma, justo donde se necesita para las reacciones oscuras. [161]
Debido a que la reducción de NADP + elimina electrones de las cadenas de transporte de electrones, deben ser reemplazados: tarea del fotosistema II , que divide las moléculas de agua (H 2 O) para obtener los electrones de sus átomos de hidrógeno . [105] [158]
Mientras que el fotosistema II fotoliza el agua para obtener y energizar nuevos electrones, el fotosistema I simplemente revitaliza los electrones agotados al final de una cadena de transporte de electrones. Normalmente, los electrones reenergizados son tomados por NADP + , aunque a veces pueden fluir de regreso a través de más cadenas de transporte de electrones que bombean H + para transportar más iones de hidrógeno al espacio tilacoide para generar más ATP. Esto se denomina fotofosforilación cíclica porque los electrones se reciclan. La fotofosforilación cíclica es común en las plantas C4 , que necesitan más ATP que NADPH . [145]
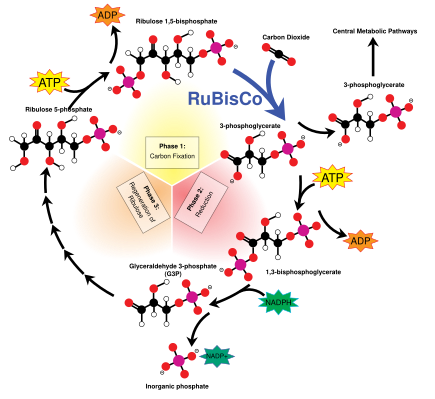
El ciclo de Calvin , también conocido como reacciones oscuras , es una serie de reacciones bioquímicas que fijan CO 2 en moléculas de azúcar G3P y utilizan la energía y los electrones del ATP y NADPH producidos en las reacciones luminosas. El ciclo de Calvin tiene lugar en el estroma del cloroplasto. [145]
Aunque se denominan "reacciones oscuras" , en la mayoría de las plantas tienen lugar en la luz, ya que las reacciones oscuras dependen de los productos de las reacciones luminosas. [dieciséis]
El ciclo de Calvin comienza utilizando la enzima RuBisCO para fijar CO 2 en moléculas de ribulosa bisfosfato (RuBP) de cinco carbonos . El resultado son moléculas inestables de seis carbonos que inmediatamente se descomponen en moléculas de tres carbonos llamadas ácido 3-fosfoglicérico o 3-PGA. El ATP y el NADPH producidos en las reacciones luminosas se utilizan para convertir el 3-PGA en gliceraldehído-3-fosfato , o moléculas de azúcar G3P. La mayoría de las moléculas de G3P se reciclan nuevamente en RuBP utilizando energía de más ATP, pero una de cada seis producidas abandona el ciclo: el producto final de las reacciones oscuras. [145]

El gliceraldehído-3-fosfato puede duplicarse para formar moléculas de azúcar más grandes, como glucosa y fructosa . Estas moléculas se procesan y, a partir de ellas, se fabrica la sacarosa aún más grande , un disacárido comúnmente conocido como azúcar de mesa, aunque este proceso tiene lugar fuera del cloroplasto, en el citoplasma . [162]
Alternativamente, los monómeros de glucosa en el cloroplasto se pueden unir para producir almidón , que se acumula en los granos de almidón que se encuentran en el cloroplasto. [162] En condiciones tales como altas concentraciones atmosféricas de CO 2 , estos granos de almidón pueden crecer mucho, distorsionando la grana y los tilacoides. Los gránulos de almidón desplazan a los tilacoides, pero los dejan intactos. [163] Las raíces anegados también pueden causar acumulación de almidón en los cloroplastos, posiblemente debido a que se exporta menos sacarosa fuera del cloroplasto (o más exactamente, de la célula vegetal ). Esto agota el suministro libre de fosfato de la planta , lo que estimula indirectamente la síntesis de almidón del cloroplasto. [163] Si bien están relacionados con bajas tasas de fotosíntesis, los propios granos de almidón no necesariamente interfieren significativamente con la eficiencia de la fotosíntesis, [164] y podrían ser simplemente un efecto secundario de otro factor que deprime la fotosíntesis. [163]
La fotorrespiración puede ocurrir cuando la concentración de oxígeno es demasiado alta. RuBisCO no puede distinguir muy bien entre oxígeno y dióxido de carbono, por lo que accidentalmente puede agregar O 2 en lugar de CO 2 a RuBP . Este proceso reduce la eficiencia de la fotosíntesis: consume ATP y oxígeno, libera CO 2 y no produce azúcar. Puede desperdiciar hasta la mitad del carbono fijado por el ciclo de Calvin. [158] Varios mecanismos han evolucionado en diferentes linajes que aumentan la concentración de dióxido de carbono en relación con el oxígeno dentro del cloroplasto, aumentando la eficiencia de la fotosíntesis. Estos mecanismos se denominan mecanismos de concentración de dióxido de carbono o CCM. Estos incluyen el metabolismo del ácido crasuláceo , la fijación de carbono C4 , [ 158] y los pirenoides . Los cloroplastos en las plantas C 4 son notables porque exhiben un dimorfismo de cloroplasto distinto.
Debido al gradiente de H + a través de la membrana tilacoide, el interior del tilacoide es ácido , con un pH alrededor de 4, [165] mientras que el estroma es ligeramente básico, con un pH alrededor de 8. [166] El pH óptimo del estroma para el ciclo de Calvin es 8,1 y la reacción casi se detiene cuando el pH cae por debajo de 7,3. [167]
El CO 2 en el agua puede formar ácido carbónico , que puede alterar el pH de los cloroplastos aislados, interfiriendo con la fotosíntesis, aunque el CO 2 se utiliza en la fotosíntesis. Sin embargo, los cloroplastos de las células vegetales vivas no se ven tan afectados por esto. [166]
Los cloroplastos pueden bombear iones K + y H + dentro y fuera de sí mismos mediante un sistema de transporte impulsado por luz poco conocido. [166]
En presencia de luz, el pH de la luz del tilacoide puede descender hasta 1,5 unidades de pH, mientras que el pH del estroma puede aumentar casi una unidad de pH. [167]
Los cloroplastos por sí solos producen casi todos los aminoácidos de una célula vegetal en su estroma [168], excepto los que contienen azufre, como la cisteína y la metionina . [169] [170] La cisteína se produce en el cloroplasto (el proplastidio también), pero también se sintetiza en el citosol y las mitocondrias , probablemente porque tiene problemas para cruzar las membranas para llegar a donde se necesita. [170] Se sabe que el cloroplasto produce los precursores de la metionina, pero no está claro si el orgánulo lleva a cabo el último tramo del camino o si ocurre en el citosol . [171]
Los cloroplastos producen todas las purinas y pirimidinas de una célula , las bases nitrogenadas que se encuentran en el ADN y el ARN . [168] También convierten el nitrito (NO 2 − ) en amoníaco (NH 3 ), que suministra a la planta nitrógeno para producir sus aminoácidos y nucleótidos . [168]
El plástido es el sitio de síntesis de lípidos diversa y compleja en las plantas. [172] [173] El carbono utilizado para formar la mayor parte del lípido proviene del acetil-CoA , que es el producto de descarboxilación del piruvato . [172] El piruvato puede ingresar al plastidio desde el citosol mediante difusión pasiva a través de la membrana después de su producción en la glucólisis . [174] El piruvato también se produce en el plastidio a partir de fosfoenolpiruvato, un metabolito producido en el citosol a partir de piruvato o PGA . [172] El acetato en el citosol no está disponible para la biosíntesis de lípidos en el plástido. [175] La longitud típica de los ácidos grasos producidos en el plástido es de 16 o 18 carbonos, con 0-3 dobles enlaces cis . [176]
La biosíntesis de ácidos grasos a partir de acetil-CoA requiere principalmente dos enzimas. La acetil-CoA carboxilasa crea malonil-CoA, que se utiliza tanto en el primer paso como en los pasos de extensión de la síntesis. La ácido graso sintasa (FAS) es un gran complejo de enzimas y cofactores que incluye la proteína transportadora de acilo (ACP) que sostiene la cadena de acilo a medida que se sintetiza. El inicio de la síntesis comienza con la condensación de malonil-ACP con acetil-CoA para producir cetobutiril-ACP. 2 reducciones que implican el uso de NADPH y una deshidratación crean butiril-ACP. La extensión del ácido graso proviene de ciclos repetidos de condensación, reducción y deshidratación de malonil-ACP. [172]
Otros lípidos se derivan de la vía del metil-eritritol fosfato (MEP) y consisten en giberelinas , esteroles , ácido abscísico , fitol e innumerables metabolitos secundarios . [172]
Los cloroplastos son un tipo especial de orgánulo de célula vegetal llamado plástido , aunque los dos términos a veces se usan indistintamente. Hay muchos otros tipos de plastidios, que realizan diversas funciones. Todos los cloroplastos de una planta descienden de proplastidios indiferenciados que se encuentran en el cigoto , [168] o en el óvulo fertilizado. Los proplastidios se encuentran comúnmente en los meristemas apicales de una planta adulta . Los cloroplastos normalmente no se desarrollan a partir de proplastidios en los meristemas de la punta de la raíz [177] ; en cambio, la formación de amiloplastos que almacenan almidón es más común. [168]
En los brotes , los proplastidios de los meristemas apicales de los brotes pueden convertirse gradualmente en cloroplastos en los tejidos foliares fotosintéticos a medida que la hoja madura, si se exponen a la luz requerida. [12] Este proceso implica invaginaciones de la membrana plástida interna, formando láminas de membrana que se proyectan hacia el estroma interno . Estas láminas de membrana luego se pliegan para formar tilacoides y grana . [178]
Si los brotes de angiospermas no se exponen a la luz necesaria para la formación de cloroplastos, los proplastidios pueden desarrollarse hasta una etapa de etioplasto antes de convertirse en cloroplastos. Un etioplasto es un plastidio que carece de clorofila , y tiene invaginaciones de membrana interna que forman un entramado de tubos en su estroma, llamado cuerpo prolamelar . Si bien los etioplastos carecen de clorofila, tienen un precursor de clorofila amarillo almacenado. [12] A los pocos minutos de exposición a la luz, el cuerpo prolaminar comienza a reorganizarse en pilas de tilacoides y comienza a producirse clorofila. Este proceso, en el que el etioplasto se convierte en cloroplasto, lleva varias horas. [178] Las gimnospermas no requieren luz para formar cloroplastos. [178]
La luz, sin embargo, no garantiza que un proplastidio se convierta en cloroplasto. El hecho de que un proplastidio se convierta en cloroplasto o algún otro tipo de plastidio está controlado principalmente por el núcleo [12] y está influenciado en gran medida por el tipo de célula en la que reside. [168]
La diferenciación de plástidos no es permanente; de hecho, son posibles muchas interconversiones. Los cloroplastos pueden convertirse en cromoplastos , que son plastidios llenos de pigmentos responsables de los colores brillantes que se ven en las flores y los frutos maduros . Los amiloplastos que almacenan almidón también se pueden convertir en cromoplastos, y es posible que los proplastidios se conviertan directamente en cromoplastos. Los cromoplastos y amiloplastos también pueden convertirse en cloroplastos, como ocurre cuando se ilumina una zanahoria o una patata . Si una planta se daña o algo más hace que una célula vegetal vuelva a un estado meristemático , los cloroplastos y otros plastidios pueden volver a convertirse en proplastidios. El cloroplasto, el amiloplasto, el cromoplasto y el proplastidio no son absolutos; estado: las formas intermedias son comunes. [168]
La mayoría de los cloroplastos en una célula fotosintética no se desarrollan directamente a partir de proplastidios o etioplastos. De hecho, una célula vegetal meristemática típica de un brote contiene sólo entre 7 y 20 proplastidios . Estos proplastidios se diferencian en cloroplastos, que se dividen para crear los 30 a 70 cloroplastos que se encuentran en una célula vegetal fotosintética madura. Si la célula se divide , la división de cloroplastos proporciona cloroplastos adicionales para dividirse entre las dos células hijas. [179]
En las algas unicelulares , la división de los cloroplastos es la única forma en que se forman nuevos cloroplastos. No hay diferenciación de proplastidios: cuando una célula de alga se divide, su cloroplasto se divide junto con ella y cada célula hija recibe un cloroplasto maduro. [178]
Casi todos los cloroplastos de una célula se dividen, en lugar de un pequeño grupo de cloroplastos que se dividen rápidamente. [180] Los cloroplastos no tienen una fase S definida : su replicación de ADN no está sincronizada ni limitada a la de sus células huésped. [181] Gran parte de lo que sabemos sobre la división del cloroplasto proviene del estudio de organismos como Arabidopsis y el alga roja Cyanidioschyzon merolæ . [151]
![La mayoría de los cloroplastos de las células vegetales y todos los cloroplastos de las algas surgen de la división de los cloroplastos.[178] Referencias de imágenes,[151][182]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/df/Chloroplast_division.svg/800px-Chloroplast_division.svg.png)
El proceso de división comienza cuando las proteínas FtsZ1 y FtsZ2 se ensamblan en filamentos y, con la ayuda de una proteína ARC6, forman una estructura llamada anillo Z dentro del estroma del cloroplasto. [151] [182] El sistema Min gestiona la colocación del anillo Z, asegurando que el cloroplasto se escinda de manera más o menos uniforme. La proteína MinD evita que FtsZ se una y forme filamentos. Otra proteína, ARC3, también puede estar implicada, pero no se comprende muy bien. Estas proteínas están activas en los polos del cloroplasto, impidiendo la formación del anillo Z allí, pero cerca del centro del cloroplasto, MinE las inhibe, permitiendo que se forme el anillo Z. [151]
A continuación, se forman los dos anillos divisores de plastidios, o anillos PD. El anillo interior divisor de plastidios se encuentra en el lado interno de la membrana interna del cloroplasto y se forma primero. [151] El anillo divisor externo del plastidio se encuentra envuelto alrededor de la membrana externa del cloroplasto. Consta de filamentos de unos 5 nanómetros de ancho, [151] dispuestos en filas con una separación de 6,4 nanómetros y se encoge para apretar el cloroplasto. Aquí es cuando comienza la constricción de los cloroplastos. [182]
En algunas especies como Cyanidioschyzon merolæ , los cloroplastos tienen un tercer anillo divisor de plástidos ubicado en el espacio intermembrana del cloroplasto. [151] [182]
Al final de la fase de constricción, las proteínas dinamina se ensamblan alrededor del anillo divisor externo del plastidio, [182] ayudando a proporcionar fuerza para apretar el cloroplasto. [151] Mientras tanto, el anillo Z y el anillo interior divisor de plastidios se rompen. [182] Durante esta etapa, los numerosos plásmidos de ADN del cloroplasto que flotan en el estroma se dividen y distribuyen a los dos cloroplastos hijos en formación. [183]
Más tarde, las dinaminas migran debajo del anillo divisor externo del plastidio, en contacto directo con la membrana externa del cloroplasto, [182] para escindir el cloroplasto en dos cloroplastos hijos. [151]
Un remanente del anillo divisor externo del plastidio permanece flotando entre los dos cloroplastos hijos, y un remanente del anillo de dinamina permanece unido a uno de los cloroplastos hijos. [182]
De los cinco o seis anillos involucrados en la división del cloroplasto, solo el anillo externo que divide el plastidio está presente durante toda la fase de constricción y división; mientras que el anillo Z se forma primero, la constricción no comienza hasta que se forma el anillo externo que divide el plastidio. [182]


En especies de algas que contienen un solo cloroplasto, la regulación de la división del cloroplasto es extremadamente importante para garantizar que cada célula hija reciba un cloroplasto; los cloroplastos no se pueden producir desde cero. [79] [151] En organismos como las plantas, cuyas células contienen múltiples cloroplastos, la coordinación es más laxa y menos importante. Es probable que el cloroplasto y la división celular estén algo sincronizados, aunque los mecanismos que lo provocan son en su mayoría desconocidos. [151]
Se ha demostrado que la luz es un requisito para la división del cloroplasto. Los cloroplastos pueden crecer y progresar a través de algunas de las etapas de constricción bajo luz verde de mala calidad , pero tardan en completar la división; requieren exposición a luz blanca brillante para completar la división. Se ha observado que las hojas de espinaca cultivadas bajo luz verde contienen muchos cloroplastos grandes en forma de mancuerna. La exposición a la luz blanca puede estimular la división de estos cloroplastos y reducir la población de cloroplastos en forma de mancuerna. [180] [183]
Al igual que las mitocondrias , los cloroplastos suelen heredarse de un solo progenitor. La herencia biparental de cloroplastos, donde los genes de plástidos se heredan de ambas plantas madre, ocurre en niveles muy bajos en algunas plantas con flores. [184]
Muchos mecanismos previenen la herencia biparental del ADN del cloroplasto, incluida la destrucción selectiva de los cloroplastos o sus genes dentro del gameto o cigoto , y la exclusión del embrión de los cloroplastos de uno de los padres. Los cloroplastos parentales se pueden clasificar de modo que solo haya un tipo presente en cada descendencia. [185]
Las gimnospermas , como los pinos , en su mayoría transmiten cloroplastos por vía paterna, [186] mientras que las plantas con flores a menudo heredan los cloroplastos por vía materna. [187] [188] Alguna vez se pensó que las plantas con flores solo heredaban los cloroplastos por vía materna. Sin embargo, en la actualidad hay muchos casos documentados de angiospermas que heredan cloroplastos por vía paterna. [184]
Las angiospermas , que transmiten cloroplastos por vía materna, tienen muchas formas de prevenir la herencia paterna. La mayoría de ellos producen espermatozoides que no contienen plastidios. Hay muchos otros mecanismos documentados que previenen la herencia paterna en estas plantas con flores, como las diferentes tasas de replicación del cloroplasto dentro del embrión. [184]
Entre las angiospermas, la herencia paterna de cloroplastos se observa con mayor frecuencia en híbridos que en descendientes de padres de la misma especie. Esto sugiere que genes híbridos incompatibles podrían interferir con los mecanismos que previenen la herencia paterna. [184]
Recientemente, los cloroplastos han llamado la atención de los desarrolladores de cultivos genéticamente modificados . Dado que, en la mayoría de las plantas con flores, los cloroplastos no se heredan del progenitor masculino, los transgenes en estos plastidios no pueden diseminarse mediante el polen . Esto hace que la transformación de plastidios sea una herramienta valiosa para la creación y el cultivo de plantas genéticamente modificadas que estén contenidas biológicamente, lo que plantea riesgos ambientales significativamente menores. Esta estrategia de contención biológica es, por tanto, adecuada para establecer la coexistencia de la agricultura convencional y ecológica . Si bien la confiabilidad de este mecanismo aún no se ha estudiado para todas las especies de cultivos relevantes, los resultados recientes en plantas de tabaco son prometedores y muestran una tasa de contención fallida de plantas transplastómicas de 3 en 1.000.000. [188]
Número de copias de ctDNA por cloroplasto.
En los pinos, el genoma del cloroplasto se transmite a través del polen.