El zinc es un elemento químico con el símbolo Zn y número atómico 30. Es un metal ligeramente quebradizo a temperatura ambiente y tiene un aspecto grisáceo brillante cuando se elimina la oxidación. Es el primer elemento del grupo 12 (IIB) de la tabla periódica . En algunos aspectos, el zinc es químicamente similar al magnesio : ambos elementos exhiben solo un estado de oxidación normal (+2), y los iones Zn 2+ y Mg 2+ son de tamaño similar. [b] El zinc es el 24.º elemento más abundante en la corteza terrestre y tiene cinco isótopos estables . El mineral de zinc más común es la esfalrita (blenda de zinc), un mineral de sulfuro de zinc . Las vetas explotables más grandes se encuentran en Australia, Asia y Estados Unidos. El zinc se refina mediante flotación por espuma del mineral, tostado y extracción final mediante electricidad ( electroobtención ).
El zinc es un oligoelemento esencial para los seres humanos, [6] [7] [8] los animales, [9] las plantas [10] y los microorganismos [11] y es necesario para el desarrollo prenatal y postnatal. [12] Es el segundo metal traza más abundante en los seres humanos después del hierro y es el único metal que aparece en todas las clases de enzimas . [10] [8] El zinc también es un elemento nutritivo esencial para el crecimiento de los corales, ya que es un cofactor importante para muchas enzimas. [13]
La deficiencia de zinc afecta a unos dos mil millones de personas en el mundo en desarrollo y está asociada con muchas enfermedades. [14] En los niños, la deficiencia causa retraso del crecimiento, maduración sexual tardía, susceptibilidad a infecciones y diarrea . [12] Las enzimas con un átomo de zinc en el centro reactivo están muy extendidas en la bioquímica, como la alcohol deshidrogenasa en humanos. [15] El consumo de zinc en exceso puede causar ataxia , letargo y deficiencia de cobre . En los biomas marinos, especialmente en las regiones polares, un déficit de zinc puede comprometer la vitalidad de las comunidades de algas primarias, desestabilizando potencialmente las intrincadas estructuras tróficas marinas y, en consecuencia, afectando la biodiversidad. [16]
El latón , una aleación de cobre y zinc en diversas proporciones, se utilizó ya en el tercer milenio a. C. en el área del Egeo y la región que actualmente incluye Irak , los Emiratos Árabes Unidos , Kalmykia , Turkmenistán y Georgia . En el segundo milenio a. C. se utilizó en las regiones que actualmente incluyen India Occidental , Uzbekistán , Irán , Siria , Irak e Israel . [17] [18] [19] El metal de zinc no se produjo a gran escala hasta el siglo XII en la India, aunque era conocido por los antiguos romanos y griegos. [20] Las minas de Rajastán han dado evidencia definitiva de la producción de zinc que se remonta al siglo VI a. C. [21] La evidencia más antigua de zinc puro proviene de Zawar, en Rajastán, ya en el siglo IX d. C., cuando se empleó un proceso de destilación para producir zinc puro. [22] Los alquimistas quemaban zinc en el aire para formar lo que llamaban " lana filosofal " o "nieve blanca".
El elemento fue nombrado probablemente por el alquimista Paracelso a partir de la palabra alemana Zinke (punta, diente). Al químico alemán Andreas Sigismund Marggraf se le atribuye el descubrimiento del zinc metálico puro en 1746. El trabajo de Luigi Galvani y Alessandro Volta descubrió las propiedades electroquímicas del zinc en 1800. El recubrimiento de zinc resistente a la corrosión del hierro ( galvanizado por inmersión en caliente ) es la principal aplicación del zinc. Otras aplicaciones son en baterías eléctricas , pequeñas fundiciones no estructurales y aleaciones como el latón. Se utilizan comúnmente una variedad de compuestos de zinc, como el carbonato de zinc y el gluconato de zinc (como suplementos dietéticos), el cloruro de zinc (en desodorantes), la piritiona de zinc (champús anticaspa ) , el sulfuro de zinc (en pinturas luminiscentes) y el dimetilzinc o dietilzinc en el laboratorio orgánico.
El zinc es un metal diamagnético , brillante y de color blanco azulado , [23] aunque la mayoría de los grados comerciales del metal tienen un acabado opaco. [24] Es algo menos denso que el hierro y tiene una estructura cristalina hexagonal , con una forma distorsionada de empaquetamiento compacto hexagonal , en el que cada átomo tiene seis vecinos más cercanos (a 265,9 pm) en su propio plano y otros seis a una distancia mayor de 290,6 pm. [25] El metal es duro y quebradizo a la mayoría de las temperaturas, pero se vuelve maleable entre 100 y 150 °C. [23] [24] Por encima de 210 °C, el metal se vuelve quebradizo nuevamente y se puede pulverizar golpeándolo. [26] El zinc es un buen conductor de electricidad . [23] Para un metal, el zinc tiene un punto de fusión (419,5 °C) y un punto de ebullición (907 °C) relativamente bajos. [27] El punto de fusión es el más bajo de todos los metales del bloque d, aparte del mercurio y el cadmio ; por esta razón, entre otras, el zinc, el cadmio y el mercurio a menudo no se consideran metales de transición como el resto de los metales del bloque d. [27]
Muchas aleaciones contienen cinc, incluido el latón. Otros metales que desde hace tiempo se sabe que forman aleaciones binarias con el cinc son el aluminio , el antimonio , el bismuto , el oro , el hierro, el plomo , el mercurio, la plata , el estaño , el magnesio , el cobalto , el níquel , el telurio y el sodio . [28] Aunque ni el cinc ni el circonio son ferromagnéticos , su aleación, ZrZn
2, exhibe ferromagnetismo por debajo de 35 K. [ 23]
El zinc constituye alrededor de 75 ppm (0,0075 %) de la corteza terrestre , lo que lo convierte en el 24.º elemento más abundante. [29] También constituye 312 ppm del sistema solar, donde es el 22.º elemento más abundante. [30] Las concentraciones de fondo típicas de zinc no superan 1 μg/m 3 en la atmósfera; 300 mg/kg en el suelo; 100 mg/kg en la vegetación; 20 μg/L en agua dulce y 5 μg/L en agua de mar. [31] El elemento se encuentra normalmente asociado con otros metales básicos como el cobre y el plomo en los minerales . [32] El zinc es un calcófilo , lo que significa que es más probable que el elemento se encuentre en minerales junto con azufre y otros calcógenos pesados , en lugar de con el oxígeno calcógeno ligero o con elementos electronegativos no calcógenos como los halógenos . Los sulfuros se formaron a medida que la corteza se solidificó bajo las condiciones reductoras de la atmósfera de la Tierra primitiva. [33] La esfalrita , que es una forma de sulfuro de zinc, es el mineral que contiene zinc más extraído porque su concentrado contiene entre un 60 y un 62 % de zinc. [32]
Otros minerales fuente de zinc incluyen smithsonita ( carbonato de zinc ), hemimorfita ( silicato de zinc ), wurtzita (otro sulfuro de zinc) y, a veces, hidrozincita ( carbonato de zinc básico ). [34] Con la excepción de la wurtzita, todos estos otros minerales se formaron por la erosión de los sulfuros de zinc primordiales. [33]
Los recursos mundiales identificados de zinc suman alrededor de 1.900 a 2.800 millones de toneladas . [35] [36] Los grandes depósitos se encuentran en Australia, Canadá y los Estados Unidos, con las mayores reservas en Irán . [33] [37] [38] La estimación más reciente de la base de reservas de zinc (que cumple con los criterios físicos mínimos específicos relacionados con las prácticas actuales de minería y producción) se realizó en 2009 y se calculó en aproximadamente 480 Mt. [39] Las reservas de zinc, por otro lado, son cuerpos de mineral identificados geológicamente cuya idoneidad para la recuperación se basa en la economía (ubicación, grado, calidad y cantidad) en el momento de la determinación. Dado que la exploración y el desarrollo de la mina es un proceso continuo, la cantidad de reservas de zinc no es un número fijo y la sostenibilidad de los suministros de mineral de zinc no se puede juzgar simplemente extrapolando la vida útil combinada de las minas de zinc actuales. Este concepto está bien respaldado por los datos del Servicio Geológico de los Estados Unidos (USGS), que ilustran que, si bien la producción de zinc refinado aumentó un 80% entre 1990 y 2010, la vida útil de las reservas de zinc se ha mantenido sin cambios. A lo largo de la historia hasta 2002 se han extraído alrededor de 346 millones de toneladas, y los investigadores han estimado que se utilizan entre 109 y 305 millones de toneladas. [40] [41] [42]

En la naturaleza existen cinco isótopos estables de zinc, siendo el 64 Zn el isótopo más abundante (49,17 % de abundancia natural ). [43] [44] Los otros isótopos que se encuentran en la naturaleza son66
Zinc (27,73%),67
Zinc (4,04 %),68
Zn (18,45%), y70
Zn (0,61%). [44]
Se han caracterizado varias docenas de radioisótopos .65
El Zn , que tiene una vida media de 243,66 días, es el radioisótopo menos activo, seguido de72
Zn con una vida media de 46,5 horas. [43] El zinc tiene 10 isómeros nucleares , de los cuales 69m Zn tiene la vida media más larga, 13,76 h. [43] El superíndice m indica un isótopo metaestable . El núcleo de un isótopo metaestable está en un estado excitado y volverá al estado fundamental emitiendo un fotón en forma de rayo gamma .61
El Zn tiene tres estados metaestables excitados y73
El Zn tiene dos. [45] Los isótopos65
Zinc ,71
Zinc ,77
Zn y78
Cada Zn tiene solo un estado metaestable excitado. [43]
El modo de desintegración más común de un radioisótopo de cinc con un número másico inferior a 66 es la captura de electrones . El producto de desintegración resultante de la captura de electrones es un isótopo de cobre. [43]
El modo de desintegración más común de un radioisótopo de zinc con un número másico superior a 66 es la desintegración beta (β − ), que produce un isótopo de galio . [43]
El zinc tiene una configuración electrónica de [Ar]3d 10 4s 2 y es miembro del grupo 12 de la tabla periódica . Es un metal moderadamente reactivo y un fuerte agente reductor . [46] La superficie del metal puro se empaña rápidamente, formando finalmente una capa pasivante protectora de carbonato de zinc básico , Zn
5(OH)
6( CO3 )
2, por reacción con el dióxido de carbono atmosférico . [47]
El zinc arde en el aire con una llama verde azulada brillante, emitiendo humos de óxido de zinc . [48] El zinc reacciona fácilmente con ácidos , álcalis y otros no metales. [49] El zinc extremadamente puro reacciona sólo lentamente a temperatura ambiente con ácidos. [48] Los ácidos fuertes, como el ácido clorhídrico o sulfúrico , pueden eliminar la capa pasivante y la reacción posterior con el ácido libera gas hidrógeno. [48]
La química del zinc está dominada por el estado de oxidación +2. Cuando se forman compuestos en este estado de oxidación, se pierden los electrones de la capa externa, lo que produce un ion de zinc desnudo con la configuración electrónica [Ar]3d 10 . [50] En solución acuosa, un complejo octaédrico, [Zn(H
2O) 6 ]2+
es la especie predominante. [51] La volatilización del zinc en combinación con cloruro de zinc a temperaturas superiores a 285 °C indica la formación de Zn
2Cl
2, un compuesto de zinc con un estado de oxidación de +1. [ 48] No se conocen compuestos de zinc en estados de oxidación positivos distintos de +1 o +2. [52] Los cálculos indican que es poco probable que exista un compuesto de zinc con el estado de oxidación de +4. [53] Se predice que Zn(III) existe en presencia de trianiones fuertemente electronegativos; [54] sin embargo, existen algunas dudas en torno a esta posibilidad. [55] Pero en 2021 se informó de otro compuesto con más evidencia que tenía el estado de oxidación de +3 con la fórmula ZnBeB 11 (CN) 12 . [56]
La química del zinc es similar a la química de los metales de transición de primera fila tardía, el níquel y el cobre, aunque tiene una capa d llena y los compuestos son diamagnéticos y en su mayoría incoloros. [57] Los radios iónicos del zinc y el magnesio son casi idénticos. Debido a esto, algunas de las sales equivalentes tienen la misma estructura cristalina , [58] y en otras circunstancias donde el radio iónico es un factor determinante, la química del zinc tiene mucho en común con la del magnesio. [48] En otros aspectos, hay poca similitud con los metales de transición de primera fila tardía. El zinc tiende a formar enlaces con un mayor grado de covalencia y complejos mucho más estables con donantes de N y S. [57] Los complejos de zinc son en su mayoría de coordinación 4 o 6 , aunque se conocen complejos de coordinación 5. [48]
Los compuestos de zinc(I) son muy raros. El ion [Zn 2 ] 2+ está implicado en la formación de un vidrio diamagnético amarillo al disolver zinc metálico en ZnCl 2 . [59] El núcleo [Zn 2 ] 2+ sería análogo al catión [Hg 2 ] 2+ presente en los compuestos de mercurio (I). La naturaleza diamagnética del ion confirma su estructura dimérica. El primer compuesto de zinc(I) que contiene el enlace Zn–Zn, (η 5 -C 5 Me 5 ) 2 Zn 2 .


Los compuestos binarios de zinc son conocidos para la mayoría de los metaloides y todos los no metales excepto los gases nobles . El óxido ZnO es un polvo blanco que es casi insoluble en soluciones acuosas neutras, pero es anfótero , disolviéndose tanto en soluciones ácidas como básicas fuertes. [48] Los otros calcogenuros ( ZnS , ZnSe y ZnTe ) tienen aplicaciones variadas en electrónica y óptica. [60] Los pnictogenuros ( Zn
3norte
2, Zinc
3PAG
2, Zinc
3Como
2y Zn
3Sb
2), [61] [62] el peróxido ( ZnO2), el hidruro ( ZnH2), y el carburo ( ZnC
2) también son conocidos. [63] De los cuatro haluros , ZnF2tiene el carácter más iónico, mientras que los demás ( ZnCl
2, Bromuro de cinc
2, y ZnI2) tienen puntos de fusión relativamente bajos y se considera que tienen un carácter más covalente. [64]
En soluciones básicas débiles que contienen Zn2+
iones, el hidróxido Zn(OH)
2Se forma como un precipitado blanco . En soluciones alcalinas más fuertes, este hidróxido se disuelve para formar cincatos ( [Zn(OH) 4 ]2−
). [48] El nitrato Zn(NO 3 )
2, clorato Zn(ClO 3 )
2, sulfato de ZnSO
4, fosfato de zinc
3(Punto 4 )
2, molibdato ZnMoO
4, cianuro Zn(CN)
2, arsenito Zn(AsO 2 )
2, arseniato Zn(AsO 4 )
2·8 horas
2O y el cromato ZnCrO
4(uno de los pocos compuestos de zinc coloreados) son algunos ejemplos de otros compuestos inorgánicos comunes de zinc. [65] [66]
Los compuestos de organocinc son aquellos que contienen enlaces covalentes zinc- carbono . El dietilzinc ( (C
2H5 )
2El Zn ) es un reactivo de la química sintética. Se informó por primera vez en 1848 a partir de la reacción de zinc y yoduro de etilo , y fue el primer compuesto conocido que contenía un enlace sigma metal-carbono. [67]
El papel de cianuro de cobalto (prueba de Rinnmann para Zn) se puede utilizar como indicador químico del cinc. Se disuelven 4 g de K3Co ( CN) 6 y 1 g de KClO3 en 100 ml de agua. Se sumerge el papel en la solución y se seca a 100 °C. Se deja caer una gota de la muestra sobre el papel seco y se calienta. Un disco verde indica la presencia de cinc. [68]
Se han descubierto varios ejemplos aislados del uso de cinc impuro en la antigüedad. Los minerales de cinc se utilizaban para fabricar el latón, aleación cinc-cobre , miles de años antes del descubrimiento del cinc como elemento independiente. El latón de Judea de los siglos XIV al X a. C. contiene un 23 % de cinc. [18]
El conocimiento de cómo producir latón se extendió a la Antigua Grecia en el siglo VII a. C., pero se fabricaron pocas variedades. [19] Se han encontrado adornos hechos de aleaciones que contienen entre un 80 y un 90 % de zinc, con plomo, hierro, antimonio y otros metales que componen el resto, que tienen 2500 años de antigüedad. [32] Una estatuilla posiblemente prehistórica que contiene un 87,5 % de zinc fue encontrada en un sitio arqueológico de Dacia . [69]
En un escrito del siglo I a. C. (pero citando una obra ahora perdida del historiador del siglo IV a. C. Teopompo ), Estrabón menciona "gotas de plata falsa" que, al mezclarse con cobre, forman latón. Esto puede referirse a pequeñas cantidades de cinc que es un subproducto de la fundición de minerales de sulfuro . [70] El cinc que quedaba en esos restos en los hornos de fundición solía desecharse porque se pensaba que no tenía ningún valor. [71]
Los romanos ya conocían la fabricación del latón alrededor del año 30 a. C. [72] Fabricaban latón calentando calamina en polvo ( silicato o carbonato de cinc), carbón y cobre juntos en un crisol. [72] El latón de calamina resultante se fundía o se martillaba para darle forma y usarse en armas. [73] Algunas monedas acuñadas por los romanos en la era cristiana están hechas de lo que probablemente sea latón de calamina. [74]

Las píldoras más antiguas conocidas estaban hechas de carbonatos de cinc, hidrocincita y smithsonita. Las píldoras se utilizaban para el dolor de ojos y se encontraron a bordo del barco romano Relitto del Pozzino, que naufragó en el año 140 a. C. [75] [76]
La placa de zinc de Berna es una placa votiva que data de la Galia romana y está hecha de una aleación compuesta principalmente por zinc. [77]
El Charaka Samhita , que se cree que fue escrito entre 300 y 500 d. C., [78] menciona un metal que, cuando se oxida, produce pushpanjan , que se cree que es óxido de zinc. [79] Las minas de zinc en Zawar, cerca de Udaipur en la India, han estado activas desde el período Maurya ( c. 322 y 187 a. C.). Sin embargo, la fundición de zinc metálico aquí parece haber comenzado alrededor del siglo XII d. C. [80] [81] Una estimación es que esta ubicación produjo un millón de toneladas de zinc metálico y óxido de zinc desde el siglo XII al XVI. [34] Otra estimación da una producción total de 60.000 toneladas de zinc metálico durante este período. [80] El Rasaratna Samuccaya , escrito aproximadamente en el siglo XIII d. C., menciona dos tipos de minerales que contienen zinc: uno utilizado para la extracción de metales y otro utilizado con fines medicinales. [81]
El zinc fue reconocido claramente como un metal bajo la designación de Yasada o Jasada en el Léxico médico atribuido al rey hindú Madanapala (de la dinastía Taka) y escrito alrededor del año 1374. [82] La fundición y extracción de zinc impuro mediante la reducción de calamina con lana y otras sustancias orgánicas se logró en el siglo XIII en la India. [23] [83] Los chinos no aprendieron la técnica hasta el siglo XVII. [83]

Los alquimistas quemaban zinc metálico en el aire y recogían el óxido de zinc resultante en un condensador . Algunos alquimistas llamaban a este óxido de zinc lana philosophica , que en latín significa "lana filosófica", porque se acumulaba en mechones lanudos, mientras que otros pensaban que parecía nieve blanca y lo llamaban nix album . [84]
El nombre del metal fue probablemente documentado por primera vez por Paracelso , un alquimista alemán nacido en Suiza, quien se refirió al metal como "zincum" o "zinken" en su libro Liber Mineralium II , en el siglo XVI. [83] [85] La palabra probablemente se deriva del alemán zinke , y supuestamente significaba "similar a un diente, puntiagudo o dentado" (los cristales metálicos de zinc tienen una apariencia similar a una aguja). [86] Zink también podría implicar "similar al estaño" debido a su relación con el alemán zinn que significa estaño. [87] Otra posibilidad es que la palabra se derive de la palabra persa سنگ seng que significa piedra. [88] El metal también se llamaba estaño indio , tutanego , calamina y spinter . [32]
El metalúrgico alemán Andreas Libavius recibió una cantidad de lo que llamó "calay" (de la palabra malaya o hindi para estaño) procedente de Malabar de un barco de carga capturado a los portugueses en el año 1596. [89] Libavius describió las propiedades de la muestra, que podría haber sido zinc. El zinc se importaba regularmente a Europa desde Oriente en los siglos XVII y principios del XVIII, [83] pero a veces era muy caro. [c]

El zinc metálico fue aislado en la India alrededor del año 1300 d. C. [90] [91] [92] Antes de que fuera aislado en Europa, fue importado de la India alrededor del año 1600 d. C. [93] El Diccionario Universal de Postlewayt , una fuente contemporánea que brinda información tecnológica en Europa, no mencionó el zinc antes de 1751, pero el elemento fue estudiado antes de esa fecha. [81] [94]
El metalúrgico y alquimista flamenco P. M. de Respour informó que había extraído zinc metálico del óxido de zinc en 1668. [34] A principios del siglo XVIII, Étienne François Geoffroy describió cómo el óxido de zinc se condensa como cristales amarillos en barras de hierro colocadas sobre el mineral de zinc que se está fundiendo. [34] En Gran Bretaña, se dice que John Lane llevó a cabo experimentos para fundir zinc, probablemente en Landore , antes de su quiebra en 1726. [95]
En 1738, en Gran Bretaña, William Champion patentó un proceso para extraer zinc de la calamina en una fundición vertical de tipo retorta . [96] Su técnica se parecía a la utilizada en las minas de zinc de Zawar en Rajastán , pero no hay evidencia que sugiera que haya visitado Oriente. [93] El proceso de Champion se utilizó hasta 1851. [83]
El químico alemán Andreas Marggraf suele recibir el crédito por aislar el zinc metálico puro en Occidente, a pesar de que el químico sueco Anton von Swab había destilado zinc a partir de calamina cuatro años antes. [83] En su experimento de 1746, Marggraf calentó una mezcla de calamina y carbón en un recipiente cerrado sin cobre para obtener un metal. [97] [71] Este procedimiento se volvió comercialmente práctico en 1752. [98]

En 1758, el hermano de William Champion, John, patentó un proceso para calcinar sulfuro de cinc y convertirlo en un óxido que se pudiera utilizar en el proceso de retorta. [32] Antes de esto, solo se podía utilizar calamina para producir cinc. En 1798, Johann Christian Ruberg mejoró el proceso de fundición al construir la primera fundición de retorta horizontal. [99] Jean-Jacques Daniel Dony construyó un tipo diferente de fundición de cinc horizontal en Bélgica que procesaba incluso más cinc. [83] El médico italiano Luigi Galvani descubrió en 1780 que conectar la médula espinal de una rana recién disecada a un riel de hierro sujeto por un gancho de latón hacía que la pata de la rana se moviera. [100] Creyó incorrectamente que había descubierto una capacidad de los nervios y los músculos para crear electricidad y llamó al efecto " electricidad animal ". [101] Tanto la celda galvánica como el proceso de galvanización recibieron el nombre de Luigi Galvani, y sus descubrimientos allanaron el camino para las baterías eléctricas , la galvanización y la protección catódica . [101]
El amigo de Galvani, Alessandro Volta , continuó investigando el efecto e inventó la pila voltaica en 1800. [100] La pila de Volta consistía en una pila de celdas galvánicas simplificadas , cada una de las cuales era una placa de cobre y una de zinc conectadas por un electrolito . Al apilar estas unidades en serie, la pila voltaica (o "batería") en su conjunto tenía un voltaje más alto, que podía usarse más fácilmente que las celdas individuales. La electricidad se produce porque el potencial de Volta entre las dos placas de metal hace que los electrones fluyan del zinc al cobre y corroan el zinc. [100]
El carácter no magnético del zinc y su falta de color en solución retrasaron el descubrimiento de su importancia para la bioquímica y la nutrición. [102] Esto cambió en 1940 cuando se demostró que la anhidrasa carbónica , una enzima que elimina el dióxido de carbono de la sangre, tenía zinc en su sitio activo . [102] La enzima digestiva carboxipeptidasa se convirtió en la segunda enzima conocida que contenía zinc en 1955. [102]
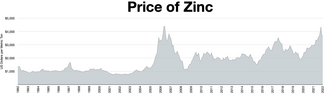


El zinc es el cuarto metal más común en uso, solo detrás del hierro , el aluminio y el cobre , con una producción anual de aproximadamente 13 millones de toneladas. [35] El mayor productor de zinc del mundo es Nyrstar , una fusión de la australiana OZ Minerals y la belga Umicore . [104] Aproximadamente el 70% del zinc del mundo proviene de la minería, mientras que el 30% restante proviene del reciclaje de zinc secundario. [105]
El zinc comercialmente puro se conoce como grado alto especial, a menudo abreviado como SHG , y tiene una pureza del 99,995 %. [106]
A nivel mundial, el 95% del zinc nuevo se extrae de depósitos minerales sulfídicos , en los que la esfalrita (ZnS) casi siempre está mezclada con sulfuros de cobre, plomo y hierro. [107] : 6 Las minas de zinc están repartidas por todo el mundo, siendo las principales áreas China, Australia y Perú. China produjo el 38% de la producción mundial de zinc en 2014. [35]
El metal de zinc se produce mediante metalurgia extractiva . [108] : 7 El mineral se muele finamente y luego se somete a una flotación por espuma para separar los minerales de la ganga (por la propiedad de hidrofobicidad ), para obtener un concentrado de mineral de sulfuro de zinc [108] : 16 que consta de aproximadamente 50% de zinc, 32% de azufre, 13% de hierro y 5% de SiO
2. [108] : 16
La tostación convierte el concentrado de sulfuro de zinc en óxido de zinc: [107]
El dióxido de azufre se utiliza para la producción de ácido sulfúrico, que es necesario para el proceso de lixiviación. Si se utilizan depósitos de carbonato de cinc , silicato de cinc o espinela de cinc (como el depósito Skorpion en Namibia ) para la producción de cinc, se puede omitir la tostación. [109]
Para su posterior procesamiento se utilizan dos métodos básicos: pirometalurgia o electroobtención . La pirometalurgia reduce el óxido de zinc con carbono o monóxido de carbono a 950 °C (1740 °F) hasta obtener el metal, que se destila como vapor de zinc para separarlo de otros metales, que no son volátiles a esas temperaturas. [110] El vapor de zinc se recoge en un condensador. [107] Las ecuaciones siguientes describen este proceso: [107]
En la electroobtención , el zinc se lixivia del concentrado de mineral con ácido sulfúrico y las impurezas se precipitan: [111]
Finalmente, el zinc se reduce mediante electrólisis . [107]
El ácido sulfúrico se regenera y se recicla en la etapa de lixiviación.
Cuando se alimenta materia prima galvanizada a un horno de arco eléctrico , el zinc se recupera del polvo mediante una serie de procesos, predominantemente el proceso Waelz (90 % en 2014). [112]
El refinamiento de minerales de cinc sulfídico produce grandes volúmenes de dióxido de azufre y vapor de cadmio . Las escorias de fundición y otros residuos contienen cantidades significativas de metales. Alrededor de 1,1 millones de toneladas de cinc metálico y 130.000 toneladas de plomo se extrajeron y fundieron en las ciudades belgas de La Calamine y Plombières entre 1806 y 1882. [113] Los vertederos de las antiguas operaciones mineras lixivian cinc y cadmio, y los sedimentos del río Geul contienen cantidades no triviales de metales. [113] Hace unos dos mil años, las emisiones de cinc procedentes de la minería y la fundición ascendían a 10.000 toneladas al año. Tras multiplicarse por diez desde 1850, las emisiones de zinc alcanzaron un máximo de 3,4 millones de toneladas por año en la década de 1980 y disminuyeron a 2,7 millones de toneladas en la década de 1990, aunque un estudio de 2005 sobre la troposfera del Ártico concluyó que las concentraciones allí no reflejaban esa disminución. Las emisiones naturales y de origen humano se producen en una proporción de 20 a 1. [10]
El zinc en los ríos que fluyen a través de áreas industriales y mineras puede llegar a tener niveles de hasta 20 ppm. [114] Un tratamiento eficaz de las aguas residuales reduce este nivel en gran medida; el tratamiento a lo largo del Rin , por ejemplo, ha reducido los niveles de zinc a 50 ppb. [114] Concentraciones de zinc tan bajas como 2 ppm afectan negativamente la cantidad de oxígeno que los peces pueden transportar en su sangre. [115]
Los suelos contaminados con zinc provenientes de la minería, la refinación o la fertilización con lodos que contienen zinc pueden contener varios gramos de zinc por kilogramo de suelo seco. Los niveles de zinc superiores a 500 ppm en el suelo interfieren con la capacidad de las plantas para absorber otros metales esenciales , como el hierro y el manganeso . Se han registrado niveles de zinc de 2000 ppm a 180 000 ppm (18 %) en algunas muestras de suelo. [114]
Las principales aplicaciones del zinc incluyen, con porcentajes indicados para los EE. UU. [118]


El zinc se utiliza más comúnmente como agente anticorrosivo , [119] y la galvanización (recubrimiento de hierro o acero ) es la forma más conocida. En 2009, en los Estados Unidos, el 55% u 893.000 toneladas del metal zinc se utilizaron para galvanización. [118]
El zinc es más reactivo que el hierro o el acero y, por lo tanto, atraerá casi toda la oxidación local hasta que se corroa por completo. [120] Una capa superficial protectora de óxido y carbonato ( Zn
5(OH)
6(CO
3)
2) se forma a medida que el zinc se corroe. [121] Esta protección dura incluso después de que se rasque la capa de zinc, pero se degrada con el tiempo a medida que el zinc se corroe. [121] El zinc se aplica electroquímicamente o como zinc fundido mediante galvanización por inmersión en caliente o pulverización. La galvanización se utiliza en cercas de alambre de cadena, barandillas, puentes colgantes, postes de luz, techos de metal, intercambiadores de calor y carrocerías de automóviles. [122]
La reactividad relativa del zinc y su capacidad para atraer la oxidación lo convierten en un ánodo de sacrificio eficiente en la protección catódica (CP). Por ejemplo, la protección catódica de una tubería enterrada se puede lograr conectando ánodos hechos de zinc a la tubería. [121] El zinc actúa como ánodo (terminal negativo) al corroerse lentamente a medida que pasa corriente eléctrica a la tubería de acero. [121] [d] El zinc también se utiliza para proteger catódicamente los metales que están expuestos al agua de mar. [123] Un disco de zinc unido al timón de hierro de un barco se corroerá lentamente mientras el timón permanece intacto. [120] De manera similar, un tapón de zinc unido a una hélice o al protector metálico de la quilla del barco proporciona protección temporal.
Con un potencial de electrodo estándar (SEP) de -0,76 voltios , el zinc se utiliza como material de ánodo para baterías. (El litio más reactivo (SEP -3,04 V) se utiliza para los ánodos de las baterías de litio ). El zinc en polvo se utiliza de esta manera en baterías alcalinas y la carcasa (que también sirve como ánodo) de las baterías de zinc-carbono se forma a partir de láminas de zinc. [124] [125] El zinc se utiliza como ánodo o combustible de la batería /célula de combustible de zinc-aire . [126] [127] [128] La batería de flujo redox de zinc-cerio también se basa en una semicelda negativa a base de zinc. [129]
Una aleación de zinc ampliamente utilizada es el latón, en el que el cobre se alea con entre un 3% y un 45% de zinc, dependiendo del tipo de latón. [121] El latón es generalmente más dúctil y más fuerte que el cobre, y tiene una resistencia superior a la corrosión . [121] Estas propiedades lo hacen útil en equipos de comunicación, hardware, instrumentos musicales y válvulas de agua. [121]

Otras aleaciones de zinc ampliamente utilizadas incluyen alpaca , metal de máquina de escribir, soldadura blanda y de aluminio y bronce comercial . [23] El zinc también se utiliza en órganos de tubos contemporáneos como sustituto de la aleación tradicional de plomo/estaño en los tubos. [130] Las aleaciones de 85-88% de zinc, 4-10% de cobre y 2-8% de aluminio encuentran un uso limitado en ciertos tipos de cojinetes de máquinas. El zinc ha sido el metal principal en las monedas de un centavo estadounidenses (pennies) desde 1982. [131] El núcleo de zinc está recubierto con una fina capa de cobre para dar la apariencia de una moneda de cobre. En 1994, se utilizaron 33.200 toneladas (36.600 toneladas cortas) de zinc para producir 13.6 mil millones de centavos en los Estados Unidos. [132]
Las aleaciones de zinc con pequeñas cantidades de cobre, aluminio y magnesio son útiles en la fundición a presión , así como en la fundición por centrifugado , especialmente en las industrias automotriz, eléctrica y de hardware. [23] Estas aleaciones se comercializan bajo el nombre de Zamak . [133] Un ejemplo de esto es el zinc y aluminio . El bajo punto de fusión junto con la baja viscosidad de la aleación hace posible la producción de formas pequeñas e intrincadas. La baja temperatura de trabajo conduce a un enfriamiento rápido de los productos fundidos y a una producción rápida para el ensamblaje. [23] [134] Otra aleación, comercializada bajo la marca Prestal, contiene 78% de zinc y 22% de aluminio, y se informa que es casi tan fuerte como el acero pero tan maleable como el plástico. [23] [135] Esta superplasticidad de la aleación permite que se moldee utilizando moldes fundidos a presión hechos de cerámica y cemento. [23]
Aleaciones similares con la adición de una pequeña cantidad de plomo se pueden laminar en frío para formar láminas. Una aleación de 96% de zinc y 4% de aluminio se utiliza para fabricar matrices de estampación para aplicaciones de baja producción para las que las matrices de metal ferroso serían demasiado caras. [136] Para fachadas de edificios, techos y otras aplicaciones para chapa metálica formada por embutición profunda , laminado o doblado , se utilizan aleaciones de zinc con titanio y cobre. [137] El zinc sin alear es demasiado frágil para estos procesos de fabricación. [137]
El zinc, un material denso, económico y de fácil procesamiento, se utiliza como sustituto del plomo . A raíz de las preocupaciones por el plomo , el zinc aparece en pesas para diversas aplicaciones, desde la pesca [138] hasta los balanceadores de neumáticos y los volantes de inercia. [139]
El telururo de cadmio y zinc (CZT) es una aleación semiconductora que se puede dividir en una serie de pequeños dispositivos de detección. [140] Estos dispositivos son similares a un circuito integrado y pueden detectar la energía de los fotones de rayos gamma entrantes. [140] Cuando está detrás de una máscara absorbente, la serie de sensores CZT puede determinar la dirección de los rayos. [140]

Aproximadamente una cuarta parte de toda la producción de zinc en los Estados Unidos en 2009 se consumió en compuestos de zinc; [118] una variedad de los cuales se utilizan industrialmente. El óxido de zinc se usa ampliamente como pigmento blanco en pinturas y como catalizador en la fabricación de caucho para dispersar el calor. El óxido de zinc se utiliza para proteger los polímeros de caucho y los plásticos de la radiación ultravioleta (UV). [122] Las propiedades semiconductoras del óxido de zinc lo hacen útil en varistores y productos de fotocopiado. [141] El ciclo de zinc-óxido de zinc es un proceso termoquímico de dos pasos basado en zinc y óxido de zinc para la producción de hidrógeno . [142]
El cloruro de zinc se añade a menudo a la madera como retardante del fuego [143] y, a veces, como conservante de la madera . [144] Se utiliza en la fabricación de otros productos químicos. [143] El metilzinc ( Zn(CH 3 )
2) se utiliza en varias síntesis orgánicas . [145] El sulfuro de zinc (ZnS) se utiliza en pigmentos luminiscentes como en las manecillas de los relojes, las pantallas de rayos X y de televisión y las pinturas luminosas . [146] Los cristales de ZnS se utilizan en láseres que operan en la parte infrarroja media del espectro. [147] El sulfato de zinc es una sustancia química presente en tintes y pigmentos. [143] La piritiona de zinc se utiliza en pinturas antiincrustantes . [148]
El polvo de zinc se utiliza a veces como propulsor en cohetes modelo . [149] Cuando se enciende una mezcla comprimida de 70% de zinc y 30% de polvo de azufre , se produce una reacción química violenta. [149] Esto produce sulfuro de zinc, junto con grandes cantidades de gas caliente, calor y luz. [149]
La chapa de zinc se utiliza como revestimiento duradero para techos, paredes y encimeras, esta última a menudo vista en bistrós y bares de ostras , y es conocida por el aspecto rústico que imparte la oxidación de su superficie con el uso hasta una pátina gris azulada y la susceptibilidad a los rayones. [150] [151] [152] [153]
64
El Zn , el isótopo más abundante del zinc, es muy susceptible a la activación neutrónica , transmutándose en el altamente radiactivo65
El Zn , que tiene una vida media de 244 días y produce una intensa radiación gamma , por lo que el óxido de zinc utilizado en los reactores nucleares como agente anticorrosivo se ve desprovisto de64
Zn antes de su uso, esto se llama óxido de zinc empobrecido . Por la misma razón, el zinc se ha propuesto como material de salazón para armas nucleares ( el cobalto es otro material de salazón más conocido). [154] Una cubierta de isótopos enriquecidos 64
El Zn sería irradiado por el intenso flujo de neutrones de alta energía de un arma termonuclear en explosión, formando una gran cantidad de65
El Zn aumenta significativamente la radiactividad de las partículas radiactivas del arma . [154] No se sabe que alguna vez se haya construido, probado o utilizado un arma de este tipo. [154]
65
El zinc se utiliza como trazador para estudiar cómo se desgastan las aleaciones que contienen zinc, o la trayectoria y el papel del zinc en los organismos. [155]
Los complejos de ditiocarbamato de zinc se utilizan como fungicidas agrícolas ; estos incluyen Zineb , Metiram, Propineb y Ziram. [156] El naftenato de zinc se utiliza como conservante de la madera. [157] El zinc en forma de ZDDP se utiliza como aditivo antidesgaste para piezas metálicas en aceite de motor. [158]

La química del organocinc es la ciencia de los compuestos que contienen enlaces carbono-cinc, que describe las propiedades físicas, la síntesis y las reacciones químicas. Muchos compuestos de organocinc son importantes desde el punto de vista comercial. [160] [161] [162] [163] Entre las aplicaciones importantes se encuentran:
El zinc ha encontrado muchos usos en la catálisis en síntesis orgánica, incluida la síntesis enantioselectiva , siendo una alternativa barata y fácilmente disponible a los complejos de metales preciosos. Los resultados cuantitativos (rendimiento y exceso enantiomérico ) obtenidos con catalizadores de zinc quirales pueden ser comparables a los logrados con paladio, rutenio, iridio y otros. [166]


En la mayoría de los suplementos vitamínicos y minerales diarios de venta libre y en comprimidos individuales , el zinc se incluye en formas como óxido de zinc , acetato de zinc , gluconato de zinc o quelato de aminoácido de zinc. [167] [168]
En general, se recomienda la administración de suplementos de zinc en los casos en que existe un alto riesgo de deficiencia de este mineral (como en los países de ingresos bajos y medios) como medida preventiva. [169] Aunque el sulfato de zinc es una forma de zinc de uso común, el citrato, el gluconato y el picolinato de zinc también pueden ser opciones válidas. Estas formas se absorben mejor que el óxido de zinc. [170]
El zinc es un componente económico y eficaz del tratamiento de la diarrea en niños en los países en desarrollo. El zinc se agota en el cuerpo durante la diarrea y la reposición de zinc con un tratamiento de 10 a 14 días puede reducir la duración y la gravedad de los episodios de diarrea y también puede prevenir episodios futuros durante hasta tres meses. [171] La gastroenteritis se atenúa en gran medida con la ingestión de zinc, posiblemente por la acción antimicrobiana directa de los iones en el tracto gastrointestinal , o por la absorción del zinc y su liberación nuevamente por parte de las células inmunes (todos los granulocitos secretan zinc), o ambas. [172] [173]
Los suplementos de zinc (con frecuencia, pastillas de acetato de zinc o de gluconato de zinc ) son un grupo de suplementos dietéticos que se utilizan comúnmente en un intento de tratar el resfriado común . [174] La evidencia de cualquier beneficio es débil, pero parece que el zinc puede no prevenir los resfriados, pero posiblemente reduzca su duración sin reducir la gravedad de los síntomas. [175] Los efectos adversos de los suplementos de zinc por vía oral incluyen mal sabor y náuseas . [174] [176] El uso intranasal de aerosoles nasales que contienen zinc se ha asociado con la pérdida del sentido del olfato ; [174] en consecuencia, en junio de 2009, la Administración de Alimentos y Medicamentos de los Estados Unidos (USFDA) advirtió a los consumidores que dejaran de usar zinc intranasal. [174]
El rinovirus humano , el patógeno viral más común en los seres humanos, es la causa predominante del resfriado común. [177] El mecanismo de acción hipotético por el cual el zinc reduce la gravedad y/o duración de los síntomas del resfriado es la supresión de la inflamación nasal y la inhibición directa de la unión del receptor rinoviral y la replicación rinoviral en la mucosa nasal . [174]La deficiencia de zinc puede provocar pérdida de apetito. [178] El uso de zinc en el tratamiento de la anorexia ha sido recomendado desde 1979. Al menos 15 ensayos clínicos han demostrado que el zinc mejoraba el aumento de peso en la anorexia. Un ensayo de 1994 demostró que el zinc duplicaba la tasa de aumento de masa corporal en el tratamiento de la anorexia nerviosa. La deficiencia de otros nutrientes como la tirosina, el triptófano y la tiamina podría contribuir a este fenómeno de "desnutrición inducida por desnutrición". [179] Un metaanálisis de 33 ensayos de intervención prospectivos sobre la suplementación con zinc y sus efectos sobre el crecimiento de los niños en muchos países mostró que la suplementación con zinc por sí sola tenía un efecto estadísticamente significativo sobre el crecimiento lineal y el aumento de peso corporal, lo que indica que otras deficiencias que pueden haber estado presentes no eran responsables del retraso del crecimiento. [180]
Una revisión Cochrane afirmó que las personas que toman suplementos de zinc pueden tener menos probabilidades de progresar a la degeneración macular relacionada con la edad . [181] Los suplementos de zinc son un tratamiento eficaz para la acrodermatitis enteropática , un trastorno genético que afecta la absorción de zinc y que anteriormente era fatal para los bebés afectados. [72] La deficiencia de zinc se ha asociado con el trastorno depresivo mayor (TDM), y los suplementos de zinc pueden ser un tratamiento eficaz. [182] El zinc puede ayudar a las personas a dormir más. [8]
Las preparaciones tópicas de zinc incluyen aquellas que se usan sobre la piel, a menudo en forma de óxido de zinc . El óxido de zinc es generalmente reconocido por la FDA como seguro y efectivo [183] y se considera muy fotoestable. [184] El óxido de zinc es uno de los ingredientes activos más comunes formulados en un protector solar para mitigar las quemaduras solares . [72] Aplicado en una fina capa sobre el área del pañal de un bebé ( perineo ) con cada cambio de pañal, puede proteger contra la dermatitis del pañal . [72]
El zinc quelado se utiliza en pastas de dientes y enjuagues bucales para prevenir el mal aliento ; el citrato de zinc ayuda a reducir la acumulación de sarro . [185] [186]
La piritiona de zinc se incluye ampliamente en los champús para prevenir la caspa. [187]
También se ha demostrado que el zinc tópico trata eficazmente y prolonga la remisión del herpes genital . [188]
El zinc es un oligoelemento esencial para los seres humanos. [6] [7] [8] y otros animales, [9] para las plantas [10] y para los microorganismos . [11] El zinc es necesario para el funcionamiento de más de 300 enzimas y 1000 factores de transcripción , [8] y se almacena y transfiere en metalotioneínas . [189] [190] Es el segundo metal traza más abundante en los seres humanos después del hierro y es el único metal que aparece en todas las clases de enzimas . [10] [8]
En las proteínas, los iones de zinc suelen estar coordinados con las cadenas laterales de aminoácidos del ácido aspártico , el ácido glutámico , la cisteína y la histidina . La descripción teórica y computacional de esta unión del zinc en las proteínas (así como la de otros metales de transición) es difícil. [191]
Aproximadamente entre 2 y 4 gramos de zinc [192] se distribuyen por todo el cuerpo humano. La mayor parte del zinc se encuentra en el cerebro, los músculos, los huesos, los riñones y el hígado, con las mayores concentraciones en la próstata y en partes del ojo. [193] El semen es particularmente rico en zinc, un factor clave en la función de la glándula prostática y el crecimiento de los órganos reproductivos . [194]
La homeostasis del zinc en el organismo está controlada principalmente por el intestino. En este caso, ZIP4 y, especialmente , TRPM7 se relacionaron con la absorción intestinal de zinc, esencial para la supervivencia posnatal. [195] [196]
En los seres humanos, las funciones biológicas del zinc son omnipresentes. [12] [7] Interactúa con "una amplia gama de ligandos orgánicos ", [12] y tiene funciones en el metabolismo del ARN y el ADN, la transducción de señales y la expresión génica . También regula la apoptosis . Una revisión de 2015 indicó que alrededor del 10% de las proteínas humanas (~3000) se unen al zinc, [197] además de cientos más que transportan y trafican el zinc; un estudio in silico similar en la planta Arabidopsis thaliana encontró 2367 proteínas relacionadas con el zinc. [10]
En el cerebro , el zinc se almacena en vesículas sinápticas específicas por neuronas glutamatérgicas y puede modular la excitabilidad neuronal. [7] [8] [198] Desempeña un papel clave en la plasticidad sináptica y, por lo tanto, en el aprendizaje. [7] [199] La homeostasis del zinc también desempeña un papel crítico en la regulación funcional del sistema nervioso central . [7] [198] [8] Se cree que la desregulación de la homeostasis del zinc en el sistema nervioso central que resulta en concentraciones excesivas de zinc sináptico induce neurotoxicidad a través del estrés oxidativo mitocondrial (p. ej., al alterar ciertas enzimas involucradas en la cadena de transporte de electrones , incluido el complejo I , el complejo III y la α-cetoglutarato deshidrogenasa ), la desregulación de la homeostasis del calcio, la excitotoxicidad neuronal glutamatérgica y la interferencia con la transducción de señales intraneuronales . [7] [200] La L- y D-histidina facilitan la captación de zinc en el cerebro. [201] SLC30A3 es el principal transportador de zinc involucrado en la homeostasis cerebral del zinc. [7]


El zinc es un ácido de Lewis eficiente , lo que lo convierte en un agente catalítico útil en la hidroxilación y otras reacciones enzimáticas. [202] El metal también tiene una geometría de coordinación flexible , que permite que las proteínas que lo utilizan cambien rápidamente de conformaciones para realizar reacciones biológicas. [203] Dos ejemplos de enzimas que contienen zinc son la anhidrasa carbónica y la carboxipeptidasa , que son vitales para los procesos de dióxido de carbono ( CO
2) regulación y digestión de proteínas, respectivamente. [204]
En la sangre de los vertebrados, la anhidrasa carbónica convierte el CO
2en bicarbonato y la misma enzima transforma el bicarbonato nuevamente en CO
2para la exhalación a través de los pulmones. [205] Sin esta enzima, esta conversión ocurriría aproximadamente un millón de veces más lento [206] al pH sanguíneo normal de 7 o requeriría un pH de 10 o más. [207] La anhidrasa β-carbónica no relacionada es necesaria en las plantas para la formación de hojas, la síntesis de ácido indol acético (auxina) y la fermentación alcohólica . [208]
La carboxipeptidasa rompe los enlaces peptídicos durante la digestión de las proteínas. Se forma un enlace covalente coordinado entre el péptido terminal y un grupo C=O unido al cinc, lo que le da al carbono una carga positiva. Esto ayuda a crear una cavidad hidrofóbica en la enzima cerca del cinc, que atrae la parte no polar de la proteína que se está digiriendo. [204]
Se ha reconocido que el zinc es un mensajero capaz de activar vías de señalización. Muchas de estas vías son la fuerza impulsora del crecimiento anormal del cáncer y pueden ser atacadas por transportadores ZIP . [209]
El zinc cumple una función puramente estructural en los dedos de zinc , giros y racimos. [210] Los dedos de zinc forman parte de algunos factores de transcripción , que son proteínas que reconocen secuencias de bases de ADN durante la replicación y transcripción del ADN . Cada uno de los nueve o diez Zn2+
Los iones en un dedo de zinc ayudan a mantener la estructura del dedo uniéndose coordinadamente a cuatro aminoácidos en el factor de transcripción. [206]
En el plasma sanguíneo , el zinc se une a la albúmina y es transportado por ésta (60 %, de baja afinidad) y la transferrina (10 %). [192] Debido a que la transferrina también transporta hierro, el exceso de hierro reduce la absorción de zinc, y viceversa. Existe un antagonismo similar con el cobre. [211] La concentración de zinc en el plasma sanguíneo se mantiene relativamente constante independientemente de la ingesta de zinc. [202] Las células de la glándula salival, la próstata, el sistema inmunológico y el intestino utilizan la señalización del zinc para comunicarse con otras células. [212]
El zinc puede estar presente en las reservas de metalotioneína dentro de los microorganismos o en los intestinos o el hígado de los animales. [213] La metalotioneína en las células intestinales es capaz de ajustar la absorción de zinc en un 15-40%. [214] Sin embargo, la ingesta inadecuada o excesiva de zinc puede ser perjudicial; el exceso de zinc perjudica particularmente la absorción de cobre porque la metalotioneína absorbe ambos metales. [215]
El transportador de dopamina humano contiene un sitio de unión de zinc extracelular de alta afinidad que, al unirse al zinc, inhibe la recaptación de dopamina y amplifica el eflujo de dopamina inducido por anfetamina in vitro . [216] [217] [218] El transportador de serotonina humano y el transportador de noradrenalina no contienen sitios de unión de zinc. [218] Algunas proteínas de unión de calcio EF-hand como S100 o NCS-1 también pueden unirse a iones de zinc. [219]
El Instituto de Medicina de los Estados Unidos (IOM) actualizó los Requerimientos Promedio Estimados (EAR) y las Ingestas Dietéticas Recomendadas (RDA) de zinc en 2001. Las EAR actuales para el zinc para mujeres y hombres de 14 años en adelante son 6,8 y 9,4 mg/día, respectivamente. Las RDA son 8 y 11 mg/día. Las RDA son más altas que las EAR para identificar las cantidades que cubrirán a las personas con requerimientos más altos que el promedio. La RDA para el embarazo es de 11 mg/día. La RDA para la lactancia es de 12 mg/día. Para bebés de hasta 12 meses, la RDA es de 3 mg/día. Para niños de 1 a 13 años, la RDA aumenta con la edad de 3 a 8 mg/día. En cuanto a la seguridad, el IOM establece niveles máximos de ingesta tolerables (UL) para vitaminas y minerales cuando la evidencia es suficiente. En el caso del zinc, el UL para adultos es de 40 mg/día, incluidos los alimentos y los suplementos combinados (menor para los niños). En conjunto, las EAR, RDA, AI y UL se denominan Ingestas Dietéticas de Referencia (DRI). [202]
La Autoridad Europea de Seguridad Alimentaria (AESA) se refiere al conjunto colectivo de información como Valores Dietéticos de Referencia, con Ingesta de Referencia Poblacional (PRI) en lugar de RDA, y Requerimiento Promedio en lugar de EAR. AI y UL se definen de la misma manera que en los Estados Unidos. Para las personas de 18 años o más, los cálculos de PRI son complejos, ya que la AESA ha establecido valores cada vez más altos a medida que aumenta el contenido de fitato de la dieta. Para las mujeres, los PRI aumentan de 7,5 a 12,7 mg/día a medida que la ingesta de fitato aumenta de 300 a 1200 mg/día; para los hombres, el rango es de 9,4 a 16,3 mg/día. Estos PRI son más altos que las RDA de EE. UU. [220] La AESA revisó la misma cuestión de seguridad y estableció su UL en 25 mg/día, que es mucho más bajo que el valor de EE. UU. [221]
Para los fines del etiquetado de alimentos y suplementos dietéticos en EE. UU., la cantidad en una porción se expresa como un porcentaje del valor diario (%VD). Para los fines del etiquetado de zinc, el 100 % del valor diario era de 15 mg, pero el 27 de mayo de 2016, se revisó a 11 mg. [222] [223] Se proporciona una tabla de los valores diarios antiguos y nuevos para adultos en Ingesta diaria de referencia .

Los productos animales como la carne, el pescado, los mariscos, las aves, los huevos y los productos lácteos contienen zinc. La concentración de zinc en las plantas varía según el nivel en el suelo. Con una cantidad adecuada de zinc en el suelo, las plantas alimenticias que contienen más zinc son el trigo (germen y salvado) y varias semillas, incluyendo sésamo , amapola , alfalfa , apio y mostaza . [224] El zinc también se encuentra en frijoles , nueces , almendras , granos integrales , semillas de calabaza , semillas de girasol y grosella negra . [225]
Otras fuentes incluyen alimentos fortificados y suplementos dietéticos en diversas formas. Una revisión de 1998 concluyó que el óxido de zinc, uno de los suplementos más comunes en los Estados Unidos, y el carbonato de zinc son casi insolubles y se absorben mal en el cuerpo. [226] Esta revisión citó estudios que encontraron concentraciones plasmáticas de zinc más bajas en los sujetos que consumieron óxido de zinc y carbonato de zinc que en aquellos que tomaron acetato de zinc y sales de sulfato. [226] Para la fortificación, sin embargo, una revisión de 2003 recomendó cereales (que contienen óxido de zinc) como una fuente barata y estable que se absorbe tan fácilmente como las formas más caras. [227] Un estudio de 2005 encontró que varios compuestos de zinc, incluido el óxido y el sulfato, no mostraron diferencias estadísticamente significativas en la absorción cuando se agregaron como fortificantes a las tortillas de maíz. [228]
Casi dos mil millones de personas en el mundo en desarrollo tienen deficiencia de zinc. Los grupos en riesgo incluyen a los niños en países en desarrollo y a los ancianos con enfermedades crónicas. [14] En los niños, causa un aumento de infecciones y diarrea y contribuye a la muerte de unos 800.000 niños en todo el mundo por año. [12] La Organización Mundial de la Salud recomienda la suplementación con zinc para la desnutrición grave y la diarrea. [229] Los suplementos de zinc ayudan a prevenir enfermedades y reducir la mortalidad, especialmente entre los niños con bajo peso al nacer o retraso en el crecimiento. [229] Sin embargo, los suplementos de zinc no deben administrarse solos, porque muchos en el mundo en desarrollo tienen varias deficiencias, y el zinc interactúa con otros micronutrientes. [230] Si bien la deficiencia de zinc generalmente se debe a una ingesta dietética insuficiente, puede estar asociada con malabsorción , acrodermatitis enteropática , enfermedad hepática crónica, enfermedad renal crónica, anemia de células falciformes , diabetes , malignidad y otras enfermedades crónicas. [14]
En Estados Unidos, una encuesta federal sobre el consumo de alimentos determinó que, en el caso de las mujeres y los hombres mayores de 19 años, el consumo promedio era de 9,7 y 14,2 mg/día, respectivamente. En el caso de las mujeres, el 17 % consumía menos que la EAR, y en el de los hombres, el 11 %. Los porcentajes por debajo de la EAR aumentaban con la edad. [231] La actualización más reciente publicada de la encuesta (NHANES 2013-2014) informó promedios más bajos (9,3 y 13,2 mg/día), y nuevamente con una ingesta que disminuía con la edad. [232]
Los síntomas de una deficiencia leve de zinc son diversos. [202] Los resultados clínicos incluyen crecimiento deprimido, diarrea, impotencia y maduración sexual retrasada, alopecia , lesiones oculares y cutáneas, pérdida de apetito, alteración de la cognición, deterioro de las funciones inmunitarias, defectos en el uso de carbohidratos y teratogénesis reproductiva . [202] La deficiencia de zinc deprime la inmunidad, [233] pero el exceso de zinc también lo hace. [192]
A pesar de algunas preocupaciones, [234] los vegetarianos y veganos occidentales no sufren más de deficiencia manifiesta de zinc que los carnívoros. [235] Las principales fuentes vegetales de zinc incluyen frijoles secos cocidos, vegetales marinos, cereales fortificados, alimentos de soja, nueces, guisantes y semillas. [234] Sin embargo, los fitatos en muchos granos integrales y fibras pueden interferir con la absorción de zinc y la ingesta marginal de zinc tiene efectos poco comprendidos. El quelante de zinc fitato , que se encuentra en semillas y salvado de cereales , puede contribuir a la malabsorción de zinc. [14] Algunas evidencias sugieren que puede ser necesario más que la dosis diaria recomendada de EE. UU. (8 mg/día para mujeres adultas; 11 mg/día para hombres adultos) en aquellos cuya dieta es alta en fitatos, como algunos vegetarianos. [234] Las directrices de la Autoridad Europea de Seguridad Alimentaria (AESA) intentan compensar esto recomendando una mayor ingesta de zinc cuando la ingesta dietética de fitato es mayor. [220] Estas consideraciones deben equilibrarse con la escasez de biomarcadores de zinc adecuados , y el indicador más utilizado, el zinc plasmático, tiene poca sensibilidad y especificidad . [236]
Las especies de Calluna , Erica y Vaccinium pueden crecer en suelos metalíferos de zinc, porque la translocación de iones tóxicos se previene por la acción de hongos micorrízicos ericoides . [237]
La deficiencia de zinc parece ser la deficiencia de micronutrientes más común en las plantas de cultivo; es particularmente común en suelos con pH alto. [238] El suelo deficiente en zinc se cultiva en las tierras de cultivo de aproximadamente la mitad de Turquía y la India, un tercio de China y la mayor parte de Australia Occidental. Se han informado respuestas sustanciales a la fertilización con zinc en estas áreas. [10] Las plantas que crecen en suelos deficientes en zinc son más susceptibles a las enfermedades. El zinc se agrega al suelo principalmente a través de la erosión de las rocas, pero los humanos han agregado zinc a través de la combustión de combustibles fósiles, desechos mineros, fertilizantes fosfatados, pesticidas ( fosfuro de zinc ), piedra caliza, estiércol, lodos de depuradora y partículas de superficies galvanizadas. El exceso de zinc es tóxico para las plantas, aunque la toxicidad del zinc está mucho menos extendida. [10]
Aunque el zinc es un requisito esencial para la buena salud, el exceso de zinc puede ser perjudicial. La absorción excesiva de zinc suprime la absorción de cobre y hierro. [215] El ion zinc libre en solución es altamente tóxico para las plantas, los invertebrados e incluso los peces vertebrados. [239] El modelo de actividad de iones libres está bien establecido en la literatura y muestra que solo cantidades micromolares del ion libre matan a algunos organismos. Un ejemplo reciente mostró que 6 micromolares mataban al 93% de todas las Daphnia en el agua. [240]
El ion zinc libre es un ácido de Lewis potente hasta el punto de ser corrosivo . El ácido del estómago contiene ácido clorhídrico , en el que el zinc metálico se disuelve fácilmente para dar lugar a cloruro de zinc corrosivo. La ingestión de una moneda de un centavo estadounidense posterior a 1982 (97,5 % de zinc) puede provocar daños en el revestimiento del estómago debido a la alta solubilidad del ion zinc en el estómago ácido. [241]
La evidencia muestra que las personas que toman de 100 a 300 mg de zinc al día pueden sufrir deficiencia inducida de cobre . Un ensayo de 2007 observó que los hombres de edad avanzada que tomaban 80 mg al día fueron hospitalizados por complicaciones urinarias con más frecuencia que los que tomaban un placebo. [242] Los niveles de 100 a 300 mg pueden interferir con el uso de cobre y hierro o afectar negativamente al colesterol. [215] El zinc en exceso de 500 ppm en el suelo interfiere con la absorción de otros metales esenciales por parte de las plantas, como el hierro y el manganeso. [114] Una condición llamada temblores de zinc o "escalofríos de zinc" puede ser inducida por la inhalación de vapores de zinc mientras se sueldan o se sueldan materiales galvanizados. [146] El zinc es un ingrediente común de la crema para dentaduras postizas que puede contener entre 17 y 38 mg de zinc por gramo. Se han reportado discapacidades e incluso muertes por el uso excesivo de estos productos. [243]
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) afirma que el zinc daña los receptores nerviosos de la nariz, lo que provoca anosmia . También se observaron informes de anosmia en la década de 1930, cuando se utilizaron preparaciones de zinc en un intento fallido de prevenir las infecciones de polio . [244] El 16 de junio de 2009, la FDA ordenó la eliminación de los productos para el resfriado intranasal a base de zinc de los estantes de las tiendas. La FDA dijo que la pérdida del olfato puede ser potencialmente mortal porque las personas con olfato deteriorado no pueden detectar fugas de gas o humo, y no pueden saber si los alimentos se han echado a perder antes de comerlos. [245]
Investigaciones recientes sugieren que el antimicrobiano tópico piritionato de zinc es un potente inductor de respuesta al choque térmico que puede perjudicar la integridad genómica con la inducción de una crisis energética dependiente de PARP en queratinocitos y melanocitos humanos cultivados . [246]
En 1982, la Casa de la Moneda de Estados Unidos comenzó a acuñar monedas de un centavo recubiertas de cobre, pero que contenían principalmente zinc. Las monedas de un centavo de zinc presentan un riesgo de intoxicación por zinc, que puede ser mortal. Un caso notificado de ingestión crónica de 425 monedas de un centavo (más de 1 kg de zinc) resultó en la muerte debido a una sepsis bacteriana y fúngica gastrointestinal . Otro paciente que ingirió 12 gramos de zinc mostró únicamente letargo y ataxia (falta grave de coordinación de los movimientos musculares). [247] Se han notificado varios otros casos de seres humanos que sufrieron intoxicación por zinc por la ingestión de monedas de zinc. [248] [249]
Los perros a veces ingieren centavos y otras monedas pequeñas, por lo que es necesario que el veterinario retire los objetos extraños. El contenido de zinc de algunas monedas puede causar toxicidad por zinc, que suele ser mortal en los perros debido a una anemia hemolítica grave y daño hepático o renal; los vómitos y la diarrea son síntomas posibles. [250] El zinc es muy tóxico para los loros y el envenenamiento puede ser a menudo mortal. [251] El consumo de jugos de frutas almacenados en latas galvanizadas ha provocado envenenamientos masivos de loros con zinc. [72]
El zinc es el segundo metal traza más abundante en el cuerpo humano y es esencial para muchos procesos biológicos. ... El oligoelemento zinc es un cofactor esencial para más de 300 enzimas y 1000 factores de transcripción [16]. ... En el sistema nervioso central, el zinc es el segundo oligoelemento más abundante y está involucrado en muchos procesos. Además de su papel en la actividad enzimática, también juega un papel importante en la señalización celular y la modulación de la actividad neuronal.
El Zn está presente en hasta el 10 % de las proteínas del proteoma humano y el análisis computacional predijo que ~30 % de estas ~3000 proteínas que contienen Zn son enzimas celulares cruciales, como hidrolasas, ligasas, transferasas, oxidorreductasas e isomerasas (42,43).
2+
endógeno de alta afinidad
con tres residuos de coordinación en su cara extracelular (His193, His375 y Glu396). ... Por lo tanto, cuando Zn
2+
se co-libera con glutamato, puede aumentar en gran medida el eflujo de dopamina.