El plomo (pronunciado "led") es un elemento químico ; su símbolo es Pb (del latín plumbum ) y su número atómico es 82. Es un metal pesado más denso que la mayoría de los materiales comunes. El plomo es blando y maleable , y también tiene un punto de fusión relativamente bajo . Cuando está recién cortado, el plomo es de un gris brillante con un toque de azul. Se empaña hasta adquirir un color gris opaco cuando se expone al aire. El plomo tiene el número atómico más alto de todos los elementos estables y tres de sus isótopos son puntos finales de las principales cadenas de desintegración nuclear de elementos más pesados.
El plomo es un metal de post-transición relativamente poco reactivo . Su carácter metálico débil se ilustra por su naturaleza anfótera ; el plomo y los óxidos de plomo reaccionan con ácidos y bases , y tiende a formar enlaces covalentes . Los compuestos de plomo se encuentran generalmente en el estado de oxidación +2 en lugar del estado +4 común con los miembros más ligeros del grupo del carbono . Las excepciones se limitan principalmente a los compuestos orgánicos de plomo . Al igual que los miembros más ligeros del grupo, el plomo tiende a unirse consigo mismo ; puede formar cadenas y estructuras poliédricas.
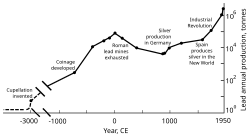
Como el plomo se extrae fácilmente de sus minerales , los pueblos prehistóricos del Cercano Oriente lo conocían . La galena es un mineral principal del plomo que a menudo contiene plata. El interés por la plata ayudó a iniciar la extracción y el uso generalizados del plomo en la antigua Roma . La producción de plomo disminuyó después de la caída de Roma y no alcanzó niveles comparables hasta la Revolución Industrial . El plomo jugó un papel crucial en el desarrollo de la imprenta , ya que los tipos móviles podían fundirse con relativa facilidad a partir de aleaciones de plomo. [9] En 2014, la producción mundial anual de plomo fue de unos diez millones de toneladas, más de la mitad de las cuales procedían del reciclaje. La alta densidad del plomo, su bajo punto de fusión, su ductilidad y su relativa inercia a la oxidación lo hacen útil. Estas propiedades, combinadas con su relativa abundancia y bajo coste, dieron como resultado su amplio uso en la construcción , la fontanería , las baterías , las balas , los perdigones , las pesas , las soldaduras , los peltre , las aleaciones fusibles , las pinturas con plomo , la gasolina con plomo y el blindaje contra la radiación .
El plomo es una neurotoxina que se acumula en los tejidos blandos y los huesos. Daña el sistema nervioso e interfiere en la función de las enzimas biológicas , provocando trastornos neurológicos que van desde problemas de conducta hasta daño cerebral, y también afecta la salud general y los sistemas cardiovascular y renal. La toxicidad del plomo fue documentada por primera vez por los escritores griegos y romanos antiguos, quienes notaron algunos de los síntomas del envenenamiento por plomo , pero se reconoció ampliamente en Europa a fines del siglo XIX d. C.
Un átomo de plomo tiene 82 electrones , dispuestos en una configuración electrónica de [ Xe ]4f 14 5d 10 6s 2 6p 2 . La suma de las energías de ionización primera y segunda del plomo (la energía total requerida para eliminar los dos electrones 6p) es cercana a la del estaño , el vecino superior del plomo en el grupo del carbono . Esto es inusual; las energías de ionización generalmente caen al descender en un grupo, a medida que los electrones externos de un elemento se vuelven más distantes del núcleo y más protegidos por orbitales más pequeños.
La suma de las primeras cuatro energías de ionización del plomo supera a la del estaño, [10] contrariamente a lo que predecirían las tendencias periódicas . Esto se explica por los efectos relativistas , que se vuelven significativos en átomos más pesados, [11] que contraen los orbitales s y p de tal manera que los electrones 6s del plomo tienen energías de enlace mayores que sus electrones 5s. [12] Una consecuencia es el llamado efecto del par inerte : los electrones 6s del plomo se vuelven reacios a participar en la unión, estabilizando el estado de oxidación +2 y haciendo que la distancia entre los átomos más cercanos en el plomo cristalino sea inusualmente larga. [13]
Los congéneres del grupo de carbono más ligero del plomo forman alótropos estables o metaestables con la estructura cúbica de diamante coordinada tetraédricamente y unida covalentemente . Los niveles de energía de sus orbitales s y p externos están lo suficientemente cerca como para permitir la mezcla en cuatro orbitales híbridos sp 3 . En el plomo, el efecto del par inerte aumenta la separación entre sus orbitales s y p, y la brecha no puede ser superada por la energía que se liberaría por enlaces adicionales después de la hibridación. [14] En lugar de tener una estructura cúbica de diamante, el plomo forma enlaces metálicos en los que solo los electrones p están deslocalizados y compartidos entre los iones Pb 2+ . En consecuencia, el plomo tiene una estructura cúbica centrada en las caras [15] como los metales divalentes de tamaño similar [16] calcio y estroncio . [17] [a] [b] [c]
El plomo puro tiene un aspecto gris brillante con un matiz azul. [22] Se empaña al entrar en contacto con el aire húmedo y adquiere un aspecto opaco, cuyo tono depende de las condiciones predominantes. Las propiedades características del plomo incluyen alta densidad , maleabilidad, ductilidad y alta resistencia a la corrosión debido a la pasivación . [23]

La estructura cúbica centrada en las caras y el alto peso atómico del plomo dan como resultado una densidad [24] de 11,34 g/cm 3 , que es mayor que la de metales comunes como el hierro (7,87 g/cm 3 ), el cobre (8,93 g/cm 3 ) y el zinc (7,14 g/cm 3 ). [25] Esta densidad es el origen de la expresión " go over like a lead Balloon" (pasar por encima como un globo de plomo ) . [26] [27] [d] Algunos metales más raros son más densos: el tungsteno y el oro tienen ambos 19,3 g/cm 3 , y el osmio (el metal más denso conocido) tiene una densidad de 22,59 g/cm 3 , casi el doble que el plomo. [28]
El plomo es un metal muy blando con una dureza de Mohs de 1,5; se puede rayar con una uña. [29] Es bastante maleable y algo dúctil. [30] [e] El módulo volumétrico del plomo (una medida de su facilidad de compresibilidad) es de 45,8 GPa . En comparación, el del aluminio es de 75,2 GPa; el del cobre, de 137,8 GPa; y el del acero dulce, de 160-169 GPa. [31] La resistencia a la tracción del plomo , a 12-17 MPa, es baja (la del aluminio es 6 veces mayor, la del cobre, 10 veces, y la del acero dulce, 15 veces mayor); se puede reforzar añadiendo pequeñas cantidades de cobre o antimonio . [32]
El punto de fusión del plomo, a 327,5 °C (621,5 °F) [33] , es muy bajo en comparación con la mayoría de los metales. [24] [f] Su punto de ebullición de 1749 °C (3180 °F) [33] es el más bajo entre los elementos del grupo del carbono. La resistividad eléctrica del plomo a 20 °C es de 192 nanoohmios -metros, casi un orden de magnitud más alta que la de otros metales industriales (cobre a15,43 nΩ·m ; oro20,51 nΩ·m ; y aluminio a24,15 nΩ·m ). [35] El plomo es un superconductor a temperaturas inferiores a 7,19 K ; [36] esta es la temperatura crítica más alta de todos los superconductores de tipo I y la tercera más alta de los superconductores elementales. [37]
El plomo natural consta de cuatro isótopos estables con números másicos de 204, 206, 207 y 208 [38] y trazas de seis radioisótopos de vida corta con números másicos de 209 a 214 inclusive. El alto número de isótopos es consistente con el hecho de que el número atómico del plomo sea par. [g] El plomo tiene un número mágico de protones (82), para el cual el modelo de capas nucleares predice con precisión un núcleo especialmente estable. [39] El plomo-208 tiene 126 neutrones, otro número mágico, que puede explicar por qué el plomo-208 es extraordinariamente estable. [39]
Con su alto número atómico, el plomo es el elemento más pesado cuyos isótopos naturales se consideran estables; el plomo-208 es el núcleo estable más pesado. (Esta distinción anteriormente recaía en el bismuto , con un número atómico de 83, hasta que en 2003 se descubrió que su único isótopo primordial , el bismuto-209, se desintegraba muy lentamente). [h] Los cuatro isótopos estables del plomo podrían, teóricamente, sufrir una desintegración alfa en isótopos de mercurio con una liberación de energía, pero esto no se ha observado en ninguno de ellos; sus vidas medias previstas varían de 10 35 a 10 189 años [42] (al menos 10 25 veces la edad actual del universo).
Tres de los isótopos estables se encuentran en tres de las cuatro principales cadenas de desintegración : plomo-206, plomo-207 y plomo-208 son los productos finales de la desintegración del uranio-238 , uranio-235 y torio-232 , respectivamente. [43] Estas cadenas de desintegración se denominan cadena de uranio , cadena de actinio y cadena de torio . [44] Sus concentraciones isotópicas en una muestra de roca natural dependen en gran medida de la presencia de estos tres isótopos progenitores de uranio y torio. Por ejemplo, la abundancia relativa de plomo-208 puede variar del 52% en muestras normales al 90% en minerales de torio; [45] por esta razón, el peso atómico estándar del plomo se da solo con un decimal. [46] A medida que pasa el tiempo, la proporción de plomo-206 y plomo-207 a plomo-204 aumenta, ya que los dos primeros se complementan con la desintegración radiactiva de elementos más pesados mientras que el último no; esto permite la datación plomo-plomo . A medida que el uranio se desintegra en plomo, sus cantidades relativas cambian; esta es la base para la datación uranio-plomo . [47] El plomo-207 exhibe resonancia magnética nuclear , una propiedad que se ha utilizado para estudiar sus compuestos en solución y estado sólido, [48] [49] incluso en el cuerpo humano. [50]

Aparte de los isótopos estables, que constituyen casi todo el plomo que existe en la naturaleza, existen trazas de algunos isótopos radiactivos. Uno de ellos es el plomo-210; aunque tiene una vida media de solo 22,2 años, [38] se producen pequeñas cantidades en la naturaleza porque el plomo-210 se produce mediante una larga serie de desintegración que comienza con el uranio-238 (que ha estado presente durante miles de millones de años en la Tierra). El plomo-211, −212 y −214 están presentes en las cadenas de desintegración del uranio-235, el torio-232 y el uranio-238, respectivamente, por lo que se encuentran trazas de estos tres isótopos de plomo en la naturaleza. Los rastros diminutos de plomo-209 surgen de la muy rara desintegración en cúmulos del radio-223, uno de los productos derivados del uranio-235 natural, y de la cadena de desintegración del neptunio-237, cuyos rastros se producen por captura de neutrones en los minerales de uranio. El plomo-213 también se encuentra en la cadena de desintegración del neptunio-237. El plomo-210 es particularmente útil para ayudar a identificar las edades de las muestras midiendo su relación con el plomo-206 (ambos isótopos están presentes en una única cadena de desintegración). [51]
En total, se han sintetizado 43 isótopos de plomo, con números de masa 178-220. [38] El plomo-205 es el radioisótopo más estable, con una vida media de alrededor de 1,70 × 107 años. [7] [i] El segundo más estable es el plomo-202, que tiene una vida media de aproximadamente 52.500 años, más larga que cualquiera de los radioisótopos traza naturales. [38]

El plomo a granel expuesto al aire húmedo forma una capa protectora de composición variable. El carbonato de plomo (II) es un componente común; [53] [54] [55] el sulfato o cloruro también pueden estar presentes en entornos urbanos o marítimos. [56] Esta capa hace que el plomo a granel sea efectivamente químicamente inerte en el aire. [56] El plomo en polvo fino, como ocurre con muchos metales, es pirofórico [ 57] y arde con una llama de color blanco azulado. [58]
El flúor reacciona con el plomo a temperatura ambiente y forma fluoruro de plomo (II) . La reacción con el cloro es similar, pero requiere calentamiento, ya que la capa de cloruro resultante disminuye la reactividad de los elementos. [56] El plomo fundido reacciona con los calcógenos para dar calcogenuros de plomo (II). [59]
El plomo metálico resiste al ácido sulfúrico y fosfórico , pero no al ácido clorhídrico o nítrico ; el resultado depende de la insolubilidad y la pasivación posterior de la sal del producto. [60] Los ácidos orgánicos, como el ácido acético , disuelven el plomo en presencia de oxígeno. [56] Los álcalis concentrados disuelven el plomo y forman plumbitas . [61]
El plomo muestra dos estados de oxidación principales: +4 y +2. El estado tetravalente es común para el grupo del carbono. El estado divalente es raro para el carbono y el silicio , menor para el germanio, importante (pero no predominante) para el estaño y es el más importante de los dos estados de oxidación para el plomo. [56] Esto es atribuible a efectos relativistas , específicamente el efecto del par inerte , que se manifiesta cuando hay una gran diferencia de electronegatividad entre el plomo y los aniones óxido , haluro o nitruro , lo que lleva a una carga positiva parcial significativa en el plomo. El resultado es una contracción más fuerte del orbital 6s del plomo que en el caso del orbital 6p, lo que lo hace bastante inerte en compuestos iónicos. El efecto del par inerte es menos aplicable a compuestos en los que el plomo forma enlaces covalentes con elementos de electronegatividad similar, como el carbono en compuestos de organoplomo. En estos, los orbitales 6s y 6p permanecen de tamaño similar y la hibridación sp 3 sigue siendo energéticamente favorable. El plomo, al igual que el carbono, es predominantemente tetravalente en dichos compuestos. [62]
Existe una diferencia relativamente grande en la electronegatividad del plomo (II) en 1,87 y del plomo (IV) en 2,33. Esta diferencia marca la inversión de la tendencia de aumento de la estabilidad del estado de oxidación +4 a medida que se desciende en el grupo de carbonos; el estaño, en comparación, tiene valores de 1,80 en el estado de oxidación +2 y 1,96 en el estado +4. [63]

Los compuestos de plomo (II) son característicos de la química inorgánica del plomo. Incluso los agentes oxidantes fuertes como el flúor y el cloro reaccionan con el plomo para dar solo PbF 2 y PbCl 2 . [56] Los iones de plomo (II) suelen ser incoloros en solución, [64] y se hidrolizan parcialmente para formar Pb(OH) + y finalmente [Pb 4 (OH) 4 ] 4+ (en el que los iones hidroxilo actúan como ligandos puente ), [65] [66] pero no son agentes reductores como lo son los iones de estaño (II). Las técnicas para identificar la presencia del ion Pb 2+ en agua generalmente se basan en la precipitación de cloruro de plomo (II) utilizando ácido clorhídrico diluido. Como la sal de cloruro es escasamente soluble en agua, en soluciones muy diluidas la precipitación de sulfuro de plomo (II) se logra en cambio burbujeando sulfuro de hidrógeno a través de la solución. [67]
El monóxido de plomo existe en dos polimorfos , litargirio α-PbO (rojo) y masicot β-PbO (amarillo), siendo este último estable solo por encima de alrededor de 488 °C. El litargirio es el compuesto inorgánico de plomo más comúnmente utilizado. [68] No existe hidróxido de plomo (II); aumentar el pH de las soluciones de sales de plomo (II) conduce a hidrólisis y condensación. [69] El plomo reacciona comúnmente con calcógenos más pesados. El sulfuro de plomo es un semiconductor , un fotoconductor y un detector de radiación infrarroja extremadamente sensible . Los otros dos calcogenuros, el seleniuro de plomo y el telururo de plomo , también son fotoconductores. Son inusuales en el sentido de que su color se vuelve más claro a medida que desciende en el grupo. [70]

Los dihaluros de plomo están bien caracterizados; esto incluye el diastatido [71] y los haluros mixtos, como PbFCl. La insolubilidad relativa de este último constituye una base útil para la determinación gravimétrica del flúor. El difluoruro fue el primer compuesto sólido iónicamente conductor que se descubrió (en 1834, por Michael Faraday ). [72] Los otros dihaluros se descomponen al exponerse a la luz ultravioleta o visible, especialmente el diyoduro . [73] Se conocen muchos pseudohaluros de plomo (II) , como el cianuro, el cianato y el tiocianato . [70] [74] El plomo (II) forma una amplia variedad de complejos de coordinación de haluros , como [PbCl 4 ] 2− , [PbCl 6 ] 4− y el anión de cadena [Pb 2 Cl 9 ] n 5 n − . [73]
El sulfato de plomo (II) es insoluble en agua, al igual que los sulfatos de otros cationes divalentes pesados . El nitrato de plomo (II) y el acetato de plomo (II) son muy solubles, lo que se aprovecha en la síntesis de otros compuestos de plomo. [75]
Se conocen pocos compuestos inorgánicos de plomo (IV). Solo se forman en soluciones altamente oxidantes y normalmente no existen en condiciones estándar. [76] El óxido de plomo (II) da un óxido mixto en una oxidación posterior, Pb 3 O 4 . Se describe como óxido de plomo (II, IV) , o estructuralmente 2PbO·PbO 2 , y es el compuesto de plomo de valencia mixta más conocido. El dióxido de plomo es un agente oxidante fuerte, capaz de oxidar el ácido clorhídrico a gas de cloro. [77] Esto se debe a que el PbCl 4 esperado que se produciría es inestable y se descompone espontáneamente en PbCl 2 y Cl 2 . [78] De manera análoga al monóxido de plomo , el dióxido de plomo es capaz de formar aniones plumbato . El disulfuro de plomo [79] y el diseleniuro de plomo [80] solo son estables a altas presiones. El tetrafluoruro de plomo , un polvo cristalino amarillo, es estable, pero menos que el difluoruro . El tetracloruro de plomo (un aceite amarillo) se descompone a temperatura ambiente, el tetrabromuro de plomo es aún menos estable y la existencia de tetrayoduro de plomo es cuestionable. [81]

Algunos compuestos de plomo existen en estados de oxidación formales distintos de +4 o +2. El plomo (III) puede obtenerse, como intermediario entre el plomo (II) y el plomo (IV), en complejos organoplomáticos más grandes; este estado de oxidación no es estable, ya que tanto el ion plomo (III) como los complejos más grandes que lo contienen son radicales . [83] [84] [85] Lo mismo se aplica al plomo (I), que puede encontrarse en tales especies radicales. [86]
Se conocen numerosos óxidos mixtos de plomo (II, IV). Cuando el PbO 2 se calienta en el aire, se convierte en Pb 12 O 19 a 293 °C, Pb 12 O 17 a 351 °C, Pb 3 O 4 a 374 °C y, finalmente, PbO a 605 °C. Se puede obtener otro sesquióxido , Pb 2 O 3 , a alta presión, junto con varias fases no estequiométricas. Muchas de ellas muestran estructuras de fluorita defectuosas en las que algunos átomos de oxígeno están reemplazados por vacantes: se puede considerar que el PbO tiene una estructura de este tipo, con cada capa alterna de átomos de oxígeno ausente. [87]
Los estados de oxidación negativos pueden ocurrir como fases Zintl , ya sea como aniones de plomo libres, como en Ba2Pb , donde el plomo formalmente es plomo(−IV), [ 88] o en iones en forma de anillo o en racimos poliédricos sensibles al oxígeno, como el ion bipiramidal trigonal Pb52− , donde dos átomos de plomo son plomo(−I) y tres son plomo(0). [89] En tales aniones, cada átomo está en un vértice poliédrico y contribuye con dos electrones a cada enlace covalente a lo largo de un borde desde sus orbitales híbridos sp3 , siendo los otros dos un par solitario externo . [65] Pueden formarse en amoníaco líquido a través de la reducción de plomo por sodio . [90]

El plomo puede formar cadenas con enlaces múltiples , una propiedad que comparte con sus homólogos más ligeros del grupo del carbono. Su capacidad para hacerlo es mucho menor porque la energía de enlace Pb-Pb es más de tres veces y media menor que la del enlace C-C . [59] Con él mismo, el plomo puede formar enlaces metal-metal de un orden de hasta tres. [91] Con el carbono, el plomo forma compuestos organoplomos similares a los compuestos orgánicos típicos, pero generalmente menos estables que ellos [92] (debido a que el enlace Pb-C es bastante débil). [65] Esto hace que la química organometálica del plomo sea mucho menos amplia que la del estaño. [93] El plomo forma predominantemente compuestos organoplomos(IV), incluso cuando se parte de reactivos inorgánicos de plomo(II); se conocen muy pocos compuestos organoplomos(II). Las excepciones mejor caracterizadas son Pb[CH(SiMe3 ) 2 ] 2 y plumboceno . [ 93]
El análogo principal del compuesto orgánico más simple , el metano , es el plumbano . El plumbano se puede obtener en una reacción entre el plomo metálico y el hidrógeno atómico. [94] Dos derivados simples, el tetrametilplomo y el tetraetiloplomo , son los compuestos organoplomo más conocidos . Estos compuestos son relativamente estables: el tetraetiloplomo solo comienza a descomponerse si se calienta [95] o si se expone a la luz solar o ultravioleta. [96] [j] Con el metal sodio, el plomo forma fácilmente una aleación equimolar que reacciona con haluros de alquilo para formar compuestos organometálicos como el tetraetiloplomo. [97] La naturaleza oxidante de muchos compuestos organoplomo se explota de manera útil: el tetraacetato de plomo es un reactivo de laboratorio importante para la oxidación en la síntesis orgánica. [98] El tetraetiloplomo, una vez agregado a la gasolina para automóviles, se produjo en mayores cantidades que cualquier otro compuesto organometálico, [93] y todavía se usa ampliamente en el combustible para aviones pequeños . [99] Otros compuestos organoplomo son menos estables químicamente. [92] Para muchos compuestos orgánicos no existe un análogo de plomo. [94]
La abundancia de plomo por partícula en el Sistema Solar es de 0,121 ppb (partes por mil millones). [100] [k] Esta cifra es dos veces y media mayor que la del platino , ocho veces más que la del mercurio y diecisiete veces más que la del oro . [100] La cantidad de plomo en el universo está aumentando lentamente [101] a medida que la mayoría de los átomos más pesados (todos ellos inestables) se desintegran gradualmente en plomo. [102] La abundancia de plomo en el Sistema Solar desde su formación hace 4.500 millones de años ha aumentado aproximadamente un 0,75%. [103] La tabla de abundancias del sistema solar muestra que el plomo, a pesar de su número atómico relativamente alto, es más frecuente que la mayoría de los demás elementos con números atómicos superiores a 40. [100]
El plomo primordial, que comprende los isótopos plomo-204, plomo-206, plomo-207 y plomo-208, se creó principalmente como resultado de procesos repetitivos de captura de neutrones que ocurren en las estrellas. Los dos modos principales de captura son los procesos s y r . [104]
En el proceso s (s es de "lento"), las capturas están separadas por años o décadas, lo que permite que los núcleos menos estables experimenten una desintegración beta . [105] Un núcleo estable de talio-203 puede capturar un neutrón y convertirse en talio-204; este experimenta una desintegración beta para dar plomo-204 estable; al capturar otro neutrón, se convierte en plomo-205, que tiene una vida media de alrededor de 17 millones de años. Las capturas posteriores dan como resultado plomo-206, plomo-207 y plomo-208. Al capturar otro neutrón, el plomo-208 se convierte en plomo-209, que rápidamente se desintegra en bismuto-209. Al capturar otro neutrón, el bismuto-209 se convierte en bismuto-210, y este se desintegra beta en polonio-210, que se desintegra alfa en plomo-206. El ciclo termina entonces en plomo-206, plomo-207, plomo-208 y bismuto-209. [106]
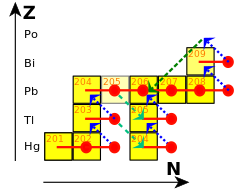
En el proceso r (r es de "rápido"), las capturas ocurren más rápido de lo que los núcleos pueden desintegrarse. [107] Esto ocurre en entornos con una alta densidad de neutrones, como una supernova o la fusión de dos estrellas de neutrones . El flujo de neutrones involucrado puede ser del orden de 10 22 neutrones por centímetro cuadrado por segundo. [108] El proceso r no forma tanto plomo como el proceso s. [109] Tiende a detenerse una vez que los núcleos ricos en neutrones alcanzan los 126 neutrones. [110] En este punto, los neutrones están dispuestos en capas completas en el núcleo atómico, y se vuelve más difícil acomodar energéticamente más de ellos. [111] Cuando el flujo de neutrones disminuye, estos núcleos se desintegran en isótopos estables de osmio , iridio y platino . [112]
El plomo se clasifica como calcófilo según la clasificación de Goldschmidt , lo que significa que generalmente se encuentra combinado con azufre. [113] Rara vez se presenta en su forma nativa , metálica. [114] Muchos minerales de plomo son relativamente ligeros y, a lo largo de la historia de la Tierra, han permanecido en la corteza en lugar de hundirse más profundamente en el interior de la Tierra. Esto explica la abundancia relativamente alta de plomo en la corteza de 14 ppm; es el 36.º elemento más abundante en la corteza. [115] [l]
El principal mineral que contiene plomo es la galena ( PbS), que se encuentra principalmente con minerales de zinc. [ 117] La mayoría de los demás minerales de plomo están relacionados con la galena de alguna manera; la boulangerita , Pb5Sb4S11 , es un sulfuro mixto derivado de la galena; la anglesita , PbSO4 , es un producto de la oxidación de la galena; y la cerusita o mineral de plomo blanco, PbCO3 , es un producto de la descomposición de la galena. El arsénico , el estaño , el antimonio , la plata , el oro , el cobre y el bismuto son impurezas comunes en los minerales de plomo. [117]
Los recursos mundiales de plomo superan los dos mil millones de toneladas. Se encuentran importantes depósitos en Australia, China, Irlanda, México, Perú, Portugal, Rusia y Estados Unidos. Las reservas mundiales (recursos cuya extracción es económicamente factible) sumaron 88 millones de toneladas en 2016, de las cuales Australia tenía 35 millones, China 17 millones y Rusia 6,4 millones. [118]
Las concentraciones típicas de fondo de plomo no superan los 0,1 μg/m3 en la atmósfera; 100 mg/kg en el suelo; 4 mg/kg en la vegetación, 5 μg/L en agua dulce y agua de mar. [119]
La palabra inglesa moderna lead es de origen germánico; proviene del inglés medio leed y del inglés antiguo lēad (con la macrón sobre la "e" que significa que el sonido vocálico de esa letra es largo). [120] La palabra inglesa antigua se deriva del protogermánico hipotético reconstruido * lauda- ('lead'). [121] Según la teoría lingüística, esta palabra tuvo descendientes en múltiples lenguas germánicas con exactamente el mismo significado. [121]
No hay consenso sobre el origen del protogermánico * lauda- . Una hipótesis sugiere que se deriva del protoindoeuropeo * lAudh- ('plomo'; la capitalización de la vocal es equivalente a la macrón). [122] Otra hipótesis sugiere que se tomó prestado del protocelta * ɸloud-io- ('plomo'). Esta palabra está relacionada con el latín plumbum , que dio al elemento su símbolo químico Pb . Se cree que la palabra * ɸloud-io- es el origen del protogermánico * bliwa- (que también significa 'plomo'), del que se derivó el alemán Blei . [123]
El nombre del elemento químico no está relacionado con el verbo de la misma ortografía, que se deriva del protogermánico * laidijan- ('conducir'). [124]
Se han encontrado cuentas de plomo metálico que datan de 7000-6500 a. C. en Asia Menor y pueden representar el primer ejemplo de fundición de metales . [126] En ese momento, el plomo tenía pocas aplicaciones (si es que tenía alguna) debido a su suavidad y apariencia opaca. [126] La principal razón para la expansión de la producción de plomo fue su asociación con la plata, que se puede obtener quemando galena (un mineral de plomo común). [127] Los antiguos egipcios fueron los primeros en usar minerales de plomo en cosméticos, una aplicación que se extendió a la Antigua Grecia y más allá; [128] los egipcios habían usado plomo para plomos en redes de pesca , esmaltes , vasos , esmaltes , adornos . [127] Varias civilizaciones del Creciente Fértil usaban plomo como material de escritura , como monedas , [129] y como material de construcción . [127] El plomo fue utilizado por los antiguos chinos como estimulante , [127] como moneda , [130] como anticonceptivo ; [131] La civilización del valle del Indo y los mesoamericanos lo utilizaban para hacer amuletos ; [127] y los africanos orientales y meridionales utilizaban plomo para trefilar alambres . [132]
Debido a que la plata se usaba ampliamente como material decorativo y medio de intercambio, los depósitos de plomo comenzaron a trabajarse en Asia Menor a partir del 3000 a. C.; más tarde, se desarrollaron depósitos de plomo en el Egeo y Laurion . [133] Estas tres regiones dominaron colectivamente la producción de plomo extraído hasta aproximadamente el 1200 a. C. [ 134] A partir del 2000 a. C., los fenicios trabajaron depósitos en la península Ibérica ; hacia el 1600 a. C., la minería de plomo existía en Chipre , Grecia y Cerdeña . [135]

La expansión territorial de Roma en Europa y el Mediterráneo, y el desarrollo de la minería, la convirtieron en el mayor productor de plomo durante la era clásica , con una producción anual estimada que alcanzó un máximo de 80.000 toneladas. Al igual que sus predecesores, los romanos obtenían plomo principalmente como subproducto de la fundición de plata. [125] [137] La minería de plomo se produjo en Europa central , Gran Bretaña , los Balcanes , Grecia , Anatolia e Hispania , esta última representando el 40% de la producción mundial. [125]

Las tablillas de plomo se usaban comúnmente como material para cartas. [138] Los ataúdes de plomo, fundidos en formas planas de arena y con motivos intercambiables para adaptarse a la fe del difunto, se usaban en la antigua Judea . [139] El plomo se usó para hacer balas de honda desde el siglo V a. C. En la época romana, las balas de honda de plomo se usaban ampliamente y eran efectivas a una distancia de entre 100 y 150 metros. Los honderos baleares , utilizados como mercenarios en los ejércitos cartagineses y romanos, eran famosos por su distancia de tiro y precisión. [140]

El plomo se utilizaba para fabricar tuberías de agua en el Imperio Romano ; la palabra latina para el metal, plumbum , es el origen de la palabra inglesa " plomería ". Su facilidad de trabajo, su bajo punto de fusión que permite la fácil fabricación de juntas soldadas completamente impermeables y su resistencia a la corrosión [141] aseguraron su uso generalizado en otras aplicaciones, incluidas las farmacéuticas, los techos, la moneda y la guerra. [142] [143] [144] Los escritores de la época, como Catón el Viejo , Columela y Plinio el Viejo , recomendaban recipientes de plomo (y revestidos de plomo) para la preparación de edulcorantes y conservantes añadidos al vino y a los alimentos. El plomo confería un sabor agradable debido a la formación de "azúcar de plomo" ( acetato de plomo (II) ), mientras que los recipientes de cobre impartían un sabor amargo a través de la formación de cardenillo . [145]
Este metal fue, con diferencia, el material más utilizado en la Antigüedad clásica, y es apropiado hacer referencia a la Edad del Plomo (romana). El plomo era para los romanos lo que el plástico es para nosotros.
Heinz Eschnauer y Markus Stoeppler
"Vino: un banco de muestras enológicas", 1992 [146]
El autor romano Vitruvio informó sobre los peligros para la salud del plomo [147] [148] y los escritores modernos han sugerido que el envenenamiento por plomo jugó un papel importante en la decadencia del Imperio Romano . [149] [150] [n] Otros investigadores han criticado tales afirmaciones, señalando, por ejemplo, que no todo el dolor abdominal es causado por envenenamiento por plomo. [152] [153] Según la investigación arqueológica, las tuberías de plomo romanas aumentaron los niveles de plomo en el agua del grifo, pero era "poco probable que tal efecto haya sido realmente dañino". [154] [155] Cuando se produjo un envenenamiento por plomo, las víctimas fueron llamadas "saturninas", oscuras y cínicas, en honor al macabro padre de los dioses, Saturno . Por asociación, el plomo era considerado el padre de todos los metales. [156] Su estatus en la sociedad romana era bajo, ya que estaba fácilmente disponible [157] y era barato. [158]
Desde la Edad del Bronce , los metalúrgicos e ingenieros han comprendido la diferencia entre el raro y valioso estaño , esencial para la aleación con cobre para producir bronce resistente y resistente a la corrosión , y el plomo, "barato y alegre". Sin embargo, la nomenclatura en algunos idiomas es similar. Los romanos llamaban al plomo plumbum nigrum ("plomo negro") y al estaño plumbum candidum ("plomo brillante"). La asociación del plomo y el estaño se puede ver en otros idiomas: la palabra olovo en checo se traduce como "plomo", pero en ruso, su cognado олово ( olovo ) significa "estaño". [159] Para aumentar la confusión, el plomo tenía una estrecha relación con el antimonio: ambos elementos se presentan comúnmente como sulfuros (galena y estibina ), a menudo juntos. Plinio escribió incorrectamente que la estibina daría plomo al calentarse, en lugar de antimonio. [160] En países como Turquía y la India, el nombre originalmente persa surma pasó a referirse tanto al sulfuro de antimonio como al sulfuro de plomo, [161] y en algunos idiomas, como el ruso, dio su nombre al antimonio ( сурьма ). [162]
_-_Portrait_of_Queen_Elizabeth_I_-_Google_Art_Project.jpg/440px-Nicholas_Hilliard_(called)_-_Portrait_of_Queen_Elizabeth_I_-_Google_Art_Project.jpg)
La minería de plomo en Europa occidental disminuyó después de la caída del Imperio Romano de Occidente , y la Iberia árabe fue la única región con una producción significativa. [164] [165] La mayor producción de plomo se produjo en el sur y el este de Asia, especialmente en China y la India, donde la minería de plomo creció rápidamente. [165]
En Europa, la producción de plomo comenzó a aumentar en los siglos XI y XII, cuando se volvió a utilizar para techos y tuberías. A partir del siglo XIII, el plomo se utilizó para crear vidrieras . [166] En las tradiciones europeas y árabes de la alquimia , el plomo (símbolo ♄ en la tradición europea) [167] se consideraba un metal base impuro que, mediante la separación, purificación y equilibrio de sus esencias constituyentes, podía transformarse en oro puro e incorruptible. [168] Durante el período, el plomo se utilizó cada vez más para adulterar el vino. El uso de dicho vino fue prohibido para su uso en ritos cristianos por una bula papal en 1498, pero continuó siendo bebido y resultó en envenenamientos masivos hasta fines del siglo XVIII. [164] [169] El plomo era un material clave en partes de la imprenta , y los trabajadores de la impresión inhalaban comúnmente polvo de plomo, lo que causaba envenenamiento por plomo. [170] El plomo también se convirtió en el material principal para fabricar balas para armas de fuego: era barato, menos dañino para los cañones de hierro, tenía una mayor densidad (lo que permitía una mejor retención de la velocidad) y su punto de fusión más bajo facilitaba la producción de balas, ya que podían fabricarse utilizando un fuego de leña. [171] El plomo, en forma de cerusa veneciana , fue ampliamente utilizado en cosméticos por la aristocracia de Europa occidental, ya que los rostros blanqueados se consideraban un signo de modestia. [172] [173] Esta práctica luego se expandió a las pelucas blancas y los delineadores de ojos, y solo se desvaneció con la Revolución Francesa a fines del siglo XVIII. Una moda similar apareció en Japón en el siglo XVIII con el surgimiento de las geishas , una práctica que continuó hasta bien entrado el siglo XX. Los rostros blancos de las mujeres "llegaron a representar su virtud femenina como mujeres japonesas", [174] y el plomo se usaba comúnmente en el blanqueador. [175]
En el Nuevo Mundo , la producción de plomo se registró poco después de la llegada de los colonos europeos. El registro más antiguo data de 1621 en la colonia inglesa de Virginia , catorce años después de su fundación. [176] En Australia, la primera mina abierta por colonos en el continente fue una mina de plomo, en 1841. [177] En África, la minería y fundición de plomo eran conocidas en la depresión de Benue [178] y la cuenca baja del Congo , donde el plomo se usaba para el comercio con los europeos y como moneda en el siglo XVII, [179] mucho antes de la lucha por África .

En la segunda mitad del siglo XVIII, Gran Bretaña, y más tarde Europa continental y Estados Unidos, experimentaron la Revolución Industrial . Esta fue la primera vez durante la cual las tasas de producción de plomo superaron las de Roma. [180] Gran Bretaña fue el principal productor, perdiendo este estatus a mediados del siglo XIX con el agotamiento de sus minas y el desarrollo de la minería de plomo en Alemania, España y Estados Unidos. [181] Para 1900, Estados Unidos era el líder en la producción mundial de plomo, y otras naciones no europeas (Canadá, México y Australia) habían comenzado una producción significativa; la producción fuera de Europa excedió a la interna. [182] Una gran parte de la demanda de plomo provenía de la plomería y la pintura: las pinturas con plomo se usaban regularmente. [183] En este momento, más personas (de clase trabajadora) estaban expuestas al metal y los casos de envenenamiento por plomo aumentaron. Esto condujo a la investigación sobre los efectos de la ingesta de plomo. Se demostró que el plomo era más peligroso en su forma de humo que como metal sólido. El envenenamiento por plomo y la gota estaban vinculados; El médico británico Alfred Baring Garrod observó que un tercio de sus pacientes con gota eran fontaneros y pintores. Los efectos de la ingestión crónica de plomo, incluidos los trastornos mentales, también se estudiaron en el siglo XIX. Las primeras leyes destinadas a reducir el envenenamiento por plomo en las fábricas se promulgaron durante las décadas de 1870 y 1880 en el Reino Unido. [183]

A finales del siglo XIX y principios del XX se descubrieron más pruebas de la amenaza que suponía el plomo para los seres humanos. Se comprendieron mejor los mecanismos de daño, se documentó la ceguera causada por el plomo y el elemento se eliminó gradualmente del uso público en los Estados Unidos y Europa. El Reino Unido introdujo inspecciones obligatorias de fábricas en 1878 y nombró al primer Inspector Médico de Fábricas en 1898; como resultado, se informó de una disminución de 25 veces en los incidentes de envenenamiento por plomo entre 1900 y 1944. [184] La mayoría de los países europeos prohibieron la pintura con plomo, de uso común debido a su opacidad y resistencia al agua [185] , para interiores en 1930. [186]
La última exposición humana importante al plomo fue la adición de tetraetilo de plomo a la gasolina como agente antidetonante , una práctica que se originó en los Estados Unidos en 1921. Se eliminó gradualmente en los Estados Unidos y la Unión Europea en 2000. [183]
En la década de 1970, Estados Unidos y los países de Europa occidental introdujeron una legislación para reducir la contaminación del aire por plomo. [187] [188] El impacto fue significativo: mientras que un estudio realizado por los Centros para el Control y la Prevención de Enfermedades en los Estados Unidos en 1976-1980 mostró que el 77,8% de la población tenía niveles elevados de plomo en sangre , en 1991-1994, un estudio del mismo instituto mostró que la proporción de personas con niveles tan altos se redujo al 2,2%. [189] El principal producto hecho de plomo a finales del siglo XX era la batería de plomo-ácido . [190]
Entre 1960 y 1990, la producción de plomo en el bloque occidental aumentó aproximadamente un 31%. [191] La participación del bloque oriental en la producción mundial de plomo aumentó del 10% al 30% entre 1950 y 1990, siendo la Unión Soviética el mayor productor mundial a mediados de los años 1970 y 1980, y China comenzó a producir plomo a gran escala a fines del siglo XX. [192] A diferencia de los países comunistas europeos, China estaba en gran parte desindustrializada a mediados del siglo XX; en 2004, China superó a Australia como el mayor productor de plomo. [193] Como fue el caso durante la industrialización europea, el plomo ha tenido un efecto negativo en la salud en China. [194]

A partir de 2014, la producción de plomo está aumentando en todo el mundo debido a su uso en baterías de plomo-ácido. [195] Hay dos categorías principales de producción: primaria a partir de minerales extraídos y secundaria a partir de chatarra. En 2014, 4,58 millones de toneladas métricas provinieron de la producción primaria y 5,64 millones de la producción secundaria. Los tres principales productores de concentrado de plomo extraído en ese año fueron China, Australia y Estados Unidos. [118] Los tres principales productores de plomo refinado fueron China, Estados Unidos e India. [196] Según el informe Metal Stocks in Society de 2010, la cantidad total de plomo en uso, almacenado, descartado o disipado en el medio ambiente, a nivel mundial, es de 8 kg per cápita. Gran parte de esto se encuentra en los países más desarrollados (20-150 kg per cápita) en lugar de los menos desarrollados (1-4 kg per cápita). [197]
Los procesos de producción de plomo primario y secundario son similares. Algunas plantas de producción primaria complementan ahora sus operaciones con plomo de desecho, y es probable que esta tendencia aumente en el futuro. Si se utilizan técnicas adecuadas, el plomo obtenido mediante procesos secundarios es indistinguible del obtenido mediante procesos primarios. El plomo de desecho de la industria de la construcción suele ser bastante limpio y se vuelve a fundir sin necesidad de fundición, aunque a veces es necesario refinarlo. Por lo tanto, la producción de plomo secundario es más barata, en términos de requisitos energéticos, que la producción primaria, a menudo en un 50% o más. [198]
La mayoría de los minerales de plomo contienen un bajo porcentaje de plomo (los minerales ricos tienen un contenido típico de 3-8%) que debe concentrarse para su extracción. [199] Durante el procesamiento inicial, los minerales suelen sufrir trituración, separación de medio denso, molienda , flotación por espuma y secado . El concentrado resultante, que tiene un contenido de plomo de 30-80% en masa (regularmente 50-60%), [199] se convierte luego en plomo metálico (impuro).
Existen dos formas principales de hacerlo: un proceso de dos etapas que implica la tostación seguida de la extracción en un alto horno, que se lleva a cabo en recipientes separados; o un proceso directo en el que la extracción del concentrado se realiza en un solo recipiente. Este último se ha convertido en la ruta más común, aunque el primero sigue siendo importante. [200]
En primer lugar, el concentrado de sulfuro se tuesta al aire para oxidar el sulfuro de plomo: [201]
Como el concentrado original no era sulfuro de plomo puro, la tostación produce no sólo el óxido de plomo (II) deseado, sino una mezcla de óxidos, sulfatos y silicatos de plomo y de los otros metales contenidos en el mineral. [202] Este óxido de plomo impuro se reduce en un alto horno alimentado con coque al metal (de nuevo, impuro): [203]
Las impurezas son principalmente arsénico, antimonio, bismuto, zinc, cobre, plata y oro. Por lo general, se eliminan en una serie de procesos pirometalúrgicos . La masa fundida se trata en un horno de reverbero con aire, vapor y azufre, que oxida las impurezas excepto la plata, el oro y el bismuto. Los contaminantes oxidados flotan en la parte superior de la masa fundida y se eliminan. [204] [205] La plata y el oro metálicos se eliminan y recuperan de forma económica mediante el proceso Parkes , en el que se añade zinc al plomo. El zinc, que es inmiscible en el plomo, disuelve la plata y el oro. La solución de zinc se puede separar del plomo y recuperar la plata y el oro. [205] [206] El plomo desplateado se libera del bismuto mediante el proceso Betterton-Kroll , tratándolo con calcio y magnesio metálicos . La escoria de bismuto resultante se puede eliminar. [205]
Como alternativa a los procesos pirometalúrgicos, se puede obtener plomo muy puro procesando el plomo fundido electrolíticamente mediante el proceso Betts . Los ánodos de plomo impuro y los cátodos de plomo puro se colocan en un electrolito de fluorosilicato de plomo (PbSiF 6 ). Una vez que se aplica potencial eléctrico, el plomo impuro en el ánodo se disuelve y se deposita sobre el cátodo, dejando la mayoría de las impurezas en solución. [205] [207] Este es un proceso de alto costo y, por lo tanto, se reserva principalmente para refinar lingotes que contienen altos porcentajes de impurezas. [208]
En este proceso, el plomo en lingotes y la escoria se obtienen directamente de los concentrados de plomo. El concentrado de sulfuro de plomo se funde en un horno y se oxida, formando monóxido de plomo. Se añade carbono (como coque o gas de hulla [o] ) a la carga fundida junto con agentes fundentes . De este modo, el monóxido de plomo se reduce a plomo metálico, en medio de una escoria rica en monóxido de plomo. [200]
Si el insumo es rico en plomo, se puede obtener hasta un 80% del plomo original en forma de lingotes; el 20% restante forma una escoria rica en monóxido de plomo. En el caso de una alimentación de baja calidad, todo el plomo se puede oxidar hasta formar una escoria con alto contenido de plomo. [200] El plomo metálico se obtiene además a partir de las escorias con alto contenido de plomo (25-40%) mediante combustión o inyección de combustible sumergido, reducción asistida por un horno eléctrico o una combinación de ambas. [200]
La investigación sobre un proceso de extracción de plomo más limpio y que consuma menos energía continúa; un inconveniente importante es que o bien se pierde demasiado plomo como residuo, o bien las alternativas dan lugar a un alto contenido de azufre en el plomo metálico resultante. La extracción hidrometalúrgica , en la que se sumergen ánodos de plomo impuro en un electrolito y se deposita plomo puro ( electrobobinado ) sobre cátodos , es una técnica que puede tener potencial, pero que actualmente no es económica, excepto en los casos en que la electricidad es muy barata. [209]
La fundición, que es una parte esencial de la producción primaria, a menudo se omite durante la producción secundaria. Solo se realiza cuando el plomo metálico ha sufrido una oxidación significativa. [198] El proceso es similar al de la producción primaria, ya sea en un alto horno o en un horno rotatorio , con la diferencia esencial de que los rendimientos son más variables: los altos hornos producen plomo duro (10 % de antimonio), mientras que los hornos de reverbero y rotatorios producen plomo semiblando (3-4 % de antimonio). [210]
El proceso ISASMELT es un método de fundición más reciente que puede actuar como una extensión de la producción primaria; a la pasta de batería de baterías de plomo-ácido usadas (que contienen sulfato de plomo y óxidos de plomo) se le elimina el sulfato tratándola con álcali, y luego se la trata en un horno alimentado con carbón en presencia de oxígeno, lo que produce plomo impuro, siendo el antimonio la impureza más común. [211] La refinación del plomo secundario es similar a la del plomo primario; algunos procesos de refinación pueden omitirse dependiendo del material reciclado y su posible contaminación. [211]
Entre las fuentes de plomo para reciclaje, las baterías de plomo-ácido son las más importantes; las tuberías, láminas y revestimientos de cables de plomo también son importantes. [198]

Contrariamente a la creencia popular, las minas de los lápices de madera nunca han sido hechas de plomo. Cuando el lápiz se originó como una herramienta de escritura de grafito envuelto, el tipo particular de grafito utilizado se llamaba plumbago (literalmente, maqueta de plomo ). [213]
El plomo metálico tiene varias propiedades mecánicas útiles, entre ellas, alta densidad, bajo punto de fusión, ductilidad y relativa inercia. Muchos metales son superiores al plomo en algunos de estos aspectos, pero generalmente son menos comunes y más difíciles de extraer de los minerales originales. La toxicidad del plomo ha hecho que se lo deje de usar para algunos usos. [214]
El plomo se ha utilizado para las balas desde su invención en la Edad Media. Es barato; su bajo punto de fusión significa que la munición de armas pequeñas y los perdigones de escopeta se pueden fundir con un equipo técnico mínimo; y es más denso que otros metales comunes, lo que permite una mejor retención de la velocidad. Sigue siendo el material principal para las balas, aleado con otros metales como endurecedores. [171] Se ha expresado la preocupación de que las balas de plomo utilizadas para la caza pueden dañar el medio ambiente. [p] Los cartuchos de escopeta utilizados para la caza de aves acuáticas deben estar hoy libres de plomo en los Estados Unidos , [216] Canadá , [217] y en Europa . [218]
La alta densidad del plomo y su resistencia a la corrosión se han aprovechado en diversas aplicaciones relacionadas. Se utiliza como lastre en las quillas de los veleros; su densidad le permite ocupar un volumen pequeño y minimizar la resistencia al agua, contrarrestando así el efecto de escora del viento sobre las velas. [219] Se utiliza en los cinturones de peso de los buceadores para contrarrestar la flotabilidad del buceador. [220] En 1993, la base de la Torre Inclinada de Pisa se estabilizó con 600 toneladas de plomo. [221] Debido a su resistencia a la corrosión, el plomo se utiliza como funda protectora para cables submarinos. [222]
_07.jpg/440px-Parc_de_Versailles,_Bassin_de_Flore,_Jean-Baptiste_Tuby_(1672-79)_07.jpg)
El plomo tiene muchos usos en la industria de la construcción; las láminas de plomo se utilizan como metales arquitectónicos en materiales para techos , revestimientos , tapajuntas , canaletas y juntas de canaletas, parapetos de techos. [223] [224] El plomo todavía se utiliza en estatuas y esculturas, [q] incluso para armaduras . [226] En el pasado, se utilizaba a menudo para equilibrar las ruedas de los automóviles ; por razones medioambientales, este uso se está eliminando gradualmente en favor de otros materiales. [118]
El plomo se añade a las aleaciones de cobre, como el latón y el bronce , para mejorar la maquinabilidad y por sus cualidades lubricantes. Al ser prácticamente insoluble en cobre, el plomo forma glóbulos sólidos en imperfecciones a lo largo de la aleación, como los límites de grano . En bajas concentraciones, además de actuar como lubricante, los glóbulos impiden la formación de virutas a medida que se trabaja la aleación, mejorando así la maquinabilidad. Las aleaciones de cobre con mayores concentraciones de plomo se utilizan en cojinetes . El plomo proporciona lubricación y el cobre proporciona el soporte de carga. [227]
La alta densidad, el número atómico y la formabilidad del plomo forman la base para el uso del plomo como una barrera que absorbe el sonido, la vibración y la radiación. [228] El plomo no tiene frecuencias de resonancia naturales; [228] como resultado, las láminas de plomo se utilizan como una capa amortiguadora de sonido en las paredes, pisos y techos de los estudios de sonido. [229] Los tubos de órgano a menudo están hechos de una aleación de plomo, mezclada con varias cantidades de estaño para controlar el tono de cada tubo. [230] [231] El plomo es un material de protección establecido contra la radiación en la ciencia nuclear y en las salas de rayos X [232] debido a su densidad y alto coeficiente de atenuación . [233] El plomo fundido se ha utilizado como refrigerante para reactores rápidos refrigerados por plomo . [234]
El plomo se utiliza con mayor frecuencia a principios del siglo XXI en baterías de plomo-ácido . El plomo de las baterías no entra en contacto directo con los seres humanos, por lo que existen menos problemas de toxicidad. [r] Las personas que trabajan en plantas de producción o reciclaje de baterías de plomo pueden estar expuestas al polvo de plomo e inhalarlo. [236] Las reacciones en la batería entre el plomo, el dióxido de plomo y el ácido sulfúrico proporcionan una fuente confiable de voltaje . [s] Los supercondensadores que incorporan baterías de plomo-ácido se han instalado en aplicaciones a escala de kilovatios y megavatios en Australia, Japón y Estados Unidos en regulación de frecuencia, suavizado y desplazamiento solar, suavizado del viento y otras aplicaciones. [238] Estas baterías tienen una densidad de energía y una eficiencia de carga y descarga más bajas que las baterías de iones de litio , pero son significativamente más baratas. [239]
El plomo se utiliza en cables de alta tensión como material de cubierta para evitar la difusión de agua en el aislamiento; este uso está disminuyendo a medida que se elimina gradualmente el plomo. [240] Su uso en soldaduras para dispositivos electrónicos también se está eliminando gradualmente en algunos países para reducir la cantidad de desechos peligrosos para el medio ambiente . [241] El plomo es uno de los tres metales utilizados en la prueba Oddy para materiales de museos, que ayuda a detectar ácidos orgánicos, aldehídos y gases ácidos. [242] [243]


Además de ser la principal aplicación del plomo metálico, las baterías de plomo-ácido también son el principal consumidor de compuestos de plomo. La reacción de almacenamiento/liberación de energía que se utiliza en estos dispositivos implica sulfato de plomo y dióxido de plomo :
Otras aplicaciones de los compuestos de plomo son muy especializadas y a menudo se desvanecen. Los agentes colorantes a base de plomo se utilizan en esmaltes cerámicos y vidrio, especialmente para tonos rojos y amarillos. [244] Si bien las pinturas con plomo se están eliminando gradualmente en Europa y América del Norte, siguen utilizándose en países menos desarrollados como China, [245] India, [246] o Indonesia. [247] El tetraacetato de plomo y el dióxido de plomo se utilizan como agentes oxidantes en química orgánica. El plomo se utiliza con frecuencia en el revestimiento de cloruro de polivinilo de los cables eléctricos. [248] [249] Se puede utilizar para tratar las mechas de las velas para garantizar una combustión más prolongada y uniforme. Debido a su toxicidad, los fabricantes europeos y norteamericanos utilizan alternativas como el zinc. [250] [251] El vidrio con plomo está compuesto de un 12-28% de óxido de plomo , lo que cambia sus características ópticas y reduce la transmisión de radiación ionizante, [252] una propiedad utilizada en televisores antiguos y monitores de ordenador con tubos de rayos catódicos . Los semiconductores a base de plomo, como el telururo de plomo y el seleniuro de plomo, se utilizan en células fotovoltaicas y detectores infrarrojos . [253]
El plomo no tiene un papel biológico confirmado y no hay un nivel seguro confirmado de exposición al plomo. [255] Un estudio canadiense-estadounidense de 2009 concluyó que incluso en niveles que se consideran que plantean poco o ningún riesgo, el plomo puede causar "resultados adversos para la salud mental". [256] Su prevalencia en el cuerpo humano (con un promedio de 120 mg [t] en adultos) es, sin embargo, superada solo por el zinc (2500 mg) y el hierro (4000 mg) entre los metales pesados. [258] Las sales de plomo son absorbidas de manera muy eficiente por el cuerpo. [259] Una pequeña cantidad de plomo (1%) se almacena en los huesos; el resto se excreta en la orina y las heces en unas pocas semanas después de la exposición. Un niño solo excreta alrededor de un tercio del plomo. La exposición continua puede resultar en la bioacumulación de plomo. [260]
El plomo es un metal altamente venenoso (ya sea inhalado o ingerido), que afecta a casi todos los órganos y sistemas del cuerpo humano. [261] En niveles de 100 mg/m3 en el aire , es inmediatamente peligroso para la vida y la salud . [262] La mayor parte del plomo ingerido se absorbe en el torrente sanguíneo. [263] La causa principal de su toxicidad es su predilección por interferir con el funcionamiento adecuado de las enzimas. Lo hace uniéndose a los grupos sulfhidrilo que se encuentran en muchas enzimas, [264] o imitando y desplazando a otros metales que actúan como cofactores en muchas reacciones enzimáticas. [265] Los metales esenciales con los que interactúa el plomo incluyen calcio, hierro y zinc. [266] Los altos niveles de calcio y hierro tienden a proporcionar cierta protección contra el envenenamiento por plomo; los niveles bajos causan una mayor susceptibilidad. [259]
El plomo puede causar graves daños al cerebro y a los riñones y, en última instancia, la muerte. Al imitar al calcio, el plomo puede atravesar la barrera hematoencefálica . Degrada las vainas de mielina de las neuronas , reduce su número, interfiere en las vías de neurotransmisión y disminuye el crecimiento neuronal. [264] En el cuerpo humano, el plomo inhibe la porfobilinógeno sintasa y la ferroquelatasa , impidiendo tanto la formación de porfobilinógeno como la incorporación de hierro a la protoporfirina IX , el paso final en la síntesis del hemo . Esto provoca una síntesis ineficaz del hemo y anemia microcítica . [267]

Los síntomas de envenenamiento por plomo incluyen nefropatía , dolores abdominales similares a cólicos y posiblemente debilidad en los dedos, muñecas o tobillos. Pueden ser evidentes pequeños aumentos de la presión arterial, particularmente en personas de mediana edad y mayores, que pueden causar anemia . [ cita requerida ] Varios estudios, en su mayoría transversales, encontraron una asociación entre una mayor exposición al plomo y una disminución de la variabilidad de la frecuencia cardíaca. [268] En mujeres embarazadas, los altos niveles de exposición al plomo pueden causar abortos espontáneos. Se ha demostrado que la exposición crónica a altos niveles reduce la fertilidad en los hombres. [269]
En el cerebro en desarrollo de un niño, el plomo interfiere con la formación de sinapsis en la corteza cerebral , el desarrollo neuroquímico (incluido el de los neurotransmisores) y la organización de los canales iónicos . [270] La exposición en la primera infancia se ha relacionado con un mayor riesgo de trastornos del sueño y somnolencia diurna excesiva en la infancia posterior. [271] Los niveles altos en sangre se asocian con un retraso en la pubertad en las niñas. [272] El aumento y la caída de la exposición al plomo en el aire de la combustión de tetraetilo de plomo en la gasolina durante el siglo XX se ha relacionado con aumentos y disminuciones históricas en los niveles de delincuencia .
La exposición al plomo es un problema mundial, ya que la extracción y fundición de plomo, así como la fabricación, eliminación y reciclaje de baterías , son actividades habituales en muchos países. El plomo entra en el organismo por inhalación, ingestión o absorción cutánea. Casi todo el plomo inhalado se absorbe en el organismo; en el caso de la ingestión, la tasa es del 20 al 70%, y los niños absorben un porcentaje mayor que los adultos. [273]
El envenenamiento generalmente resulta de la ingestión de alimentos o agua contaminados con plomo, y con menos frecuencia después de la ingestión accidental de tierra contaminada, polvo o pintura a base de plomo. [274] Los productos de agua de mar pueden contener plomo si se ven afectados por aguas industriales cercanas. [275] Las frutas y verduras pueden contaminarse por altos niveles de plomo en los suelos en los que se cultivaron. El suelo puede contaminarse a través de la acumulación de partículas de plomo en las tuberías, pintura con plomo y emisiones residuales de gasolina con plomo. [276]
El uso de plomo para las tuberías de agua es un problema en áreas con agua blanda o ácida . [277] El agua dura forma capas protectoras insolubles en la superficie interior de las tuberías, mientras que el agua blanda y ácida disuelve las tuberías de plomo. [278] El dióxido de carbono disuelto en el agua transportada puede dar lugar a la formación de bicarbonato de plomo soluble ; el agua oxigenada puede disolver el plomo de forma similar al hidróxido de plomo (II) . Beber este tipo de agua, con el tiempo, puede causar problemas de salud debido a la toxicidad del plomo disuelto. Cuanto más dura es el agua, más bicarbonato de calcio y sulfato contiene, y más se recubre el interior de las tuberías con una capa protectora de carbonato de plomo o sulfato de plomo. [279]

La ingestión de pintura a base de plomo aplicada es la principal fuente de exposición para los niños: una fuente directa es masticar alféizares de ventanas viejos y pintados. Además, a medida que la pintura con plomo se deteriora sobre una superficie, se descascara y se pulveriza hasta convertirse en polvo. El polvo luego ingresa al cuerpo a través del contacto de las manos con la boca o de alimentos o bebidas contaminados. La ingestión de ciertos remedios caseros puede dar lugar a la exposición al plomo o sus compuestos. [280]
La inhalación es la segunda vía de exposición más importante, que afecta a los fumadores y, especialmente, a los trabajadores en ocupaciones relacionadas con el plomo. [263] El humo del cigarrillo contiene, entre otras sustancias tóxicas, plomo radiactivo 210. [ 281] "Como resultado de los esfuerzos regulatorios de la EPA, los niveles de plomo en el aire [en los Estados Unidos] disminuyeron en un 86 por ciento entre 2010 y 2020". [282] La concentración de plomo en el aire en los Estados Unidos cayó por debajo del estándar nacional de 0,15 μg/m 3 [283] en 2014. [284]
La exposición cutánea puede ser significativa para las personas que trabajan con compuestos orgánicos de plomo. La tasa de absorción cutánea es menor en el caso del plomo inorgánico. [285]
El plomo puede encontrarse en los alimentos cuando estos se cultivan en suelos con alto contenido de plomo, el plomo transportado por el aire contamina los cultivos, los animales ingieren plomo en su dieta o el plomo entra en los alimentos ya sea a través de lo que se almacenó o cocinó. [286] La ingestión de pintura y baterías con plomo también es una vía de exposición para el ganado, que posteriormente puede afectar a los seres humanos. [287] La leche producida por ganado contaminado se puede diluir a una concentración de plomo más baja y venderse para el consumo. [288]
En Bangladesh, se han añadido compuestos de plomo a la cúrcuma para hacerla más amarilla. [289] Se cree que esto comenzó en la década de 1980 y continúa a partir de 2019. [289] Se cree que es una de las principales fuentes de altos niveles de plomo en el país. [actualizar][ 290] En Hong Kong, el nivel máximo de plomo permitido en los alimentos es de 6 partes por millón en sólidos y 1 parte por millón en líquidos. [291]
El polvo que contiene plomo puede depositarse en los granos de cacao que se están secando cuando se dejan al aire libre cerca de plantas industriales contaminantes. [292] En diciembre de 2022, Consumer Reports analizó 28 marcas de chocolate negro y descubrió que 23 de ellas contenían niveles potencialmente nocivos de plomo, cadmio o ambos. Han instado a los fabricantes de chocolate a reducir el nivel de plomo, que podría ser perjudicial, especialmente para un feto en desarrollo. [293]
Según el Centro para el Control de Enfermedades de los Estados Unidos , el uso de plomo en plásticos no ha sido prohibido a partir de 2024. El plomo ablanda el plástico y lo hace más flexible para que pueda volver a su forma original. Se descubrió que masticar habitualmente el aislamiento de plástico de colores de los cables eléctricos pelados causaba niveles elevados de plomo en un hombre de 46 años. [294] El plomo se puede utilizar en juguetes de plástico para estabilizar las moléculas frente al calor. Se puede formar polvo de plomo cuando el plástico se expone a la luz solar, el aire y los detergentes que rompen el enlace químico entre el plomo y los plásticos. [295]
El tratamiento del envenenamiento por plomo normalmente implica la administración de dimercaprol y succímero . [296] Los casos agudos pueden requerir el uso de edetato de calcio disódico , el quelato de calcio y la sal disódica del ácido etilendiaminotetraacético ( EDTA ). Tiene una mayor afinidad por el plomo que el calcio, con el resultado de que el quelato de plomo se forma por intercambio y se excreta en la orina, dejando atrás calcio inofensivo. [297]

La extracción, producción, uso y eliminación del plomo y sus productos han causado una contaminación significativa de los suelos y las aguas de la Tierra. Las emisiones atmosféricas de plomo alcanzaron su punto máximo durante la Revolución Industrial y el período de la gasolina con plomo en la segunda mitad del siglo XX. [298]
Las emisiones de plomo se originan en fuentes naturales (es decir, la concentración del plomo que se encuentra en la naturaleza), la producción industrial, la incineración y el reciclaje, y la movilización de plomo previamente enterrado. [298] En particular, a medida que el plomo se ha ido eliminando gradualmente de otros usos, en el Sur Global, las operaciones de reciclaje de plomo diseñadas para extraer plomo barato utilizado para la fabricación global se han convertido en una fuente de exposición bien documentada. [299] Persisten concentraciones elevadas de plomo en suelos y sedimentos en áreas postindustriales y urbanas; las emisiones industriales, incluidas las que surgen de la quema de carbón, [300] continúan en muchas partes del mundo, particularmente en los países en desarrollo. [301]
El plomo puede acumularse en los suelos, especialmente en aquellos con un alto contenido orgánico, donde permanece durante cientos o miles de años. El plomo ambiental puede competir con otros metales que se encuentran en las superficies de las plantas y potencialmente inhibir la fotosíntesis y, en concentraciones suficientemente altas, afectar negativamente el crecimiento y la supervivencia de las plantas. La contaminación de los suelos y las plantas puede permitir que el plomo ascienda en la cadena alimentaria afectando a los microorganismos y los animales. En los animales, el plomo exhibe toxicidad en muchos órganos, dañando los sistemas nervioso, renal , reproductivo, hematopoyético y cardiovascular después de la ingestión, inhalación o absorción cutánea. [302] Los peces absorben plomo tanto del agua como de los sedimentos; [303] la bioacumulación en la cadena alimentaria plantea un peligro para los peces, las aves y los mamíferos marinos. [304]
El plomo antropogénico incluye el plomo de los perdigones y las plomadas . Estas son algunas de las fuentes más potentes de contaminación por plomo junto con los sitios de producción de plomo. [305] El plomo fue prohibido para los perdigones y las plomadas en los Estados Unidos en 2017, [306] aunque esa prohibición solo estuvo vigente durante un mes, [307] y se está considerando una prohibición similar en la Unión Europea. [308]
Los métodos analíticos para la determinación del plomo en el medio ambiente incluyen la espectrofotometría , la fluorescencia de rayos X , la espectroscopia atómica y los métodos electroquímicos . Se ha desarrollado un electrodo selectivo de iones específico basado en el ionóforo S , S'- metilenbis( N , N -diisobutil ditiocarbamato ). [309] Un ensayo de biomarcador importante para el envenenamiento por plomo son los niveles de ácido δ-aminolevulínico en plasma, suero y orina. [310]

A mediados de la década de 1980, se produjo un descenso significativo del uso de plomo en la industria. [311] En Estados Unidos, las reglamentaciones medioambientales redujeron o eliminaron el uso de plomo en productos distintos de las baterías, como la gasolina, las pinturas, las soldaduras y los sistemas de agua. Se instalaron dispositivos de control de partículas en las centrales eléctricas de carbón para capturar las emisiones de plomo. [300] En 1992, el Congreso de Estados Unidos exigió a la Agencia de Protección Ambiental que redujera los niveles de plomo en sangre de los niños del país. [312] El uso de plomo se redujo aún más mediante la Directiva de Restricción de Sustancias Peligrosas de 2003 de la Unión Europea . [313] En los Países Bajos se produjo una importante caída en la deposición de plomo tras la prohibición nacional de 1993 del uso de perdigones de plomo para la caza y el tiro deportivo: de 230 toneladas en 1990 a 47,5 toneladas en 1995. [314] El uso de plomo en Avgas 100LL para la aviación general está permitido en la UE a partir de 2022. [315]
En los Estados Unidos, el límite de exposición permisible para el plomo en el lugar de trabajo, que comprende plomo metálico, compuestos inorgánicos de plomo y jabones de plomo, se estableció en 50 μg/m3 durante una jornada laboral de 8 horas, y el límite del nivel de plomo en sangre en 5 μg por 100 g de sangre en 2012. [316] El plomo todavía se puede encontrar en cantidades nocivas en cerámica, [317] vinilo [318] (como el que se usa para tuberías y el aislamiento de cables eléctricos) y latón chino. [u] Las casas antiguas aún pueden contener pintura con plomo. [318] La pintura de plomo blanco se ha retirado de la venta en los países industrializados, pero siguen existiendo usos especializados de otros pigmentos como el cromato de plomo amarillo , [185] especialmente en la pintura para marcar el pavimento de las carreteras. [320] Quitar la pintura vieja lijándola produce polvo que se puede inhalar. [321] Algunas autoridades han ordenado programas de reducción del plomo en propiedades donde viven niños pequeños. [322] El uso de plomo en Avgas 100LL para aviación general está generalmente permitido en Estados Unidos a partir de 2023. [323]
Los desechos de plomo, dependiendo de la jurisdicción y la naturaleza de los desechos, pueden ser tratados como desechos domésticos (para facilitar las actividades de reducción de plomo), [324] o como desechos potencialmente peligrosos que requieren un tratamiento o almacenamiento especializado. [325] El plomo se libera al medio ambiente en los lugares de tiro y se han desarrollado varias prácticas de gestión del plomo para contrarrestar la contaminación por plomo. [326] La migración de plomo puede verse mejorada en suelos ácidos; para contrarrestar eso, se recomienda tratar los suelos con cal para neutralizarlos y evitar la lixiviación del plomo. [327]
Se han llevado a cabo investigaciones sobre cómo eliminar el plomo de los biosistemas por medios biológicos: se están investigando los huesos de pescado por su capacidad para biorremediar el plomo en suelos contaminados. [328] [329] El hongo Aspergillus versicolor es eficaz para absorber iones de plomo de los desechos industriales antes de liberarse a los cuerpos de agua. [330] Se han investigado varias bacterias por su capacidad para eliminar el plomo del medio ambiente, incluidas las bacterias reductoras de sulfato Desulfovibrio y Desulfotomaculum , ambas muy eficaces en soluciones acuosas. [331] La hierba de mijo Urochloa ramosa tiene la capacidad de acumular cantidades significativas de metales como plomo y zinc en sus tejidos de brotes y raíces, lo que la convierte en una planta importante para la remediación de suelos contaminados. [332]
Como resultado de los esfuerzos regulatorios de la EPA, los niveles de plomo en el aire a nivel nacional disminuyeron en un 86 por ciento entre 2010 y 2020.
Estándares nacionales de calidad del aire ambiental (40 CFR parte 50) para seis contaminantes principales
![]() Este artículo fue enviado a WikiJournal of Science para su revisión académica externa por pares en 2017 (informes de los revisores). El contenido actualizado fue reintegrado a la página de Wikipedia bajo una licencia CC-BY-SA-3.0 ( 2018 ). La versión de registro revisada es: Mikhail Boldyrev; et al. (3 de julio de 2018). "Lead: properties, history, and applications" (PDF) . WikiJournal of Science . 1 (2): 7. doi : 10.15347/WJS/2018.007 . ISSN 2470-6345. Wikidata Q56050531.
Este artículo fue enviado a WikiJournal of Science para su revisión académica externa por pares en 2017 (informes de los revisores). El contenido actualizado fue reintegrado a la página de Wikipedia bajo una licencia CC-BY-SA-3.0 ( 2018 ). La versión de registro revisada es: Mikhail Boldyrev; et al. (3 de julio de 2018). "Lead: properties, history, and applications" (PDF) . WikiJournal of Science . 1 (2): 7. doi : 10.15347/WJS/2018.007 . ISSN 2470-6345. Wikidata Q56050531.
La demanda mundial de plomo se ha más que duplicado desde principios de los años 90 y casi el 90% del uso se realiza ahora en baterías de plomo-ácido.