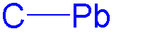
La química de organoplomo es el estudio científico de la síntesis y las propiedades de los compuestos de organoplomo , que son compuestos organometálicos que contienen un enlace químico entre el carbono y el plomo . El primer compuesto de organoplomo fue el hexaetildiplomo (Pb 2 (C 2 H 5 ) 6 ), sintetizado por primera vez en 1858. [1] El plomo, que comparte el mismo grupo con el carbono, es tetravalente .
Al descender en el grupo de carbono, el enlace C– X ( X = C, Si, Ge, Sn, Pb) se vuelve más débil y la longitud del enlace más grande. El enlace C–Pb en el tetrametilplomo tiene una longitud de 222 pm con una energía de disociación de 49 kcal / mol (204 kJ /mol). A modo de comparación, el enlace C–Sn en el tetrametilestaño tiene una longitud de 214 pm con una energía de disociación de 71 kcal/mol (297 kJ /mol). El predominio de Pb(IV) en la química del organoplomo es notable porque los compuestos de plomo inorgánico tienden a tener centros de Pb(II). La razón es que con los compuestos de plomo inorgánico, elementos como el nitrógeno , el oxígeno y los haluros tienen una electronegatividad mucho mayor que el propio plomo y la carga positiva parcial en el plomo conduce a una contracción más fuerte del orbital 6s que del orbital 6p, lo que hace que el orbital 6s sea inerte; esto se llama efecto de par inerte . [2]
Con mucho, el compuesto organoplomo que ha tenido el mayor impacto es el tetraetilo de plomo , anteriormente utilizado como agente antidetonante en la gasolina destinada a los motores de combustión interna de los automóviles y todavía ampliamente utilizado en el avgas para aviones pequeños. [3] Los reactivos de plomo más importantes para introducir plomo son el tetraacetato de plomo y el cloruro de plomo (II) .
El uso de organoplomos está limitado en parte debido a su toxicidad.
Los compuestos organoplomos pueden derivarse de reactivos de Grignard y cloruro de plomo . Por ejemplo, el cloruro de metilmagnesio reacciona con cloruro de plomo para formar tetrametilplomo, un líquido transparente con un punto de ebullición de 110 °C y una densidad de 1,995 g/cm 3 . La reacción de una fuente de plomo (II) con ciclopentadienuro de sodio produce el metaloceno de plomo , plumboceno .
Ciertos compuestos de areno reaccionan directamente con tetraacetato de plomo para formar compuestos de plomo arílico en una sustitución aromática electrofílica . Por ejemplo, el anisol con tetraacetato de plomo forma triacetato de p-metoxifenilplomo: [4]
La reacción se acelera en presencia de ácido dicloroacético , que forma el dicloroacetato de plomo (IV) como intermedio.
Otros compuestos organoplomos son los haluros del tipo R n PbX (4-n) , sulfinatos (R n Pb(OSOR) (4−n) ) e hidróxidos (R n Pb(OH) (4−n) ). Las reacciones típicas son: [5]
R
2Pb(OH)
2Los compuestos son anfóteros . A pH inferior a 8 forman iones R 2 Pb 2+ y con pH superior a 10, iones R 2 Pb(OH) 3 − .
De los hidróxidos se derivan los plumboxanos:
que dan acceso a alcóxidos poliméricos:
El enlace C–Pb es débil y por esta razón la escisión homolítica de compuestos de organoplomo a radicales libres es fácil. En su capacidad antidetonante, su propósito es el de un iniciador de radicales . Los tipos generales de reacción de organoplomos de arilo y vinilo son la transmetalación , por ejemplo con ácidos borónicos y la escisión heterocíclica catalizada por ácidos. Los organoplomos se utilizan en reacciones de acoplamiento entre compuestos de areno . Son más reactivos que los organoestaños y, por lo tanto, se pueden utilizar para sintetizar biarilos estéricamente abarrotados .
En la oxiplomación , se añaden alcóxidos de organoplomo a los alquenos polares:
El alcóxido se regenera en la metanólisis posterior y, por tanto, actúa como catalizador.
El sustituyente principal en el triacetato de p -metoxifenilplomo es desplazado por nucleófilos de carbono , como el fenol mesitol , exclusivamente en la posición orto aromática : [6]
La reacción requiere la presencia de un gran exceso de una amina coordinadora, como la piridina , que presumiblemente se une al plomo durante la reacción. La reacción es insensible a los captadores de radicales y, por lo tanto, se puede descartar un mecanismo de radicales libres . Es probable que el mecanismo de reacción implique el desplazamiento nucleofílico de un grupo acetato por el grupo fenólico a un intermediario de diorganoplomo que, en algunas reacciones relacionadas, se puede aislar. El segundo paso es entonces similar a una transposición de Claisen, excepto que la reacción depende de la electrofilicidad (de ahí la preferencia orto) del fenol.
El nucleófilo también puede ser el carbanión de un compuesto β-dicarbonílico: [4]
El carbanión se forma por abstracción de protones del protón α ácido por la piridina (que ahora cumple una doble función), de forma similar a la condensación de Knoevenagel . Este intermediario desplaza un ligando de acetato a un compuesto de diorganoplomo y, nuevamente, estos intermediarios se pueden aislar con reactivos adecuados como intermediarios inestables. El segundo paso es la eliminación reductiva con formación de un nuevo enlace C–C y acetato de plomo(II) .
Los compuestos orgánicos de plomo forman una variedad de intermediarios reactivos como los radicales libres de plomo :
y plumbilenos , las contrapartes del carbeno de plomo:
Estos intermedios se descomponen por desproporción .
Las plumbilidinas del tipo RPb (formalmente Pb(I)) son ligandos de otros metales en compuestos L n MPbR (compárese con los carbinos metálicos de carbono).