

El metabolismo ( / məˈtæbəlɪzəm / , del griego : μεταβολή metabolē , "cambio") es el conjunto de reacciones químicas que sustentan la vida en los organismos . Las tres funciones principales del metabolismo son : la conversión de la energía de los alimentos en energía disponible para ejecutar procesos celulares; la conversión de los alimentos en bloques de construcción de proteínas , lípidos , ácidos nucleicos y algunos carbohidratos ; y la eliminación de desechos metabólicos . Estas reacciones catalizadas por enzimas permiten a los organismos crecer y reproducirse, mantener sus estructuras y responder a sus entornos. La palabra metabolismo también puede referirse a la suma de todas las reacciones químicas que ocurren en los organismos vivos, incluida la digestión y el transporte de sustancias hacia y entre diferentes células, en cuyo caso el conjunto de reacciones descrito anteriormente dentro de las células se denomina metabolismo intermediario (o intermedio).
Las reacciones metabólicas pueden clasificarse como catabólicas (la descomposición de compuestos, por ejemplo, de glucosa a piruvato mediante la respiración celular ) o anabólicas ( la formación ( síntesis ) de compuestos, como proteínas, carbohidratos, lípidos y ácidos nucleicos). Por lo general, el catabolismo libera energía y el anabolismo la consume.
Las reacciones químicas del metabolismo se organizan en vías metabólicas , en las que una sustancia química se transforma a través de una serie de pasos en otra sustancia química, cada paso facilitado por una enzima específica . Las enzimas son cruciales para el metabolismo porque permiten a los organismos impulsar reacciones deseables que requieren energía y que no ocurrirían por sí solas, acoplándolas a reacciones espontáneas que liberan energía. Las enzimas actúan como catalizadores (permiten que una reacción se realice más rápidamente) y también permiten la regulación de la velocidad de una reacción metabólica, por ejemplo, en respuesta a cambios en el entorno de la célula o a señales de otras células.
El sistema metabólico de un organismo en particular determina qué sustancias le resultarán nutritivas y cuáles venenosas . Por ejemplo, algunos procariotas utilizan sulfuro de hidrógeno como nutriente, pero este gas es venenoso para los animales. [1] La tasa metabólica basal de un organismo es la medida de la cantidad de energía consumida por todas estas reacciones químicas.
Una característica sorprendente del metabolismo es la similitud de las vías metabólicas básicas entre especies muy diferentes. [2] Por ejemplo, el conjunto de ácidos carboxílicos que son mejor conocidos como intermediarios en el ciclo del ácido cítrico están presentes en todos los organismos conocidos, y se encuentran en especies tan diversas como la bacteria unicelular Escherichia coli y enormes organismos multicelulares como los elefantes . [3] Estas similitudes en las vías metabólicas probablemente se deban a su aparición temprana en la historia evolutiva , y su retención probablemente se deba a su eficacia . [4] [5] En varias enfermedades, como la diabetes tipo II , el síndrome metabólico y el cáncer , el metabolismo normal se altera. [6] El metabolismo de las células cancerosas también es diferente del metabolismo de las células normales, y estas diferencias se pueden utilizar para encontrar objetivos para la intervención terapéutica en el cáncer. [7]


La mayoría de las estructuras que forman los animales, las plantas y los microbios están hechas de cuatro clases básicas de moléculas : aminoácidos , carbohidratos , ácido nucleico y lípidos (a menudo llamados grasas ). Como estas moléculas son vitales para la vida, las reacciones metabólicas se centran o bien en fabricar estas moléculas durante la construcción de células y tejidos, o bien en descomponerlas y utilizarlas para obtener energía, mediante su digestión. Estos compuestos bioquímicos pueden unirse para formar polímeros como el ADN y las proteínas , macromoléculas esenciales para la vida. [8]
Las proteínas están formadas por aminoácidos dispuestos en una cadena lineal unida por enlaces peptídicos . Muchas proteínas son enzimas que catalizan las reacciones químicas en el metabolismo. Otras proteínas tienen funciones estructurales o mecánicas, como las que forman el citoesqueleto , un sistema de andamiaje que mantiene la forma celular. [9] Las proteínas también son importantes en la señalización celular , las respuestas inmunitarias , la adhesión celular , el transporte activo a través de las membranas y el ciclo celular . [10] Los aminoácidos también contribuyen al metabolismo energético celular al proporcionar una fuente de carbono para la entrada en el ciclo del ácido cítrico ( ciclo del ácido tricarboxílico ), [11] especialmente cuando una fuente primaria de energía, como la glucosa , es escasa, o cuando las células sufren estrés metabólico. [12]
Los lípidos son el grupo más diverso de sustancias bioquímicas. Sus principales usos estructurales son como parte de las membranas biológicas internas y externas , como la membrana celular . [10] También se puede utilizar su energía química . Los lípidos contienen una cadena de hidrocarburos larga y no polar con una pequeña región polar que contiene oxígeno. Los lípidos suelen definirse como moléculas biológicas hidrófobas o anfipáticas , pero se disolverán en disolventes orgánicos como el etanol , el benceno o el cloroformo . [13] Las grasas son un gran grupo de compuestos que contienen ácidos grasos y glicerol ; una molécula de glicerol unida a tres ácidos grasos mediante enlaces éster se denomina triacilglicérido . [14] Existen varias variaciones de la estructura básica, incluidas las cadenas principales como la esfingosina en la esfingomielina y los grupos hidrófilos como el fosfato en los fosfolípidos . Los esteroides como el esterol son otra clase importante de lípidos. [15]
Los carbohidratos son aldehídos o cetonas , con muchos grupos hidroxilo unidos, que pueden existir como cadenas lineales o anillos. Los carbohidratos son las moléculas biológicas más abundantes y cumplen numerosas funciones, como el almacenamiento y transporte de energía ( almidón , glucógeno ) y componentes estructurales ( celulosa en plantas, quitina en animales). [10] Las unidades básicas de carbohidratos se denominan monosacáridos e incluyen galactosa , fructosa y, lo más importante, glucosa . Los monosacáridos se pueden unir entre sí para formar polisacáridos de formas casi ilimitadas. [16]
Los dos ácidos nucleicos, ADN y ARN , son polímeros de nucleótidos . Cada nucleótido está compuesto de un fosfato unido a un grupo de azúcar ribosa o desoxirribosa que está unido a una base nitrogenada . Los ácidos nucleicos son fundamentales para el almacenamiento y uso de la información genética, y su interpretación a través de los procesos de transcripción y biosíntesis de proteínas . [10] Esta información está protegida por mecanismos de reparación del ADN y se propaga a través de la replicación del ADN . Muchos virus tienen un genoma de ARN , como el VIH , que utiliza la transcripción inversa para crear una plantilla de ADN a partir de su genoma de ARN viral. [17] El ARN en ribozimas como los espliceosomas y los ribosomas es similar a las enzimas, ya que puede catalizar reacciones químicas. Los nucleósidos individuales se forman uniendo una nucleobase a un azúcar ribosa . Estas bases son anillos heterocíclicos que contienen nitrógeno, clasificados como purinas o pirimidinas . Los nucleótidos también actúan como coenzimas en reacciones de transferencia de grupos metabólicos. [18]

El metabolismo implica una amplia gama de reacciones químicas, pero la mayoría se enmarca en unos pocos tipos básicos de reacciones que implican la transferencia de grupos funcionales de átomos y sus enlaces dentro de las moléculas. [19] Esta química común permite que las células utilicen un pequeño conjunto de intermediarios metabólicos para transportar grupos químicos entre diferentes reacciones. [18] Estos intermediarios de transferencia de grupos se denominan coenzimas . Cada clase de reacciones de transferencia de grupos se lleva a cabo por una coenzima particular, que es el sustrato para un conjunto de enzimas que la producen y un conjunto de enzimas que la consumen. Por lo tanto, estas coenzimas se producen, consumen y luego reciclan continuamente. [20]
Una coenzima central es el trifosfato de adenosina (ATP), la moneda energética de las células. Este nucleótido se utiliza para transferir energía química entre diferentes reacciones químicas. Hay sólo una pequeña cantidad de ATP en las células, pero como se regenera continuamente, el cuerpo humano puede utilizar aproximadamente su propio peso en ATP por día. [20] El ATP actúa como un puente entre el catabolismo y el anabolismo . El catabolismo descompone las moléculas y el anabolismo las une. Las reacciones catabólicas generan ATP y las reacciones anabólicas lo consumen. También sirve como transportador de grupos fosfato en las reacciones de fosforilación . [21]
Una vitamina es un compuesto orgánico necesario en pequeñas cantidades que no se puede producir en las células. En la nutrición humana , la mayoría de las vitaminas funcionan como coenzimas después de la modificación; por ejemplo, todas las vitaminas solubles en agua se fosforilan o se acoplan a nucleótidos cuando se utilizan en las células. [22] El dinucleótido de nicotinamida y adenina (NAD + ), un derivado de la vitamina B3 ( niacina ) , es una coenzima importante que actúa como aceptor de hidrógeno. Cientos de tipos separados de deshidrogenasas eliminan electrones de sus sustratos y reducen el NAD + en NADH. Esta forma reducida de la coenzima es entonces un sustrato para cualquiera de las reductasas en la célula que necesitan transferir átomos de hidrógeno a sus sustratos. [23] El dinucleótido de nicotinamida y adenina existe en dos formas relacionadas en la célula, NADH y NADPH. La forma NAD + /NADH es más importante en las reacciones catabólicas, mientras que NADP + /NADPH se utiliza en las reacciones anabólicas. [24]

Los elementos inorgánicos desempeñan papeles críticos en el metabolismo; algunos son abundantes (por ejemplo , sodio y potasio ) mientras que otros funcionan en concentraciones mínimas. Aproximadamente el 99% del peso corporal de un ser humano está compuesto por los elementos carbono , nitrógeno , calcio , sodio , cloro , potasio , hidrógeno , fósforo , oxígeno y azufre . Los compuestos orgánicos (proteínas, lípidos y carbohidratos) contienen la mayoría del carbono y nitrógeno; la mayor parte del oxígeno y el hidrógeno están presentes en forma de agua. [25]
Los abundantes elementos inorgánicos actúan como electrolitos . Los iones más importantes son sodio , potasio , calcio , magnesio , cloruro , fosfato y el ion orgánico bicarbonato . El mantenimiento de gradientes iónicos precisos a través de las membranas celulares mantiene la presión osmótica y el pH . [26] Los iones también son críticos para la función nerviosa y muscular , ya que los potenciales de acción en estos tejidos se producen por el intercambio de electrolitos entre el líquido extracelular y el líquido de la célula, el citosol . [27] Los electrolitos entran y salen de las células a través de proteínas en la membrana celular llamadas canales iónicos . Por ejemplo, la contracción muscular depende del movimiento de calcio, sodio y potasio a través de canales iónicos en la membrana celular y los túbulos T. [28]
Los metales de transición suelen estar presentes como oligoelementos en los organismos, siendo el zinc y el hierro los más abundantes. [29] Los cofactores metálicos están unidos firmemente a sitios específicos en las proteínas; aunque los cofactores enzimáticos pueden modificarse durante la catálisis, siempre vuelven a su estado original al final de la reacción catalizada. Los micronutrientes metálicos son absorbidos por los organismos por transportadores específicos y se unen a proteínas de almacenamiento como la ferritina o la metalotioneína cuando no se utilizan. [30] [31]
El catabolismo es el conjunto de procesos metabólicos que descomponen moléculas grandes. Estos incluyen la descomposición y oxidación de las moléculas de los alimentos. El propósito de las reacciones catabólicas es proporcionar la energía y los componentes necesarios para las reacciones anabólicas que construyen las moléculas. [32] La naturaleza exacta de estas reacciones catabólicas difiere de un organismo a otro, y los organismos pueden clasificarse según sus fuentes de energía, hidrógeno y carbono (sus grupos nutricionales primarios ), como se muestra en la siguiente tabla. Los organótrofos utilizan moléculas orgánicas como fuente de átomos de hidrógeno o electrones , mientras que los litótrofos utilizan sustratos inorgánicos. Mientras que los fotótrofos convierten la luz solar en energía química , [33] los quimiótrofos dependen de reacciones redox que implican la transferencia de electrones de moléculas donadoras reducidas como moléculas orgánicas , hidrógeno , sulfuro de hidrógeno o iones ferrosos a oxígeno , nitrato o sulfato . En los animales, estas reacciones involucran moléculas orgánicas complejas que se descomponen en moléculas más simples, como dióxido de carbono y agua. Los organismos fotosintéticos , como las plantas y las cianobacterias , utilizan reacciones de transferencia de electrones similares para almacenar la energía absorbida de la luz solar. [34]
El conjunto más común de reacciones catabólicas en animales se puede separar en tres etapas principales. En la primera etapa, las moléculas orgánicas grandes, como las proteínas , los polisacáridos o los lípidos , se digieren en sus componentes más pequeños fuera de las células. A continuación, estas moléculas más pequeñas son absorbidas por las células y convertidas en moléculas más pequeñas, generalmente acetil coenzima A (acetil-CoA), que libera algo de energía. Finalmente, el grupo acetilo en acetil-CoA se oxida a agua y dióxido de carbono en el ciclo del ácido cítrico y la cadena de transporte de electrones , liberando más energía mientras se reduce la coenzima nicotinamida adenina dinucleótido (NAD + ) en NADH. [32]
Las células no pueden procesar directamente las macromoléculas, por lo que deben descomponerse en unidades más pequeñas antes de poder utilizarlas en el metabolismo celular. Para digerir estos polímeros se utilizan diferentes clases de enzimas. Estas enzimas digestivas incluyen proteasas que digieren las proteínas en aminoácidos, así como glicósidos hidrolasas que digieren los polisacáridos en azúcares simples conocidos como monosacáridos . [36]
Los microbios simplemente secretan enzimas digestivas en su entorno, [37] [38] mientras que los animales solo secretan estas enzimas de células especializadas en sus intestinos , incluido el estómago y el páncreas , y en las glándulas salivales . [39] Los aminoácidos o azúcares liberados por estas enzimas extracelulares luego son bombeados a las células por proteínas de transporte activo . [40] [41]

El catabolismo de los carbohidratos es la descomposición de los carbohidratos en unidades más pequeñas. Los carbohidratos suelen llegar a las células después de haber sido digeridos en monosacáridos como la glucosa y la fructosa . [42] Una vez dentro, la principal vía de descomposición es la glucólisis , en la que la glucosa se convierte en piruvato . Este proceso genera la molécula transportadora de energía NADH a partir de NAD + , y genera ATP a partir de ADP para su uso en la alimentación de muchos procesos dentro de la célula. [43] El piruvato es un intermediario en varias vías metabólicas, pero la mayoría se convierte en acetil-CoA y se introduce en el ciclo del ácido cítrico , que permite una mayor producción de ATP mediante la fosforilación oxidativa . Esta oxidación consume oxígeno molecular y libera agua y el producto de desecho dióxido de carbono. Cuando falta oxígeno, o cuando el piruvato se produce temporalmente más rápido de lo que puede ser consumido por el ciclo del ácido cítrico (como en el caso de un esfuerzo muscular intenso), el piruvato se convierte en lactato por la enzima lactato deshidrogenasa , un proceso que también oxida el NADH de nuevo a NAD + para su reutilización en una glucólisis posterior, lo que permite que continúe la producción de energía. [44] El lactato se convierte más tarde de nuevo en piruvato para la producción de ATP donde se necesita energía, o de nuevo en glucosa en el ciclo de Cori . Una ruta alternativa para la descomposición de la glucosa es la vía de la pentosa fosfato , que produce menos energía pero favorece el anabolismo (síntesis de biomoléculas). Esta vía reduce la coenzima NADP + a NADPH y produce compuestos de pentosa como la ribosa 5-fosfato para la síntesis de muchas biomoléculas como nucleótidos y aminoácidos aromáticos . [45]

Las grasas se catabolizan por hidrólisis a ácidos grasos libres y glicerol. El glicerol entra en la glucólisis y los ácidos grasos se descomponen por oxidación beta para liberar acetil-CoA, que luego se incorpora al ciclo del ácido cítrico. Los ácidos grasos liberan más energía al oxidarse que los carbohidratos. Algunas bacterias también descomponen los esteroides en un proceso similar a la oxidación beta, y este proceso de descomposición implica la liberación de cantidades significativas de acetil-CoA, propionil-CoA y piruvato, que la célula puede utilizar para obtener energía. M. tuberculosis también puede crecer en el colesterol lipídico como única fuente de carbono, y los genes involucrados en la(s) vía(s) de uso del colesterol han sido validados como importantes durante varias etapas del ciclo de vida de la infección de M. tuberculosis . [46]
Los aminoácidos se utilizan para sintetizar proteínas y otras biomoléculas, o se oxidan a urea y dióxido de carbono para producir energía. [47] La vía de oxidación comienza con la eliminación del grupo amino por una transaminasa . El grupo amino se introduce en el ciclo de la urea , dejando un esqueleto de carbono desaminado en forma de cetoácido . Varios de estos cetoácidos son intermediarios en el ciclo del ácido cítrico, por ejemplo, el α- cetoglutarato formado por la desaminación del glutamato . [48] Los aminoácidos glucogénicos también se pueden convertir en glucosa, a través de la gluconeogénesis . [49]
En la fosforilación oxidativa, los electrones extraídos de las moléculas orgánicas en áreas como el ciclo del ácido cítrico se transfieren al oxígeno y la energía liberada se utiliza para producir ATP. Esto se hace en eucariotas mediante una serie de proteínas en las membranas de las mitocondrias llamadas cadena de transporte de electrones . En procariotas , estas proteínas se encuentran en la membrana interna de la célula . [50] Estas proteínas utilizan la energía de moléculas reducidas como NADH para bombear protones a través de una membrana. [51]

El bombeo de protones fuera de las mitocondrias crea una diferencia de concentración de protones a través de la membrana y genera un gradiente electroquímico . [52] Esta fuerza impulsa los protones de regreso a la mitocondria a través de la base de una enzima llamada ATP sintasa . El flujo de protones hace que la subunidad del tallo gire, lo que hace que el sitio activo del dominio de la sintasa cambie de forma y fosforile el difosfato de adenosina, convirtiéndolo en ATP. [20]
La quimiolitotrofía es un tipo de metabolismo que se encuentra en los procariotas donde la energía se obtiene de la oxidación de compuestos inorgánicos . Estos organismos pueden utilizar hidrógeno , [53] compuestos de azufre reducido (como sulfuro , sulfuro de hidrógeno y tiosulfato ), [1] hierro ferroso (Fe(II)) [54] o amoníaco [55] como fuentes de poder reductor y obtienen energía de la oxidación de estos compuestos. [56] Estos procesos microbianos son importantes en los ciclos biogeoquímicos globales como la acetogénesis , la nitrificación y la desnitrificación y son críticos para la fertilidad del suelo . [57] [58]
La energía de la luz solar es captada por plantas , cianobacterias , bacterias púrpuras , bacterias verdes del azufre y algunos protistas . Este proceso a menudo está acoplado a la conversión de dióxido de carbono en compuestos orgánicos, como parte de la fotosíntesis, que se analiza a continuación. Sin embargo, los sistemas de captura de energía y fijación de carbono pueden operar por separado en procariotas, ya que las bacterias púrpuras y las bacterias verdes del azufre pueden utilizar la luz solar como fuente de energía, mientras alternan entre la fijación de carbono y la fermentación de compuestos orgánicos. [59] [60]
En muchos organismos, la captura de energía solar es similar en principio a la fosforilación oxidativa, ya que implica el almacenamiento de energía como un gradiente de concentración de protones. Esta fuerza motriz de protones impulsa luego la síntesis de ATP. [61] Los electrones necesarios para impulsar esta cadena de transporte de electrones provienen de proteínas que captan luz llamadas centros de reacción fotosintética . Los centros de reacción se clasifican en dos tipos según la naturaleza del pigmento fotosintético presente, y la mayoría de las bacterias fotosintéticas solo tienen un tipo, mientras que las plantas y las cianobacterias tienen dos. [62]
En plantas, algas y cianobacterias, el fotosistema II utiliza la energía de la luz para extraer electrones del agua, liberando oxígeno como producto de desecho. Los electrones luego fluyen al complejo citocromo b6f , que utiliza su energía para bombear protones a través de la membrana tilacoide en el cloroplasto . [34] Estos protones se mueven de regreso a través de la membrana mientras impulsan la ATP sintasa, como antes. Los electrones luego fluyen a través del fotosistema I y luego pueden usarse para reducir la coenzima NADP + . [63] Esta coenzima puede ingresar al ciclo de Calvin o reciclarse para una mayor generación de ATP. [ cita requerida ]
El anabolismo es el conjunto de procesos metabólicos constructivos donde la energía liberada por el catabolismo se utiliza para sintetizar moléculas complejas. En general, las moléculas complejas que forman las estructuras celulares se construyen paso a paso a partir de precursores más pequeños y simples. El anabolismo implica tres etapas básicas. En primer lugar, la producción de precursores como aminoácidos , monosacáridos , isoprenoides y nucleótidos , en segundo lugar, su activación en formas reactivas utilizando energía del ATP, y en tercer lugar, el ensamblaje de estos precursores en moléculas complejas como proteínas , polisacáridos , lípidos y ácidos nucleicos . [64]
El anabolismo en los organismos puede ser diferente según la fuente de moléculas construidas en sus células. Los autótrofos como las plantas pueden construir las moléculas orgánicas complejas en sus células, como polisacáridos y proteínas, a partir de moléculas simples como dióxido de carbono y agua. Los heterótrofos , por otro lado, requieren una fuente de sustancias más complejas, como monosacáridos y aminoácidos, para producir estas moléculas complejas. Los organismos pueden clasificarse además por la fuente última de su energía: los fotoautótrofos y fotoheterótrofos obtienen energía de la luz, mientras que los quimioautótrofos y quimioheterótrofos obtienen energía de reacciones de oxidación. [64]

La fotosíntesis es la síntesis de carbohidratos a partir de la luz solar y el dióxido de carbono (CO 2 ). En las plantas, las cianobacterias y las algas, la fotosíntesis oxigénica divide el agua, produciendo oxígeno como producto de desecho. Este proceso utiliza el ATP y el NADPH producidos por los centros de reacción fotosintética , como se describió anteriormente, para convertir el CO 2 en glicerato 3-fosfato , que luego puede convertirse en glucosa. Esta reacción de fijación de carbono la lleva a cabo la enzima RuBisCO como parte del ciclo de Calvin-Benson . [65] En las plantas se producen tres tipos de fotosíntesis: fijación de carbono C3 , fijación de carbono C4 y fotosíntesis CAM . Estas se diferencian por la ruta que toma el dióxido de carbono hacia el ciclo de Calvin, ya que las plantas C3 fijan el CO 2 directamente, mientras que la fotosíntesis C4 y CAM incorporan primero el CO 2 a otros compuestos, como adaptaciones para lidiar con la luz solar intensa y las condiciones secas. [66]
En los procariotas fotosintéticos los mecanismos de fijación del carbono son más diversos. En estos casos, el dióxido de carbono puede fijarse mediante el ciclo de Calvin-Benson, un ciclo inverso del ácido cítrico [67] o la carboxilación de acetil-CoA [68] [69] Los quimioautótrofos procariotas también fijan el CO2 mediante el ciclo de Calvin-Benson, pero utilizan la energía de compuestos inorgánicos para impulsar la reacción [70] .
En el anabolismo de carbohidratos, los ácidos orgánicos simples pueden convertirse en monosacáridos como la glucosa y luego usarse para ensamblar polisacáridos como el almidón . La generación de glucosa a partir de compuestos como piruvato , lactato , glicerol , glicerato 3-fosfato y aminoácidos se llama gluconeogénesis . La gluconeogénesis convierte el piruvato en glucosa-6-fosfato a través de una serie de intermediarios, muchos de los cuales se comparten con la glucólisis . [43] Sin embargo, esta vía no es simplemente una glucólisis ejecutada en sentido inverso, ya que varios pasos son catalizados por enzimas no glucolíticas. Esto es importante ya que permite que la formación y la descomposición de la glucosa se regulen por separado y evita que ambas vías se ejecuten simultáneamente en un ciclo inútil . [71] [72]
Aunque la grasa es una forma común de almacenar energía, en vertebrados como los humanos los ácidos grasos en estas reservas no se pueden convertir en glucosa a través de la gluconeogénesis ya que estos organismos no pueden convertir el acetil-CoA en piruvato ; las plantas sí tienen, pero los animales no, la maquinaria enzimática necesaria. [73] Como resultado, después de una inanición prolongada, los vertebrados necesitan producir cuerpos cetónicos a partir de ácidos grasos para reemplazar la glucosa en tejidos como el cerebro que no pueden metabolizar los ácidos grasos. [74] En otros organismos como las plantas y las bacterias, este problema metabólico se resuelve utilizando el ciclo del glioxilato , que evita el paso de descarboxilación en el ciclo del ácido cítrico y permite la transformación del acetil-CoA en oxaloacetato , donde se puede utilizar para la producción de glucosa. [73] [75] Aparte de la grasa, la glucosa se almacena en la mayoría de los tejidos, como un recurso energético disponible dentro del tejido a través de la glucogénesis que generalmente se usaba para mantener el nivel de glucosa en la sangre. [76]
Los polisacáridos y los glicanos se forman mediante la adición secuencial de monosacáridos por la glicosiltransferasa desde un donante de fosfato de azúcar reactivo como la glucosa difosfato de uridina (UDP-Glc) a un grupo hidroxilo aceptor en el polisacárido en crecimiento. Como cualquiera de los grupos hidroxilo en el anillo del sustrato pueden ser aceptores, los polisacáridos producidos pueden tener estructuras rectas o ramificadas. [77] Los polisacáridos producidos pueden tener funciones estructurales o metabólicas por sí mismos, o ser transferidos a lípidos y proteínas por las enzimas oligosacariltransferasas . [78] [79]

Los ácidos grasos son producidos por sintetasas de ácidos grasos que polimerizan y luego reducen las unidades de acetil-CoA. Las cadenas de acilo en los ácidos grasos se extienden mediante un ciclo de reacciones que agregan el grupo acilo, lo reducen a un alcohol, lo deshidratan a un grupo alqueno y luego lo reducen nuevamente a un grupo alcano . Las enzimas de la biosíntesis de ácidos grasos se dividen en dos grupos: en animales y hongos, todas estas reacciones de sintetasa de ácidos grasos son llevadas a cabo por una sola proteína multifuncional de tipo I, [80] mientras que en los plástidos vegetales y las bacterias, enzimas de tipo II separadas realizan cada paso en la vía. [81] [82]
Los terpenos e isoprenoides son una gran clase de lípidos que incluyen los carotenoides y forman la clase más grande de productos naturales vegetales . [83] Estos compuestos se forman mediante el ensamblaje y modificación de unidades de isopreno donadas a partir de los precursores reactivos pirofosfato de isopentenilo y pirofosfato de dimetilalilo . [84] Estos precursores se pueden producir de diferentes maneras. En animales y arqueas, la vía del mevalonato produce estos compuestos a partir de acetil-CoA, [85] mientras que en plantas y bacterias la vía no mevalonato utiliza piruvato y gliceraldehído 3-fosfato como sustratos. [84] [86] Una reacción importante que utiliza estos donantes de isopreno activados es la biosíntesis de esteroles . Aquí, las unidades de isopreno se unen para formar escualeno y luego se pliegan y forman un conjunto de anillos para formar lanosterol . [87] El lanosterol puede luego convertirse en otros esteroles como el colesterol y el ergosterol . [87] [88]
Los organismos varían en su capacidad para sintetizar los 20 aminoácidos comunes. La mayoría de las bacterias y plantas pueden sintetizar los veinte, pero los mamíferos solo pueden sintetizar once aminoácidos no esenciales, por lo que nueve aminoácidos esenciales deben obtenerse de los alimentos. [10] Algunos parásitos simples , como la bacteria Mycoplasma pneumoniae , carecen de toda síntesis de aminoácidos y toman sus aminoácidos directamente de sus huéspedes. [89] Todos los aminoácidos se sintetizan a partir de intermediarios en la glucólisis, el ciclo del ácido cítrico o la vía de las pentosas fosfato. El nitrógeno es proporcionado por el glutamato y la glutamina . La síntesis de aminoácidos no esenciales depende de la formación del alfa-cetoácido apropiado, que luego se transamina para formar un aminoácido. [90]
Los aminoácidos se convierten en proteínas al unirse en una cadena de enlaces peptídicos . Cada proteína diferente tiene una secuencia única de residuos de aminoácidos: esta es su estructura primaria . Así como las letras del alfabeto se pueden combinar para formar una variedad casi infinita de palabras, los aminoácidos se pueden unir en secuencias variables para formar una gran variedad de proteínas. Las proteínas se forman a partir de aminoácidos que se han activado mediante la unión a una molécula de ARN de transferencia a través de un enlace éster . Este precursor de aminoacil-ARNt se produce en una reacción dependiente de ATP llevada a cabo por una aminoacil-ARNt sintetasa . [91] Este aminoacil-ARNt es entonces un sustrato para el ribosoma , que une el aminoácido a la cadena proteica en elongación, utilizando la información de la secuencia en un ARN mensajero . [92]
Los nucleótidos se forman a partir de aminoácidos, dióxido de carbono y ácido fórmico en vías que requieren grandes cantidades de energía metabólica. [93] En consecuencia, la mayoría de los organismos tienen sistemas eficientes para recuperar nucleótidos preformados. [93] [94] Las purinas se sintetizan como nucleósidos (bases unidas a la ribosa ). [95] Tanto la adenina como la guanina se forman a partir del precursor nucleósido inosina monofosfato, que se sintetiza utilizando átomos de los aminoácidos glicina , glutamina y ácido aspártico , así como formato transferido desde la coenzima tetrahidrofolato . Las pirimidinas , por otro lado, se sintetizan a partir de la base orotato , que se forma a partir de glutamina y aspartato. [96]
Todos los organismos están constantemente expuestos a compuestos que no pueden utilizar como alimentos y que serían dañinos si se acumularan en las células, ya que no tienen función metabólica. Estos compuestos potencialmente dañinos se llaman xenobióticos . [97] Los xenobióticos como las drogas sintéticas , los venenos naturales y los antibióticos son desintoxicados por un conjunto de enzimas metabolizadoras de xenobióticos. En los humanos, estas incluyen citocromo P450 oxidasas , [98] UDP-glucuronosiltransferasas , [99] y glutatión S -transferasas . [100] Este sistema de enzimas actúa en tres etapas para oxidar primero el xenobiótico (fase I) y luego conjugar grupos solubles en agua en la molécula (fase II). El xenobiótico soluble en agua modificado puede luego ser bombeado fuera de las células y en organismos multicelulares puede ser metabolizado aún más antes de ser excretado (fase III). En ecología , estas reacciones son particularmente importantes en la biodegradación microbiana de contaminantes y la biorremediación de tierras contaminadas y derrames de petróleo. [101] Muchas de estas reacciones microbianas son compartidas con organismos multicelulares, pero debido a la increíble diversidad de tipos de microbios, estos organismos pueden lidiar con una gama mucho más amplia de xenobióticos que los organismos multicelulares, y pueden degradar incluso contaminantes orgánicos persistentes como compuestos organoclorados . [102]
Un problema relacionado para los organismos aeróbicos es el estrés oxidativo . [103] Aquí, los procesos que incluyen la fosforilación oxidativa y la formación de enlaces disulfuro durante el plegamiento de proteínas producen especies reactivas de oxígeno como el peróxido de hidrógeno . [104] Estos oxidantes dañinos son eliminados por metabolitos antioxidantes como el glutatión y enzimas como las catalasas y las peroxidasas . [105] [106]
Los organismos vivos deben obedecer las leyes de la termodinámica , que describen la transferencia de calor y trabajo . La segunda ley de la termodinámica establece que en cualquier sistema aislado , la cantidad de entropía (desorden) no puede disminuir. Aunque la sorprendente complejidad de los organismos vivos parece contradecir esta ley, la vida es posible ya que todos los organismos son sistemas abiertos que intercambian materia y energía con su entorno. Los sistemas vivos no están en equilibrio , sino que son sistemas disipativos que mantienen su estado de alta complejidad al provocar un mayor aumento en la entropía de sus entornos. [107] El metabolismo de una célula logra esto al acoplar los procesos espontáneos de catabolismo a los procesos no espontáneos de anabolismo. En términos termodinámicos , el metabolismo mantiene el orden creando desorden. [108]
Como los entornos de la mayoría de los organismos cambian constantemente, las reacciones del metabolismo deben estar finamente reguladas para mantener un conjunto constante de condiciones dentro de las células, una condición llamada homeostasis . [109] [110] La regulación metabólica también permite a los organismos responder a señales e interactuar activamente con sus entornos. [111] Dos conceptos estrechamente vinculados son importantes para comprender cómo se controlan las vías metabólicas. En primer lugar, la regulación de una enzima en una vía es cómo su actividad aumenta y disminuye en respuesta a señales. En segundo lugar, el control ejercido por esta enzima es el efecto que estos cambios en su actividad tienen sobre la velocidad general de la vía (el flujo a través de la vía). [112] Por ejemplo, una enzima puede mostrar grandes cambios en la actividad (es decir, está altamente regulada) pero si estos cambios tienen poco efecto sobre el flujo de una vía metabólica, entonces esta enzima no está involucrada en el control de la vía. [113]
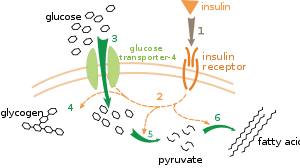
Existen múltiples niveles de regulación metabólica. En la regulación intrínseca, la vía metabólica se autorregula para responder a los cambios en los niveles de sustratos o productos; por ejemplo, una disminución en la cantidad de producto puede aumentar el flujo a través de la vía para compensar. [112] Este tipo de regulación a menudo implica la regulación alostérica de las actividades de múltiples enzimas en la vía. [114] El control extrínseco implica que una célula en un organismo multicelular cambia su metabolismo en respuesta a señales de otras células. Estas señales suelen estar en forma de mensajeros solubles en agua, como hormonas y factores de crecimiento , y son detectadas por receptores específicos en la superficie celular. [115] Estas señales luego se transmiten dentro de la célula por sistemas de segundos mensajeros que a menudo implican la fosforilación de proteínas. [116]
Un ejemplo muy bien entendido de control extrínseco es la regulación del metabolismo de la glucosa por la hormona insulina . [117] La insulina se produce en respuesta a aumentos en los niveles de glucosa en sangre . La unión de la hormona a los receptores de insulina en las células activa una cascada de proteínas quinasas que hacen que las células absorban glucosa y la conviertan en moléculas de almacenamiento como ácidos grasos y glucógeno . [118] El metabolismo del glucógeno está controlado por la actividad de la fosforilasa , la enzima que descompone el glucógeno, y la glucógeno sintasa , la enzima que lo produce. Estas enzimas se regulan de manera recíproca, con la fosforilación inhibiendo la glucógeno sintasa, pero activando la fosforilasa. La insulina causa la síntesis de glucógeno activando las proteínas fosfatasas y produciendo una disminución en la fosforilación de estas enzimas. [119]

Las vías centrales del metabolismo descritas anteriormente, como la glucólisis y el ciclo del ácido cítrico, están presentes en los tres dominios de los seres vivos y estaban presentes en el último ancestro común universal . [3] [120] Esta célula ancestral universal era procariota y probablemente un metanógeno que tenía un extenso metabolismo de aminoácidos, nucleótidos, carbohidratos y lípidos. [121] [122] La retención de estas vías antiguas durante la evolución posterior puede ser el resultado de que estas reacciones hayan sido una solución óptima a sus problemas metabólicos particulares, con vías como la glucólisis y el ciclo del ácido cítrico produciendo sus productos finales de manera altamente eficiente y en un número mínimo de pasos. [4] [5] Las primeras vías del metabolismo basado en enzimas pueden haber sido partes del metabolismo de nucleótidos de purina , mientras que las vías metabólicas anteriores eran parte del antiguo mundo del ARN . [123]
Se han propuesto muchos modelos para describir los mecanismos por los cuales evolucionan nuevas vías metabólicas. Estos incluyen la adición secuencial de nuevas enzimas a una vía ancestral corta, la duplicación y luego divergencia de vías enteras, así como el reclutamiento de enzimas preexistentes y su ensamblaje en una nueva vía de reacción. [124] La importancia relativa de estos mecanismos no está clara, pero los estudios genómicos han demostrado que es probable que las enzimas en una vía tengan una ascendencia compartida, lo que sugiere que muchas vías han evolucionado paso a paso con funciones nuevas creadas a partir de pasos preexistentes en la vía. [125] Un modelo alternativo proviene de estudios que rastrean la evolución de las estructuras de las proteínas en redes metabólicas, esto ha sugerido que las enzimas son reclutadas de manera generalizada, tomando prestadas enzimas para realizar funciones similares en diferentes vías metabólicas (evidente en la base de datos MANET ) [126] Estos procesos de reclutamiento dan como resultado un mosaico enzimático evolutivo. [127] Una tercera posibilidad es que algunas partes del metabolismo puedan existir como "módulos" que puedan reutilizarse en diferentes vías y realizar funciones similares en diferentes moléculas. [128]
Además de la evolución de nuevas vías metabólicas, la evolución también puede provocar la pérdida de funciones metabólicas. Por ejemplo, en algunos parásitos se pierden procesos metabólicos que no son esenciales para la supervivencia y, en su lugar, los aminoácidos, nucleótidos y carbohidratos preformados pueden ser extraídos del huésped . [129] Se observan capacidades metabólicas reducidas similares en organismos endosimbióticos . [130]

Clásicamente, el metabolismo se estudia mediante un enfoque reduccionista que se centra en una única vía metabólica. Particularmente valioso es el uso de trazadores radiactivos a nivel de todo el organismo, tejido y célula, que definen las rutas desde los precursores hasta los productos finales mediante la identificación de intermediarios y productos marcados radiactivamente. [131] Las enzimas que catalizan estas reacciones químicas pueden luego purificarse e investigarse su cinética y respuestas a los inhibidores . Un enfoque paralelo es identificar las pequeñas moléculas en una célula o tejido; el conjunto completo de estas moléculas se denomina metaboloma . En general, estos estudios dan una buena visión de la estructura y la función de vías metabólicas simples, pero son inadecuados cuando se aplican a sistemas más complejos como el metabolismo de una célula completa. [132]
Una idea de la complejidad de las redes metabólicas en células que contienen miles de enzimas diferentes la da la figura que muestra las interacciones entre sólo 43 proteínas y 40 metabolitos a la derecha: las secuencias de genomas proporcionan listas que contienen hasta 26.500 genes. [133] Sin embargo, ahora es posible utilizar estos datos genómicos para reconstruir redes completas de reacciones bioquímicas y producir modelos matemáticos más holísticos que puedan explicar y predecir su comportamiento. [134] Estos modelos son especialmente poderosos cuando se utilizan para integrar los datos de vías y metabolitos obtenidos a través de métodos clásicos con datos sobre la expresión genética de estudios proteómicos y de microarrays de ADN . [135] Utilizando estas técnicas, ahora se ha producido un modelo del metabolismo humano, que guiará el descubrimiento de fármacos futuros y la investigación bioquímica. [136] Estos modelos se utilizan ahora en el análisis de redes , para clasificar las enfermedades humanas en grupos que comparten proteínas o metabolitos comunes. [137] [138]
Las redes metabólicas bacterianas son un ejemplo sorprendente de organización en forma de pajarita [139] [140] [141] , una arquitectura capaz de introducir una amplia gama de nutrientes y producir una gran variedad de productos y macromoléculas complejas utilizando relativamente pocas monedas comunes intermedias. [142]
Una de las principales aplicaciones tecnológicas de esta información es la ingeniería metabólica . En ella, organismos como levaduras , plantas o bacterias se modifican genéticamente para que sean más útiles en la biotecnología y ayuden a la producción de fármacos como antibióticos o productos químicos industriales como el 1,3-propanodiol y el ácido shikímico . [143] [144] [145] Estas modificaciones genéticas suelen tener como objetivo reducir la cantidad de energía utilizada para producir el producto, aumentar los rendimientos y reducir la producción de desechos. [146]
El término metabolismo se deriva de la palabra griega antigua μεταβολή—“metabole” para “un cambio” que se deriva de μεταβάλλειν—“metaballein”, que significa “cambiar” [147]
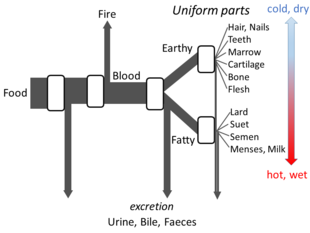
En Las partes de los animales, Aristóteles expone con suficiente detalle sus ideas sobre el metabolismo como para que se pueda elaborar un modelo de flujo abierto. Creía que en cada etapa del proceso se transformaban los materiales de los alimentos, se liberaba calor (el elemento clásico del fuego) y los materiales residuales se excretaban en forma de orina, bilis o heces. [148]
Ibn al-Nafis describió el metabolismo en su obra de 1260 d.C. titulada Al-Risalah al-Kamiliyyah fil Siera al-Nabawiyyah (El Tratado de Kamil sobre la biografía del Profeta) que incluía la siguiente frase: "Tanto el cuerpo como sus partes están en un estado continuo de disolución y nutrición, por lo que inevitablemente están experimentando un cambio permanente". [149]
La historia del estudio científico del metabolismo abarca varios siglos y ha evolucionado desde el examen de animales enteros en los primeros estudios hasta el examen de reacciones metabólicas individuales en la bioquímica moderna. Los primeros experimentos controlados sobre el metabolismo humano fueron publicados por Santorio Santorio en 1614 en su libro Ars de statica medicina . [150] Describió cómo se pesaba antes y después de comer, dormir , trabajar, tener relaciones sexuales, ayunar, beber y excretar. Descubrió que la mayor parte de los alimentos que ingería se perdían a través de lo que llamó " transpiración insensible ".

En estos primeros estudios, no se habían identificado los mecanismos de estos procesos metabólicos y se pensaba que una fuerza vital animaba el tejido vivo. [151] En el siglo XIX, al estudiar la fermentación del azúcar en alcohol por la levadura , Louis Pasteur concluyó que la fermentación era catalizada por sustancias dentro de las células de levadura que él llamó "fermentos". Escribió que "la fermentación alcohólica es un acto correlacionado con la vida y la organización de las células de levadura, no con la muerte o putrefacción de las células". [152] Este descubrimiento, junto con la publicación por Friedrich Wöhler en 1828 de un artículo sobre la síntesis química de la urea , [153] y es notable por ser el primer compuesto orgánico preparado a partir de precursores completamente inorgánicos. Esto demostró que los compuestos orgánicos y las reacciones químicas encontradas en las células no eran diferentes en principio a cualquier otra parte de la química.
Fue el descubrimiento de las enzimas a principios del siglo XX por Eduard Buchner lo que separó el estudio de las reacciones químicas del metabolismo del estudio biológico de las células, y marcó el comienzo de la bioquímica . [154] La masa de conocimiento bioquímico creció rápidamente a lo largo de principios del siglo XX. Uno de los más prolíficos de estos bioquímicos modernos fue Hans Krebs , quien hizo enormes contribuciones al estudio del metabolismo. [155] Descubrió el ciclo de la urea y más tarde, trabajando con Hans Kornberg , el ciclo del ácido cítrico y el ciclo del glioxilato. [156] [157] [75] La investigación bioquímica moderna se ha visto muy ayudada por el desarrollo de nuevas técnicas como la cromatografía , la difracción de rayos X , la espectroscopia de RMN , el marcaje radioisotópico , la microscopía electrónica y las simulaciones de dinámica molecular . Estas técnicas han permitido el descubrimiento y el análisis detallado de las muchas moléculas y vías metabólicas en las células. [ cita requerida ]
{{cite book}}: CS1 maint: DOI inactive as of September 2024 (link){{cite book}}: |journal=ignorado ( ayuda )Introductorio
Avanzado
información general
Metabolismo humano
Bases de datos
Vías metabólicas