La dextroanfetamina (DCI: dexanfetamina) es un potente estimulante del sistema nervioso central (SNC) y un enantiómero [nota 1] de la anfetamina que se prescribe para el tratamiento del trastorno por déficit de atención con hiperactividad (TDAH) y la narcolepsia . [11] [28] También se utiliza como potenciador del rendimiento atlético y cognitivo , y de forma recreativa como afrodisíaco y euforizante . La dextroanfetamina se considera generalmente el estimulante prototípico .
La molécula de anfetamina existe como dos enantiómeros, [nota 1] levoanfetamina y dextroanfetamina. La dextroanfetamina es el enantiómero dextrorrotatorio , o "diestro", y exhibe efectos más pronunciados en el sistema nervioso central que la levoanfetamina. El sulfato de dextroanfetamina farmacéutico está disponible tanto como medicamento de marca como genérico en una variedad de formas de dosificación . La dextroanfetamina a veces se prescribe como el profármaco inactivo lisdexanfetamina , que se convierte en dextroanfetamina después de la absorción.
Los efectos secundarios de la dextroanfetamina en dosis terapéuticas incluyen estado de ánimo elevado , disminución del apetito , sequedad de boca , rechinamiento excesivo de dientes , dolor de cabeza , aumento de la frecuencia cardíaca , aumento de la vigilia o insomnio , ansiedad e irritabilidad , entre otros. [30] En dosis excesivamente altas, puede producirse psicosis (es decir, alucinaciones , delirios ), adicción y degradación muscular rápida , aunque algunas personas experimentan psicosis incluso en dosis terapéuticas. [31]
La dextroanfetamina, al igual que otras anfetaminas, produce sus efectos estimulantes a través de varias acciones distintas: inhibe o revierte las proteínas transportadoras de los neurotransmisores monoamínicos (a saber, los transportadores de serotonina , noradrenalina y dopamina ) ya sea a través del receptor 1 asociado a aminas traza (TAAR1) o de manera independiente de TAAR1 cuando hay altas concentraciones citosólicas de los neurotransmisores monoamínicos [32] y libera estos neurotransmisores de las vesículas sinápticas a través del transportador vesicular de monoaminas 2. [ 33] También comparte muchas propiedades químicas y farmacológicas con las aminas traza humanas , particularmente la fenetilamina y la N -metilfenetilamina , siendo esta última un isómero de la anfetamina producida dentro del cuerpo humano. Está disponible como medicamento genérico . [30] En 2022, las sales mixtas de anfetamina (Adderall) fueron el decimocuarto medicamento más recetado en los Estados Unidos, con más de 34 millones de recetas. [34] [35]
La dextroanfetamina se utiliza para tratar el trastorno por déficit de atención con hiperactividad (TDAH) y la narcolepsia (un trastorno del sueño), [11] y a veces se prescribe fuera de etiqueta para la depresión y la obesidad . [28]
La dextroanfetamina reduce los síntomas negativos de la esquizofrenia y se ha demostrado que mejora los efectos del entrenamiento de discriminación auditiva en pacientes esquizofrénicos. [36] [37] También se ha demostrado que la dextroanfetamina prescrita reduce las tasas de hospitalización en pacientes con esquizofrenia, aunque dosis elevadas repetidas pueden provocar psicosis. [38]
Se sabe que la exposición prolongada a dosis suficientemente altas de anfetaminas en algunas especies animales produce un desarrollo anormal del sistema de dopamina o daño nervioso, [39] [40] pero, en humanos con TDAH, el uso prolongado de anfetaminas farmacéuticas en dosis terapéuticas parece mejorar el desarrollo cerebral y el crecimiento nervioso. [41] [42] [43] Las revisiones de estudios de imágenes por resonancia magnética (IRM) sugieren que el tratamiento prolongado con anfetaminas disminuye las anomalías en la estructura y función cerebral encontradas en sujetos con TDAH y mejora la función en varias partes del cerebro, como el núcleo caudado derecho de los ganglios basales . [41] [42] [43]
Las revisiones de la investigación clínica sobre estimulantes han establecido la seguridad y eficacia del uso continuo de anfetaminas a largo plazo para el tratamiento del TDAH. [44] [45] [46] Los ensayos controlados aleatorios de terapia estimulante continua para el tratamiento del TDAH que abarcan 2 años han demostrado la eficacia y seguridad del tratamiento. [44] [45] Dos revisiones han indicado que la terapia estimulante continua a largo plazo para el TDAH es eficaz para reducir los síntomas centrales del TDAH (es decir, hiperactividad, falta de atención e impulsividad), mejorar la calidad de vida y el rendimiento académico, y producir mejoras en una gran cantidad de resultados funcionales [nota 2] en 9 categorías de resultados relacionados con lo académico, el comportamiento antisocial , la conducción, el uso de drogas no medicinales, la obesidad, la ocupación, la autoestima , el uso de servicios (es decir, académicos, ocupacionales, de salud, financieros y legales) y la función social. [44] [46] Una revisión destacó un ensayo controlado aleatorio de nueve meses de tratamiento con anfetaminas para el TDAH en niños que encontró un aumento promedio de 4,5 puntos de CI , aumentos continuos en la atención y disminuciones continuas en conductas disruptivas e hiperactividad. [45] Otra revisión indicó que, con base en los estudios de seguimiento más largos realizados hasta la fecha, la terapia estimulante de por vida que comienza durante la infancia es continuamente efectiva para controlar los síntomas del TDAH y reduce el riesgo de desarrollar un trastorno por consumo de sustancias en la edad adulta. [44]
Los modelos actuales del TDAH sugieren que está asociado con deterioros funcionales en algunos de los sistemas de neurotransmisores del cerebro ; [47] estos deterioros funcionales implican una alteración de la neurotransmisión de dopamina en la proyección mesocorticolímbica y de la neurotransmisión de noradrenalina en las proyecciones noradrenérgicas desde el locus coeruleus hasta la corteza prefrontal . [47] Los estimulantes como el metilfenidato y la anfetamina son eficaces en el tratamiento del TDAH porque aumentan la actividad de los neurotransmisores en estos sistemas. [48] [47] [49] Aproximadamente el 80% de los que usan estos estimulantes ven mejoras en los síntomas del TDAH. [50] Los niños con TDAH que usan medicamentos estimulantes generalmente tienen mejores relaciones con sus compañeros y familiares, tienen un mejor desempeño en la escuela, son menos distraídos e impulsivos y tienen períodos de atención más largos. [51] [52] Las revisiones Cochrane [nota 3] sobre el tratamiento del TDAH en niños, adolescentes y adultos con anfetaminas farmacéuticas afirmaron que los estudios a corto plazo han demostrado que estos fármacos disminuyen la gravedad de los síntomas, pero tienen tasas de interrupción más altas que los medicamentos no estimulantes debido a sus efectos secundarios adversos . [54] [55] Una revisión Cochrane sobre el tratamiento del TDAH en niños con trastornos de tics como el síndrome de Tourette indicó que los estimulantes en general no empeoran los tics , pero las dosis altas de dextroanfetamina podrían exacerbar los tics en algunos individuos. [56]
La narcolepsia es un trastorno crónico del sueño y la vigilia que se asocia con somnolencia diurna excesiva, cataplejía y parálisis del sueño . [57] Los pacientes con narcolepsia son diagnosticados como tipo 1 o tipo 2, y solo los primeros presentan síntomas de cataplejía. [58] La narcolepsia tipo 1 resulta de la pérdida de aproximadamente 70.000 neuronas liberadoras de orexina en el hipotálamo lateral , lo que conduce a niveles significativamente reducidos de orexina cerebroespinal ; [59] [60] esta reducción es un biomarcador diagnóstico para la narcolepsia tipo 1. [58] Las neuronas de orexina del hipotálamo lateral inervan cada componente del sistema activador reticular ascendente (ARAS), que incluye núcleos noradrenérgicos , dopaminérgicos , histaminérgicos y serotoninérgicos que promueven la vigilia . [60] [61]
El modo de acción terapéutico de la anfetamina en la narcolepsia implica principalmente aumentar la actividad del neurotransmisor monoamínico en el ARAS. [59] [62] [63] Esto incluye neuronas noradrenérgicas en el locus coeruleus , neuronas dopaminérgicas en el área tegmental ventral , neuronas histaminérgicas en el núcleo tuberomamilar y neuronas serotoninérgicas en el núcleo del rafe dorsal . [61] [63] La dextroanfetamina, el enantiómero más dopaminérgico de la anfetamina, es particularmente eficaz para promover la vigilia porque la liberación de dopamina tiene la mayor influencia en la activación cortical y la excitación cognitiva, en relación con otras monoaminas. [59] Por el contrario, la levoanfetamina puede tener un mayor efecto sobre la cataplejía, un síntoma más sensible a los efectos de la noradrenalina y la serotonina. [59] Los núcleos noradrenérgicos y serotoninérgicos en el ARAS están involucrados en la regulación del ciclo del sueño REM y funcionan como células "REM-off", con el efecto de la anfetamina sobre la noradrenalina y la serotonina contribuyendo a la supresión del sueño REM y una posible reducción de la cataplejía en dosis altas. [59] [58] [61]
La guía de práctica clínica de 2021 de la Academia Estadounidense de Medicina del Sueño (AASM) recomienda condicionalmente la dextroanfetamina para el tratamiento de la narcolepsia tipo 1 y tipo 2. [64] El tratamiento con anfetaminas farmacéuticas generalmente es menos preferido en relación con otros estimulantes (p. ej., modafinilo ) y se considera una opción de tratamiento de tercera línea . [65] [66] [67] Las revisiones médicas indican que la anfetamina es segura y eficaz para el tratamiento de la narcolepsia. [59] [65] [64] La anfetamina parece ser más eficaz para mejorar los síntomas asociados con la hipersomnolencia , y tres revisiones encontraron reducciones clínicamente significativas en la somnolencia diurna en pacientes con narcolepsia. [59] [65] [64] Además, estas revisiones sugieren que la anfetamina puede mejorar de forma dosis-dependiente los síntomas de cataplejía. [59] [65] [64] Sin embargo, la calidad de la evidencia de estos hallazgos es baja y, en consecuencia, se refleja en la recomendación condicional de la AASM de la dextroanfetamina como una opción de tratamiento para la narcolepsia. [64]
En 2015, una revisión sistemática y un metaanálisis de ensayos clínicos de alta calidad encontraron que, cuando se usa en dosis bajas (terapéuticas), la anfetamina produce mejoras modestas pero inequívocas en la cognición, incluida la memoria de trabajo , la memoria episódica a largo plazo , el control inhibitorio y algunos aspectos de la atención , en adultos sanos normales; [68] [69] Se sabe que estos efectos de mejora de la cognición de la anfetamina están parcialmente mediados por la activación indirecta tanto del receptor de dopamina D 1 como del receptor α 2 -adrenérgico en la corteza prefrontal . [48] [68] Una revisión sistemática de 2014 encontró que las dosis bajas de anfetamina también mejoran la consolidación de la memoria , lo que a su vez conduce a una mejor recuperación de la información . [70] Las dosis terapéuticas de anfetamina también mejoran la eficiencia de la red cortical, un efecto que media mejoras en la memoria de trabajo en todos los individuos. [48] [71] La anfetamina y otros estimulantes del TDAH también mejoran la relevancia de la tarea (motivación para realizar una tarea) y aumentan la excitación (vigilia), lo que a su vez promueve el comportamiento dirigido a objetivos. [48] [72] [73] Los estimulantes como la anfetamina pueden mejorar el rendimiento en tareas difíciles y aburridas y algunos estudiantes los utilizan como ayuda para estudiar y realizar exámenes. [48] [73] [74] Según estudios sobre el uso de estimulantes ilícitos autodeclarado, entre el 5 y el 35 % de los estudiantes universitarios utilizan estimulantes desviados para el TDAH, que se utilizan principalmente para mejorar el rendimiento académico en lugar de como drogas recreativas. [75] [76] [77] Sin embargo, las dosis altas de anfetamina que están por encima del rango terapéutico pueden interferir con la memoria de trabajo y otros aspectos del control cognitivo. [48] [73]
La anfetamina es utilizada por algunos atletas por sus efectos psicológicos y de mejora del rendimiento atlético , como el aumento de la resistencia y el estado de alerta; [78] [79] sin embargo, el uso no médico de anfetamina está prohibido en eventos deportivos que están regulados por agencias antidopaje universitarias, nacionales e internacionales. [80] [81] En personas sanas en dosis terapéuticas orales, se ha demostrado que la anfetamina aumenta la fuerza muscular , la aceleración, el rendimiento atlético en condiciones anaeróbicas y la resistencia (es decir, retrasa la aparición de la fatiga ), al tiempo que mejora el tiempo de reacción . [78] [82] [83] La anfetamina mejora la resistencia y el tiempo de reacción principalmente a través de la inhibición de la recaptación y la liberación de dopamina en el sistema nervioso central. [82] [83] [84] La anfetamina y otras drogas dopaminérgicas también aumentan la potencia de salida a niveles fijos de esfuerzo percibido al anular un "interruptor de seguridad", lo que permite que el límite de temperatura central aumente para acceder a una capacidad de reserva que normalmente está fuera de los límites. [83] [85] [86] En dosis terapéuticas, los efectos adversos de la anfetamina no impiden el rendimiento atlético; [78] [82] sin embargo, en dosis mucho más altas, la anfetamina puede inducir efectos que perjudican gravemente el rendimiento, como la rápida degradación muscular y la temperatura corporal elevada . [87] [82]
La dextroanfetamina también se utiliza de forma recreativa como euforizante y afrodisíaco, y al igual que otras anfetaminas se utiliza como droga de club por su efecto energético y eufórico. Se considera que la dextroanfetamina tiene un alto potencial de mal uso de forma recreativa ya que las personas suelen informar que se sienten eufóricas , más alertas y con más energía después de tomar la droga. [88] [89] [90] Las propiedades dopaminérgicas (gratificantes) de la dextroanfetamina afectan al circuito mesocorticolímbico ; un grupo de estructuras neuronales responsables de la saliencia del incentivo (es decir, "querer"; deseo o ansia de una recompensa y motivación), el refuerzo positivo y las emociones con valencia positiva , particularmente las que involucran placer . [91] Grandes dosis recreativas de dextroanfetamina pueden producir síntomas de sobredosis de dextroanfetamina. [90] Los usuarios recreativos a veces abren las cápsulas de dexedrina y trituran el contenido para insuflarlo (inhalarlo) o luego disolverlo en agua e inyectarlo. [90] Las formulaciones de liberación inmediata tienen un mayor potencial de abuso por insuflación (inhalación) o inyección intravenosa debido a un perfil farmacocinético más favorable y una fácil triturabilidad (especialmente tabletas). [92] [93]
La razón para usar espátulas trituradas para métodos de insuflación e inyección se debe evidentemente a las formas de "liberación instantánea" de la droga que se observan en preparaciones de tabletas que a menudo contienen una cantidad considerable de aglutinantes y rellenos inactivos junto con la d-anfetamina activa , como la dextrosa . [94] La inyección en el torrente sanguíneo puede ser peligrosa porque los rellenos insolubles dentro de las tabletas pueden bloquear los vasos sanguíneos pequeños. [90] El uso excesivo crónico de dextroanfetamina puede provocar una dependencia grave de la droga , lo que resulta en síntomas de abstinencia cuando se interrumpe el consumo de la droga. [90]
Según el Programa Internacional de Seguridad Química (IPCS) y la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA), [nota 4] la anfetamina está contraindicada en personas con antecedentes de abuso de drogas , [nota 5] enfermedad cardiovascular , agitación severa o ansiedad severa. [96] [87] [97] También está contraindicada en individuos con arteriosclerosis avanzada (endurecimiento de las arterias), glaucoma (aumento de la presión ocular), hipertiroidismo (producción excesiva de hormona tiroidea) o hipertensión moderada a severa . [96] [87] [97] Estas agencias indican que las personas que han experimentado reacciones alérgicas a otros estimulantes o que están tomando inhibidores de la monoaminooxidasa (IMAO) no deben tomar anfetamina, [96] [87] [97] aunque se ha documentado el uso concurrente seguro de anfetamina e inhibidores de la monoaminooxidasa. [98] [99] Estas agencias también establecen que cualquier persona con anorexia nerviosa , trastorno bipolar , depresión, hipertensión, problemas hepáticos o renales, manía , psicosis , fenómeno de Raynaud , convulsiones , problemas de tiroides , tics o síndrome de Tourette debe controlar sus síntomas mientras toma anfetamina. [87] [97] La evidencia de estudios en humanos indica que el uso terapéutico de anfetamina no causa anomalías del desarrollo en el feto o los recién nacidos (es decir, no es un teratógeno humano ), pero el abuso de anfetaminas sí plantea riesgos para el feto. [97] También se ha demostrado que la anfetamina pasa a la leche materna, por lo que el IPCS y la FDA aconsejan a las madres que eviten la lactancia materna cuando la usen. [87] [97] Debido al potencial de alteraciones reversibles del crecimiento, [nota 6] la FDA aconseja controlar la altura y el peso de los niños y adolescentes a los que se les prescribe un fármaco de anfetamina. [87]
Los efectos secundarios cardiovasculares pueden incluir hipertensión o hipotensión debido a una respuesta vasovagal , fenómeno de Raynaud (flujo sanguíneo reducido a las manos y los pies) y taquicardia (aumento de la frecuencia cardíaca). [87] [79] [100] Los efectos secundarios sexuales en los hombres pueden incluir disfunción eréctil , erecciones frecuentes o erecciones prolongadas . [87] Los efectos secundarios gastrointestinales pueden incluir dolor abdominal , estreñimiento , diarrea y náuseas . [5] [87] [101] Otros posibles efectos secundarios físicos incluyen pérdida de apetito , visión borrosa , boca seca , rechinamiento excesivo de dientes , hemorragia nasal, sudoración profusa, rinitis medicamentosa (congestión nasal inducida por fármacos), umbral convulsivo reducido , tics (un tipo de trastorno del movimiento) y pérdida de peso . [fuentes 1] Los efectos secundarios físicos peligrosos son raros en dosis farmacéuticas típicas. [79]
La anfetamina estimula los centros respiratorios medulares , produciendo respiraciones más rápidas y profundas. [79] En una persona normal en dosis terapéuticas, este efecto no suele ser perceptible, pero cuando la respiración ya está comprometida, puede ser evidente. [79 ] La anfetamina también induce la contracción en el esfínter de la vejiga urinaria , el músculo que controla la micción, lo que puede provocar dificultad para orinar. [79] Este efecto puede ser útil para tratar la enuresis y la pérdida del control de la vejiga . [79] Los efectos de la anfetamina en el tracto gastrointestinal son impredecibles. [79] Si la actividad intestinal es alta, la anfetamina puede reducir la motilidad gastrointestinal (la velocidad a la que el contenido se mueve a través del sistema digestivo); [79] sin embargo, la anfetamina puede aumentar la motilidad cuando el músculo liso del tracto está relajado. [79] La anfetamina también tiene un ligero efecto analgésico y puede mejorar los efectos analgésicos de los opioides . [5] [79]
Estudios encargados por la FDA en 2011 indican que en niños, adultos jóvenes y adultos no existe asociación entre eventos cardiovasculares adversos graves ( muerte súbita , ataque cardíaco y accidente cerebrovascular ) y el uso médico de anfetaminas u otros estimulantes del TDAH. [fuentes 2] Sin embargo, los fármacos de anfetamina están contraindicados en personas con enfermedad cardiovascular . [fuentes 3]
En dosis terapéuticas normales, los efectos secundarios psicológicos más comunes de la anfetamina incluyen aumento del estado de alerta , aprensión, concentración , iniciativa, confianza en uno mismo y sociabilidad, cambios de humor ( estado de ánimo eufórico seguido de estado de ánimo levemente deprimido ), insomnio o vigilia y disminución de la sensación de fatiga. [87] [79] Los efectos secundarios menos comunes incluyen ansiedad , cambio en la libido , grandiosidad , irritabilidad , comportamientos repetitivos u obsesivos e inquietud; [fuentes 4] estos efectos dependen de la personalidad del usuario y del estado mental actual. [79] La psicosis por anfetamina (p. ej., delirios y paranoia ) puede ocurrir en usuarios habituales. [87] [109] [110] Aunque es muy poco común, esta psicosis también puede ocurrir en dosis terapéuticas durante la terapia a largo plazo. [87] [110] [111] Según la FDA, "no hay evidencia sistemática" de que los estimulantes produzcan comportamiento agresivo u hostilidad. [87]
También se ha demostrado que la anfetamina produce una preferencia condicionada por el lugar en los seres humanos que toman dosis terapéuticas, [54] [112] lo que significa que los individuos adquieren una preferencia por pasar el tiempo en lugares donde han consumido anfetamina previamente. [112] [113]
La adicción es un riesgo grave con el uso recreativo intenso de anfetaminas, pero es poco probable que ocurra con el uso médico a largo plazo en dosis terapéuticas; [123] [124] [65] de hecho, la terapia estimulante de por vida para el TDAH que comienza durante la infancia reduce el riesgo de desarrollar trastornos por uso de sustancias en la edad adulta. [44] La hiperactivación patológica de la vía mesolímbica , una vía de dopamina que conecta el área tegmental ventral con el núcleo accumbens , juega un papel central en la adicción a las anfetaminas. [125] [126] Las personas que frecuentemente se autoadministran altas dosis de anfetamina tienen un alto riesgo de desarrollar una adicción a las anfetaminas, ya que el uso crónico en dosis altas aumenta gradualmente el nivel de ΔFosB accumbal , un "interruptor molecular" y "proteína de control maestro" para la adicción. [114] [127] [128] Una vez que el ΔFosB del núcleo accumbens se sobreexpresa lo suficiente, comienza a aumentar la gravedad de la conducta adictiva (es decir, la búsqueda compulsiva de la droga) con aumentos adicionales en su expresión. [127] [129] Si bien actualmente no existen medicamentos efectivos para tratar la adicción a las anfetaminas, la participación regular en ejercicio aeróbico sostenido parece reducir el riesgo de desarrollar dicha adicción. [130] [131] La terapia con ejercicios mejora los resultados del tratamiento clínico y puede usarse como terapia complementaria con terapias conductuales para la adicción. [130] [132] [fuentes 5]
El uso crónico de anfetamina en dosis excesivas provoca alteraciones en la expresión génica en la proyección mesocorticolímbica , que surgen a través de mecanismos transcripcionales y epigenéticos . [128] [133] [134] Los factores de transcripción más importantes [nota 7] que producen estas alteraciones son el homólogo B del oncogén viral del osteosarcoma murino Delta FBJ ( ΔFosB ), la proteína de unión al elemento de respuesta a AMPc ( CREB ) y el factor nuclear kappa B ( NF-κB ). [128] ΔFosB es el mecanismo biomolecular más significativo en la adicción porque la sobreexpresión de ΔFosB (es decir, un nivel anormalmente alto de expresión génica que produce un fenotipo pronunciado relacionado con el gen ) en las neuronas espinosas medianas de tipo D1 en el núcleo accumbens es necesaria y suficiente [nota 8] para muchas de las adaptaciones neuronales y regula múltiples efectos conductuales (p. ej., sensibilización a la recompensa y autoadministración creciente de drogas ) involucrados en la adicción. [114] [127] [128] Una vez que ΔFosB se sobreexpresa suficientemente, induce un estado adictivo que se vuelve cada vez más grave con mayores aumentos en la expresión de ΔFosB. [114] [127] Se ha implicado en adicciones al alcohol , cannabinoides , cocaína , metilfenidato , nicotina , opioides , fenciclidina , propofol y anfetaminas sustituidas , entre otros. [fuentes 6]
ΔJunD , un factor de transcripción, y G9a , una enzima metiltransferasa de histonas , se oponen a la función de ΔFosB e inhiben los aumentos en su expresión. [114] [128] [138] La sobreexpresión suficiente de ΔJunD en el núcleo accumbens con vectores virales puede bloquear por completo muchas de las alteraciones neuronales y conductuales observadas en el abuso crónico de drogas (es decir, las alteraciones mediadas por ΔFosB). [128] De manera similar, la hiperexpresión de G9a accumbal resulta en una dimetilación marcadamente aumentada del residuo 9 de lisina de la histona 3 ( H3K9me2 ) y bloquea la inducción de plasticidad neuronal y conductual mediada por ΔFosB por el uso crónico de drogas, [fuentes 7] que ocurre a través de la represión mediada por H3K9me2 de factores de transcripción para ΔFosB y la represión mediada por H3K9me2 de varios objetivos transcripcionales de ΔFosB (por ejemplo, CDK5 ). [128] [138] [139] ΔFosB también juega un papel importante en la regulación de las respuestas conductuales a las recompensas naturales , como la comida sabrosa, el sexo y el ejercicio. [129] [128] [142] Dado que tanto las recompensas naturales como las drogas adictivas inducen la expresión de ΔFosB (es decir, hacen que el cerebro produzca más), la adquisición crónica de estas recompensas puede resultar en un estado patológico similar de adicción. [129] [128] En consecuencia, ΔFosB es el factor más significativo involucrado tanto en la adicción a las anfetaminas como en las adicciones sexuales inducidas por anfetaminas , que son conductas sexuales compulsivas que resultan de la actividad sexual excesiva y el uso de anfetaminas. [129] [143] [144] Estas adicciones sexuales están asociadas con un síndrome de desregulación de la dopamina que ocurre en algunos pacientes que toman fármacos dopaminérgicos . [129] [142]
Los efectos de la anfetamina sobre la regulación genética dependen tanto de la dosis como de la vía de administración. [134] La mayor parte de la investigación sobre la regulación genética y la adicción se basa en estudios en animales con administración intravenosa de anfetamina en dosis muy altas. [134] Los pocos estudios que han utilizado dosis terapéuticas humanas equivalentes (ajustadas al peso) y administración oral muestran que estos cambios, si ocurren, son relativamente menores. [134] Esto sugiere que el uso médico de la anfetamina no afecta significativamente a la regulación genética. [134]
A diciembre de 2019, [actualizar]no existe una farmacoterapia eficaz para la adicción a las anfetaminas. [145] [146] [147] Las revisiones de 2015 y 2016 indicaron que los agonistas selectivos de TAAR1 tienen un potencial terapéutico significativo como tratamiento para las adicciones a los psicoestimulantes; [148] [149] sin embargo, a febrero de 2016, [actualizar]los únicos compuestos que se sabe que funcionan como agonistas selectivos de TAAR1 son medicamentos experimentales . [148] [149] La adicción a las anfetaminas está mediada en gran medida por una mayor activación de los receptores de dopamina y los receptores NMDA co-localizados [nota 9] en el núcleo accumbens; [126] los iones de magnesio inhiben los receptores NMDA al bloquear el canal de calcio del receptor . [126] [150] Una revisión sugirió que, basándose en pruebas con animales, el uso patológico (que induce adicción) de psicoestimulantes reduce significativamente el nivel de magnesio intracelular en todo el cerebro. [ 126] Se ha demostrado que el tratamiento con magnesio suplementario [nota 10] reduce la autoadministración de anfetaminas (es decir, las dosis que uno mismo se administra) en humanos, pero no es una monoterapia eficaz para la adicción a las anfetaminas. [126]
Una revisión sistemática y un metanálisis de 2019 evaluaron la eficacia de 17 farmacoterapias diferentes utilizadas en ensayos controlados aleatorios (ECA) para la adicción a la anfetamina y la metanfetamina; [146] solo encontró evidencia de baja fuerza de que el metilfenidato podría reducir la autoadministración de anfetamina o metanfetamina. [146] Hubo evidencia de baja a moderada fuerza de que no hubo beneficio para la mayoría de los otros medicamentos utilizados en ECA, que incluyeron antidepresivos (bupropión, mirtazapina , sertralina ), antipsicóticos ( aripiprazol ), anticonvulsivos ( topiramato , baclofeno , gabapentina ), naltrexona , vareniclina , citicolina , ondansetrón , prometa , riluzol , atomoxetina , dextroanfetamina y modafinilo . [146]
Una revisión sistemática y un metanálisis en red de 2018 de 50 ensayos que involucraron 12 intervenciones psicosociales diferentes para la adicción a la anfetamina, la metanfetamina o la cocaína encontraron que la terapia combinada con un enfoque de manejo de contingencias y refuerzo comunitario tuvo la mayor eficacia (es decir, tasa de abstinencia) y aceptabilidad (es decir, tasa de abandono más baja). [151] Otras modalidades de tratamiento examinadas en el análisis incluyeron monoterapia con manejo de contingencias o enfoque de refuerzo comunitario, terapia cognitivo conductual , programas de 12 pasos , terapias basadas en recompensas no contingentes, terapia psicodinámica y otras terapias combinadas que involucran estos. [151]
Además, la investigación sobre los efectos neurobiológicos del ejercicio físico sugiere que el ejercicio aeróbico diario, especialmente el ejercicio de resistencia (p. ej., correr maratones ), previene el desarrollo de la adicción a las drogas y es una terapia complementaria eficaz (es decir, un tratamiento complementario) para la adicción a las anfetaminas. [fuentes 5] El ejercicio conduce a mejores resultados del tratamiento cuando se utiliza como tratamiento complementario, en particular para las adicciones a los psicoestimulantes. [130] [132] [152] En particular, el ejercicio aeróbico disminuye la autoadministración de psicoestimulantes, reduce el restablecimiento (es decir, la recaída) de la búsqueda de drogas e induce una mayor densidad del receptor de dopamina D 2 (DRD2) en el cuerpo estriado . [129] [152] Esto es lo opuesto al uso patológico de estimulantes, que induce una disminución de la densidad del DRD2 estriatal. [129] Una revisión señaló que el ejercicio también puede prevenir el desarrollo de una adicción a las drogas al alterar la inmunorreactividad de ΔFosB o c-Fos en el cuerpo estriado u otras partes del sistema de recompensa . [131]
La tolerancia a las drogas se desarrolla rápidamente en el abuso de anfetaminas (es decir, uso recreativo de anfetaminas), por lo que los períodos de abuso prolongado requieren dosis cada vez mayores de la droga para lograr el mismo efecto. [153] [154] Según una revisión Cochrane sobre la abstinencia en personas que consumen anfetaminas y metanfetaminas compulsivamente, "cuando los grandes consumidores crónicos interrumpen abruptamente el consumo de anfetaminas, muchos informan un síndrome de abstinencia limitado en el tiempo que ocurre dentro de las 24 horas posteriores a su última dosis". [155] Esta revisión señaló que los síntomas de abstinencia en los consumidores crónicos de dosis altas son frecuentes, ocurren en aproximadamente el 88% de los casos y persisten durante 3 a 4 semanas con una marcada fase de "caída" que ocurre durante la primera semana. [155] Los síntomas de abstinencia de anfetaminas pueden incluir ansiedad, ansia por la droga , estado de ánimo deprimido , fatiga , aumento del apetito , aumento del movimiento o disminución del movimiento , falta de motivación, insomnio o somnolencia y sueños lúcidos . [155] La revisión indicó que la gravedad de los síntomas de abstinencia está correlacionada positivamente con la edad del individuo y el grado de dependencia. [155] Los síntomas de abstinencia leves por la interrupción del tratamiento con anfetaminas en dosis terapéuticas se pueden evitar reduciendo gradualmente la dosis. [5]
Una sobredosis de anfetamina puede provocar muchos síntomas diferentes, pero rara vez es mortal con el cuidado adecuado. [5] [97] [156] La gravedad de los síntomas de sobredosis aumenta con la dosis y disminuye con la tolerancia a la droga anfetamina. [79] [97] Se sabe que las personas tolerantes toman hasta 5 gramos de anfetamina en un día, que es aproximadamente 100 veces la dosis terapéutica diaria máxima. [97] Los síntomas de una sobredosis moderada y extremadamente grande se enumeran a continuación; la intoxicación mortal por anfetamina generalmente también implica convulsiones y coma . [87] [79] En 2013, la sobredosis de anfetamina, metanfetamina y otros compuestos implicados en un " trastorno por consumo de anfetaminas " resultó en un estimado de 3.788 muertes en todo el mundo ( 3.425–4.145 muertes, 95% de confianza ). [nota 11] [157]
En roedores y primates, dosis suficientemente altas de anfetamina causan neurotoxicidad dopaminérgica , o daño a las neuronas de dopamina, que se caracteriza por la degeneración terminal de la dopamina y la reducción de la función del transportador y receptor. [160] [161] No hay evidencia de que la anfetamina sea directamente neurotóxica en humanos. [162] [163] Sin embargo, grandes dosis de anfetamina pueden causar neurotoxicidad dopaminérgica indirectamente como resultado de la hiperpirexia , la formación excesiva de especies reactivas de oxígeno y el aumento de la autooxidación de la dopamina. [fuentes 9] Los modelos animales de neurotoxicidad por exposición a altas dosis de anfetamina indican que la aparición de hiperpirexia (es decir, temperatura corporal central ≥ 40 °C) es necesaria para el desarrollo de la neurotoxicidad inducida por anfetamina. [161] Las elevaciones prolongadas de la temperatura cerebral por encima de los 40 °C probablemente promueven el desarrollo de neurotoxicidad inducida por anfetamina en animales de laboratorio al facilitar la producción de especies reactivas de oxígeno, alterar la función de las proteínas celulares y aumentar transitoriamente la permeabilidad de la barrera hematoencefálica . [161]
Una sobredosis de anfetamina puede provocar una psicosis estimulante que puede implicar una variedad de síntomas, como delirios y paranoia. [109] [110] Una revisión Cochrane sobre el tratamiento de la psicosis por anfetamina, dextroanfetamina y metanfetamina afirma que entre el 5 y el 15 % de los usuarios no se recuperan por completo. [109] [166] Según la misma revisión, hay al menos un ensayo que muestra que los medicamentos antipsicóticos resuelven eficazmente los síntomas de la psicosis anfetamínica aguda. [109] La psicosis rara vez surge del uso terapéutico. [87] [110] [111]
Se sabe que muchos tipos de sustancias interactúan con la anfetamina, lo que resulta en una acción alterada del fármaco o del metabolismo de la anfetamina, la sustancia interactuante o ambos. [20] [167] [31] Los inhibidores de las enzimas que metabolizan la anfetamina (p. ej., CYP2D6 y FMO3 ) prolongarán su vida media de eliminación , lo que significa que sus efectos durarán más. [27] [167] [31] La anfetamina también interactúa con los IMAO , particularmente los inhibidores de la monoaminooxidasa A , ya que tanto los IMAO como la anfetamina aumentan las catecolaminas plasmáticas (es decir, noradrenalina y dopamina); [167] [31] por lo tanto, el uso concurrente de ambos es peligroso. [167] [31] La anfetamina modula la actividad de la mayoría de las drogas psicoactivas. En particular, la anfetamina puede disminuir los efectos de los sedantes y depresores y aumentar los efectos de los estimulantes y antidepresivos . [167] [31] La anfetamina también puede disminuir los efectos de los antihipertensivos y antipsicóticos debido a sus efectos sobre la presión arterial y la dopamina respectivamente. [167] [31] La suplementación con zinc puede reducir la dosis mínima efectiva de anfetamina cuando se utiliza para el tratamiento del TDAH. [nota 12] [171]
La anfetamina y sus enantiómeros han sido identificados como potentes agonistas completos del receptor 1 asociado a aminas traza (TAAR1), un GPCR , descubierto en 2001, que es importante para la regulación de los sistemas monoaminérgicos en el cerebro. [177] [178] La activación de TAAR1 aumenta la producción de AMPc a través de la activación de la adenilil ciclasa e inhibe la función del transportador de dopamina , el transportador de noradrenalina y el transportador de serotonina , además de inducir la liberación de estos neurotransmisores de monoamina (eflujo). [32] [177] [179] Los enantiómeros de anfetamina también son sustratos para un transportador de captación de vesículas sinápticas neuronales específico llamado VMAT2 . [33] Cuando la anfetamina es captada por VMAT2 , la vesícula libera (eflujos) dopamina, noradrenalina y serotonina, entre otras monoaminas, en el citosol a cambio. [33]
La dextroanfetamina (el enantiómero dextrógiro ) y la levoanfetamina (el enantiómero levógiro ) tienen una farmacodinámica idéntica, pero sus afinidades de unión a sus objetivos biomoleculares varían. [178] [180] La dextroanfetamina es un agonista más potente de TAAR1 que la levoanfetamina. [178] En consecuencia, la dextroanfetamina produce aproximadamente de tres a cuatro veces más estimulación del sistema nervioso central (SNC) que la levoanfetamina; [178] [180] sin embargo, la levoanfetamina tiene efectos cardiovasculares y periféricos ligeramente mayores. [180]
La anfetamina tiene una estructura y función muy similar a las aminas traza endógenas, que son moléculas neuromoduladoras naturales producidas en el cuerpo y el cerebro humanos. [32] [181] [182] Entre este grupo, los compuestos más estrechamente relacionados son la fenetilamina , el compuesto original de la anfetamina, y la N -metilfenetilamina , un isómero estructural de la anfetamina (es decir, tiene una fórmula molecular idéntica). [32] [181] [183] En los seres humanos, la fenetilamina se produce directamente a partir de L-fenilalanina por la enzima descarboxilasa de aminoácidos aromáticos (AADC), que también convierte L-DOPA en dopamina. [181] [183] A su vez, la N -metilfenetilamina se metaboliza a partir de fenetilamina por la feniletanolamina N -metiltransferasa , la misma enzima que metaboliza la noradrenalina en epinefrina. [181] [183] Al igual que la anfetamina, tanto la fenetilamina como la N -metilfenetilamina regulan la neurotransmisión de monoamina a través de TAAR1 ; [32] [182] [183] a diferencia de la anfetamina, ambas sustancias son descompuestas por la monoaminooxidasa B y, por lo tanto, tienen una vida media más corta que la anfetamina. [181] [183]
La biodisponibilidad oral de la anfetamina varía con el pH gastrointestinal; [87] se absorbe bien en el intestino y la biodisponibilidad es típicamente del 90%. [14] La anfetamina es una base débil con un p K a de 9,9; [20] en consecuencia, cuando el pH es básico, más del fármaco está en su forma de base libre soluble en lípidos y más se absorbe a través de las membranas celulares ricas en lípidos del epitelio intestinal . [20] [87] Por el contrario, un pH ácido significa que el fármaco está predominantemente en una forma catiónica (sal) soluble en agua y se absorbe menos. [20] Aproximadamente el 20% de la anfetamina que circula en el torrente sanguíneo está unida a las proteínas plasmáticas . [15] Después de la absorción, la anfetamina se distribuye fácilmente en la mayoría de los tejidos del cuerpo, con altas concentraciones en el líquido cefalorraquídeo y el tejido cerebral . [22]
Las vidas medias de los enantiómeros de anfetamina difieren y varían con el pH de la orina. [20] A un pH urinario normal, las vidas medias de la dextroanfetamina y la levoanfetamina son de 9 a 11 horas y de 11 a 14 horas, respectivamente. [20] La orina muy ácida reducirá las vidas medias de los enantiómeros a 7 horas; [22] la orina muy alcalina aumentará las vidas medias hasta 34 horas. [22] Las variantes de liberación inmediata y liberación prolongada de las sales de ambos isómeros alcanzan concentraciones plasmáticas máximas a las 3 y 7 horas después de la dosis respectivamente. [20] La anfetamina se elimina por los riñones , y entre el 30 y el 40 % de la droga se excreta sin cambios a un pH urinario normal. [20] Cuando el pH urinario es básico, la anfetamina está en su forma de base libre, por lo que se excreta menos. [20] Cuando el pH de la orina es anormal, la recuperación urinaria de anfetamina puede variar desde un mínimo de 1% hasta un máximo de 75%, dependiendo principalmente de si la orina es demasiado básica o ácida, respectivamente. [20] Después de la administración oral, la anfetamina aparece en la orina dentro de las 3 horas. [22] Aproximadamente el 90% de la anfetamina ingerida se elimina 3 días después de la última dosis oral. [22]
CYP2D6 , dopamina β-hidroxilasa (DBH), monooxigenasa que contiene flavina 3 (FMO3), butirato-CoA ligasa (XM-ligasa) y glicina N -aciltransferasa (GLYAT) son las enzimas conocidas por metabolizar la anfetamina o sus metabolitos en humanos. [fuentes 10] La anfetamina tiene una variedad de productos metabólicos excretados, incluyendo 4-hidroxianfetamina , 4-hidroxinorefedrina , 4-hidroxifenilacetona , ácido benzoico , ácido hipúrico , norefedrina y fenilacetona . [20] [184] Entre estos metabolitos, los simpaticomiméticos activos son 4-hidroxianfetamina , [185] 4-hidroxinorefedrina , [186] y norefedrina. [187] Las principales vías metabólicas implican la parahidroxilación aromática, la alfa y beta hidroxilación alifática, la N -oxidación, la N -desalquilación y la desaminación. [20] [188] Las vías metabólicas conocidas, los metabolitos detectables y las enzimas metabolizadoras en humanos incluyen los siguientes:
La anfetamina racémica fue sintetizada por primera vez bajo el nombre químico "fenilisopropilamina" en Berlín en 1887 por el químico rumano Lazăr Edeleanu . No se comercializó ampliamente hasta 1932, cuando la compañía farmacéutica Smith, Kline & French (ahora conocida como GlaxoSmithKline ) la introdujo en forma de inhalador Benzedrine para su uso como broncodilatador . Cabe destacar que la anfetamina contenida en el inhalador Benzedrine era la base libre líquida, [nota 14] no una sal de cloruro o sulfato.
Tres años después, en 1935, la comunidad médica se dio cuenta de las propiedades estimulantes de la anfetamina, específicamente del isómero dextroanfetamina, y en 1937 Smith, Kline y French introdujeron tabletas bajo la marca Dexedrine . [197] En los Estados Unidos, Dexedrine fue aprobado para tratar la narcolepsia y el trastorno por déficit de atención con hiperactividad (TDAH). [11] En Canadá, las indicaciones alguna vez incluyeron la epilepsia y el parkinsonismo. [198] La dextroanfetamina se comercializó en varias otras formas en las décadas siguientes, principalmente por Smith, Kline y French, como varios medicamentos combinados que incluían una mezcla de dextroanfetamina y amobarbital (un barbitúrico ) vendido bajo la marca Dexamyl y, en la década de 1950, una cápsula de liberación prolongada (la "Spansule"). [199] Las preparaciones que contenían dextroanfetamina también se utilizaron en la Segunda Guerra Mundial como tratamiento contra la fatiga . [28]
Rápidamente se hizo evidente que la dextroanfetamina y otras anfetaminas tenían un alto potencial de mal uso , aunque no fueron fuertemente controladas hasta 1970, cuando el Congreso de los Estados Unidos aprobó la Ley Integral de Prevención y Control del Abuso de Drogas . La dextroanfetamina, junto con otros simpaticomiméticos, fue finalmente clasificada como Lista II, la categoría más restrictiva posible para una droga con un uso médico reconocido y sancionado por el gobierno. [200] A nivel internacional, ha estado disponible bajo los nombres de AmfeDyn (Italia), Curban (EE. UU.), Obetrol (Suiza), Simpamina (Italia), Dexedrine/GSK (EE. UU. y Canadá), Dexedrine/UCB (Reino Unido), Dextropa (Portugal) y Stild (España). [201] Se hizo popular en la escena mod en Inglaterra a principios de la década de 1960, y se trasladó a la escena Northern Soul en el norte de Inglaterra hasta finales de la década de 1970.
En octubre de 2010, GlaxoSmithKline vendió los derechos de Dexedrine Spansule a Amedra Pharmaceuticals (una subsidiaria de CorePharma). [202]
La Fuerza Aérea de los Estados Unidos utiliza la dextroanfetamina como una de sus "pastillas para la acción", que se les da a los pilotos en misiones largas para ayudarlos a permanecer concentrados y alertas. Por el contrario, las "pastillas para la acción" se utilizan una vez finalizada la misión, para combatir los efectos de la misión y de las "pastillas para la acción". [203] [204] [205] Los informes de los medios vincularon el incidente de la granja Tarnak con el uso de esta droga en pilotos fatigados a largo plazo. Los militares no aceptaron esta explicación, citando la falta de incidentes similares. Se están investigando nuevos medicamentos estimulantes o agentes que promueven el estado de vigilia con diferentes perfiles de efectos secundarios, como el modafinilo , y a veces se prescriben por este motivo. [204]
La dextroanfetamina está disponible como un parche transdérmico que contiene base de dextroanfetamina bajo la marca Xelstrym. [12]
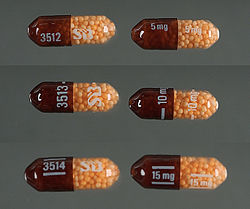
En los Estados Unidos, las formulaciones de liberación inmediata (IR) de sulfato de dextroanfetamina están disponibles genéricamente como tabletas de 5 mg y 10 mg, comercializadas por Barr ( Teva Pharmaceutical Industries ), Mallinckrodt Pharmaceuticals , Wilshire Pharmaceuticals, Aurobindo Pharmaceutical USA y CorePharma. Las tabletas IR anteriores vendidas bajo las marcas Dexedrine y Dextrostat han sido descontinuadas, pero en 2015, las tabletas IR comenzaron a estar disponibles bajo la marca Zenzedi, ofrecidas como tabletas de 2,5 mg, 5 mg, 7,5 mg, 10 mg, 15 mg, 20 mg y 30 mg. [218] El sulfato de dextroanfetamina también está disponible como una preparación de cápsula de liberación controlada (CR) en concentraciones de 5 mg, 10 mg y 15 mg bajo la marca Dexedrine Spansule, con versiones genéricas comercializadas por Barr y Mallinckrodt. Existe una solución oral con sabor a chicle disponible bajo la marca ProCentra, fabricada por FSC Pediatrics, que está diseñada para ser un método de administración más fácil en niños que tienen dificultad para tragar comprimidos; cada 5 ml contiene 5 mg de dextroanfetamina. [219] La tasa de conversión entre el sulfato de dextroanfetamina y la base libre de anfetamina es de 0,728. [220]
En Australia, la dexanfetamina está disponible en frascos de 100 comprimidos de liberación instantánea de 5 mg como fármaco genérico [221] o los preparados de dextroanfetamina de liberación lenta pueden ser elaborados por químicos individuales. [222] En el Reino Unido, está disponible en comprimidos de sulfato de liberación instantánea de 5 mg bajo el nombre genérico de sulfato de dexanfetamina, así como en comprimidos de 10 mg y 20 mg bajo la marca Amfexa. También está disponible en jarabe oral genérico sin azúcar de sulfato de dexanfetamina de 5 mg/ml. [223] La marca Dexedrine estaba disponible en el Reino Unido antes de que UCB Pharma desinvirtiera el producto a otra empresa farmacéutica ( Auden Mckenzie ). [224]
La dextroanfetamina es el metabolito activo del profármaco lisdexanfetamina (L-lisina-dextroanfetamina), disponible bajo la marca Vyvanse (Elvanse en el mercado europeo) (Venvanse en el mercado brasileño) (lisdexanfetamina di mesilato ). La dextroanfetamina se libera de la lisdexanfetamina enzimáticamente después del contacto con los glóbulos rojos. La conversión está limitada por la enzima, lo que evita altas concentraciones de dextroanfetamina en sangre y reduce el gusto por la lisdexanfetamina y el potencial de abuso en dosis clínicas. [225] [226] Vyvanse se comercializa como una dosis de una vez al día, ya que proporciona una liberación lenta de dextroanfetamina en el cuerpo. Vyvanse está disponible en cápsulas y tabletas masticables, y en siete concentraciones; 10 mg, 20 mg, 30 mg, 40 mg, 50 mg, 60 mg y 70 mg. La tasa de conversión entre dimesilato de lisdexanfetamina (Vyvanse) y dextroanfetamina base es del 29,5 %. [227] [228] [229]

Otro fármaco que contiene dextroanfetamina es conocido comúnmente por la marca Adderall. [167] [31] Está disponible en comprimidos de liberación inmediata (IR) y cápsulas de liberación prolongada (XR). [167] [31] Adderall contiene cantidades iguales de cuatro sales de anfetamina: [167] [31]
La equivalencia total de la base de anfetamina en Adderall es del 63 %. [167] [31] Si bien la relación enantiomérica entre las sales de dextroanfetamina y las sales de levoanfetamina es de 3:1, el contenido de base de anfetamina es de 75,9 % de dextroanfetamina y 24,1 % de levoanfetamina. [nota 16]
se consume habitualmente por vía inhalatoria o por vía oral, ya sea en forma de mezcla racémica (levoanfetamina y dextroanfetamina) o dextroanfetamina sola (Childress et al. 2019). En general, todas las anfetaminas presentan una alta biodisponibilidad cuando se consumen por vía oral, y en el caso específico de la anfetamina, el 90% de la dosis consumida se absorbe en el tracto gastrointestinal, sin diferencias significativas en la velocidad y grado de absorción entre ambos enantiómeros (Carvalho et al. 2012; Childress et al. 2019). El inicio de la acción se produce aproximadamente entre 30 y 45 minutos después del consumo, dependiendo de la dosis ingerida y del grado de pureza o del consumo concomitante de determinados alimentos (Observatorio Europeo de las Drogas y las Toxicomanías 2021a; Steingard et al. 2019). Se describe que aquellas sustancias que promueven la acidificación del tracto gastrointestinal provocan una disminución en la absorción de anfetaminas, mientras que la alcalinización gastrointestinal puede estar relacionada con un aumento en la absorción del compuesto (Markowitz y Patrick 2017).
Inicio de acción: 1–1,5 h
Formulaciones de dextroanfetamina de medicamentos estimulantes
Dexedrine [Pico: 2-3 h] [Duración: 5-6 h] ...
Adderall [Pico: 2-3 h] [Duración: 5-7 h]
Dexedrine spansules [Pico: 7-8 h] [Duración: 12 h] ...
Adderall XR [Pico: 7-8 h] [Duración: 12 h]
Vyvanse [Pico: 3-4 h] [Duración: 12 h]
El inicio de la eficacia fue más temprano para d-MPH-ER a las 0,5 horas, seguido de d, l-MPH-LA a las 1 a 2 horas, MCD a las 1,5 horas, d, l-MPH-OR a las 1 a 2 horas, MAS-XR a las 1,5 a 2 horas, MTS a las 2 horas y LDX a las 2 horas aproximadamente. ... MAS-XR y LDX tienen una larga duración de acción a las 12 horas posteriores a la dosis.
La excreción aumenta en orinas más ácidas. La vida media es de 7 a 34 horas y depende, en parte, del pH de la orina (la vida media es más larga con orina alcalina). ... Las anfetaminas se distribuyen en la mayoría de los tejidos corporales y se producen altas concentraciones en el cerebro y el LCR. La anfetamina aparece en la orina aproximadamente 3 horas después de la administración oral. ... Tres días después de una dosis de (+ o -)-anfetamina, los sujetos humanos habían excretado el 91% del (14)C en la orina.
la oxidación directa de la anfetamina por la DA β-hidroxilasa puede producir norefedrina.
Las regiones de los ganglios basales como el globo pálido derecho, el putamen derecho y el núcleo caudado se ven afectadas estructuralmente en niños con TDAH. Estos cambios y alteraciones en las regiones límbicas como la corteza cerebral anterior y la amígdala son más pronunciados en poblaciones no tratadas y parecen disminuir con el tiempo desde la infancia hasta la edad adulta. El tratamiento parece tener efectos positivos en la estructura cerebral.
Varios otros estudios,
[97-101]
incluyendo una revisión metaanalítica
[98]
y un estudio retrospectivo,
[97]
sugirieron que la terapia estimulante en la niñez está asociada con un riesgo reducido de uso posterior de sustancias, tabaquismo y trastornos por consumo de alcohol. ... Estudios recientes han demostrado que los estimulantes, junto con los no estimulantes atomoxetina y guanfacina de liberación prolongada, son continuamente efectivos durante más de períodos de tratamiento de 2 años con pocos y tolerables efectos adversos. La eficacia de la terapia a largo plazo incluye no sólo los síntomas principales del TDAH, sino también una mejor calidad de vida y logros académicos. Los efectos adversos a corto plazo más preocupantes de los estimulantes, como la presión arterial y la frecuencia cardíaca elevadas, disminuyeron en los estudios de seguimiento a largo plazo. ... Los datos actuales no respaldan el impacto potencial de los estimulantes en el empeoramiento o desarrollo de tics o abuso de sustancias en la edad adulta. En el estudio de seguimiento más largo (de más de 10 años), el tratamiento de por vida con estimulantes para el TDAH fue eficaz y protector contra el desarrollo de trastornos psiquiátricos adversos.
investigaciones en curso han proporcionado respuestas a muchas de las preocupaciones de los padres y han confirmado la eficacia y seguridad del uso a largo plazo de la medicación.
La mayor proporción de resultados mejorados se informó con el tratamiento combinado (83% de los resultados). Entre los resultados significativamente mejorados, los mayores tamaños de efecto se encontraron para el tratamiento combinado. Las mayores mejoras se asociaron con los resultados académicos, de autoestima o de función social.
Las dosis terapéuticas (relativamente bajas) de psicoestimulantes, como el metilfenidato y la anfetamina, mejoran el rendimiento en tareas de memoria de trabajo tanto en sujetos normales como en aquellos con TDAH. ... los estimulantes actúan no sólo sobre la función de la memoria de trabajo, sino también sobre los niveles generales de excitación y, dentro del núcleo accumbens, mejoran la relevancia de las tareas. Por lo tanto, los estimulantes mejoran el rendimiento en tareas que requieren esfuerzo pero son tediosas ... a través de la estimulación indirecta de los receptores de dopamina y noradrenalina. ...
Más allá de estos efectos permisivos generales, la dopamina (que actúa a través de los receptores D1) y la noradrenalina (que actúa en varios receptores) pueden, en niveles óptimos, mejorar la memoria de trabajo y aspectos de la atención.
Solo un artículo
53
que examinaba los resultados más allá de los 36 meses cumplió con los criterios de revisión. ... Hay evidencia de alto nivel que sugiere que el tratamiento farmacológico puede tener un efecto beneficioso importante sobre los síntomas centrales del TDAH (hiperactividad, falta de atención e impulsividad) en aproximadamente el 80% de los casos en comparación con los controles de placebo, a corto plazo.
La narcolepsia tipo 1 se denominaba "narcolepsia con cataplejía" antes de 2014 (AASM, 2005), pero pasó a denominarse NT1 en la tercera y última clasificación internacional de los trastornos del sueño (AASM, 2014). ... Un nivel bajo de Hcrt-1 en el LCR es muy sensible y específico para el diagnóstico de NT1. ...
Todos los pacientes con niveles bajos de Hcrt-1 en LCR se consideran pacientes NT1, incluso si no informan cataplejía (en alrededor del 10-20% de los casos), y todos los pacientes con niveles normales de Hcrt-1 en LCR (o sin cataplejía cuando no se realiza la punción lumbar) como pacientes NT2 (Baumann et al., 2014). ...
En pacientes con NT1, la ausencia de Hcrt conduce a la inhibición de regiones que suprimen el sueño REM, permitiendo así la activación de vías descendentes que inhiben las neuronas motoras, lo que lleva a la cataplejía.
A nivel fisiopatológico, ahora está claro que la mayoría de los casos de narcolepsia con cataplejía, y una minoría de casos (5-30 %) sin cataplejía o con síntomas atípicos similares a la cataplejía, son causados por una falta de hipocretina (orexina) de probable origen autoinmune. En estos casos, una vez establecida la enfermedad, la mayoría de las 70.000 células productoras de hipocretina han sido destruidas y el trastorno es irreversible. ...
Las anfetaminas son excepcionalmente promotoras del estado de vigilia y, en dosis altas, también reducen la cataplejía en pacientes narcolépticos, un efecto que se explica mejor por su acción sobre las sinapsis adrenérgicas y serotoninérgicas. ...
El isómero D es más específico para la transmisión de DA y es un compuesto estimulante mejor. Algunos efectos sobre la cataplejía (especialmente para el isómero L), secundarios a los efectos adrenérgicos, ocurren en dosis más altas. ...
Numerosos estudios han demostrado que el aumento de la liberación de dopamina es la propiedad principal que explica la promoción del estado de vigilia, aunque los efectos de la noradrenalina también contribuyen.
se descubrió que el hipotálamo lateral también desempeña un papel central en la excitación. Las neuronas de esta región contienen cuerpos celulares que producen los péptidos orexina (también llamados hipocretina) (Capítulo 6). Estas neuronas se proyectan ampliamente por todo el cerebro y están involucradas en el sueño, la excitación, la alimentación, la recompensa, aspectos de la emoción y el aprendizaje. De hecho, se cree que la orexina promueve la alimentación principalmente al promover la excitación. Las mutaciones en los receptores de orexina son responsables de la narcolepsia en un modelo canino, la eliminación del gen de la orexina produce narcolepsia en ratones y los humanos con narcolepsia tienen niveles bajos o nulos de péptidos de orexina en el líquido cefalorraquídeo (Capítulo 13). Las neuronas del hipotálamo lateral tienen conexiones recíprocas con neuronas que producen neurotransmisores monoamínicos (Capítulo 6).
incluidas las cuatro vías monoaminérgicas principales analizadas en el Capítulo 6. La vía de la noradrenalina se origina en el LC y los núcleos relacionados del tronco encefálico; las neuronas serotoninérgicas se originan también en el RN dentro del tronco encefálico; las neuronas dopaminérgicas se originan en el área tegmental ventral (VTA); y la vía histaminérgica se origina en neuronas en el núcleo tuberomamilar (TMN) del hipotálamo posterior. Como se analiza en el Capítulo 6, estas neuronas se proyectan ampliamente por todo el cerebro desde grupos restringidos de cuerpos celulares. La noradrenalina, la serotonina, la dopamina y la histamina tienen funciones moduladoras complejas y, en general, promueven la vigilia. El PT en el tronco encefálico también es un componente importante del ARAS. La actividad de las neuronas colinérgicas del PT (células REM-on) promueve el sueño REM, como se señaló anteriormente. Durante la vigilia, las células REM activas son inhibidas por un subconjunto de neuronas de noradrenalina y serotonina ARAS llamadas células REM desactivadas.
dopamina, noradrenalina y 5HT. Provocan la liberación presináptica de transmisores preformados y también inhiben la recaptación de dopamina y noradrenalina. Estas acciones son más prominentes en el sistema activador reticular ascendente del tronco encefálico y la corteza cerebral.
estado de alerta y la excitación cortical y del prosencéfalo asociadas están mediadas por varias vías ascendentes con componentes neuronales distintos que se proyectan desde el tronco encefálico superior cerca de la unión de la protuberancia y el mesencéfalo. ...
Las poblaciones celulares clave de la vía ascendente de excitación incluyen neuronas colinérgicas, noradrenérgicas, serotoninérgicas, dopaminérgicas e histaminérgicas ubicadas en el núcleo tegmental pedunculopontino y laterodorsal (PPT/LDT), el locus coeruleus, el núcleo del rafe dorsal y medio y el núcleo tuberomamilar (TMN), respectivamente. ...
El mecanismo de acción de los fármacos de alerta simpaticomiméticos (p. ej., dextro- y metanfetamina, metilfenidato) es la estimulación directa o indirecta de los núcleos dopaminérgicos y noradrenérgicos, lo que a su vez aumenta la eficacia del área gris periacueductal ventral y el locus coeruleus, ambos componentes de la rama secundaria del sistema ascendente de excitación. ...
Los fármacos simpaticomiméticos se han utilizado durante mucho tiempo para tratar la narcolepsia .
TF identificó 1 ECA doble ciego, 1 ECA simple ciego y 1 serie de casos retrospectiva observacional a largo plazo autoinformada que evaluaban la eficacia de la dextroanfetamina en pacientes con narcolepsia tipo 1 y narcolepsia tipo 2. Estos estudios demostraron mejoras clínicamente significativas en la somnolencia diurna excesiva y la cataplejía.
La utilidad de las anfetaminas está limitada por un riesgo potencial de abuso y sus efectos adversos cardiovasculares (Tabla 1). Es por eso que, aunque son más baratas que otros medicamentos y eficientes, siguen siendo una terapia de tercera línea en la narcolepsia. Tres estudios de clase II mostraron una mejoría del EDS en esa enfermedad. ...
A pesar del potencial de abuso o tolerancia de drogas usando estimulantes, los pacientes con narcolepsia rara vez muestran adicción a su medicación. ...
Algunos estimulantes, como el mazindol, las anfetaminas y el pitolisant, también pueden tener algunos efectos anticatapléjicos.
Ensayos clínicos y guías de práctica recientes han confirmado que los estimulantes como el modafinilo, el armodafinilo o el oxibato de sodio (como primera línea); el metilfenidato y el pitolisant (como segunda línea [pitolisant actualmente solo está disponible en Europa]); y las anfetaminas (como tercera línea) son medicamentos apropiados para la somnolencia diurna excesiva.
Los primeros agentes utilizados para tratar el SED (es decir, anfetaminas, metilfenidato) ahora se consideran opciones de segunda o tercera línea porque se han desarrollado medicamentos más nuevos con mejor tolerabilidad y menor potencial de abuso (p. ej., modafinilo/armodafinilo, solriamfetol, pitolisant)
Las acciones procognitivas de los psicoestimulantes solo se asocian con dosis bajas. Sorprendentemente, a pesar de casi 80 años de uso clínico, la neurobiología de las acciones procognitivas de los psicoestimulantes solo se ha investigado sistemáticamente recientemente. Los hallazgos de esta investigación demuestran inequívocamente que los efectos potenciadores cognitivos de los psicoestimulantes implican la elevación preferencial de las catecolaminas en la corteza prefrontal y la posterior activación de los receptores de noradrenalina α2 y dopamina D1. ... Esta modulación diferencial de los procesos dependientes de la corteza prefrontal en función de la dosis parece estar asociada con la participación diferencial de los receptores noradrenérgicos α2 frente a los α1. En conjunto, esta evidencia indica que en dosis bajas y clínicamente relevantes, los psicoestimulantes carecen de las acciones conductuales y neuroquímicas que definen a esta clase de fármacos y, en cambio, actúan en gran medida como potenciadores cognitivos (mejorando la función dependiente de la corteza prefrontal). ... En particular, tanto en animales como en humanos, las dosis más bajas mejoran al máximo el rendimiento en pruebas de memoria de trabajo e inhibición de la respuesta, mientras que la supresión máxima de la conducta manifiesta y la facilitación de los procesos de atención se produce en dosis más altas.
Específicamente, en un conjunto de experimentos limitados a diseños de alta calidad, encontramos una mejora significativa de varias habilidades cognitivas. ... Los resultados de este metaanálisis ... confirman la realidad de los efectos de mejora cognitiva para adultos sanos normales en general, al tiempo que indican que estos efectos son de tamaño modesto.
Se ha demostrado que la anfetamina mejora la consolidación de la información (0,02 ≥ P ≤ 0,05), lo que conduce a una mejor recuperación.
La dopamina actúa en el núcleo accumbens para otorgar significado motivacional a los estímulos asociados con la recompensa.
El uso indebido de estimulantes recetados se ha convertido en un problema grave en los campus universitarios de los EE. UU. y también se ha documentado recientemente en otros países. ... De hecho, un gran número de estudiantes afirman haber participado en el uso no médico de estimulantes recetados, lo que se refleja en las tasas de prevalencia de por vida del uso indebido de estimulantes recetados que van del 5% a casi el 34% de los estudiantes.
En general, los datos sugieren que el uso indebido y el desvío de medicamentos para el TDAH son problemas de atención médica comunes para los medicamentos estimulantes, con una prevalencia que se cree que es aproximadamente del 5% al 10% de los estudiantes de secundaria y del 5% al 35% de los estudiantes universitarios, según el estudio.
Las anfetaminas y la cafeína son estimulantes que aumentan el estado de alerta, mejoran la concentración, disminuyen el tiempo de reacción y retrasan la fatiga, lo que permite una mayor intensidad y duración del entrenamiento ...
Efectos fisiológicos y de rendimiento
• Las anfetaminas aumentan la liberación de dopamina/norepinefrina e inhiben su recaptación, lo que conduce a la estimulación del sistema nervioso central (SNC)
• Las anfetaminas parecen mejorar el rendimiento atlético en condiciones anaeróbicas 39 40
• Tiempo de reacción mejorado
• Mayor fuerza muscular y fatiga muscular retrasada
• Mayor aceleración
• Mayor estado de alerta y atención a la tarea
En 1980, Chandler y Blair
47
demostraron aumentos significativos en la fuerza de extensión de la rodilla, la aceleración, la capacidad anaeróbica, el tiempo hasta el agotamiento durante el ejercicio, las frecuencias cardíacas previas al ejercicio y máximas, y el tiempo hasta el agotamiento durante la prueba de consumo máximo de oxígeno (VO2máx) después de la administración de 15 mg de dextroanfetamina frente a placebo. La mayor parte de la información para responder a esta pregunta se ha obtenido en la última década a través de estudios sobre la fatiga en lugar de un intento de investigar sistemáticamente el efecto de los fármacos para el TDAH en el ejercicio.
En temperaturas ambientales altas, las manipulaciones dopaminérgicas mejoran claramente el rendimiento. La distribución de la potencia de salida revela que después de la inhibición de la recaptación de dopamina, los sujetos pueden mantener una mayor potencia de salida en comparación con el placebo. ... Los fármacos dopaminérgicos parecen anular un interruptor de seguridad y permitir a los atletas utilizar una capacidad de reserva que está "fuera de los límites" en una situación normal (placebo).
Las manipulaciones de la señalización dopaminérgica influyen profundamente en la sincronización del intervalo, lo que lleva a la hipótesis de que la dopamina influye en la actividad del marcapasos interno o "reloj". Por ejemplo, la anfetamina, que aumenta las concentraciones de dopamina en la hendidura sináptica, adelanta el inicio de la respuesta durante la sincronización del intervalo, mientras que los antagonistas de los receptores de dopamina de tipo D2 suelen ralentizar la sincronización;... El agotamiento de dopamina en voluntarios sanos altera la sincronización, mientras que la anfetamina libera dopamina sináptica y acelera la sincronización.
Además de tener en cuenta el rendimiento reducido de los participantes con fatiga mental, este modelo racionaliza la RPE reducida y, por lo tanto, el rendimiento mejorado en la prueba contrarreloj de ciclismo de los atletas que usan un enjuague bucal de glucosa (Chambers et al., 2009) y la mayor producción de potencia durante una prueba contrarreloj de ciclismo con RPE igualado después de la ingestión de anfetaminas (Swart, 2009). ... Se sabe que los fármacos estimulantes de la dopamina mejoran aspectos del rendimiento deportivo (Roelands et al., 2008)
Esto indica que los sujetos no sintieron que estaban produciendo más potencia y, en consecuencia, más calor. Los autores concluyeron que el "interruptor de seguridad" o los mecanismos existentes en el cuerpo para prevenir efectos nocivos son anulados por la administración del fármaco (Roelands et al., 2008b). En conjunto, estos datos indican fuertes efectos ergogénicos de una mayor concentración de DA en el cerebro, sin ningún cambio en la percepción del esfuerzo.
Las recompensas en el condicionamiento operante son reforzadores positivos. ... La conducta operante ofrece una buena definición de recompensas. Cualquier cosa que haga que un individuo vuelva a por más es un reforzador positivo y, por lo tanto, una recompensa. Aunque ofrece una buena definición, el refuerzo positivo es solo una de varias funciones de recompensa. ... Las recompensas son atractivas. Son motivadoras y nos hacen hacer un esfuerzo. ... Las recompensas inducen una conducta de aproximación, también llamada conducta apetitiva o preparatoria, conducta sexual y conducta consumatoria. ... Por lo tanto, cualquier estímulo, objeto, evento, actividad o situación que tenga el potencial de hacer que nos acerquemos a ella y la consumamos es, por definición, una recompensa. ... Los estímulos, objetos, eventos, situaciones y actividades gratificantes constan de varios componentes principales. En primer lugar, las recompensas tienen componentes sensoriales básicos (visual, auditivo, somatosensorial, gustativo y olfativo) ... En segundo lugar, las recompensas son salientes y, por lo tanto, provocan atención, que se manifiesta como respuestas de orientación. La relevancia de las recompensas se deriva de tres factores principales, a saber, su intensidad física e impacto (relevancia física), su novedad y sorpresa (relevancia novedad/sorpresa) y su impacto motivacional general compartido con los castigos (relevancia motivacional). Una forma separada no incluida en este esquema, la relevancia de incentivo, aborda principalmente la función de la dopamina en la adicción y se refiere solo a la conducta de aproximación (en oposición al aprendizaje) ... En tercer lugar, las recompensas tienen un componente de valor que determina los efectos motivadores positivos de las recompensas y no está contenido en, ni explicado por, los componentes sensoriales y atencionales. Este componente refleja preferencias conductuales y, por lo tanto, es subjetivo y solo parcialmente determinado por parámetros físicos. Solo este componente constituye lo que entendemos como recompensa. Media el refuerzo conductual específico, la generación de aproximación y los efectos emocionales de las recompensas que son cruciales para la supervivencia y reproducción del organismo, mientras que todos los demás componentes solo apoyan estas funciones. ... Las recompensas también pueden ser intrínsecas a la conducta. Contrastan con las recompensas extrínsecas que proporcionan motivación para la conducta y constituyen la esencia de la conducta operante en pruebas de laboratorio. Las recompensas intrínsecas son actividades que son placenteras por sí mismas y se realizan por sí mismas, sin ser el medio para obtener recompensas extrínsecas. ... Las recompensas intrínsecas son recompensas genuinas por derecho propio, ya que inducen aprendizaje, aproximación y placer, como perfeccionar, tocar y disfrutar del piano. Aunque pueden servir para condicionar recompensas de orden superior, no son recompensas condicionadas de orden superior, ya que la obtención de sus propiedades de recompensa no requiere emparejarse con una recompensa incondicionada. ... Estas emociones también se denominan gusto (por placer) y deseo (por deseo) en la investigación de la adicción y respaldan firmemente las funciones de generación de aprendizaje y aproximación de la recompensa.
Las declaraciones en los prospectos no tienen como objetivo limitar la práctica médica. Más bien, tienen como objetivo limitar las afirmaciones de las compañías farmacéuticas. ... la FDA afirma explícitamente, y los tribunales han confirmado, que las decisiones clínicas deben ser tomadas por médicos y pacientes en situaciones individuales.
Tabla 2. Descongestionantes que causan rinitis medicamentosa
– Descongestionantes nasales:
– Simpaticomiméticos:
• Anfetamina
así como alucinaciones auditivas y visuales en presencia de agitación extrema. Más común (alrededor del 18%) es que los usuarios frecuentes de anfetaminas reporten síntomas psicóticos que son subclínicos y que no requieren una intervención de alta intensidad...
Alrededor del 5 al 15% de los usuarios que desarrollan una psicosis anfetamínica no se recuperan completamente (Hofmann 1983)...
Los hallazgos de un ensayo indican que el uso de medicamentos antipsicóticos resuelve eficazmente los síntomas de la psicosis anfetamínica aguda.
Los síntomas psicóticos de las personas con psicosis anfetamínica pueden deberse exclusivamente al uso intensivo de la droga o el uso intensivo de la droga puede exacerbar una vulnerabilidad subyacente a la esquizofrenia.
En estos estudios, se administró anfetamina en dosis consecutivamente más altas hasta que se precipitó la psicosis, a menudo después de 100–300 mg de anfetamina ... En segundo lugar, la psicosis se ha visto como un evento adverso, aunque poco común, en niños con TDAH que han sido tratados con anfetamina.
estudio demuestra que los humanos, al igual que los no humanos, prefieren un lugar asociado con la administración de anfetaminas. Estos hallazgos respaldan la idea de que las respuestas subjetivas a una droga contribuyen a su capacidad para establecer el condicionamiento del lugar.
A pesar de la importancia de numerosos factores psicosociales, en esencia, la adicción a las drogas implica un proceso biológico: la capacidad de la exposición repetida a una droga de abuso para inducir cambios en un cerebro vulnerable que impulsan la búsqueda y el consumo compulsivo de drogas, y la pérdida de control sobre el consumo de drogas, que definen un estado de adicción. ... Una gran cantidad de literatura ha demostrado que dicha inducción de ΔFosB en neuronas de tipo D1 [núcleo accumbens] aumenta la sensibilidad de un animal a la droga, así como las recompensas naturales y promueve la autoadministración de la droga, presumiblemente a través de un proceso de refuerzo positivo... Otro objetivo de ΔFosB es cFos: a medida que ΔFosB se acumula con la exposición repetida a la droga, reprime c-Fos y contribuye al interruptor molecular por el cual ΔFosB se induce selectivamente en el estado de tratamiento crónico con la droga.
41
. ... Además, hay cada vez más evidencia de que, a pesar de una variedad de riesgos genéticos para la adicción en la población, la exposición a dosis suficientemente altas de una droga durante largos períodos de tiempo puede transformar a alguien que tiene una carga genética relativamente menor en un adicto.
Trastorno por consumo de sustancias: término diagnóstico de la quinta edición del Manual diagnóstico y estadístico de los trastornos mentales (DSM-5) que se refiere al consumo recurrente de alcohol u otras drogas que causa un deterioro clínica y funcionalmente significativo, como problemas de salud, discapacidad e incapacidad para cumplir con responsabilidades importantes en el trabajo, la escuela o el hogar. Según el nivel de gravedad, este trastorno se clasifica como leve, moderado o grave.
Adicción: término utilizado para indicar la etapa más grave y crónica del trastorno por consumo de sustancias, en la que hay una pérdida sustancial del autocontrol, como lo indica el consumo compulsivo de drogas a pesar del deseo de dejar de tomarlas. En el DSM-5, el término adicción es sinónimo de la clasificación de trastorno grave por consumo de sustancias.
[Los psicoestimulantes] aumentan los niveles de AMPc en el cuerpo estriado, lo que activa la proteína quinasa A (PKA) y conduce a la fosforilación de sus objetivos. Esto incluye la proteína de unión al elemento de respuesta al AMPc (CREB), cuya fosforilación induce su asociación con la histona acetiltransferasa, la proteína de unión a CREB (CBP) para acetilar histonas y facilitar la activación genética. Se sabe que esto ocurre en muchos genes, incluidos fosB y
c-fos,
en respuesta a la exposición a psicoestimulantes. ΔFosB también se regula positivamente con tratamientos psicoestimulantes crónicos, y se sabe que activa ciertos genes (p. ej., cdk5) y reprime otros (p. ej.,
c-fos
) donde recluta HDAC1 como correpresor. ... La exposición crónica a psicoestimulantes aumenta la [señalización] glutamatérgica desde la corteza prefrontal hasta el NAc. La señalización glutamatérgica eleva los niveles de Ca2+ en los elementos postsinápticos del NAc donde activa la señalización de CaMK (proteínas quinasas de calcio/calmodulina), que, además de fosforilar CREB, también fosforila HDAC5.
La entrada coincidente y convergente a menudo induce plasticidad en una neurona postsináptica. El NAc integra información procesada sobre el entorno de la amígdala basolateral, el hipocampo y la corteza prefrontal (CPF), así como proyecciones de las neuronas dopaminérgicas del mesencéfalo. Estudios previos han demostrado cómo la dopamina modula este proceso integrador. Por ejemplo, la estimulación de alta frecuencia potencia las entradas hipocampales al NAc mientras que simultáneamente deprime las sinapsis de la CPF (Goto y Grace, 2005). También se demostró que lo inverso es cierto; La estimulación en la corteza prefrontal potencia las sinapsis entre la corteza prefrontal y el núcleo del lóbulo frontal, pero deprime las sinapsis entre el hipocampo y el núcleo del lóbulo frontal. A la luz de la nueva evidencia funcional de la cotransmisión dopamina/glutamato en el mesencéfalo (referencias anteriores), nuevos experimentos sobre la función del núcleo del lóbulo frontal tendrán que probar si las entradas glutamatérgicas del mesencéfalo sesgan o filtran las entradas límbicas o corticales para guiar la conducta dirigida a un objetivo.
La mayoría de las drogas adictivas aumentan las concentraciones extracelulares de dopamina (DA) en el núcleo accumbens (NAc) y la corteza prefrontal medial (mPFC), áreas de proyección de neuronas DA mesocorticolímbicas y componentes clave del "circuito de recompensa cerebral". La anfetamina logra esta elevación en los niveles extracelulares de DA al promover el eflujo desde las terminales sinápticas. ... La exposición crónica a la anfetamina induce un factor de transcripción único, delta FosB, que desempeña un papel esencial en los cambios adaptativos a largo plazo en el cerebro.
ΔFosB actúa como una de las proteínas de control maestras que gobiernan esta plasticidad estructural. ... ΔFosB también reprime la expresión de G9a, lo que conduce a una reducción de la metilación represiva de histonas en el gen cdk5. El resultado neto es la activación del gen y el aumento de la expresión de CDK5. ... Por el contrario, ΔFosB se une al gen
c-fos
y recluta varios correpresores, incluidos HDAC1 (histona desacetilasa 1) y SIRT 1 (sirtuina 1). ... El resultado neto es la represión del gen
c-fos
.
Las isoformas ΔFosB de 35-37 kD se acumulan con la exposición crónica a drogas debido a sus vidas medias extraordinariamente largas. ... Como resultado de su estabilidad, la proteína ΔFosB persiste en las neuronas durante al menos varias semanas después del cese de la exposición a drogas. ... La sobreexpresión de ΔFosB en el núcleo accumbens induce NFκB... Por el contrario, la capacidad de ΔFosB para reprimir el gen
c-Fos
ocurre en conjunto con el reclutamiento de una histona desacetilasa y presumiblemente varias otras proteínas represivas como una histona metiltransferasa represiva.
Evidencias recientes han demostrado que ΔFosB también reprime el gen
c-fos
que ayuda a crear el interruptor molecular, desde la inducción de varias proteínas de la familia Fos de vida corta después de la exposición aguda a drogas hasta la acumulación predominante de ΔFosB después de la exposición crónica a drogas.
agentes también tienen importantes usos terapéuticos; la cocaína, por ejemplo, se utiliza como anestésico local (Capítulo 2), y las anfetaminas y el metilfenidato se utilizan en dosis bajas para tratar el trastorno por déficit de atención e hiperactividad y en dosis más altas para tratar la narcolepsia (Capítulo 12). A pesar de sus usos clínicos, estas drogas son fuertemente reforzantes, y su uso a largo plazo en dosis altas está vinculado con una posible adicción, especialmente cuando se administran rápidamente o cuando se dan formas de alta potencia.
Cuando se utilizan formulaciones orales de psicoestimulantes en las dosis y frecuencias recomendadas, es poco probable que produzcan efectos consistentes con el potencial de abuso en pacientes con TDAH.
{{cite journal}}: CS1 maint: DOI inactivo a partir de septiembre de 2024 ( enlace )ΔFosB es un factor de transcripción esencial implicado en las vías moleculares y conductuales de la adicción tras la exposición repetida a drogas.
ΔFosB se ha relacionado directamente con varias conductas relacionadas con la adicción ... Es importante destacar que la sobreexpresión genética o viral de ΔJunD, un mutante negativo dominante de JunD que antagoniza la actividad transcripcional mediada por ΔFosB y otras AP-1, en el NAc o el OFC bloquea estos efectos clave de la exposición a drogas
14,22–24
. Esto indica que ΔFosB es necesario y suficiente para muchos de los cambios provocados en el cerebro por la exposición crónica a drogas. ΔFosB también se induce en MSN NAc de tipo D1 por el consumo crónico de varias recompensas naturales, entre ellas la sacarosa, los alimentos ricos en grasas, el sexo y correr en rueda, donde promueve ese consumo
14,26–30
. Esto implica a ΔFosB en la regulación de las recompensas naturales en condiciones normales y quizás durante estados patológicos similares a la adicción. ... ΔFosB sirve como una de las proteínas de control maestras que gobiernan esta plasticidad estructural.
De manera similar al enriquecimiento ambiental, los estudios han descubierto que el ejercicio reduce la autoadministración y la recaída en las drogas de abuso (Cosgrove et al., 2002; Zlebnik et al., 2010). También hay cierta evidencia de que estos hallazgos preclínicos se trasladan a las poblaciones humanas, ya que el ejercicio reduce los síntomas de abstinencia y la recaída en fumadores abstinentes (Daniel et al., 2006; Prochaska et al., 2008), y un programa de recuperación de drogas ha tenido éxito en participantes que entrenan y compiten en una maratón como parte del programa (Butler, 2005). ... En humanos, el papel de la señalización de dopamina en los procesos de sensibilización a incentivos ha sido resaltado recientemente por la observación de un síndrome de desregulación de dopamina en algunos pacientes que toman fármacos dopaminérgicos. Este síndrome se caracteriza por un aumento inducido por medicamentos en (o participación compulsiva) en recompensas no farmacológicas como el juego, las compras o el sexo (Evans et al., 2006; Aiken, 2007; Lader, 2008).
Estos hallazgos sugieren que el ejercicio puede prevenir de forma "magnética" el desarrollo de un fenotipo adicto, posiblemente al bloquear/revertir los cambios conductuales y neuroadaptativos que se desarrollan durante y después del acceso prolongado a la droga. ... El ejercicio se ha propuesto como un tratamiento para la adicción a las drogas que puede reducir el ansia por la droga y el riesgo de recaída. Aunque pocos estudios clínicos han investigado la eficacia del ejercicio para prevenir las recaídas, los pocos estudios que se han realizado generalmente informan una reducción en el ansia de drogas y mejores resultados del tratamiento... En conjunto, estos datos sugieren que los beneficios potenciales del ejercicio durante la recaída, particularmente para la recaída a los psicoestimulantes, pueden estar mediados por la remodelación de la cromatina y posiblemente conducir a mejores resultados del tratamiento.
En conjunto, estos hallazgos demuestran que el ejercicio puede servir como sustituto o competencia para el abuso de drogas al cambiar la inmunorreactividad de ΔFosB o cFos en el sistema de recompensa para proteger contra el uso posterior o previo de drogas. ... El postulado de que el ejercicio sirve como una intervención ideal para la adicción a las drogas ha sido ampliamente reconocido y utilizado en la rehabilitación humana y animal.
La investigación limitada realizada sugiere que el ejercicio puede ser un tratamiento complementario eficaz para los SUD. En contraste con los escasos ensayos de intervención hasta la fecha, se ha publicado una abundancia relativa de literatura sobre las razones teóricas y prácticas que respaldan la investigación de este tema. ... numerosas razones teóricas y prácticas respaldan los tratamientos basados en ejercicios para los SUD, incluidos los efectos psicológicos, conductuales, neurobiológicos, el perfil de seguridad casi universal y los efectos generales positivos para la salud.
Se ha descubierto que el gen deltaFosB en el NAc es fundamental para reforzar los efectos de la recompensa sexual. Pitchers y colegas (2010) informaron que se ha demostrado que la experiencia sexual causa acumulación de DeltaFosB en varias regiones cerebrales límbicas, incluyendo el NAc, la corteza prefrontal medial, el VTA, el caudado y el putamen, pero no el núcleo preóptico medial. ... estos hallazgos respaldan un papel crítico para la expresión de DeltaFosB en el NAc en los efectos de refuerzo del comportamiento sexual y la facilitación inducida por la experiencia sexual del desempeño sexual. ... tanto la adicción a las drogas como la adicción sexual representan formas patológicas de neuroplasticidad junto con el surgimiento de comportamientos aberrantes que involucran una cascada de cambios neuroquímicos principalmente en los circuitos de recompensa del cerebro.
El tratamiento farmacológico de la adicción a los psicoestimulantes suele ser insatisfactorio. Como se ha comentado anteriormente, el abandono del consumo de cocaína y de otros psicoestimulantes en personas dependientes no produce un síndrome de abstinencia física, pero puede producir disforia, anhedonia y un deseo intenso de reiniciar el consumo de drogas.
A pesar de los esfuerzos concertados para identificar una farmacoterapia para el manejo de los trastornos por consumo de estimulantes, no se han aprobado medicamentos ampliamente efectivos.
se considera junto con la literatura de rápido crecimiento en el campo, surge un caso convincente en apoyo del desarrollo de agonistas selectivos de TAAR1 como medicamentos para prevenir la recaída en el abuso de psicoestimulantes.
Los datos existentes proporcionaron evidencia preclínica sólida que respalda el desarrollo de agonistas de TAAR1 como tratamiento potencial para el abuso y la adicción a los psicoestimulantes.
Ejercicio físico
Hay evidencia creciente de que el ejercicio físico es un tratamiento útil para prevenir y reducir la adicción a las drogas ... En algunas personas, el ejercicio tiene sus propios efectos gratificantes, y puede ocurrir una interacción económica conductual, de modo que las recompensas físicas y sociales del ejercicio pueden sustituir los efectos gratificantes del abuso de drogas. ... El valor de esta forma de tratamiento para la adicción a las drogas en animales de laboratorio y humanos es que el ejercicio, si puede sustituir los efectos gratificantes de las drogas, podría automantenerse durante un período prolongado de tiempo. Los trabajos realizados hasta la fecha en [animales de laboratorio y seres humanos] sobre el ejercicio como tratamiento para la adicción a las drogas apoyan esta hipótesis. ... Las investigaciones realizadas en animales y seres humanos sobre el ejercicio físico como tratamiento para la adicción a los estimulantes indican que este es uno de los tratamientos más prometedores en el horizonte.
La prevalencia de este síndrome de abstinencia es extremadamente común (Cantwell 1998; Gossop 1982) y el 87,6% de 647 personas con dependencia de anfetaminas informan seis o más signos de abstinencia de anfetaminas enumerados en el DSM cuando la droga no está disponible (Schuckit 1999) ... La gravedad de los síntomas de abstinencia es mayor en las personas dependientes de anfetaminas que son mayores y que tienen trastornos de consumo de anfetaminas más extensos (McGregor 2005). Los síntomas de abstinencia generalmente se presentan dentro de las 24 horas posteriores al último consumo de anfetamina, y el síndrome de abstinencia implica dos fases generales que pueden durar 3 semanas o más. La primera fase de este síndrome es el "colapso" inicial que se resuelve en aproximadamente una semana (Gossop 1982; McGregor 2005) ...
La anfetamina, la dextroanfetamina y el metilfenidato actúan como sustratos para el transportador celular de monoaminas, especialmente el transportador de dopamina (DAT) y en menor medida el transportador de noradrenalina (NET) y serotonina. El mecanismo de toxicidad está relacionado principalmente con el exceso de dopamina, noradrenalina y serotonina extracelulares.
Trastornos por consumo de anfetaminas ... 3788 (3425–4145)
La hipertermia por sí sola no produce neurotoxicidad similar a la de las anfetaminas, pero las exposiciones a AMPH y METH que no producen hipertermia (≥40 °C) son mínimamente neurotóxicas. Es probable que la hipertermia mejore la neurotoxicidad de AMPH y METH directamente a través de la alteración de la función proteica, los canales iónicos y la mayor producción de ROS. ... La hipertermia y la hipertensión producidas por dosis altas de anfetaminas son una causa primaria de rupturas transitorias en la barrera hematoencefálica (BHE) resultando en neurodegeneración regional concomitante y neuroinflamación en animales de laboratorio. ... En modelos animales que evalúan la neurotoxicidad de AMPH y METH, está bastante claro que la hipertermia es uno de los componentes esenciales necesarios para la producción de signos histológicos de daño terminal de dopamina y neurodegeneración en la corteza, cuerpo estriado, tálamo e hipocampo.
Parece poco probable que se produzcan daños tóxicos directos a los vasos sanguíneos debido a la dilución que se produce antes de que la droga llegue a la circulación cerebral.
A diferencia de la cocaína y la anfetamina, la metanfetamina es directamente tóxica para las neuronas dopaminérgicas del mesencéfalo.
El zinc se une a ... sitios extracelulares del DAT [103], actuando como inhibidor del DAT. En este contexto, son de interés los estudios controlados doble ciego en niños, que mostraron efectos positivos del zinc [suplementación] sobre los síntomas del TDAH [105,106]. Cabe señalar que en este momento [la suplementación] con zinc no está integrada en ningún algoritmo de tratamiento del TDAH.
No confirmaron la relación directa predicha entre la captación y la liberación, sino que algunos compuestos, incluido el AMPH, eran mejores liberadores que sustratos para la captación. Además, el zinc estimula el eflujo de [3H]DA intracelular a pesar de su inhibición concomitante de la captación (Scholze et al., 2002).
pesar de los desafíos para determinar el pH de la vesícula sináptica, el gradiente de protones a través de la membrana de la vesícula es de importancia fundamental para su función. La exposición de vesículas de catecolaminas aisladas a protonóforos colapsa el gradiente de pH y redistribuye rápidamente el transmisor desde el interior hacia el exterior de la vesícula. ... La anfetamina y sus derivados como la metanfetamina son compuestos de base débil que son la única clase de drogas ampliamente utilizada que se sabe que provoca la liberación del transmisor mediante un mecanismo no exocítico. Como sustratos tanto para DAT como para VMAT, las anfetaminas pueden llegar al citosol y luego secuestrarse en vesículas, donde actúan para colapsar el gradiente de pH vesicular.
Recientemente han surgido tres nuevos aspectos importantes de la acción de los TA: (a) inhibición de la activación debido al aumento de la liberación de dopamina; (b) reducción de las respuestas inhibidoras mediadas por los receptores D2 y GABAB (efectos excitatorios debido a la desinhibición); y (c) una activación directa mediada por el receptor TA1 de los canales GIRK que producen hiperpolarización de la membrana celular.
• activa tónicamente los canales de K(+) rectificadores internos, lo que reduce la frecuencia de activación basal de las neuronas dopaminérgicas (DA) del área tegmental ventral (VTA)
La AMPH también aumenta el calcio intracelular (Gnegy et al., 2004) que está asociado con la activación de calmodulina/CamKII (Wei et al., 2007) y la modulación y el tráfico del DAT (Fog et al., 2006; Sakrikar et al., 2012). ... Por ejemplo, el AMPH aumenta el glutamato extracelular en varias regiones cerebrales, incluido el cuerpo estriado, el ATV y el NAc (Del Arco et al., 1999; Kim et al., 1981; Mora y Porras, 1993; Xue et al., 1996), pero no se ha establecido si este cambio puede explicarse por una mayor liberación sináptica o por una menor eliminación del glutamato. ... La captación de EAAT2 sensible a DHK no se vio alterada por el AMPH (Figura 1A). El transporte de glutamato restante en estos cultivos de mesencéfalo probablemente esté mediado por EAAT3 y este componente se redujo significativamente por el AMPH.
El AMPH y la metanfetamina también estimulan el eflujo de DA, que se cree que es un elemento crucial en sus propiedades adictivas [80], aunque los mecanismos no parecen ser idénticos para cada droga [81]. Estos procesos dependen de PKCβ y CaMK [72, 82], y los ratones knock-out de PKCβ muestran un eflujo inducido por AMPH disminuido que se correlaciona con una locomoción inducida por AMPH reducida [72].
La fenilisopropilamina no sustituida más simple, 1-fenil-2-aminopropano, o anfetamina, sirve como una plantilla estructural común para alucinógenos y psicoestimulantes. La anfetamina produce acciones estimulantes centrales, anoréxicas y simpaticomiméticas, y es el miembro prototipo de esta clase (39). ... El metabolismo de fase 1 de los análogos de anfetamina es catalizado por dos sistemas: citocromo P450 y flavina monooxigenasa. ... La anfetamina también puede sufrir hidroxilación aromática a p -hidroxianfetamina. ... La oxidación posterior en la posición bencílica por DA β-hidroxilasa produce p -hidroxinorefedrina. Alternativamente, la oxidación directa de la anfetamina por DA β-hidroxilasa puede producir norefedrina.
La dopamina-β-hidroxilasa catalizó la eliminación del átomo de hidrógeno pro-
R
y la producción de 1-norefedrina, (2
S
, 1
R
)-2-amino-1-hidroxil-1-fenilpropano, a partir de
d
-anfetamina.
Se administró hidroxianfetamina por vía oral a cinco sujetos humanos ... Dado que la conversión de hidroxianfetamina en hidroxinorefedrina ocurre in vitro por la acción de la dopamina-β-oxidasa, se sugiere un método simple para medir la actividad de esta enzima y el efecto de sus inhibidores en el hombre. ... La falta de efecto de la administración de neomicina a un paciente indica que la hidroxilación ocurre en los tejidos corporales. ... una parte importante de la β-hidroxilación de la hidroxianfetamina se produce en el tejido no suprarrenal. Lamentablemente, en la actualidad no se puede estar completamente seguro de que la hidroxilación de la hidroxianfetamina in vivo se lleve a cabo por la misma enzima que convierte la dopamina en noradrenalina.
Figura 1. Conjugación de glicina del ácido benzoico. La vía de conjugación de glicina consta de dos pasos. Primero, el benzoato se liga a CoASH para formar el tioéster de benzoil-CoA de alta energía. Esta reacción es catalizada por las ligasas de cadena media de ácido:CoA HXM-A y HXM-B y requiere energía en forma de ATP. ... El benzoil-CoA se conjuga luego con glicina por GLYAT para formar ácido hipúrico, liberando CoASH. Además de los factores enumerados en los recuadros, los niveles de ATP, CoASH y glicina pueden influir en la velocidad general de la vía de conjugación de glicina.
La importancia biológica de los diferentes niveles de actividad sérica de DβH se estudió de dos maneras. En primer lugar, se comparó la capacidad in vivo para β-hidroxilar el sustrato sintético hidroxianfetamina en dos sujetos con baja actividad sérica de DβH y dos sujetos con actividad media. ... En un estudio, se administró hidroxianfetamina (Paredrine), un sustrato sintético para DβH, a sujetos con niveles bajos o medios de actividad sérica de DβH. El porcentaje del fármaco hidroxilado a hidroxinorefedrina fue comparable en todos los sujetos (6,5-9,62) (Tabla 3).
En especies en las que la hidroxilación aromática de la anfetamina es la principal vía metabólica,
la p
-hidroxianfetamina (POH) y
la p
-hidroxinorefedrina (PHN) pueden contribuir al perfil farmacológico de la droga original. ... La ubicación de las reacciones de
p
-hidroxilación y β-hidroxilación es importante en especies en las que la hidroxilación aromática de la anfetamina es la vía predominante del metabolismo. Tras la administración sistémica de anfetamina a ratas, se ha encontrado POH en la orina y en el plasma.
La falta observada de una acumulación significativa de PHN en el cerebro después de la administración intraventricular de (+)-anfetamina y la formación de cantidades apreciables de PHN a partir de (+)-POH en el tejido cerebral in vivo apoya la opinión de que la hidroxilación aromática de la anfetamina después de su administración sistémica ocurre predominantemente en la periferia, y que luego la POH es transportada a través de la barrera hematoencefálica, captada por las neuronas noradrenérgicas en el cerebro, donde la (+)-POH es convertida en las vesículas de almacenamiento por la dopamina β-hidroxilasa a PHN.
El metabolismo de
p
-OHA a
p
-OHNor está bien documentado y la dopamina-β hidroxilasa presente en las neuronas noradrenérgicas podría convertir fácilmente
p
-OHA a
p
-OHNor después de la administración intraventricular.
08/02/1976 ... Aprobación
Bradley experimentó con sulfato de benzedrina, un fármaco comercializado a los médicos por la empresa Smith, Kline & French (SKF) entre 1935 y 1937...
Fecha de acción 5/11/1982, Número de suplemento 007, Tipo de aprobación Química