Bicapa lipídica
La bicapa lipídica es la barrera que mantiene a iones, proteínas y otras moléculas donde se necesitan evitando su dispersión.
Las bicapas biológicas están compuestas por fosfolípidos anfifílicos, tienen una cabeza fosfato hidrofílica y una cola hidrofóbica que consiste en dos cadenas de ácidos grasos.
Los fosfolípidos con ciertos grupos en su cabeza pueden alterar la superficie química de una bicapa y pueden servir como señales "anclas" para otras moléculas en las membranas celulares.
Este complejo proceso incluye las interacciones no covalentes, tales como Van der Waals, enlaces electrostáticos y puentes de hidrógeno.
[6] En algunos casos, la región hidratada puede extenderse mucho más, por ejemplo, en los lípidos con una proteína grande o una cadena larga de azúcar injertada en la cabeza.
[12][13] En algunos casos, la asimetría está basada en dónde se crean los lípidos en la célula y refleja su orientación inicial.
Esta asimetría puede perderse con el tiempo así como los lípidos en las bicapas soportadas pueden ser propensos al proceso de flip-flop.
[21] A una temperatura dada una bicapa lipídica puede existir en forma líquida o una fase de gel (sólido).
Un doble enlace insaturado puede producir un estrechamiento en la cadena del alcano, lo que altera el empaque de los lípidos.
Esta interrupción crea un espacio libre extra dentro de la bicapa que permite una mayor flexibilidad en las cadenas adyacentes.
Esta separación de fases desempeña un papel fundamental en los fenómenos bioquímicos debido a que los componentes de la membrana, tales como las proteínas pueden repartirse en una u otra fase[23] y por lo tanto están concentradas o activadas a nivel local.
Estos grupos de cabeza alternos a menudo confieren funcionalidad biológica específica que es altamente dependiente del contexto.
En contraste, los eucariontes tienen una gama de organelos, incluyendo el núcleo, mitocondrias, lisosomas y retículo endoplasmático.
Se estima que hasta un tercio del proteoma humano pueden ser proteínas de membrana.
Normalmente, la fosfatidilserina se distribuye de manera asimétrica en la membrana celular y está presente solo en el lado interior.
Durante la muerte celular programada, una proteína llamada escramblasa equilibra esta distribución, se presenta fosfatidilserina en la cara extracelular bicapa.
La presencia de fosfatidilserina a continuación, desencadena la fagocitosis para eliminar las células muertas o las que están por morir.
La bicapa lipídica es una estructura muy difícil de estudiar debido a que es muy delgada y frágil.
Esta resistencia suele ser bastante alta (108 Ohm-cm^2 o más)[34] ya que el núcleo hidrofóbico es impermeable a especies cargadas.
Las bicapas lipídicas no se pueden ver en un microscopio tradicional, ya que son demasiado delgadas.
AFM es una técnica prometedora, ya que tiene el potencial de imagen con una resolución nanométrica a temperatura ambiente e incluso bajo el agua o tampón fisiológico, condiciones necesarias para el comportamiento bicapa natural.
Es una técnica particularmente útil para grandes moléculas altamente cargadas tales como ADN, que nunca se difundiría pasivamente a través del núcleo de la bicapa hidrofóbica.
Aunque las bicapas lipídicas pueden doblarse fácilmente, la mayoría no puede estirarse más que un pequeño tanto por ciento antes de romperse.
[10] Debido a que las fuerzas implicadas son tan pequeñas, es difícil de determinar experimentalmente la Ka.
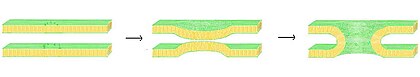
[66] La fusión es el proceso por el cual dos bicapas lipídicas se funden, lo que resulta en una estructura conectada.
La fusión está implicada en muchos procesos celulares, en particular, en eucariontes, ya que la célula eucariota es ampliamente subdividida por bicapas lipídicas de membrana.
La presencia de iones, en particular, cationes divalentes tales como magnesio y calcio, afecta fuertemente a este paso.
[72] En los estudios de biología molecular y celular a menudo es deseable inducir artificialmente la fusión.
En teoría, los liposomas deben hacer un sistema de suministro de fármaco ideal ya que pueden aislar casi cualquier fármaco hidrofílico, se pueden injertar con las moléculas a los tejidos objetivo específicos y pueden ser relativamente no tóxicos ya que el cuerpo posee rutas bioquímicas para degradar lípidos.
[76] El avance más significativo en esta área fue el injerto de polietilenglicol (PEG) sobre la superficie del liposoma para producir vesículas "ocultas", que circulan durante tiempos largos sin la eliminación inmune o renal.