Helicobacter pylori
Helicobacter pylori es un bacilo gramnegativo helicoidal caracterizado por proliferar en la mucosa gástrica humana.
[1] Su característica forma espiral le facilita invadir e infectar el epitelio gástrico humano, mientras que la producción de la enzima ureasa, neutraliza el entorno ácido permitiéndole multiplicarse de forma más exitosa.
Sin embargo, la infección por este microorganismo se asocia a largo plazo con la presencia de gastritis y úlceras, (enfermedad ácido péptica) así como con el desarrollo de Linfomas MALT (mucose asociated lymphoid tissue o tejido linfoide asociado a mucosas).
Aunque este trabajo fue incluido en el Manual de enfermedades gástricas no tuvo mucho impacto debido a que estaba escrito en polaco.
Posteriormente, Marshall y Warren descubrieron que los antibióticos eran efectivos para el tratamiento de la gastritis.
Esto hacía muchas veces que las úlceras reaparecieran después de dejar el tratamiento.
Desde 2006, muchas úlceras son tratadas de forma efectiva utilizando antibióticos frente a H. pylori.
Así pues, las variedades encontradas estarían relacionadas con el origen de los humanos modernos y sus migraciones prehistóricas.
Es microaerófila, es decir, requiere oxígeno pero a más bajas concentraciones de las encontradas en la atmósfera.
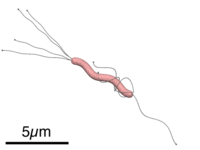
Con su flagelo y su forma espiral, la bacteria «taladra» literalmente la capa de mucus del estómago, y después puede quedarse suspendida en la mucosa gástrica o adherirse a células epiteliales ya que produce adhesinas, (que son proteínas fijantes).
[15] En ausencia de un tratamiento basado en antibióticos, una infección por H. pylori persiste aparentemente durante toda la vida.
En este último caso, es común encontrar infecciones en niños, probablemente por las malas condiciones sanitarias.
También se utiliza la prueba del aliento con urea, en la cual el paciente bebe urea marcada con 14C o 13C, produciéndose posteriormente (debido al metabolismo de la bacteria) dióxido de carbono marcado, el cual es detectado en la respiración.
Si la enzima ureasa producida por la bacteria está presente, descompone la urea del medio en amoníaco y CO2.
La medicación, por otro lado, puede afectar a la actividad de la ureasa y dar falsos positivos en los métodos basados en ella.
Se demostró que la variedad aislada de la bacteria del kimchi, designada Lb.
[17] Un estudio de 2009, develó que el té verde puede prevenir la inflamación producida por la H. pylori.
[18][19] Inicialmente se utilizaba metronidazol, el cual presenta actualmente resistencia en más del 80 % de los casos.
[23] El gastroenterólogo Thomas Borody de Sídney, Australia, inventó la primera terapia triple en 1987.
Se ha encontrado que cada vez más individuos infectados tienen bacterias resistentes a los antibióticos, de modo que el tratamiento inicial no resulta efectivo y se requieren rondas adicionales de terapias con antibióticos o estrategias alternativas tales como una terapia cuádruple.
[26][27] Sin embargo, en la gente anciana es posible que la infección pueda desaparecer conforme la mucosa estomacal se vuelva cada vez más atrófica e inhóspita para la colonización.
[32] En pacientes que presentan una infección asintomática, el tratamiento generalmente no está recomendado.
Desafortunadamente, se ha incrementado el número de infecciones individuales que portan cepas resistentes a este primer tratamiento con antibióticos.
Esto ha hecho que el tratamiento inicial falle y se requieran aplicaciones adicionales de terapia antibiótica.
Se utiliza entonces una cuádruple terapia, incorporándose el bismuto, un metal que es también efectivo en combinación con otros fármacos.
Las cepas bacterianas que tienen el gen cagA, están asociadas con la habilidad de causar úlceras severas.
Este gen codifica para la síntesis de una proteína relativamente larga (1186 aminoácidos).
La proteína CagA ingresa a las células humanas, donde interrumpe el normal funcionamiento del citoesqueleto.



1. H. pylori penetra la capa mucosa del estómago y se adhiere a la superficie de la capa mucosa epitelial gástrica.
2. Produce amoníaco a partir de la urea , para neutralizar el ácido gástrico.
3. Migración y proliferación de H. pylori al foco de infección.
4. Se desarrolla la ulceración gástrica con destrucción de la mucosa, inflamación y muerte de las células mucosas. El amoníaco es el responsable de la destrucción de la mucosa, permitiendo que el ácido penetre a la pared muscular gastrointestinal.


