CRISPR
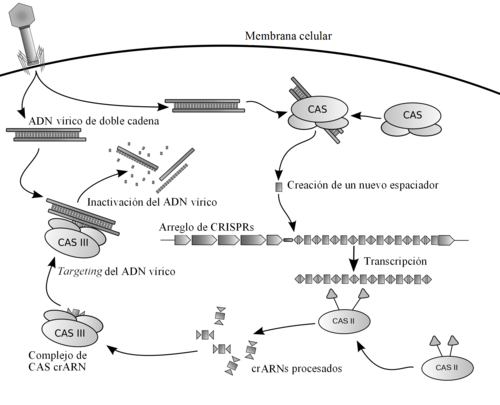
Estos fragmentos son utilizados por la célula procariota en el futuro para detectar y destruir el material genético de virus infecciosos similares mediante proteínas que, con base en las secuencias integradas de ataques anteriores, reconocen y cortan el nuevo ADN viral dejándolo inutilizado, funcionando como un sistema inmunitario de defensa procariota eficaz y altamente específico.
[10] Las secuencias repetidas que luego se conocerían como CRISPR fueron identificadas por primera vez por un grupo de científicos japoneses en 1987 (Yoshizumi Ishino et al).
[17] Pocos años después, Francisco J. M. Mojica propuso y acuñó el acrónimo CRISPR (del inglés: Clustered Regularly Interspaced Short Palyndromic Repeats), propuesta que quedó recogida en una publicación de microbiólogos holandeses en 2002[18] y que sería utilizada universalmente desde entonces para referirse a estas secuencias.
[21] Esas observaciones clave indican que el sistema CRISPR/cas puede tener un rol en la inmunidad adaptativa en las bacterias.
Jinek propuso que estos ARN guía sintéticos podrían usarse para la edición de genes.
[23][24] Desde entonces se ha utilizado en muchos organismos, incluida la levadura del pan (Saccharomyces cerevisiae),[25] el pez cebra (Danio rerio),[26] la mosca de la fruta (Drosophila melanogaster),[27] nematodos (Caenorhabditis elegans)[28] plantas[29] y ratones,[30] entre otros.
Adicionalmente, CRISPR ha sido modificada para hacer factores de transcripción programables que permiten a los científicos silenciar o activar ciertos genes.
Además, en esta última variante se descubrió una mutación puntual, D156R, que representa la sustitución del aminoácido ácido aspártico por arginina en la posición 156 de la proteína.
Muchos organismos contienen múltiples sistemas CRISPR-Cas sugiriendo que son compatibles e incluso podrían compartir elementos.
Capturar al ADN invasor e integrarlo en un locus CRISPR en forma de un espaciador es la primera etapa en la respuesta inmune.
[67] Es probable que en esos sistemas, un extremo romo es generado al final de la repetición directa y el protoespaciador durante la adquisición.
[66] Ha sido notado en una cantidad de CRISPRs que estos contienen muchos espaciadores para el mismo fago.
Este ‘cebado’ requiere que tanto las proteínas Cas involucradas en adquisición como en interferencia interactúen entre sí.
Tanto en sistemas del tipo I-E como I-F las proteínas Cas6e y Cas6f respectivamente, reconocen giros[74][75][76] creados por la naturaleza palindrómica de las repeticiones directas.
[78][79][80] Los sistemas tipo II no poseen el gen Cas6 así que utilizan a la ARNsaIII para hacer los cortes.
[48] Los ARNcr se asocian con las proteínas Cas para formar complejos de ribonucleótidos que reconocen ácidos nucleicos extraños.
[44] El mecanismo para distinguir ADN propio del externo durante la interferencia está dentro de los ARNcr y por lo tanto se infiere que es conservado en los 3 sistemas.
[62][90] El modelo básico de evolución CRISPR se explica como el modelo donde los espaciadores recientemente incorporados llevan a los fagos a mutar sus genomas creando diversidad en las poblaciones tanto de fagos y bacterias.
[69] Del mismo ambiente, se aisló una cepa particular usando primers de PCR específicos para su CRISPR.
El enfoque alterativo es extraer y reconstruir matrices CRISPR basándose en datos metagenómicos al azar.
El gen "corregido" permanece en su lugar habitual en su cromosoma, quien contiene la forma en que la célula normalmente activa o inhibe su expresión.
La cepa promete reducir o eliminar el gran uso de fungicidas para controlar la enfermedad.
Gao usó los sistemas de edición génica transcription activator-like effector nuclease (TALENs) y CRISPR para agregar o cambiar ningún otro gen.
[126] Marcadores moleculares como el estado epigenético, la accesibilidad a la cromatina, la vinculación de factores de transcripción y la conservación evolutiva, se correlacionan con elementos funcionales putativos en el genoma no codificante y pueden predecir su función reguladora.
Se concluyó que las mutaciones en la región no codificante 5' del gen CUL3 alteran los entornos locales epigenéticos y la interacción con distintos factores de transcripción (yin yang 1 (YY1), zinc finger protein 263 (ZNF263), CCCTC-binding factor (CTCF), y el complejo activation-protein 1 (AP-1) formado por Jun:Fos).
[22] Los "CRISPRi", análogos a los ARNi, tienen la capacidad de desactivar los genes en un modo reversible al ser específicos pero sin hacer cortes.
Esta técnica logró un fuerte efecto al dirigir múltiples constructos de CRISPR a lugares ligeramente diferentes en el promotor del gen.
Un subtipo de islas llamada phage-inducible chromosomal island (PICI) es cortada del cromosoma bacteriano cuando se presenta la infección por fago y puede inhibir su replicación.
[140] Desde diciembre de 2014 se espera que Doudna y Charpentier planteen su oposición contra la patente del Broad Institute.
En su monografía El fenotipo revolucionario (The revolutionary phenotype), el neurólogo canadiense Jean-François Gariépy desarrolla una teoría basada en la Hipótesis del mundo de ARN en que la edición del genoma humano podría llegar a un reemplazo de la reproducción biológica.