Un organismo genéticamente modificado ( OGM ) es cualquier organismo cuyo material genético ha sido alterado mediante técnicas de ingeniería genética . La definición exacta de un organismo genéticamente modificado y lo que constituye ingeniería genética varía, siendo la más común un organismo alterado de una manera que "no ocurre naturalmente por apareamiento y/o recombinación natural ". [1] Una amplia variedad de organismos han sido modificados genéticamente (OGM), incluidos animales, plantas y microorganismos.
La modificación genética puede incluir la introducción de nuevos genes o la mejora, alteración o eliminación de genes endógenos . En algunas modificaciones genéticas, los genes se transfieren dentro de la misma especie , entre especies (creando organismos transgénicos) e incluso entre reinos . La creación de un organismo genéticamente modificado es un proceso de varios pasos. Los ingenieros genéticos deben aislar el gen que desean insertar en el organismo huésped y combinarlo con otros elementos genéticos, incluida una región promotora y terminadora y, a menudo, un marcador seleccionable . Hay varias técnicas disponibles para insertar el gen aislado en el genoma del huésped . Los avances recientes que utilizan técnicas de edición genómica , en particular CRISPR , han simplificado mucho la producción de OGM. Herbert Boyer y Stanley Cohen crearon el primer organismo genéticamente modificado en 1973, una bacteria resistente al antibiótico kanamicina . El primer animal genéticamente modificado , un ratón, fue creado en 1974 por Rudolf Jaenisch , y la primera planta fue producida en 1983. En 1994, se lanzó el tomate Flavr Savr , el primer alimento genéticamente modificado comercializado . El primer animal genéticamente modificado en comercializarse fue el GloFish (2003) y el primer animal genéticamente modificado en ser aprobado para uso alimentario fue el salmón AquAdvantage en 2015.
Las bacterias son los organismos más fáciles de diseñar y se han utilizado para la investigación, la producción de alimentos, la purificación industrial de proteínas (incluidos los medicamentos), la agricultura y el arte. Existe el potencial de utilizarlas con fines ambientales o como medicina. Los hongos han sido diseñados con objetivos muy similares. Los virus desempeñan un papel importante como vectores para insertar información genética en otros organismos. Este uso es especialmente relevante para la terapia génica humana . Hay propuestas para eliminar los genes virulentos de los virus para crear vacunas. Las plantas han sido diseñadas para la investigación científica, para crear nuevos colores en las plantas, administrar vacunas y crear cultivos mejorados. Los cultivos genéticamente modificados son públicamente los OGM más controvertidos, a pesar de tener la mayor cantidad de beneficios para la salud humana y el medio ambiente. [2] Los animales son generalmente mucho más difíciles de transformar y la gran mayoría aún se encuentran en la etapa de investigación. Los mamíferos son los mejores organismos modelo para los humanos. El ganado se modifica con la intención de mejorar rasgos económicamente importantes como la tasa de crecimiento, la calidad de la carne, la composición de la leche, la resistencia a las enfermedades y la supervivencia. Los peces genéticamente modificados se utilizan para la investigación científica, como mascotas y como fuente de alimento. La ingeniería genética se ha propuesto como una forma de controlar a los mosquitos, vectores de muchas enfermedades mortales. Aunque la terapia génica humana es todavía relativamente nueva, se ha utilizado para tratar trastornos genéticos como la inmunodeficiencia combinada grave y la amaurosis congénita de Leber .
Se han planteado muchas objeciones al desarrollo de los OGM, en particular a su comercialización. Muchas de ellas tienen que ver con los cultivos transgénicos y con la seguridad de los alimentos producidos a partir de ellos y el impacto que su cultivo tendrá sobre el medio ambiente. Otras preocupaciones son la objetividad y el rigor de las autoridades reguladoras, la contaminación de los alimentos no modificados genéticamente, el control del suministro de alimentos , las patentes de vida y el uso de los derechos de propiedad intelectual . Aunque existe un consenso científico de que los alimentos actualmente disponibles derivados de cultivos transgénicos no plantean un riesgo mayor para la salud humana que los alimentos convencionales, la seguridad de los alimentos transgénicos es un tema principal entre los críticos. El flujo genético , el impacto en organismos no objetivo y el escape son las principales preocupaciones ambientales. Los países han adoptado medidas regulatorias para abordar estas preocupaciones. Existen diferencias en la regulación para la liberación de OGM entre países, y algunas de las diferencias más marcadas se dan entre los EE. UU. y Europa. Las cuestiones clave que afectan a los reguladores incluyen si los alimentos transgénicos deben etiquetarse y el estado de los organismos editados genéticamente.
La definición de un organismo genéticamente modificado (OGM) no es clara y varía ampliamente entre países, organismos internacionales y otras comunidades. En su forma más amplia, la definición de un OGM puede incluir cualquier cosa que haya tenido sus genes alterados, incluso por la naturaleza. [3] [4] Si se adopta una visión menos amplia, puede abarcar todos los organismos cuyos genes hayan sido alterados por los seres humanos, lo que incluiría todos los cultivos y el ganado. En 1993, la Enciclopedia Británica definió la ingeniería genética como "cualquiera de una amplia gama de técnicas... entre ellas la inseminación artificial , la fertilización in vitro ( por ejemplo , bebés 'de probeta'), los bancos de esperma , la clonación y la manipulación genética". [5] La Unión Europea (UE) incluyó una definición igualmente amplia en las primeras revisiones, mencionando específicamente que los OGM se producen mediante " crianza selectiva y otros medios de selección artificial". [6] Estas definiciones se ajustaron rápidamente con una serie de excepciones añadidas como resultado de la presión de las comunidades científicas y agrícolas, así como de los avances en la ciencia. La definición de la UE excluyó posteriormente la cría tradicional, la fertilización in vitro, la inducción de poliploidía , la cría por mutación y las técnicas de fusión celular que no utilizan ácidos nucleicos recombinantes o un organismo modificado genéticamente en el proceso. [7] [8] [9]
Otro enfoque fue la definición proporcionada por la Organización de las Naciones Unidas para la Alimentación y la Agricultura , la Organización Mundial de la Salud y la Comisión Europea , que establece que los organismos deben ser alterados de una manera que "no ocurra naturalmente por apareamiento y/o recombinación natural ". [10] [11] [12] El progreso en la ciencia, como el descubrimiento de la transferencia horizontal de genes como un fenómeno natural relativamente común, se sumó a la confusión sobre lo que "ocurre naturalmente", lo que llevó a más ajustes y excepciones. [13] Hay ejemplos de cultivos que se ajustan a esta definición, pero que normalmente no se consideran OGM. [14] Por ejemplo, el cultivo de cereales triticale se desarrolló completamente en un laboratorio en 1930 utilizando varias técnicas para alterar su genoma. [15]
El término organismo genéticamente modificado (OGM) puede considerarse más preciso en comparación con OGM cuando se describen los genomas de organismos que han sido manipulados directamente con biotecnología. [16] [8] El Protocolo de Cartagena sobre Seguridad de la Biotecnología utilizó el sinónimo organismo vivo modificado ( OVM ) en 2000 y lo definió como "cualquier organismo vivo que posee una nueva combinación de material genético obtenido mediante el uso de la biotecnología moderna". [17] La biotecnología moderna se define además como "técnicas de ácido nucleico in vitro, incluido el ácido desoxirribonucleico (ADN) recombinante y la inyección directa de ácido nucleico en células u orgánulos, o la fusión de células más allá de la familia taxonómica". [18]
Originalmente, el término OGM no era comúnmente utilizado por los científicos para describir organismos genéticamente modificados hasta después de que el uso de OGM se volviera común en los medios populares. [19] El Departamento de Agricultura de los Estados Unidos (USDA) considera que los OGM son plantas o animales con cambios hereditarios introducidos por ingeniería genética o métodos tradicionales, mientras que GEO se refiere específicamente a organismos con genes introducidos, eliminados o reorganizados utilizando biología molecular, particularmente técnicas de ADN recombinante , como la transgénesis . [20]
Las definiciones se centran en el proceso más que en el producto, lo que significa que podría haber OGM y no OGM con genotipos y fenotipos muy similares. [21] [22] Esto ha llevado a los científicos a etiquetarlo como una categoría sin sentido científico, [23] diciendo que es imposible agrupar todos los diferentes tipos de OGM bajo una definición común. [24] También ha causado problemas para las instituciones orgánicas y los grupos que buscan prohibir los OGM. [25] [26] También plantea problemas a medida que se desarrollan nuevos procesos. Las definiciones actuales llegaron antes de que la edición del genoma se volviera popular y existe cierta confusión sobre si son OGM. La UE ha dictaminado que están [27] cambiando su definición de OGM para incluir "organismos obtenidos por mutagénesis ", pero los ha excluido de la regulación basándose en su "largo historial de seguridad" y que han sido "utilizados convencionalmente en varias aplicaciones". [9] En contraste, el USDA ha dictaminado que los organismos editados genéticamente no se consideran OGM. [28]
Una incoherencia y una confusión aún mayores se asocian con diversos esquemas de etiquetado "sin OGM" o "libre de OGM" en la comercialización de alimentos, donde incluso productos como el agua o la sal, que no contienen ninguna sustancia orgánica ni material genético (y por lo tanto no pueden ser modificados genéticamente por definición), se etiquetan para crear una impresión de ser "más saludables". [29] [30] [31]

La creación de un organismo genéticamente modificado (OGM) es un proceso de varios pasos. Los ingenieros genéticos deben aislar el gen que desean insertar en el organismo huésped. Este gen puede tomarse de una célula [32] o sintetizarse artificialmente [33] . Si el gen elegido o el genoma del organismo donante ha sido bien estudiado, es posible que ya sea accesible desde una biblioteca genética . Luego, el gen se combina con otros elementos genéticos, incluida una región promotora y terminadora y un marcador seleccionable [34] .
Hay varias técnicas disponibles para insertar el gen aislado en el genoma del huésped . Se puede inducir a las bacterias a absorber ADN extraño, generalmente mediante choque térmico expuesto o electroporación . [35] El ADN generalmente se inserta en células animales mediante microinyección , donde se puede inyectar a través de la envoltura nuclear de la célula directamente en el núcleo , o mediante el uso de vectores virales . [36] En las plantas, el ADN a menudo se inserta utilizando recombinación mediada por Agrobacterium , [37] [38] biolística [39] o electroporación.
Como sólo una única célula se transforma con material genético, el organismo debe regenerarse a partir de esa única célula. En las plantas, esto se logra mediante cultivo de tejidos . [40] [41] En los animales, es necesario asegurarse de que el ADN insertado esté presente en las células madre embrionarias . [37] Se realizan pruebas adicionales mediante PCR , hibridación Southern y secuenciación de ADN para confirmar que un organismo contiene el nuevo gen. [42]
Tradicionalmente, el nuevo material genético se insertaba aleatoriamente dentro del genoma del huésped. Se han desarrollado técnicas de selección de genes , que crean roturas de doble cadena y aprovechan los sistemas naturales de reparación de recombinación homóloga de las células, para dirigir la inserción a ubicaciones exactas . La edición del genoma utiliza nucleasas diseñadas artificialmente que crean roturas en puntos específicos. Hay cuatro familias de nucleasas diseñadas: meganucleasas , [43] [44] nucleasas de dedo de zinc , [45] [46] nucleasas efectoras similares a activadores de transcripción (TALEN), [47] [48] y el sistema Cas9-ARN guía (adaptado de CRISPR). [49] [50] TALEN y CRISPR son los dos más utilizados y cada uno tiene sus propias ventajas. [51] Las TALEN tienen una mayor especificidad del objetivo, mientras que CRISPR es más fácil de diseñar y más eficiente. [51]

Los humanos han domesticado plantas y animales desde alrededor de 12.000 a. C., utilizando la cría selectiva o selección artificial (en contraste con la selección natural ). [52] : 25 El proceso de cría selectiva , en el que se utilizan organismos con rasgos deseados (y por lo tanto con los genes deseados ) para criar a la siguiente generación y los organismos que carecen del rasgo no se crían, es un precursor del concepto moderno de modificación genética. [53] : 1 [54] : 1 Varios avances en genética permitieron a los humanos alterar directamente el ADN y, por lo tanto, los genes de los organismos. En 1972, Paul Berg creó la primera molécula de ADN recombinante cuando combinó el ADN de un virus de mono con el del virus lambda . [55] [56]
Herbert Boyer y Stanley Cohen crearon el primer organismo modificado genéticamente en 1973. [57] Tomaron un gen de una bacteria que proporcionaba resistencia al antibiótico kanamicina , lo insertaron en un plásmido y luego indujeron a otras bacterias a incorporar el plásmido. Las bacterias que habían incorporado con éxito el plásmido pudieron sobrevivir en presencia de kanamicina. [58] Boyer y Cohen expresaron otros genes en bacterias. Esto incluyó genes del sapo Xenopus laevis en 1974, creando el primer OGM que expresaba un gen de un organismo de un reino diferente . [59]

En 1974, Rudolf Jaenisch creó un ratón transgénico introduciendo ADN extraño en su embrión, convirtiéndolo en el primer animal transgénico del mundo. [60] [61] Sin embargo, pasaron otros ocho años antes de que se desarrollaran ratones transgénicos que transmitieran el transgén a su descendencia. [62] [63] En 1984 se crearon ratones modificados genéticamente que portaban oncogenes clonados , lo que los predisponía a desarrollar cáncer. [64] En 1989 se crearon ratones con genes eliminados (denominados ratones knockout ). El primer ganado transgénico se produjo en 1985 [65] y el primer animal en sintetizar proteínas transgénicas en su leche fueron los ratones en 1987. [66] Los ratones fueron diseñados para producir activador del plasminógeno tisular humano , una proteína involucrada en la descomposición de coágulos sanguíneos . [67]
En 1983, Michael W. Bevan , Richard B. Flavell y Mary-Dell Chilton desarrollaron la primera planta genéticamente modificada . Infectaron tabaco con Agrobacterium transformado con un gen de resistencia a los antibióticos y, mediante técnicas de cultivo de tejidos, pudieron cultivar una nueva planta que contenía el gen de resistencia. [68] La pistola genética se inventó en 1987, lo que permitió la transformación de plantas no susceptibles a la infección por Agrobacterium . [69] En 2000, el arroz dorado enriquecido con vitamina A fue la primera planta desarrollada con un mayor valor nutritivo. [70]
En 1976, Genentech , la primera empresa de ingeniería genética, fue fundada por Herbert Boyer y Robert Swanson ; un año después, la empresa produjo una proteína humana ( somatostatina ) en E. coli . Genentech anunció la producción de insulina humana modificada genéticamente en 1978. [71] La insulina producida por bacterias, de marca Humulin , fue aprobada para su liberación por la Administración de Alimentos y Medicamentos en 1982. [72] En 1988, se produjeron los primeros anticuerpos humanos en plantas. [73] En 1987, una cepa de Pseudomonas syringae se convirtió en el primer organismo modificado genéticamente en ser liberado al medio ambiente [74] cuando un campo de fresas y patatas en California fue rociado con ella. [75]
El primer cultivo genéticamente modificado , una planta de tabaco resistente a los antibióticos, se produjo en 1982. [76] China fue el primer país en comercializar plantas transgénicas, introduciendo un tabaco resistente a los virus en 1992. [77] En 1994, Calgene obtuvo la aprobación para lanzar comercialmente el tomate Flavr Savr , el primer alimento genéticamente modificado . [78] También en 1994, la Unión Europea aprobó el tabaco diseñado para ser resistente al herbicida bromoxinil , convirtiéndolo en el primer cultivo genéticamente modificado comercializado en Europa. [79] Una papa resistente a los insectos fue aprobada para su lanzamiento en los EE. UU. en 1995, [80] y en 1996 se había otorgado la aprobación para cultivar comercialmente 8 cultivos transgénicos y un cultivo de flores (clavel) en 6 países más la UE. [81]
En 2010, los científicos del Instituto J. Craig Venter anunciaron que habían creado el primer genoma bacteriano sintético . Lo llamaron Synthia y fue la primera forma de vida sintética del mundo . [82] [83]
El primer animal genéticamente modificado que se comercializó fue el GloFish , un pez cebra con un gen fluorescente añadido que le permite brillar en la oscuridad bajo luz ultravioleta . [84] Fue lanzado al mercado estadounidense en 2003. [85] En 2015, el salmón AquAdvantage se convirtió en el primer animal genéticamente modificado en ser aprobado para uso alimentario. [86] La aprobación es para peces criados en Panamá y vendidos en los EE. UU. [86] El salmón se transformó con un gen regulador de la hormona del crecimiento de un salmón Chinook del Pacífico y un promotor de un faneca oceánica que le permite crecer durante todo el año en lugar de solo durante la primavera y el verano. [87]
Las bacterias fueron los primeros organismos modificados genéticamente en el laboratorio, debido a la relativa facilidad de modificar sus cromosomas. [88] Esta facilidad las convirtió en herramientas importantes para la creación de otros organismos modificados genéticamente. Los genes y otra información genética de una amplia gama de organismos se pueden agregar a un plásmido e insertar en bacterias para su almacenamiento y modificación. Las bacterias son baratas, fáciles de cultivar, clonales , se multiplican rápidamente y se pueden almacenar a -80 °C casi indefinidamente. Una vez que se aísla un gen, se puede almacenar dentro de la bacteria, lo que proporciona un suministro ilimitado para la investigación. [89] Una gran cantidad de plásmidos personalizados hacen que la manipulación del ADN extraído de las bacterias sea relativamente fácil. [90]
Su facilidad de uso los ha convertido en excelentes herramientas para los científicos que buscan estudiar la función y la evolución de los genes . Los organismos modelo más simples provienen de bacterias, y la mayor parte de nuestro conocimiento inicial de la biología molecular proviene del estudio de Escherichia coli . [91] Los científicos pueden manipular y combinar fácilmente genes dentro de las bacterias para crear proteínas nuevas o alteradas y observar el efecto que esto tiene en varios sistemas moleculares. Los investigadores han combinado los genes de bacterias y arqueas , lo que ha llevado a conocimientos sobre cómo estos dos divergieron en el pasado. [92] En el campo de la biología sintética , se han utilizado para probar varios enfoques sintéticos, desde la síntesis de genomas hasta la creación de nuevos nucleótidos . [93] [94] [95]
Las bacterias se han utilizado en la producción de alimentos durante mucho tiempo, y se han desarrollado y seleccionado cepas específicas para ese trabajo a escala industrial . Se pueden utilizar para producir enzimas , aminoácidos , saborizantes y otros compuestos utilizados en la producción de alimentos. Con el advenimiento de la ingeniería genética, se pueden introducir fácilmente nuevos cambios genéticos en estas bacterias. La mayoría de las bacterias productoras de alimentos son bacterias de ácido láctico , y aquí es donde se ha dirigido la mayoría de la investigación sobre bacterias productoras de alimentos mediante ingeniería genética. Las bacterias se pueden modificar para operar de manera más eficiente, reducir la producción de subproductos tóxicos, aumentar la producción, crear compuestos mejorados y eliminar vías innecesarias . [96] Los productos alimenticios de bacterias modificadas genéticamente incluyen alfa-amilasa , que convierte el almidón en azúcares simples, quimosina , que coagula la proteína de la leche para la elaboración de queso, y pectinesterasa , que mejora la claridad del jugo de fruta. [97] La mayoría se produce en los EE. UU. y, aunque existen regulaciones para permitir la producción en Europa, a partir de 2015 no hay productos alimenticios derivados de bacterias disponibles allí. [98]
Las bacterias modificadas genéticamente se utilizan para producir grandes cantidades de proteínas para uso industrial. Las bacterias generalmente se cultivan en un gran volumen antes de que se active el gen que codifica la proteína. Luego, las bacterias se cosechan y se purifica la proteína deseada a partir de ellas. [99] El alto costo de extracción y purificación ha significado que solo se han producido productos de alto valor a escala industrial. [100] La mayoría de estos productos son proteínas humanas para uso en medicina. [101] Muchas de estas proteínas son imposibles o difíciles de obtener a través de métodos naturales y es menos probable que estén contaminadas con patógenos, lo que las hace más seguras. [99] El primer uso medicinal de las bacterias GM fue producir la proteína insulina para tratar la diabetes . [102] Otros medicamentos producidos incluyen factores de coagulación para tratar la hemofilia , [103] hormona de crecimiento humana para tratar varias formas de enanismo , [104] [105] interferón para tratar algunos cánceres, eritropoyetina para pacientes anémicos y activador del plasminógeno tisular que disuelve los coágulos sanguíneos. [99] Fuera de la medicina se han utilizado para producir biocombustibles . [106] Existe interés en desarrollar un sistema de expresión extracelular dentro de las bacterias para reducir costos y hacer económica la producción de más productos. [100]
Con una mayor comprensión del papel que desempeña el microbioma en la salud humana, existe la posibilidad de tratar enfermedades alterando genéticamente las bacterias para que sean agentes terapéuticos. Las ideas incluyen alterar las bacterias intestinales para que destruyan las bacterias dañinas, o usar bacterias para reemplazar o aumentar las enzimas o proteínas deficientes. Un enfoque de investigación es modificar Lactobacillus , bacterias que naturalmente brindan cierta protección contra el VIH , con genes que mejorarán aún más esta protección. Si las bacterias no forman colonias dentro del paciente, la persona debe ingerir repetidamente las bacterias modificadas para obtener las dosis necesarias. Permitir que las bacterias formen una colonia podría proporcionar una solución más a largo plazo, pero también podría plantear problemas de seguridad, ya que las interacciones entre las bacterias y el cuerpo humano son menos conocidas que con los medicamentos tradicionales. Existe la preocupación de que la transferencia horizontal de genes a otras bacterias pueda tener efectos desconocidos. A partir de 2018, hay ensayos clínicos en curso que prueban la eficacia y seguridad de estos tratamientos. [107]
Durante más de un siglo, las bacterias se han utilizado en la agricultura. Los cultivos se han inoculado con Rhizobia (y más recientemente Azospirillum ) para aumentar su producción o permitir que se cultiven fuera de su hábitat original . La aplicación de Bacillus thuringiensis (Bt) y otras bacterias puede ayudar a proteger los cultivos de la infestación de insectos y las enfermedades de las plantas. Con los avances en ingeniería genética, estas bacterias se han manipulado para aumentar la eficiencia y ampliar el rango de hospedadores. También se han agregado marcadores para ayudar a rastrear la propagación de las bacterias. Las bacterias que colonizan naturalmente ciertos cultivos también se han modificado, en algunos casos para expresar los genes Bt responsables de la resistencia a las plagas. Las cepas de bacterias Pseudomonas causan daños por heladas al nuclear agua en cristales de hielo a su alrededor. Esto condujo al desarrollo de bacterias sin hielo , a las que se les han eliminado los genes formadores de hielo. Cuando se aplican a los cultivos, pueden competir con las bacterias no modificadas y conferir cierta resistencia a las heladas. [108]

Otros usos de las bacterias modificadas genéticamente incluyen la biorremediación , donde las bacterias se utilizan para convertir contaminantes en una forma menos tóxica. La ingeniería genética puede aumentar los niveles de las enzimas utilizadas para degradar una toxina o para hacer que las bacterias sean más estables en condiciones ambientales. [109] También se ha creado bioarte utilizando bacterias modificadas genéticamente. En la década de 1980, el artista Jon Davis y la genetista Dana Boyd convirtieron el símbolo germánico de la feminidad (ᛉ) en un código binario y luego en una secuencia de ADN, que luego se expresó en Escherichia coli . [110] Esto se llevó un paso más allá en 2012, cuando se codificó un libro completo en ADN. [111] También se han producido pinturas utilizando bacterias transformadas con proteínas fluorescentes. [110]
Los virus suelen modificarse para que puedan utilizarse como vectores para insertar información genética en otros organismos. Este proceso se denomina transducción y, si tiene éxito, el receptor del ADN introducido se convierte en un OGM. Los distintos virus tienen distintas eficiencias y capacidades. Los investigadores pueden utilizar esto para controlar diversos factores, como la ubicación del objetivo, el tamaño del inserto y la duración de la expresión génica. Se deben eliminar todas las secuencias peligrosas inherentes al virus, mientras que se conservan las que permiten que el gen se distribuya de forma eficaz. [112]
Si bien los vectores virales se pueden utilizar para insertar ADN en casi cualquier organismo, es especialmente relevante por su potencial en el tratamiento de enfermedades humanas. Aunque principalmente todavía se encuentra en etapas de prueba, [113] ha habido algunos éxitos utilizando la terapia génica para reemplazar genes defectuosos. Esto es más evidente en la curación de pacientes con inmunodeficiencia combinada grave que surge de la deficiencia de adenosina deaminasa (ADA-SCID), [114] aunque el desarrollo de leucemia en algunos pacientes con ADA-SCID [115] junto con la muerte de Jesse Gelsinger en un ensayo de 1999 retrasaron el desarrollo de este enfoque durante muchos años. [116] En 2009, se logró otro avance cuando un niño de ocho años con amaurosis congénita de Leber recuperó la vista normal [116] y en 2016 GlaxoSmithKline obtuvo la aprobación para comercializar un tratamiento de terapia génica para ADA-SCID. [114] A partir de 2018, hay una cantidad sustancial de ensayos clínicos en curso, incluidos tratamientos para la hemofilia , el glioblastoma , la enfermedad granulomatosa crónica , la fibrosis quística y varios tipos de cáncer . [115]
El virus más común utilizado para la administración de genes proviene de los adenovirus , ya que pueden transportar hasta 7,5 kb de ADN extraño e infectar una gama relativamente amplia de células huésped, aunque se sabe que provocan respuestas inmunes en el huésped y solo proporcionan una expresión a corto plazo. Otros vectores comunes son los virus adenoasociados , que tienen una toxicidad menor y una expresión a largo plazo, pero solo pueden transportar alrededor de 4 kb de ADN. [115] Los virus del herpes simple son vectores prometedores, con una capacidad de transporte de más de 30 kb y que proporcionan una expresión a largo plazo, aunque son menos eficientes en la administración de genes que otros vectores. [117] Los mejores vectores para la integración a largo plazo del gen en el genoma del huésped son los retrovirus , pero su propensión a la integración aleatoria es problemática. Los lentivirus son parte de la misma familia que los retrovirus con la ventaja de infectar tanto a las células en división como a las que no se dividen, mientras que los retrovirus solo se dirigen a las células en división. Otros virus que se han utilizado como vectores incluyen alfavirus , flavivirus , virus del sarampión , rabdovirus , virus de la enfermedad de Newcastle , poxvirus y picornavirus . [115]
La mayoría de las vacunas consisten en virus que han sido atenuados , desactivados, debilitados o eliminados de alguna manera para que sus propiedades virulentas ya no sean efectivas. La ingeniería genética podría teóricamente usarse para crear virus con los genes virulentos eliminados. Esto no afecta la infectividad de los virus , invoca una respuesta inmune natural y no hay posibilidad de que recuperen su función de virulencia, lo que puede ocurrir con algunas otras vacunas. Como tal, generalmente se consideran más seguras y eficientes que las vacunas convencionales, aunque persisten las preocupaciones sobre la infección no objetivo, los posibles efectos secundarios y la transferencia horizontal de genes a otros virus. [118] Otro enfoque potencial es usar vectores para crear nuevas vacunas para enfermedades para las que no hay vacunas disponibles o las vacunas que no funcionan de manera efectiva, como el SIDA , la malaria y la tuberculosis . [119] La vacuna más eficaz contra la tuberculosis, la vacuna Bacillus Calmette-Guérin (BCG) , solo proporciona protección parcial. Una vacuna modificada que expresa un antígeno de M. tuberculosis puede mejorar la protección de BCG. [120] Se ha demostrado que su uso es seguro en ensayos de fase II , aunque no tan eficaz como se esperaba inicialmente. [121] Ya se han aprobado otras vacunas basadas en vectores y se están desarrollando muchas más. [119]
Otro uso potencial de los virus modificados genéticamente es alterarlos para que puedan tratar enfermedades directamente. Esto puede ser a través de la expresión de proteínas protectoras o apuntando directamente a las células infectadas. En 2004, los investigadores informaron que un virus modificado genéticamente que explota el comportamiento egoísta de las células cancerosas podría ofrecer una forma alternativa de matar tumores. [122] [123] Desde entonces, varios investigadores han desarrollado virus oncolíticos modificados genéticamente que muestran promesas como tratamientos para varios tipos de cáncer . [124] [125] [126] [127] [128] En 2017, los investigadores modificaron genéticamente un virus para expresar proteínas defensinas de espinaca . El virus se inyectó en naranjos para combatir la enfermedad del enverdecimiento de los cítricos que había reducido la producción de naranjas en un 70% desde 2005. [129]
Las enfermedades virales naturales, como la mixomatosis y la enfermedad hemorrágica del conejo , se han utilizado para ayudar a controlar las poblaciones de plagas. Con el tiempo, las plagas supervivientes se vuelven resistentes, lo que lleva a los investigadores a buscar métodos alternativos. Se han creado en el laboratorio virus modificados genéticamente que hacen que los animales objetivo sean infértiles mediante inmunocontracepción [130], así como otros que se dirigen a la etapa de desarrollo del animal. [131] Existen preocupaciones con el uso de este enfoque en relación con la contención del virus [130] y la infección entre especies. [132] A veces, el mismo virus puede modificarse con fines contrastantes. Se ha propuesto la modificación genética del virus mixoma para conservar los conejos salvajes europeos en la península ibérica y ayudar a regularlos en Australia. Para proteger a las especies ibéricas de las enfermedades virales, el virus mixoma se modificó genéticamente para inmunizar a los conejos, mientras que en Australia el mismo virus mixoma se modificó genéticamente para reducir la fertilidad en la población de conejos australianos. [133]
Fuera de la biología, los científicos han utilizado un virus modificado genéticamente para construir una batería de iones de litio y otros materiales nanoestructurados . Es posible diseñar bacteriófagos para expresar proteínas modificadas en su superficie y unirlas en patrones específicos (una técnica llamada visualización de fagos ). Estas estructuras tienen usos potenciales para el almacenamiento y la generación de energía, la biodetección y la regeneración de tejidos con algunos materiales nuevos que se producen actualmente, incluidos los puntos cuánticos , los cristales líquidos , los nanorings y las nanofibras . [134] La batería se fabricó mediante la ingeniería de bacteriófagos M13 para que se recubrieran de fosfato de hierro y luego se ensamblaran a lo largo de un nanotubo de carbono . Esto creó un medio altamente conductor para su uso en un cátodo, lo que permite transferir energía rápidamente. Podrían construirse a temperaturas más bajas con productos químicos no tóxicos, lo que los hace más respetuosos con el medio ambiente. [135]
Los hongos pueden utilizarse para muchos de los mismos procesos que las bacterias. Para aplicaciones industriales, las levaduras combinan las ventajas bacterianas de ser un organismo unicelular que es fácil de manipular y cultivar con las modificaciones avanzadas de proteínas que se encuentran en los eucariotas . Se pueden utilizar para producir moléculas grandes y complejas para su uso en alimentos, productos farmacéuticos, hormonas y esteroides. [136] La levadura es importante para la producción de vino y, a partir de 2016, se han comercializado en Estados Unidos y Canadá dos levaduras modificadas genéticamente involucradas en la fermentación del vino. Una ha aumentado la eficiencia de la fermentación maloláctica , mientras que la otra previene la producción de compuestos peligrosos de carbamato de etilo durante la fermentación. [96] También ha habido avances en la producción de biocombustible a partir de hongos modificados genéticamente. [137]
Los hongos, al ser los patógenos más comunes de los insectos, son biopesticidas atractivos . A diferencia de las bacterias y los virus, tienen la ventaja de infectar a los insectos solo por contacto, aunque son superados en eficiencia por los pesticidas químicos . La ingeniería genética puede mejorar la virulencia, generalmente agregando proteínas más virulentas, [138] aumentando la tasa de infección o mejorando la persistencia de las esporas . [139] Muchos de los vectores portadores de enfermedades son susceptibles a los hongos entomopatógenos . Un objetivo atractivo para el control biológico son los mosquitos , vectores de una variedad de enfermedades mortales, incluida la malaria , la fiebre amarilla y el dengue . Los mosquitos pueden evolucionar rápidamente, por lo que se convierte en un acto de equilibrio matarlos antes de que el Plasmodium que transmiten se convierta en la enfermedad infecciosa, pero no tan rápido como para que se vuelvan resistentes a los hongos. Al modificar genéticamente hongos como Metarhizium anisopliae y Beauveria bassiana para retrasar el desarrollo de la infecciosidad de los mosquitos, se reduce la presión de selección para desarrollar resistencia. [140] Otra estrategia es agregar proteínas a los hongos que bloquean la transmisión de la malaria [140] o eliminar el Plasmodium por completo. [141]
El hongo Agaricus bisporus , el hongo blanco común, ha sido modificado genéticamente para resistir el oscurecimiento, lo que le otorga una vida útil más larga . El proceso utilizó CRISPR para eliminar un gen que codifica la polifenol oxidasa . Como no introdujo ningún ADN extraño en el organismo, no se consideró que estuviera regulado bajo los marcos de OGM existentes y, como tal, es el primer organismo editado con CRISPR que se aprueba para su liberación. [142] Esto ha intensificado los debates sobre si los organismos editados genéticamente deben considerarse organismos modificados genéticamente [143] y cómo deben regularse. [144]

Las plantas han sido diseñadas para la investigación científica, para mostrar nuevos colores de flores, administrar vacunas y crear cultivos mejorados. Muchas plantas son pluripotentes , lo que significa que una sola célula de una planta madura puede ser cosechada y, en las condiciones adecuadas, puede convertirse en una nueva planta. Los ingenieros genéticos pueden aprovechar esta capacidad; al seleccionar células que se han transformado con éxito en una planta adulta, se puede cultivar una nueva planta que contenga el transgén en cada célula mediante un proceso conocido como cultivo de tejidos . [145]
Gran parte de los avances en el campo de la ingeniería genética provienen de la experimentación con tabaco . Los principales avances en el cultivo de tejidos y los mecanismos celulares de las plantas para una amplia gama de plantas se han originado a partir de sistemas desarrollados en tabaco. [146] Fue la primera planta en ser alterada mediante ingeniería genética y se considera un organismo modelo no solo para la ingeniería genética, sino para una variedad de otros campos. [147] Como tal, las herramientas y procedimientos transgénicos están bien establecidos, lo que hace que el tabaco sea una de las plantas más fáciles de transformar. [148] Otro organismo modelo importante relevante para la ingeniería genética es Arabidopsis thaliana . Su genoma pequeño y su ciclo de vida corto lo hacen fácil de manipular y contiene muchos homólogos de especies de cultivos importantes. [149] Fue la primera planta secuenciada , tiene una gran cantidad de recursos en línea disponibles y puede transformarse simplemente sumergiendo una flor en una solución de Agrobacterium transformada . [150]
En la investigación, las plantas se modifican para ayudar a descubrir las funciones de ciertos genes. La forma más sencilla de hacerlo es eliminar el gen y ver qué fenotipo se desarrolla en comparación con la forma de tipo salvaje . Cualquier diferencia es posiblemente el resultado del gen faltante. A diferencia de la mutagénesis , la ingeniería genética permite la eliminación dirigida sin alterar otros genes en el organismo. [145] Algunos genes solo se expresan en ciertos tejidos, por lo que los genes reporteros, como GUS , se pueden unir al gen de interés permitiendo la visualización de la ubicación. [151] Otras formas de probar un gen es alterarlo ligeramente y luego devolverlo a la planta y ver si todavía tiene el mismo efecto en el fenotipo. Otras estrategias incluyen unir el gen a un promotor fuerte y ver qué sucede cuando se sobreexpresa, lo que obliga a un gen a expresarse en una ubicación diferente o en diferentes etapas de desarrollo . [145]

Algunas plantas genéticamente modificadas son puramente ornamentales . Se modifican para el color de la flor, la fragancia, la forma de la flor y la arquitectura de la planta. [152] Las primeras plantas ornamentales genéticamente modificadas comercializaron colores alterados. [153] Los claveles se lanzaron al mercado en 1997, y el organismo genéticamente modificado más popular, una rosa azul (en realidad lavanda o malva ), creada en 2004. [154] Las rosas se venden en Japón, Estados Unidos y Canadá. [155] [156] Otras plantas ornamentales genéticamente modificadas incluyen el crisantemo y la petunia . [152] Además de aumentar el valor estético, existen planes para desarrollar plantas ornamentales que utilicen menos agua o sean resistentes al frío, lo que permitiría cultivarlas fuera de sus entornos naturales. [157]
Se ha propuesto modificar genéticamente algunas especies de plantas amenazadas de extinción para que sean resistentes a plantas invasoras y enfermedades, como el barrenador esmeralda del fresno en América del Norte y la enfermedad fúngica, Ceratocystis platani , en los plátanos europeos . [158] El virus de la mancha anular de la papaya devastó los árboles de papaya en Hawai en el siglo XX hasta que se les dio a las plantas de papaya transgénicas resistencia derivada de patógenos. [159] Sin embargo, la modificación genética para la conservación de plantas sigue siendo principalmente especulativa. Una preocupación única es que una especie transgénica puede ya no tener suficiente parecido con la especie original para afirmar verdaderamente que la especie original está siendo conservada. En cambio, la especie transgénica puede ser genéticamente lo suficientemente diferente como para ser considerada una nueva especie, disminuyendo así el valor de conservación de la modificación genética. [158]

Los cultivos modificados genéticamente son plantas modificadas genéticamente que se utilizan en la agricultura . Los primeros cultivos desarrollados se utilizaron para la alimentación animal o humana y proporcionan resistencia a ciertas plagas, enfermedades, condiciones ambientales, deterioro o tratamientos químicos (por ejemplo, resistencia a un herbicida ). La segunda generación de cultivos tenía como objetivo mejorar la calidad, a menudo alterando el perfil de nutrientes . Los cultivos modificados genéticamente de tercera generación podrían usarse para fines no alimentarios, incluida la producción de agentes farmacéuticos , biocombustibles y otros bienes de utilidad industrial, así como para la biorremediación . [160]

Hay tres objetivos principales para el avance agrícola: aumento de la producción, mejores condiciones para los trabajadores agrícolas y sostenibilidad . Los cultivos transgénicos contribuyen a mejorar las cosechas al reducir la presión de los insectos, aumentar el valor de los nutrientes y tolerar diferentes estreses abióticos . A pesar de este potencial, a partir de 2018, los cultivos comercializados se limitan principalmente a cultivos comerciales como el algodón, la soja, el maíz y la canola y la gran mayoría de los rasgos introducidos proporcionan tolerancia a los herbicidas o resistencia a los insectos. [160] La soja representó la mitad de todos los cultivos modificados genéticamente plantados en 2014. [161] La adopción por parte de los agricultores ha sido rápida, entre 1996 y 2013, la superficie total de tierra cultivada con cultivos transgénicos aumentó en un factor de 100. [162] Aunque geográficamente la propagación ha sido desigual, con un fuerte crecimiento en las Américas y partes de Asia y poco en Europa y África. [160] Su difusión socioeconómica ha sido más uniforme: aproximadamente el 54% de los cultivos transgénicos del mundo se cultivaron en países en desarrollo en 2013. [162] Aunque se han planteado dudas, [163] la mayoría de los estudios han descubierto que el cultivo de cultivos transgénicos es beneficioso para los agricultores debido a la disminución del uso de pesticidas, así como al aumento del rendimiento de los cultivos y las ganancias agrícolas. [164] [165] [166]
La mayoría de los cultivos transgénicos han sido modificados para ser resistentes a herbicidas seleccionados, generalmente a base de glifosato o glufosinato . Los cultivos modificados genéticamente diseñados para resistir herbicidas ahora están más disponibles que las variedades resistentes criadas convencionalmente; [167] en los EE. UU. el 93% de la soja y la mayoría del maíz transgénico cultivado es tolerante al glifosato. [168] La mayoría de los genes disponibles actualmente que se utilizan para diseñar la resistencia a los insectos provienen de la bacteria Bacillus thuringiensis y codifican endotoxinas delta . Unos pocos usan los genes que codifican proteínas insecticidas vegetativas. [169] El único gen utilizado comercialmente para proporcionar protección contra insectos que no se origina en B. thuringiensis es el inhibidor de tripsina de caupí (CpTI). CpTI fue aprobado por primera vez para su uso en algodón en 1999 y actualmente se está probando en arroz. [170] [171] Menos del uno por ciento de los cultivos GM contenían otras características, que incluían proporcionar resistencia a los virus, retrasar la senescencia y alterar la composición de las plantas. [161]

El arroz dorado es el cultivo transgénico más conocido que tiene como objetivo aumentar el valor nutricional. Se ha diseñado con tres genes que biosintetizan betacaroteno , un precursor de la vitamina A , en las partes comestibles del arroz. [70] Se pretende producir un alimento fortificado para cultivar y consumir en áreas con escasez de vitamina A en la dieta , [172] una deficiencia que se estima que cada año mata a 670.000 niños menores de 5 años [173] y causa 500.000 casos adicionales de ceguera infantil irreversible. [174] El arroz dorado original produjo 1,6 μg/g de carotenoides , y un desarrollo posterior aumentó esta cantidad 23 veces. [175] Obtuvo sus primeras aprobaciones para su uso como alimento en 2018. [176]
Las plantas y células vegetales han sido modificadas genéticamente para la producción de biofármacos en biorreactores , un proceso conocido como pharming . Se ha trabajado con la lenteja de agua Lemna minor , [177] el alga Chlamydomonas reinhardtii [178] y el musgo Physcomitrella patens . [179] [180] Los biofármacos producidos incluyen citocinas , hormonas , anticuerpos , enzimas y vacunas, la mayoría de las cuales se acumulan en las semillas de las plantas. Muchos fármacos también contienen ingredientes vegetales naturales y las vías que conducen a su producción han sido alteradas genéticamente o transferidas a otras especies vegetales para producir un mayor volumen. [181] Otras opciones para los biorreactores son los biopolímeros [182] y los biocombustibles . [183] A diferencia de las bacterias, las plantas pueden modificar las proteínas postraduccionalmente , lo que les permite fabricar moléculas más complejas. También presentan menos riesgo de ser contaminadas. [184] Se han cultivado terapias en células transgénicas de zanahoria y tabaco, [185] incluido un tratamiento farmacológico para la enfermedad de Gaucher . [186]
La producción y el almacenamiento de vacunas tienen un gran potencial en las plantas transgénicas. Las vacunas son caras de producir, transportar y administrar, por lo que tener un sistema que pudiera producirlas localmente permitiría un mayor acceso a las áreas más pobres y en desarrollo. [181] Además de purificar las vacunas expresadas en plantas, también es posible producir vacunas comestibles en plantas. Las vacunas comestibles estimulan el sistema inmunológico cuando se ingieren para proteger contra ciertas enfermedades. El almacenamiento en plantas reduce el costo a largo plazo, ya que se pueden diseminar sin la necesidad de almacenamiento en frío, no necesitan ser purificadas y tienen estabilidad a largo plazo. Además, estar alojadas dentro de células vegetales proporciona cierta protección contra los ácidos intestinales durante la digestión. Sin embargo, el costo de desarrollar, regular y contener plantas transgénicas es alto, lo que lleva a que la mayoría de los desarrollos actuales de vacunas basadas en plantas se apliquen a la medicina veterinaria , donde los controles no son tan estrictos. [187]
Los cultivos modificados genéticamente se han propuesto como una de las formas de reducir las emisiones de CO2 relacionadas con la agricultura debido a un mayor rendimiento, un menor uso de pesticidas, un menor uso de combustible para tractores y la siembra directa. Según un estudio de 2021, solo en la UE la adopción generalizada de cultivos modificados genéticamente reduciría las emisiones de gases de efecto invernadero en 33 millones de toneladas de CO2 equivalente o el 7,5% de las emisiones totales relacionadas con la agricultura. [188]
La gran mayoría de los animales modificados genéticamente se encuentran en la etapa de investigación y el número de animales próximos a ingresar al mercado sigue siendo pequeño. [189] En 2018, solo se aprobaron tres animales modificados genéticamente, todos en los EE. UU. Se diseñó una cabra y un pollo para producir medicamentos y se modificó un salmón para aumentar su propio crecimiento. [190] A pesar de las diferencias y dificultades para modificarlos, los objetivos finales son muy similares a los de las plantas. Los animales modificados genéticamente se crean con fines de investigación, producción de productos industriales o terapéuticos, usos agrícolas o para mejorar su salud. También existe un mercado para crear mascotas modificadas genéticamente. [191]

El proceso de ingeniería genética de mamíferos es lento, tedioso y costoso. Sin embargo, las nuevas tecnologías están haciendo que las modificaciones genéticas sean más fáciles y precisas. [192] Los primeros mamíferos transgénicos se produjeron inyectando ADN viral en embriones y luego implantándolos en hembras. [60] El embrión se desarrollaría y se esperaría que parte del material genético se incorporara a las células reproductivas. Luego, los investigadores tendrían que esperar hasta que el animal alcanzara la edad reproductiva y luego se examinaría a la descendencia para detectar la presencia del gen en cada célula. El desarrollo del sistema de edición genética CRISPR -Cas9 como una forma barata y rápida de modificar directamente las células germinales , redujo efectivamente a la mitad la cantidad de tiempo necesario para desarrollar mamíferos modificados genéticamente. [193]
Los mamíferos son los mejores modelos para las enfermedades humanas, lo que hace que los modificados genéticamente sean vitales para el descubrimiento y desarrollo de curas y tratamientos para muchas enfermedades graves. La eliminación de genes responsables de los trastornos genéticos humanos permite a los investigadores estudiar el mecanismo de la enfermedad y probar posibles curas. Los ratones modificados genéticamente han sido los mamíferos más comunes utilizados en la investigación biomédica , ya que son baratos y fáciles de manipular. Los cerdos también son un buen objetivo, ya que tienen un tamaño corporal y características anatómicas, fisiología , respuesta fisiopatológica y dieta similares. [194] Los primates no humanos son los organismos modelo más similares a los humanos, pero hay menos aceptación pública hacia su uso como animales de investigación. [195] En 2009, los científicos anunciaron que habían transferido con éxito un gen a una especie de primate ( titíes ) por primera vez. [196] [197] Su primer objetivo de investigación para estos titíes fue la enfermedad de Parkinson , pero también estaban considerando la esclerosis lateral amiotrófica y la enfermedad de Huntington . [198]
Las proteínas humanas expresadas en mamíferos tienen más probabilidades de ser similares a sus contrapartes naturales que las expresadas en plantas o microorganismos. Se ha logrado una expresión estable en ovejas, cerdos, ratas y otros animales. En 2009, se aprobó el primer fármaco biológico humano producido a partir de un animal de este tipo, una cabra . El fármaco, ATryn , es un anticoagulante que reduce la probabilidad de coágulos de sangre durante la cirugía o el parto y se extrae de la leche de cabra. [199] La alfa-1-antitripsina humana es otra proteína que se ha producido a partir de cabras y se utiliza en el tratamiento de humanos con esta deficiencia. [200] Otra área medicinal es la creación de cerdos con mayor capacidad para trasplantes de órganos humanos ( xenotrasplante ). Los cerdos han sido modificados genéticamente para que sus órganos ya no puedan transportar retrovirus [201] o tengan modificaciones para reducir la posibilidad de rechazo. [202] [203] Los cerdos quiméricos podrían llevar órganos completamente humanos. [194] [204] El primer trasplante humano de corazón de cerdo modificado genéticamente se produjo en 2023, [205] y de riñón en 2024. [206] [207]
El ganado se modifica con la intención de mejorar rasgos económicamente importantes como la tasa de crecimiento, la calidad de la carne, la composición de la leche, la resistencia a las enfermedades y la supervivencia. Los animales han sido modificados genéticamente para crecer más rápido, ser más saludables [208] y resistir las enfermedades. [209] Las modificaciones también han mejorado la producción de lana de las ovejas y la salud de las ubres de las vacas. [189] Las cabras han sido modificadas genéticamente para producir leche con fuertes proteínas de seda similares a las de una telaraña en su leche. [210] Un cerdo GM llamado Enviropig fue creado con la capacidad de digerir el fósforo de las plantas de manera más eficiente que los cerdos convencionales. [211] [212] Podrían reducir la contaminación del agua ya que excretan entre un 30 y un 70% menos de fósforo en el estiércol. [211] [213] Las vacas lecheras han sido modificadas genéticamente para producir leche que sería la misma que la leche materna humana. [214] Esto podría beneficiar potencialmente a las madres que no pueden producir leche materna pero quieren que sus hijos tomen leche materna en lugar de fórmula. [215] [216] Los investigadores también han desarrollado una vaca modificada genéticamente que produce leche libre de alergias. [217]

Los científicos han diseñado genéticamente varios organismos, incluidos algunos mamíferos, para incluir la proteína verde fluorescente (GFP), con fines de investigación. [218] La GFP y otros genes informantes similares permiten una fácil visualización y localización de los productos de la modificación genética. [219] Se han criado cerdos fluorescentes para estudiar trasplantes de órganos humanos, células fotorreceptoras oculares regenerativas y otros temas. [220] En 2011, se crearon gatos verdes fluorescentes para ayudar a encontrar terapias para el VIH/SIDA y otras enfermedades [221] ya que el virus de inmunodeficiencia felina está relacionado con el VIH . [222]
Se ha sugerido que la ingeniería genética podría utilizarse para recuperar animales de la extinción . Implica cambiar el genoma de un pariente vivo cercano para que se parezca al extinto y actualmente se está intentando con la paloma migratoria . [223] Se han añadido genes asociados con el mamut lanudo al genoma de un elefante africano , aunque el investigador principal dice que no tiene intención de crear elefantes vivos y que transferir todos los genes y revertir años de evolución genética está muy lejos de ser factible. [224] [225] Es más probable que los científicos puedan utilizar esta tecnología para conservar animales en peligro de extinción recuperando la diversidad perdida o transfiriendo ventajas genéticas evolucionadas de organismos adaptados a aquellos que están luchando. [226]
La terapia génica [227] utiliza virus modificados genéticamente para introducir genes que pueden curar enfermedades en humanos. Aunque la terapia génica es todavía relativamente nueva, ha tenido algunos éxitos. Se ha utilizado para tratar trastornos genéticos como la inmunodeficiencia combinada grave [228] y la amaurosis congénita de Leber [229] También se están desarrollando tratamientos para una serie de otras enfermedades actualmente incurables, como la fibrosis quística [230] , la anemia de células falciformes [231] , la enfermedad de Parkinson [232] [ 233] , el cáncer [234] [235] [236] , la diabetes [237] , las enfermedades cardíacas [238] y la distrofia muscular [239] Estos tratamientos solo afectan a las células somáticas , lo que significa que cualquier cambio no sería hereditario. La terapia génica de la línea germinal hace que cualquier cambio sea hereditario, lo que ha suscitado inquietudes en la comunidad científica [240] [241]
En 2015, se utilizó CRISPR para editar el ADN de embriones humanos no viables . [242] [243] En noviembre de 2018, He Jiankui anunció que había editado los genomas de dos embriones humanos, en un intento de desactivar el gen CCR5 , que codifica un receptor que el VIH usa para ingresar a las células. Dijo que las niñas gemelas, Lulu y Nana , habían nacido unas semanas antes y que portaban copias funcionales de CCR5 junto con CCR5 desactivado ( mosaicismo ) y aún eran vulnerables al VIH. El trabajo fue ampliamente condenado como poco ético, peligroso y prematuro. [244]
Los peces modificados genéticamente se utilizan para la investigación científica, como mascotas y como fuente de alimento. La acuicultura es una industria en crecimiento, que actualmente proporciona más de la mitad del pescado que se consume en todo el mundo. [246] Mediante la ingeniería genética es posible aumentar las tasas de crecimiento, reducir la ingesta de alimentos, eliminar propiedades alergénicas, aumentar la tolerancia al frío y proporcionar resistencia a las enfermedades. Los peces también pueden utilizarse para detectar la contaminación acuática o funcionar como biorreactores. [247]
Varios grupos han estado desarrollando peces cebra para detectar la contaminación mediante la unión de proteínas fluorescentes a genes activados por la presencia de contaminantes. Los peces brillarán y podrán usarse como sensores ambientales. [248] [249] El GloFish es una marca de pez cebra fluorescente modificado genéticamente con colores fluorescentes rojo, verde y naranja brillantes. Fue desarrollado originalmente por uno de los grupos para detectar la contaminación, pero ahora es parte del comercio de peces ornamentales, convirtiéndose en el primer animal modificado genéticamente en estar disponible públicamente como mascota cuando en 2003 se introdujo para la venta en los EE. UU. [250]
Los peces transgénicos se utilizan ampliamente en la investigación básica en genética y desarrollo. Dos especies de peces, el pez cebra y el medaka , son los más comúnmente modificados porque tienen coriones ópticamente transparentes (membranas en el huevo), se desarrollan rápidamente y el embrión unicelular es fácil de ver y microinyectar con ADN transgénico. [251] Los peces cebra son organismos modelo para procesos de desarrollo, regeneración , genética, comportamiento, mecanismos de enfermedades y pruebas de toxicidad. [252] Su transparencia permite a los investigadores observar etapas de desarrollo, funciones intestinales y crecimiento tumoral. [253] [254] La generación de protocolos transgénicos (organismo completo, específico de célula o tejido, marcado con genes reporteros) ha aumentado el nivel de información obtenida al estudiar estos peces. [255]
Se han desarrollado peces transgénicos con promotores que impulsan una sobreproducción de hormona de crecimiento para su uso en la industria de la acuicultura para aumentar la velocidad de desarrollo y potencialmente reducir la presión pesquera sobre las poblaciones silvestres. Esto ha dado como resultado una mejora espectacular del crecimiento en varias especies, incluido el salmón , [256] la trucha [257] y la tilapia . [258] AquaBounty Technologies , una empresa de biotecnología, ha producido un salmón (llamado salmón AquAdvantage ) que puede madurar en la mitad del tiempo que el salmón salvaje. [259] Obtuvo la aprobación regulatoria en 2015, el primer alimento transgénico no vegetal que se comercializa. [260] A partir de agosto de 2017, el salmón transgénico se vende en Canadá. [261] Las ventas en los EE. UU. comenzaron en mayo de 2021. [262]
En la investigación biológica, las moscas de la fruta transgénicas ( Drosophila melanogaster ) son organismos modelo utilizados para estudiar los efectos de los cambios genéticos en el desarrollo. [264] Las moscas de la fruta a menudo se prefieren sobre otros animales debido a su corto ciclo de vida y bajos requisitos de mantenimiento. También tienen un genoma relativamente simple en comparación con muchos vertebrados , con típicamente solo una copia de cada gen, lo que facilita el análisis fenotípico . [265] Drosophila se ha utilizado para estudiar la genética y la herencia, el desarrollo embrionario, el aprendizaje, el comportamiento y el envejecimiento. [266] El descubrimiento de transposones , en particular el elemento p , en Drosophila proporcionó un método temprano para agregar transgenes a su genoma, aunque esto ha sido asumido por técnicas de edición genética más modernas. [267]
Debido a su importancia para la salud humana, los científicos están buscando formas de controlar los mosquitos mediante ingeniería genética. Se han desarrollado mosquitos resistentes a la malaria en el laboratorio insertando un gen que reduce el desarrollo del parásito de la malaria [268] y luego usando endonucleasas homing para propagar rápidamente ese gen en toda la población masculina (conocido como impulsión genética ). [269] [270] Este enfoque se ha llevado más allá al usar la impulsión genética para propagar un gen letal. [271] [272] En los ensayos, las poblaciones de mosquitos Aedes aegypti , el portador más importante del dengue y el virus Zika, se redujeron entre un 80% y un 90%. [273] [274] [272] Otro enfoque es usar una técnica de insectos estériles , mediante la cual los machos genéticamente modificados para ser estériles compiten con los machos viables, para reducir las cifras de población. [275]
Otras plagas de insectos que son objetivos atractivos son las polillas . Las polillas de dorso de diamante causan daños de 4 a 5 mil millones de dólares cada año en todo el mundo. [276] El enfoque es similar a la técnica estéril probada en mosquitos, donde los machos se transforman con un gen que evita que las hembras nacidas alcancen la madurez. [277] Se sometieron a pruebas de campo en 2017. [276] Anteriormente, se han liberado polillas genéticamente modificadas en pruebas de campo. [278] En este caso, una cepa de gusano rosado que se esterilizó con radiación se modificó genéticamente para expresar una proteína fluorescente roja, lo que facilita a los investigadores su monitoreo. [279]
El gusano de seda, la etapa larvaria de Bombyx mori , es un insecto económicamente importante en la sericultura . Los científicos están desarrollando estrategias para mejorar la calidad y cantidad de la seda. También existe el potencial de utilizar la maquinaria productora de seda para producir otras proteínas valiosas. [280] Las proteínas desarrolladas actualmente para ser expresadas por gusanos de seda incluyen; albúmina sérica humana , cadena α de colágeno humano , anticuerpo monoclonal de ratón y N-glicanasa . [281] Se han creado gusanos de seda que producen seda de araña , una seda más fuerte pero extremadamente difícil de cosechar, [282] e incluso sedas novedosas. [283]

Se han desarrollado sistemas para crear organismos transgénicos en una amplia variedad de otros animales. Los pollos han sido modificados genéticamente para una variedad de propósitos. Esto incluye estudiar el desarrollo del embrión , [284] prevenir la transmisión de la gripe aviar [285] y proporcionar conocimientos evolutivos utilizando ingeniería inversa para recrear fenotipos similares a los de los dinosaurios. [286] Un pollo GM que produce el fármaco Kanuma , una enzima que trata una enfermedad rara, en su huevo pasó la aprobación regulatoria de EE. UU. en 2015. [287] Las ranas genéticamente modificadas, en particular Xenopus laevis y Xenopus tropicalis , se utilizan en la investigación de biología del desarrollo . Las ranas GM también se pueden utilizar como sensores de contaminación, especialmente para sustancias químicas disruptoras endocrinas . [288] Hay propuestas para utilizar la ingeniería genética para controlar los sapos de caña en Australia . [289] [290]
El nematodo Caenorhabditis elegans es uno de los principales organismos modelo para la investigación de la biología molecular . [291] La interferencia de ARN (ARNi) se descubrió en C. elegans [292] y podría inducirse simplemente alimentándolos con bacterias modificadas para expresar ARN de doble cadena . [293] También es relativamente fácil producir nematodos transgénicos estables y esto junto con el ARNi son las principales herramientas utilizadas para estudiar sus genes. [294] El uso más común de los nematodos transgénicos ha sido estudiar la expresión y localización de genes mediante la unión de genes reporteros. Los transgenes también se pueden combinar con técnicas de ARNi para rescatar fenotipos, estudiar la función de los genes, obtener imágenes del desarrollo celular en tiempo real o controlar la expresión de diferentes tejidos o etapas de desarrollo. [294] Los nematodos transgénicos se han utilizado para estudiar virus, [295] toxicología, [296] enfermedades, [297] [298] y para detectar contaminantes ambientales. [299]
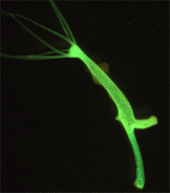
El gen responsable del albinismo en los pepinos de mar ha sido encontrado y utilizado para diseñar pepinos de mar blancos , un manjar poco común. La tecnología también abre el camino para investigar los genes responsables de algunos de los rasgos más inusuales de los pepinos, incluida la hibernación en verano, la evisceración de sus intestinos y la disolución de sus cuerpos al morir. [300] Los platelmintos tienen la capacidad de regenerarse a partir de una sola célula. [301] Hasta 2017 no había una forma efectiva de transformarlos, lo que obstaculizaba la investigación. Mediante el uso de microinyección y radiación, los científicos ahora han creado los primeros platelmintos modificados genéticamente. [302] El gusano de cerdas , un anélido marino , ha sido modificado. Es de interés debido a que su ciclo reproductivo está sincronizado con las fases lunares, la capacidad de regeneración y la lenta tasa de evolución. [303] Los cnidarios como la hidra y la anémona de mar Nematostella vectensis son organismos modelo atractivos para estudiar la evolución de la inmunidad y ciertos procesos de desarrollo. [304] Otros animales que han sido modificados genéticamente incluyen caracoles , [305] gecos , tortugas , [306] cangrejos de río , ostras , camarones , almejas , abulones [307] y esponjas . [308]
Los organismos modificados genéticamente están regulados por organismos gubernamentales. Esto se aplica tanto a la investigación como a la liberación de organismos modificados genéticamente, incluidos los cultivos y los alimentos. El desarrollo de un marco regulatorio sobre la ingeniería genética comenzó en 1975, en Asilomar , California. La reunión de Asilomar recomendó un conjunto de directrices sobre el uso cauteloso de la tecnología recombinante y de cualquier producto resultante de esa tecnología. [309] El Protocolo de Cartagena sobre Seguridad de la Biotecnología fue adoptado el 29 de enero de 2000 y entró en vigor el 11 de septiembre de 2003. [310] Es un tratado internacional que rige la transferencia, manipulación y uso de organismos modificados genéticamente. [311] Ciento cincuenta y siete países son miembros del Protocolo y muchos lo utilizan como punto de referencia para sus propias regulaciones. [312]
Las universidades y los institutos de investigación suelen contar con un comité especial que se encarga de aprobar cualquier experimento que implique ingeniería genética. Muchos experimentos también necesitan el permiso de un grupo regulador nacional o de la legislación. Todo el personal debe estar capacitado en el uso de OGM y todos los laboratorios deben obtener la aprobación de su agencia reguladora para trabajar con OGM. [313] La legislación que cubre los OGM a menudo se deriva de las regulaciones y directrices vigentes para la versión no OGM del organismo, aunque son más severas. [314] Existe un sistema casi universal para evaluar los riesgos relativos asociados con los OGM y otros agentes para el personal de laboratorio y la comunidad. Se les asigna una de cuatro categorías de riesgo en función de su virulencia, la gravedad de la enfermedad, el modo de transmisión y la disponibilidad de medidas preventivas o tratamientos. Hay cuatro niveles de bioseguridad en los que puede caer un laboratorio, que van desde el nivel 1 (que es adecuado para trabajar con agentes no asociados con enfermedades) hasta el nivel 4 (trabajar con agentes potencialmente mortales). Distintos países utilizan una nomenclatura diferente para describir los niveles y pueden tener distintos requisitos sobre lo que se puede hacer en cada nivel. [314]


Existen diferencias en la regulación de la liberación de OGM entre países, y algunas de las diferencias más marcadas se dan entre los Estados Unidos y Europa. [315] La regulación varía en un país determinado dependiendo del uso previsto de los productos de la ingeniería genética. Por ejemplo, un cultivo no destinado a uso alimentario generalmente no es revisado por las autoridades responsables de la seguridad alimentaria. [316] Algunas naciones han prohibido la liberación de OGM o restringido su uso, y otras los permiten con grados de regulación muy diferentes. [317] [318] [319] [320] En 2016, treinta y ocho países prohíben oficialmente el cultivo de OGM y nueve (Argelia, Bután, Kenia, Kirguistán, Madagascar, Perú, Rusia, Venezuela y Zimbabue) prohíben su importación. [321] La mayoría de los países que no permiten el cultivo de OGM permiten la investigación con OGM. [322] A pesar de la regulación, a veces se han producido liberaciones ilegales, debido a la debilidad de la aplicación. [8]
La Unión Europea (UE) diferencia entre la aprobación para el cultivo dentro de la UE y la aprobación para la importación y el procesamiento. [323] Mientras que sólo unos pocos OGM han sido aprobados para el cultivo en la UE, varios OGM han sido aprobados para la importación y el procesamiento. [324] El cultivo de OGM ha desencadenado un debate sobre el mercado de OGM en Europa. [325] Dependiendo de las regulaciones de coexistencia, los incentivos para el cultivo de cultivos GM difieren. [326] La política de EE.UU. no se centra en el proceso tanto como otros países, mira los riesgos científicos verificables y utiliza el concepto de equivalencia sustancial . [327] Se debate si los organismos editados genéticamente deben ser regulados de la misma manera que los organismos modificados genéticamente. Las regulaciones de EE.UU. los ven como separados y no los regulan bajo las mismas condiciones, mientras que en Europa un OGM es cualquier organismo creado utilizando técnicas de ingeniería genética. [28]
Una de las cuestiones clave que preocupa a los reguladores es si los productos transgénicos deben estar etiquetados. La Comisión Europea dice que el etiquetado y la trazabilidad obligatorios son necesarios para permitir una elección informada, evitar una posible publicidad engañosa [328] y facilitar la retirada de productos si se descubren efectos adversos para la salud o el medio ambiente [329] . La Asociación Médica Estadounidense [330] y la Asociación Estadounidense para el Avance de la Ciencia [331] dicen que, en ausencia de evidencia científica de daño, incluso el etiquetado voluntario es engañoso y alarmará falsamente a los consumidores. El etiquetado de los productos transgénicos en el mercado es obligatorio en 64 países [332] . El etiquetado puede ser obligatorio hasta un nivel umbral de contenido de transgénicos (que varía entre países) o voluntario. En los EE. UU., la Norma Nacional de Divulgación de Alimentos Bioingeniería (Fecha de Cumplimiento Obligatorio: 1 de enero de 2022) requiere el etiquetado de los alimentos transgénicos. [333] En Canadá, el etiquetado de alimentos transgénicos es voluntario, [334] mientras que en Europa todos los alimentos (incluidos los alimentos procesados ) o piensos que contengan más del 0,9% de OGM aprobados deben estar etiquetados. [335] En 2014, las ventas de productos que habían sido etiquetados como no transgénicos crecieron un 30 por ciento a 1.100 millones de dólares. [336]
Existe controversia sobre los OGM, especialmente con respecto a su liberación fuera de los entornos de laboratorio. La disputa involucra a consumidores, productores, compañías de biotecnología, reguladores gubernamentales, organizaciones no gubernamentales y científicos. Muchas de estas preocupaciones involucran cultivos OGM y si los alimentos producidos a partir de ellos son seguros y qué impacto tendrá su cultivo en el medio ambiente. Estas controversias han llevado a litigios, disputas comerciales internacionales y protestas, y a una regulación restrictiva de productos comerciales en algunos países. [337] La mayoría de las preocupaciones giran en torno a los efectos de los OGM en la salud y el medio ambiente. Estos incluyen si pueden provocar una reacción alérgica , si los transgenes podrían transferirse a células humanas y si los genes no aprobados para el consumo humano podrían cruzarse con el suministro de alimentos . [338]

Existe un consenso científico [339] [340] [341] [342] de que los alimentos actualmente disponibles derivados de cultivos transgénicos no plantean un riesgo mayor para la salud humana que los alimentos convencionales, [343] [344] [345] [346] [347] pero que cada alimento transgénico debe probarse caso por caso antes de su introducción. [348] [349] [350] No obstante, los miembros del público tienen muchas menos probabilidades que los científicos de percibir los alimentos transgénicos como seguros. [351] [352] [353] [354] El estatus legal y regulatorio de los alimentos transgénicos varía según el país, ya que algunas naciones los prohíben o restringen, y otras los permiten con grados de regulación muy diferentes. [355] [356] [357] [358]
Hasta la década de 1990, se pensaba que el flujo de genes hacia poblaciones silvestres era poco probable y raro, y si ocurriera, fácilmente erradicable. Se pensaba que esto no agregaría costos o riesgos ambientales adicionales: no se esperaban efectos distintos a los ya causados por las aplicaciones de pesticidas. [359] Sin embargo, en las décadas posteriores, se han observado varios ejemplos de este tipo. El flujo de genes entre cultivos GM y plantas compatibles, junto con el aumento del uso de herbicidas de amplio espectro , [360] puede aumentar el riesgo de poblaciones de malezas resistentes a los herbicidas . [361] El debate sobre el alcance y las consecuencias del flujo de genes se intensificó en 2001 cuando se publicó un artículo que mostraba que se habían encontrado transgenes en el maíz de raza local en México, el centro de diversidad del cultivo . [362] [363] Se ha descubierto que el flujo de genes de cultivos GM a otros organismos es generalmente menor de lo que ocurriría naturalmente. [364] Para abordar algunas de estas preocupaciones, se han desarrollado algunos OGM con rasgos que ayudan a controlar su propagación. Para evitar que el salmón modificado genéticamente se reproduzca inadvertidamente con el salmón salvaje, todos los peces criados para alimentación son hembras, triploides , el 99% son reproductivamente estériles y se crían en zonas donde el salmón escapado no podría sobrevivir. [365] [366] También se han modificado bacterias para que dependan de nutrientes que no se pueden encontrar en la naturaleza, [367] y se ha desarrollado una tecnología de restricción de uso genético , aunque todavía no se ha comercializado, que hace que la segunda generación de plantas GM sea estéril. [368]
Otras preocupaciones ambientales y agronómicas incluyen una disminución en la biodiversidad, un aumento en plagas secundarias (plagas no objetivo) y la evolución de plagas de insectos resistentes. [369] [370] [371] En las áreas de China y los EE. UU. con cultivos Bt, la biodiversidad general de insectos ha aumentado y el impacto de las plagas secundarias ha sido mínimo. [372] Se encontró que la resistencia evolucionaba lentamente cuando se seguían las mejores estrategias prácticas. [372] El impacto de los cultivos Bt en organismos beneficiosos no objetivo se convirtió en un problema público después de que un artículo de 1999 sugiriera que podrían ser tóxicos para las mariposas monarca . Estudios de seguimiento desde entonces han demostrado que los niveles de toxicidad encontrados en el campo no fueron lo suficientemente altos como para dañar a las larvas. [373]
Desde el principio se han atribuido a esta tecnología acusaciones de que los científicos están " jugando a ser Dios " y otras cuestiones religiosas . [374] Ahora que es posible manipular genéticamente a los seres humanos, existen preocupaciones éticas sobre hasta dónde debería llegar esta tecnología o si debería utilizarse en absoluto. [375] Hay mucho debate sobre dónde está la línea entre el tratamiento y la mejora y si las modificaciones deberían ser hereditarias. [376] Otras preocupaciones incluyen la contaminación del suministro de alimentos no modificados genéticamente, [377] [378] el rigor del proceso regulatorio, [379] [380] la consolidación del control del suministro de alimentos en las empresas que fabrican y venden OGM, [381] la exageración de los beneficios de la modificación genética, [382] o las preocupaciones sobre el uso de herbicidas con glifosato . [383] Otras cuestiones planteadas incluyen la patentación de la vida [384] y el uso de los derechos de propiedad intelectual . [385]
Existen grandes diferencias en la aceptación de los OGM por parte de los consumidores, y los europeos tienen más probabilidades de ver los alimentos OGM de forma negativa que los norteamericanos. [386] Los OGM aparecieron en escena cuando la confianza pública en la seguridad alimentaria, atribuida a recientes alarmas alimentarias como la encefalopatía espongiforme bovina y otros escándalos relacionados con la regulación gubernamental de productos en Europa, era baja. [387] Esto, junto con las campañas llevadas a cabo por varias organizaciones no gubernamentales (ONG), han tenido mucho éxito en bloquear o limitar el uso de cultivos OGM. [388] ONG como la Asociación de Consumidores Orgánicos , la Unión de Científicos Preocupados , [389] [390] [391] Greenpeace y otros grupos han dicho que los riesgos no se han identificado ni gestionado adecuadamente [392] y que hay preguntas sin respuesta sobre el posible impacto a largo plazo en la salud humana de los alimentos derivados de OGM. Proponen un etiquetado obligatorio [393] [394] o una moratoria sobre dichos productos. [381] [379] [395]
{{cite journal}}: CS1 maint: DOI inactive as of August 2024 (link)Un cultivo existente, el 'arroz dorado' genéticamente modificado que produce vitamina A, ya es muy prometedor para reducir la ceguera y el enanismo que resultan de una dieta deficiente en vitamina A.
{{cite journal}}: CS1 maint: DOI inactive as of April 2024 (link)El etiquetado debe incluir información objetiva que indique que un alimento o pienso está compuesto por, contiene o ha sido producido a partir de OMG. Un etiquetado claro, independientemente de la detectabilidad del ADN o la proteína resultante de la modificación genética en el producto final, satisface las demandas expresadas en numerosas encuestas por una gran mayoría de consumidores, facilita la elección informada y evita posibles engaños a los consumidores en lo que respecta a los métodos de fabricación o producción.
(3) Los requisitos de trazabilidad de los OMG deben facilitar tanto la retirada de productos cuando se establezcan efectos adversos imprevistos para la salud humana, la salud animal o el medio ambiente, incluidos los ecosistemas, como la orientación del seguimiento para examinar los posibles efectos, en particular, sobre el medio ambiente. La trazabilidad también debe facilitar la aplicación de medidas de gestión del riesgo de conformidad con el principio de precaución. (4) Deben establecerse requisitos de trazabilidad para los alimentos y piensos producidos a partir de OMG con el fin de facilitar el etiquetado preciso de dichos productos.
Hemos revisado la literatura científica sobre la seguridad de los cultivos modificados genéticamente durante los últimos 10 años que refleja el consenso científico madurado desde que las plantas modificadas genéticamente se cultivaron ampliamente en todo el mundo, y podemos concluir que la investigación científica realizada hasta ahora no ha detectado ningún peligro significativo directamente relacionado con el uso de cultivos modificados genéticamente.
La literatura sobre la biodiversidad y el consumo de alimentos/piensos modificados genéticamente a veces ha dado lugar a un debate animado sobre la idoneidad de los diseños experimentales, la elección de los métodos estadísticos o la accesibilidad pública de los datos. Este debate, aunque positivo y parte del proceso natural de revisión por parte de la comunidad científica, ha sido frecuentemente distorsionado por los medios y a menudo utilizado políticamente e inapropiadamente en campañas contra los cultivos transgénicos.
Los cultivos transgénicos actualmente disponibles y los alimentos derivados de ellos han sido considerados seguros para el consumo y los métodos utilizados para comprobar su seguridad se han considerado apropiados. Estas conclusiones representan el consenso de la evidencia científica examinada por el ICSU (2003) y son coherentes con las opiniones de la Organización Mundial de la Salud (OMS, 2002). Varias autoridades reguladoras nacionales (entre otras, Argentina, Brasil, Canadá, China, el Reino Unido y los Estados Unidos) han evaluado estos alimentos en cuanto a los mayores riesgos para la salud humana utilizando sus procedimientos nacionales de seguridad alimentaria (ICSU). Hasta la fecha, no se han descubierto efectos tóxicos o nutricionalmente perjudiciales verificables derivados del consumo de alimentos derivados de cultivos modificados genéticamente en ningún lugar del mundo (Panel de Revisión Científica de GM). Muchos millones de personas han consumido alimentos derivados de plantas transgénicas (principalmente maíz, soja y colza) sin que se haya observado ningún efecto adverso (ICSU).
Existe un amplio consenso científico sobre que los cultivos genéticamente modificados que se encuentran actualmente en el mercado son seguros para el consumo. Después de 14 años de cultivo y un total acumulado de 2 mil millones de acres plantados, no se han producido efectos adversos para la salud o el medio ambiente a raíz de la comercialización de cultivos genéticamente modificados (Junta de Agricultura y Recursos Naturales, Comité de Impactos Ambientales Asociados con la Comercialización de Plantas Transgénicas, Consejo Nacional de Investigación y División de Estudios de la Tierra y la Vida 2002). Tanto el Consejo Nacional de Investigación de los Estados Unidos como el Centro Común de Investigación (el laboratorio de investigación científica y técnica de la Unión Europea y parte integrante de la Comisión Europea) han llegado a la conclusión de que existe un amplio conjunto de conocimientos que abordan adecuadamente la cuestión de la seguridad alimentaria de los cultivos genéticamente modificados (Comité para la identificación y evaluación de los efectos no deseados de los alimentos genéticamente modificados en la salud humana y el Consejo Nacional de Investigación, 2004; Centro Común de Investigación de la Comisión Europea, 2008). Estos y otros informes recientes concluyen que los procesos de ingeniería genética y de mejoramiento convencional no son diferentes en términos de consecuencias no deseadas para la salud humana y el medio ambiente (Dirección General de Investigación e Innovación de la Comisión Europea, 2010).
A pesar de ello, el número de estudios centrados específicamente en la evaluación de la seguridad de las plantas modificadas genéticamente es todavía limitado. Sin embargo, es importante destacar que por primera vez se observó un cierto equilibrio entre el número de grupos de investigación que sugieren, con base en sus estudios, que algunas variedades de productos transgénicos (principalmente maíz y soja) son tan seguras y nutritivas como las respectivas plantas convencionales no transgénicas, y aquellos que aún plantean serias preocupaciones. Además, vale la pena mencionar que la mayoría de los estudios que demuestran que los alimentos transgénicos son tan nutritivos y seguros como los obtenidos mediante el mejoramiento convencional han sido realizados por empresas de biotecnología o asociadas, que también son responsables de la comercialización de estas plantas transgénicas. De todos modos, esto representa un avance notable en comparación con la falta de estudios publicados en los últimos años en revistas científicas por dichas empresas.
Comencé este artículo con los testimonios de científicos respetados que afirman que literalmente no existe controversia científica sobre los efectos de los OGM en la salud. Mi investigación de la literatura científica cuenta otra historia.
Y contraste:
Aquí, mostramos que una serie de artículos, algunos de los cuales han influido fuerte y negativamente en la opinión pública sobre los cultivos transgénicos e incluso han provocado acciones políticas, como el embargo de OGM, comparten fallas comunes en la evaluación estadística de los datos. Habiendo tenido en cuenta estas fallas, concluimos que los datos presentados en estos artículos no proporcionan ninguna evidencia sustancial de daño de OGM.
Los artículos presentados que sugieren el posible daño de los OGM recibieron una gran atención pública. Sin embargo, a pesar de sus afirmaciones, en realidad debilitan la evidencia sobre los daños y la falta de equivalencia sustancial de los OGM estudiados. Destacamos que, con más de 1783 artículos publicados sobre OGM en los últimos 10 años, es de esperar que algunos de ellos hayan informado sobre diferencias no deseadas entre los OGM y los cultivos convencionales, incluso si tales diferencias no existen en la realidad.
Por lo tanto, no es sorprendente que los esfuerzos para exigir el etiquetado y prohibir los OGM hayan sido un problema político creciente en los EE. UU. (citando a Domingo y Bordonaba, 2011) . En general, un amplio consenso científico sostiene que los alimentos transgénicos comercializados actualmente no plantean un riesgo mayor que los alimentos convencionales ... Las principales asociaciones científicas y médicas nacionales e internacionales han declarado que hasta la fecha no se han informado ni corroborado efectos adversos para la salud humana relacionados con los alimentos transgénicos en la literatura revisada por pares.
A pesar de las diversas preocupaciones, hoy en día, la Asociación Estadounidense para el Avance de la Ciencia, la Organización Mundial de la Salud y muchas organizaciones científicas internacionales independientes coinciden en que los OGM son tan seguros como otros alimentos. En comparación con las técnicas de cultivo convencionales, la ingeniería genética es mucho más precisa y, en la mayoría de los casos, es menos probable que genere un resultado inesperado.
La UE, por ejemplo, ha invertido más de 300 millones de euros en investigaciones sobre la bioseguridad de los OGM. Su reciente informe afirma: "La principal conclusión que se puede extraer de los esfuerzos de más de 130 proyectos de investigación, que abarcan un período de más de 25 años de investigación y en los que han participado más de 500 grupos de investigación independientes, es que la biotecnología, y en particular los OGM, no son per se más riesgosos que, por ejemplo, las tecnologías convencionales de cultivo de plantas". La Organización Mundial de la Salud, la Asociación Médica Estadounidense, la Academia Nacional de Ciencias de los Estados Unidos, la Royal Society británica y todas las demás organizaciones respetadas que han examinado las pruebas han llegado a la misma conclusión: consumir alimentos que contienen ingredientes derivados de cultivos transgénicos no es más riesgoso que consumir los mismos alimentos que contienen ingredientes de plantas de cultivo modificadas mediante técnicas convencionales de mejora vegetal.
Un informe emitido por el consejo científico de la Asociación Médica Estadounidense (AMA) dice que no se han detectado efectos a largo plazo para la salud por el uso de cultivos transgénicos y alimentos modificados genéticamente y que estos alimentos son sustancialmente equivalentes a sus contrapartes convencionales. ... Los cultivos y alimentos producidos mediante técnicas de ADN recombinante han estado disponibles durante menos de 10 años y hasta la fecha no se han detectado efectos a largo plazo. Estos alimentos son sustancialmente equivalentes a sus contrapartes convencionales.
Los alimentos obtenidos mediante bioingeniería se han consumido durante casi 20 años y, durante ese tiempo, no se han informado ni comprobado consecuencias evidentes para la salud humana en la literatura revisada por pares.
han publicado estudios o declaraciones sobre la seguridad de los OGM que indican que no hay evidencia de que los OGM presenten riesgos de seguridad únicos en comparación con los productos criados de manera convencional. Estos incluyen el Consejo Nacional de Investigación, la Asociación Estadounidense para el Avance de la Ciencia y la Asociación Médica Estadounidense. Los grupos en los EE. UU. que se oponen a los OGM incluyen algunas organizaciones ambientalistas, organizaciones de agricultura orgánica y organizaciones de consumidores. Un número sustancial de académicos legales han criticado el enfoque de los EE. UU. para regular los OGM.
Hallazgo general sobre los supuestos efectos adversos para la salud humana de los alimentos derivados de cultivos transgénicos: sobre la base de un examen detallado de las comparaciones de alimentos transgénicos comercializados actualmente con alimentos no transgénicos en análisis de composición, pruebas de toxicidad animal aguda y crónica, datos a largo plazo sobre la salud del ganado alimentado con alimentos transgénicos y datos epidemiológicos humanos, el comité no encontró diferencias que impliquen un mayor riesgo para la salud humana de los alimentos transgénicos que de sus contrapartes no transgénicas.
{{cite book}}: CS1 maint: multiple names: authors list (link)Los diferentes organismos modificados genéticamente incluyen diferentes genes insertados de distintas maneras. Esto significa que los alimentos modificados genéticamente individuales y su seguridad deben evaluarse caso por caso y que no es posible hacer declaraciones generales sobre la seguridad de todos los alimentos modificados genéticamente.
Los alimentos modificados genéticamente actualmente disponibles en el mercado internacional han pasado las evaluaciones de seguridad y no es probable que presenten riesgos para la salud humana. Además, no se han demostrado efectos sobre la salud humana como resultado del consumo de dichos alimentos por la población en general en los países donde han sido aprobados. La aplicación continua de evaluaciones de seguridad basadas en los principios del Codex Alimentarius y, cuando corresponda, un seguimiento posterior a la comercialización adecuado, deben formar la base para garantizar la seguridad de los alimentos modificados genéticamente.
Estos principios dictan una evaluación previa a la comercialización caso por caso que incluye una evaluación de los efectos directos y no deseados.
En nuestra opinión, el potencial de que los alimentos modificados genéticamente causen efectos nocivos para la salud es muy pequeño y muchas de las preocupaciones expresadas se aplican con igual vigor a los alimentos de origen convencional. Sin embargo, las preocupaciones de seguridad no pueden, por ahora, descartarse por completo sobre la base de la información actualmente disponible.
Cuando se busca optimizar el equilibrio entre beneficios y riesgos, es prudente pecar de cauteloso y, sobre todo, aprender de la acumulación de conocimientos y experiencia. Cualquier nueva tecnología, como la modificación genética, debe examinarse para determinar los posibles beneficios y riesgos para la salud humana y el medio ambiente. Como ocurre con todos los alimentos nuevos, las evaluaciones de seguridad en relación con los alimentos modificados genéticamente deben realizarse caso por caso.
Los miembros del proyecto del jurado de modificación genética fueron informados sobre varios aspectos de la modificación genética por un grupo diverso de expertos reconocidos en los temas relevantes. El jurado sobre los cultivos transgénicos llegó a la conclusión de que se debería detener la venta de alimentos transgénicos actualmente disponibles y que se debería mantener la moratoria sobre el crecimiento comercial de cultivos transgénicos. Estas conclusiones se basaron en el principio de precaución y en la falta de pruebas de que existan beneficios. El jurado expresó su preocupación por el impacto de los cultivos transgénicos en la agricultura, el medio ambiente, la seguridad alimentaria y otros posibles efectos sobre la salud.
La revisión de la Royal Society (2002) concluyó que los riesgos para la salud humana asociados con el uso de secuencias específicas de ADN viral en plantas transgénicas son insignificantes y, si bien pidió cautela en la introducción de alérgenos potenciales en los cultivos alimentarios, destacó la ausencia de pruebas de que los alimentos transgénicos disponibles comercialmente causen manifestaciones alérgicas clínicas. La BMA comparte la opinión de que no hay pruebas sólidas que demuestren que los alimentos transgénicos son inseguros, pero respaldamos el llamamiento a que se realicen más investigaciones y vigilancia para proporcionar pruebas convincentes de su seguridad y sus beneficios.
Las mayores diferencias entre el público y los científicos de la AAAS se encuentran en las creencias sobre la seguridad de comer alimentos genéticamente modificados (GM). Casi nueve de cada diez (88%) científicos dicen que, en general, es seguro comer alimentos GM, en comparación con el 37% del público en general, una diferencia de 51 puntos porcentuales.
A fines de la década de 1990, la conciencia pública sobre los alimentos transgénicos alcanzó un nivel crítico y surgieron varios grupos de interés público que se centraron en el tema. Uno de los primeros grupos que se centró en el tema fue Mothers for Natural Law ('MFNL'), una organización con sede en Iowa que tenía como objetivo prohibir los alimentos transgénicos del mercado. ... La Unión de Científicos Preocupados ('UCS'), una alianza de 50.000 ciudadanos y científicos, ha sido otra voz destacada en el tema. ... A medida que el ritmo de los productos transgénicos que ingresaban al mercado aumentó en la década de 1990, la UCS se convirtió en una crítica vocal de lo que veía como la colusión de la agencia con la industria y el fracaso a la hora de tener plenamente en cuenta la alergenicidad y otras cuestiones de seguridad.