Un impulso genético es un proceso natural [1] y una tecnología de ingeniería genética que propaga un conjunto particular de genes en una población [2] alterando la probabilidad de que un alelo específico se transmita a la descendencia (en lugar de la probabilidad mendeliana del 50% ). Los impulsos genéticos pueden surgir a través de una variedad de mecanismos. [3] [4] Se ha propuesto que proporcionan un medio eficaz para modificar genéticamente poblaciones específicas y especies enteras.
La técnica puede emplear la adición, eliminación, alteración o modificación de genes. [5] [6]
Las aplicaciones propuestas incluyen el exterminio de insectos portadores de patógenos (en particular, mosquitos que transmiten patógenos de malaria , dengue y zika ), el control de especies invasoras o la eliminación de la resistencia a herbicidas o pesticidas . [7] [5] [8] [9]
Como sucede con cualquier técnica potencialmente poderosa, los impulsores genéticos pueden utilizarse de forma indebida de diversas maneras o inducir consecuencias no deseadas . Por ejemplo, un impulsor genético destinado a afectar sólo a una población local podría propagarse a toda una especie. Los impulsores genéticos que erradican poblaciones de especies invasoras en sus hábitats no nativos pueden tener consecuencias para la población de la especie en su conjunto, incluso en su hábitat nativo. Cualquier retorno accidental de individuos de la especie a sus hábitats originales, mediante migración natural, alteración ambiental (tormentas, inundaciones, etc.), transporte humano accidental o reubicación intencionada, podría conducir involuntariamente a la especie a la extinción si los individuos reubicados portaran impulsores genéticos dañinos. [10]
Las unidades genéticas se pueden construir a partir de muchos elementos genéticos egoístas que ocurren naturalmente y que utilizan una variedad de mecanismos moleculares. [3] Estos mecanismos que ocurren naturalmente inducen una distorsión de la segregación similar en la naturaleza, que surge cuando los alelos desarrollan mecanismos moleculares que les dan una probabilidad de transmisión mayor que el 50% normal.
La mayoría de las unidades genéticas se han desarrollado en insectos, en particular mosquitos, como una forma de controlar los patógenos transmitidos por insectos. Los desarrollos recientes diseñaron unidades genéticas directamente en virus, en particular los herpesvirus . Estas unidades genéticas virales pueden propagar una modificación en la población de virus y tienen como objetivo reducir la infectividad del virus. [11] [12]
En las especies que se reproducen sexualmente , la mayoría de los genes están presentes en dos copias (que pueden ser el mismo alelo o alelos diferentes ), y cada una de ellas tiene un 50 % de posibilidades de transmitirse a un descendiente. Al sesgar la herencia de genes alterados particulares, las unidades genéticas sintéticas podrían propagar alteraciones de manera más eficaz en una población. [5] [6]
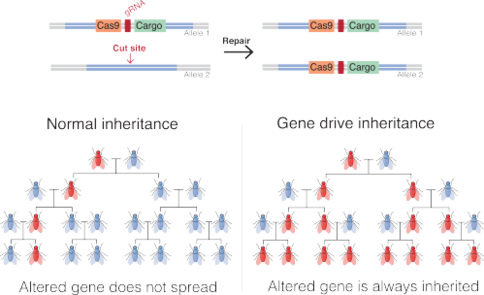
Por lo general, los científicos insertan la unidad genética en el ADN de un organismo junto con la maquinaria CRISPR-Cas9. Cuando el organismo modificado se aparea y su ADN se mezcla con el de su pareja, la herramienta CRISPR-Cas9 corta el ADN de la pareja en el mismo lugar donde se encuentra la unidad genética en el primer organismo. La célula repara el ADN cortado copiando la unidad genética del primer organismo en el lugar correspondiente en el ADN de la descendencia. Esto significa que ambas copias del gen (una de cada progenitor) ahora contienen la unidad genética.

A nivel molecular, una unidad genética endonucleasa funciona cortando un cromosoma en un sitio específico que no codifica la unidad, induciendo a la célula a reparar el daño copiando la secuencia de la unidad en el cromosoma dañado. La célula entonces tiene dos copias de la secuencia de la unidad. El método deriva de técnicas de edición genómica y se basa en la recombinación homóloga . Para lograr este comportamiento, las unidades genéticas endonucleasas constan de dos elementos anidados:
Como resultado, la inserción del gen impulsor en el genoma se repetirá en cada organismo que herede una copia de la modificación y una copia del gen de tipo salvaje. Si el gen impulsor ya está presente en el óvulo (por ejemplo, cuando se recibe de uno de los progenitores), todos los gametos del individuo portarán el gen impulsor (en lugar del 50% en el caso de un gen normal). [5]
Dado que nunca puede duplicar su frecuencia en cada generación, una unidad genética introducida en un solo individuo normalmente requiere docenas de generaciones para afectar a una fracción sustancial de una población. Alternativamente, la liberación de organismos que contienen la unidad en cantidades suficientes puede afectar al resto en unas pocas generaciones; por ejemplo, al introducirla en cada milésimo individuo, solo se necesitan de 12 a 15 generaciones para estar presente en todos los individuos. [16] Si una unidad genética finalmente se fijará en una población y a qué velocidad depende de su efecto sobre la aptitud individual, de la tasa de conversión de alelos y de la estructura de la población. En una población bien mezclada y con frecuencias de conversión de alelos realistas (≈90%), la genética de poblaciones predice que las unidades genéticas se fijan para un coeficiente de selección menor de 0,3; [16] en otras palabras, las unidades genéticas se pueden utilizar para difundir modificaciones siempre que el éxito reproductivo no se reduzca en más del 30%. Esto contrasta con los genes normales, que solo pueden difundirse en poblaciones grandes si aumentan la aptitud.
Debido a que la estrategia generalmente se basa en la presencia simultánea de un alelo no modificado y un alelo de impulsión genética en el mismo núcleo celular , generalmente se había asumido que una impulsión genética solo podía diseñarse en organismos de reproducción sexual, excluyendo bacterias y virus . Sin embargo, durante una infección viral , los virus pueden acumular cientos o miles de copias del genoma en las células infectadas. Las células son frecuentemente coinfectadas por múltiples viriones y la recombinación entre genomas virales es una fuente bien conocida y extendida de diversidad para muchos virus. En particular, los herpesvirus son virus de ADN de replicación nuclear con grandes genomas de ADN de doble cadena y con frecuencia experimentan recombinación homóloga durante su ciclo de replicación.
Estas propiedades han permitido diseñar una estrategia de impulso genético que no implica reproducción sexual, sino que se basa en la coinfección de una célula dada por un virus natural y otro modificado. Tras la coinfección, el genoma no modificado se corta y se repara mediante recombinación homóloga, lo que produce nuevos virus con impulso genético que pueden reemplazar progresivamente a la población natural. En experimentos con cultivos celulares , se demostró que un impulso genético viral puede propagarse a la población viral y reducir fuertemente la infectividad del virus, lo que abre nuevas estrategias terapéuticas contra los herpesvirus. [11]
Dado que los impulsores genéticos se propagan reemplazando otros alelos que contienen un sitio de corte y las homologías correspondientes, su aplicación se ha limitado principalmente a las especies que se reproducen sexualmente (porque son diploides o poliploides y los alelos se mezclan en cada generación). Como efecto secundario, la endogamia podría ser en principio un mecanismo de escape, pero es difícil evaluar hasta qué punto esto puede suceder en la práctica. [17]
Debido a la cantidad de generaciones necesarias para que una impulsión genética afecte a una población entera, el tiempo hasta la universalidad varía según el ciclo reproductivo de cada especie: puede requerir menos de un año para algunos invertebrados, pero siglos para organismos con intervalos de años entre el nacimiento y la madurez sexual , como los humanos. [18] Por lo tanto, esta tecnología es de mayor utilidad en especies de reproducción rápida.
La eficacia en la práctica real varía entre las técnicas, especialmente según la elección del promotor de la línea germinal . Lin y Potter 2016 (a) revelan la tecnología de promotor asistida por homología de knockin CRISPR (HACK) y Lin y Potter 2016 (b) demuestran su uso real, logrando una alta proporción de progenie alterada de cada madre alterada de Drosophila . [19]
Las cuestiones destacadas por los investigadores incluyen: [20]
El Instituto Broad del MIT y Harvard agregó los impulsores genéticos a una lista de usos de la tecnología de edición genética que no cree que las empresas deberían implementar. [21] [ se necesita una mejor fuente ]
Las unidades genéticas afectan a todas las generaciones futuras y representan la posibilidad de un cambio mayor en una especie viva de lo que ha sido posible hasta ahora. [22]
En diciembre de 2015, científicos de las principales academias del mundo pidieron una moratoria sobre las ediciones hereditarias del genoma humano que afectarían la línea germinal, incluidas las relacionadas con las tecnologías CRISPR-Cas9, [23] pero apoyaron la continuación de la investigación básica y la edición genética que no afectaría a las generaciones futuras. [24] En febrero de 2016, los reguladores dieron permiso a los científicos británicos para modificar genéticamente embriones humanos mediante el uso de CRISPR-Cas9 y técnicas relacionadas con la condición de que los embriones fueran destruidos en siete días. [25] [26] En junio de 2016, las Academias Nacionales de Ciencias, Ingeniería y Medicina de los Estados Unidos publicaron un informe sobre sus "Recomendaciones para la conducta responsable" de las unidades genéticas. [27]
Un estudio de modelado matemático de 2018 sugiere que, a pesar de la resistencia preexistente y en evolución a los impulsores genéticos (causados por mutaciones en el sitio de corte), incluso un impulsor genético de tipo "alteración" CRISPR ineficiente puede lograr la fijación en poblaciones pequeñas. Con una cantidad pequeña pero no nula de flujo genético entre muchas poblaciones locales, el impulsor genético puede escapar y convertir también a poblaciones externas. [28]
Kevin M. Esvelt afirmó que era necesario un debate abierto sobre la seguridad de los impulsores genéticos: "En nuestra opinión, es prudente asumir que los sistemas de impulsores genéticos invasivos y autopropagadores probablemente se extiendan a todas las poblaciones de las especies objetivo en todo el mundo. En consecuencia, solo deberían construirse para combatir plagas reales como la malaria, para la que tenemos pocas contramedidas adecuadas y que ofrecen un camino realista hacia un acuerdo internacional para implementar entre todas las naciones afectadas". [29] Pasó a un modelo abierto para su propia investigación sobre el uso de impulsores genéticos para erradicar la enfermedad de Lyme en Nantucket y Martha's Vineyard . [30] Esvelt y sus colegas sugirieron que CRISPR podría usarse para salvar la vida silvestre en peligro de extinción. Esvelt luego se retractó de su apoyo a la idea, excepto para poblaciones extremadamente peligrosas como los mosquitos portadores de malaria y las islas aisladas que evitarían que el impulso se extendiera más allá del área objetivo. [31]
Austin Burt, un genetista evolutivo del Imperial College de Londres , introdujo en 2003 la posibilidad de llevar a cabo impulsos genéticos basados en elementos genéticos egoístas de endonucleasas de anidación natural . [6]
Los investigadores ya habían demostrado que dichos genes podían actuar de forma egoísta para propagarse rápidamente a lo largo de generaciones sucesivas. Burt sugirió que los impulsores genéticos podrían utilizarse para impedir que una población de mosquitos transmitiera el parásito de la malaria o para acabar con una población de mosquitos. Los impulsores genéticos basados en endonucleasas homing se han demostrado en el laboratorio en poblaciones transgénicas de mosquitos [32] y moscas de la fruta. [33] [34] Sin embargo, las endonucleasas homing son específicas de la secuencia. Alterar su especificidad para dirigirse a otras secuencias de interés sigue siendo un gran desafío. [3] Las posibles aplicaciones de los impulsores genéticos siguieron siendo limitadas hasta el descubrimiento de CRISPR y las endonucleasas guiadas por ARN asociadas, como Cas9 y Cas12a .
En junio de 2014, el Programa Especial de Investigación y Formación sobre Enfermedades Tropicales de la Organización Mundial de la Salud (OMS) [35] publicó directrices [36] para evaluar mosquitos modificados genéticamente. En 2013, la Autoridad Europea de Seguridad Alimentaria publicó un protocolo [37] para las evaluaciones ambientales de todos los organismos modificados genéticamente .
Target Malaria , un proyecto financiado por la Fundación Bill y Melinda Gates , invirtió 75 millones de dólares en tecnología de impulso genético. La fundación estimó originalmente que la tecnología estaría lista para su uso en el campo en 2029 en algún lugar de África. Sin embargo, en 2016 Gates cambió esta estimación a algún momento dentro de los dos años siguientes. [38] En diciembre de 2017, documentos publicados bajo la Ley de Libertad de Información mostraron que DARPA había invertido 100 millones de dólares en investigación de impulso genético. [39]
Los científicos han diseñado múltiples estrategias para mantener el control sobre los impulsores genéticos. [ cita requerida ]
En 2020, los investigadores informaron sobre el desarrollo de dos elementos de ARN guía activos que, según su estudio, pueden permitir detener o eliminar impulsos genéticos introducidos en poblaciones en la naturaleza con la edición genética CRISPR-Cas9 . El autor principal del artículo advierte que los dos sistemas neutralizantes que demostraron en ensayos en jaulas "no deberían usarse con una falsa sensación de seguridad para impulsores genéticos implementados en el campo". [40] [41]
Si la eliminación no es necesaria, puede ser conveniente preservar intencionalmente la población objetivo a un nivel más bajo mediante el uso de una tecnología de impulso genético menos severa. Esto funciona manteniendo la población semidefectuosa indefinidamente en el área objetivo, desplazando así a las posibles poblaciones silvestres cercanas que de lo contrario regresarían para llenar un vacío. [42]
CRISPR [43] es el principal método de ingeniería genética . [44] En 2014, Esvelt y colaboradores sugirieron por primera vez que CRISPR/Cas9 podría usarse para construir impulsores genéticos. [5] En 2015, los investigadores informaron sobre la ingeniería exitosa de impulsores genéticos basados en CRISPR en Saccharomyces [45] , Drosophila [46] y mosquitos . [47] [48] Informaron una distorsión eficiente de la herencia a lo largo de generaciones sucesivas, y un estudio demostró la propagación de un gen en poblaciones de laboratorio. [ 48] Se esperaba que surgieran alelos resistentes a los impulsores para cada uno de los impulsores genéticos descritos; sin embargo, esto podría retrasarse o prevenirse al apuntar a sitios altamente conservados en los que se esperaba que la resistencia tuviera un costo de aptitud severo.
Gracias a la flexibilidad de selección de CRISPR, los impulsores genéticos podrían utilizarse teóricamente para diseñar prácticamente cualquier rasgo. A diferencia de los enfoques anteriores, podrían adaptarse para bloquear la evolución de la resistencia a los impulsores al seleccionar múltiples secuencias. CRISPR también podría permitir arquitecturas de impulsores genéticos que controlen poblaciones en lugar de eliminarlas. [ cita requerida ]
En 2022, se utilizó la técnica t-CRISPR para transmitir el gen del “haplotipo t” a aproximadamente el 95% de la descendencia. El método propaga copias defectuosas de un gen de fertilidad femenino a la descendencia, volviéndola infértil. Los investigadores informaron que sus modelos sugerían que agregar 256 animales alterados a una isla con una población de 200.000 ratones eliminaría la población en aproximadamente 25 años. Los métodos tradicionales de veneno y trampas no fueron necesarios. [49]
Las unidades genéticas tienen dos clases principales de aplicación, que tienen implicaciones de diferente importancia:
Debido a su riesgo potencial sin precedentes, se han propuesto y probado mecanismos de salvaguardia. [45] [50]
Una posible aplicación es modificar genéticamente mosquitos , ratones y otros vectores de enfermedades para que no puedan transmitir enfermedades, como la malaria y el dengue en el caso de los mosquitos, y enfermedades transmitidas por garrapatas en el caso de los ratones. [51] Los investigadores han afirmado que aplicando la técnica al 1% de la población salvaje de mosquitos, podrían erradicar la malaria en un año. [52]
Se podría utilizar un impulso genético para eliminar especies invasoras y, por ejemplo, se ha propuesto como una forma de eliminar especies invasoras en Nueva Zelanda . [53] Los impulsores genéticos con fines de conservación de la biodiversidad se están explorando como parte del programa de Biocontrol Genético de Roedores Invasores (GBIRd) porque ofrecen el potencial de reducir el riesgo para las especies no objetivo y los costos en comparación con las técnicas tradicionales de eliminación de especies invasoras. Dados los riesgos de un enfoque de este tipo que se describe a continuación, la asociación GBIRd está comprometida con un proceso deliberado y gradual que solo se llevará a cabo con la alineación pública, como lo recomiendan los principales investigadores del mundo en impulso genético de la Academia Nacional de Ciencias de Australia y Estados Unidos y muchos otros. [54] Existe una red de divulgación más amplia para la investigación de impulso genético para crear conciencia sobre el valor de la investigación de impulso genético para el bien público. [55]
Algunos científicos están preocupados por esta técnica, pues temen que pueda propagarse y acabar con especies en hábitats nativos. [56] El gen podría mutar, lo que podría causar problemas imprevistos (como podría ocurrir con cualquier gen). [57] Muchas especies no nativas pueden hibridarse con especies nativas, de modo que una impulsión genética que afecte a una planta o animal no nativo que se hibride con una especie nativa podría condenar a la especie nativa. Muchas especies no nativas se han naturalizado tan bien en su nuevo entorno que los cultivos y/o las especies nativas se han adaptado para depender de ellas. [58]
El proyecto Predator Free 2050 es un programa del gobierno de Nueva Zelanda para eliminar ocho especies invasoras de depredadores mamíferos (incluidas ratas, comadrejas de cola corta y zarigüeyas) del país para el año 2050. [59] [60] El proyecto fue anunciado por primera vez en 2016 por el primer ministro de Nueva Zelanda , John Key , y en enero de 2017 se anunció que se considerarían las unidades genéticas en el esfuerzo, pero esto aún no se ha hecho realidad. [60] En 2017, un grupo en Australia y otro en Texas publicaron una investigación preliminar sobre la creación de "ratones sin hijas" utilizando unidades genéticas en mamíferos. [61]
En 2017, científicos de la Universidad de California, Riverside, desarrollaron una genética dirigida para atacar a la invasora drosófila de alas manchadas , un tipo de mosca de la fruta nativa de Asia que le cuesta a las granjas de cerezas de California 700 millones de dólares por año debido al ovipositor afilado como una cuchilla de su cola que destruye la fruta intacta. La principal estrategia de control alternativa implica el uso de insecticidas llamados piretroides que matan a casi todos los insectos con los que entra en contacto. [21]
El filósofo transhumanista David Pearce ha abogado por el uso de impulsores genéticos basados en CRISPR para reducir el sufrimiento de los animales salvajes . [62] Kevin M. Esvelt , un biólogo estadounidense que ha ayudado a desarrollar la tecnología de impulsores genéticos, ha argumentado que existe un caso moral para la eliminación del gusano barrenador del Nuevo Mundo a través de tales tecnologías debido al inmenso sufrimiento que experimentan los animales salvajes infestados cuando son devorados vivos. [63]