Presión osmótica
La presión osmótica puede definirse como la presión que se debe aplicar a una solución para detener el flujo neto de disolvente a través de una membrana semipermeable.
La disolución más concentrada se denomina hipertónica y la diluida hipotónica.
Además aparece una diferencia de altura h y en consecuencia una presión hidrostática que, a diferencia de la osmótica, tiende a empujar el solvente hacia la parte diluida.
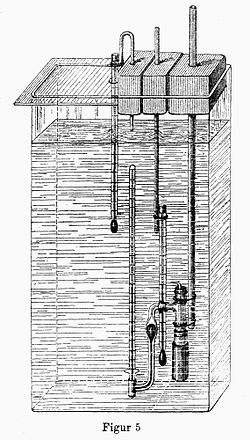
Dutrochet construyó el primer dispositivo experimental para observar la presencia de la presión osmótica, denominado osmómetro.
Al descubrir la ósmosis declaró: De este modo, Dutrochet intuyó la importancia del fenómeno en las células, las cuales absorberían o retendrían determinadas sustancias.
El inglés Thomas Graham descubrió, en 1854, que las sustancias coloidales no atravesaban ciertas membranas.
[8] En este artículo van 't Hoff fórmula una expresión, para disoluciones diluidas, que relaciona la presión osmótica con la concentración del soluto, la cual es similar a la ecuación de los gases ideales y proporciona la primera teoría para explicar la presión osmótica:
donde: Se han propuesto diversas teorías para explicar la causa de la ósmosis.
La suposición en la teoría de van 't Hoff de que las moléculas del disolvente no ejercen ningún efecto sobre la presión osmótica constituye un interrogante, ya que estas partículas se encuentran golpeando continuamente la membrana semipermeable.
La concentración se expresa en molalidad y no en molaridad, según la ecuación de Morse, pero las diferencias son mínimas.
La presión hidrostática viene dada por: donde ρ es la densidad del líquido (para agua: ρagua = 1 000 kg/m³), g es la aceleración de la gravedad (en la superficie terrestre: g = 9,81 m/s²), y h es la profundidad, expresada en metros.
De este modo, despejando h: Y convirtiendo atmósferas a pascales (27,2 atm
Además las relaciones de Onsager-Casimir nos dicen que la paridad del proceso es positiva y
Las moléculas de soluto aumentan su desorden al diluir la disolución mezclándose con el disolvente que atraviesa la membrana, ya que las moléculas de soluto tienen más espacio para moverse, lo que representa un mayor número de posiciones disponibles (mayor desorden), y, por tanto, una mayor entropía.
: Sin embargo, la ecuación obtenida por el químico estadounidense Harmon Northrop Morse se ajusta mejor a las observaciones experimentales.
Se tendrá entonces el equilibrio: El potencial químico de la disolución se podrá expresar en función del potencial químico del disolvente y de su fracción molar (
[13] Para disoluciones concentradas, se ha de utilizar la actividad (más concretamente su logaritmo,
De esta manera se obtiene una expresión más precisa, aplicable a las disoluciones concentradas que contienen un término añadido donde aparece la presión osmótica al cuadrado: donde
Por este motivo, el coeficiente de actividad del disolvente no resulta adecuado para caracterizar las propiedades reales de la disolución electrolítica concentrada y se define el coeficiente osmótico (
), por parte del químico danés Niels J. Bjerrum, de la siguiente manera: Así, la expresión de la presión osmótica para electrolitos queda corregida con el coeficiente osmótico:[13] La ósmosis tiene una gran importancia en los seres vivos.
En cambio, los iones inorgánicos y los disacáridos, como la sacarosa, pasan muy lentamente a través de las membranas celulares.
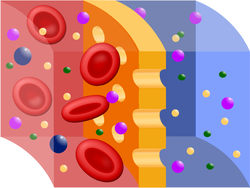
No obstante, existe un gran número de especies, tanto en el fluido que rodea la célula como en el fluido celular o citoplasma, que no pueden atravesar la membrana.
En caso contrario, cuando la concentración total del soluto que no puede atravesar la membrana es mayor en el fluido de la célula, esta ganará agua del líquido hipotónico circundante (de menor presión osmótica).
Cuando no se produce transferencia neta de agua entre el fluido celular y el que rodea la célula, se dice que los dos fluidos son isotónicos, es decir, tienen la misma presión osmótica.
[7] Existen unas células especializadas en detectar cambios de la presión osmótica en los líquidos corporales (plasma sanguíneo, fluido intercelular...), llamadas osmorreceptores.
Mediante estas células, el organismo puede regular la concentración de sales en sus fluidos, la osmolalidad.
[16] Los vegetales utilizan la presión osmótica para hacer ascender agua a través del xilema desde las raíces hasta las hojas.
Las raíces tienen una gran concentración de azúcares almacenados, producidos durante el verano.
[17] Se denominan osmófilos los organismos extremófilos que pueden crecer en ambientes con una alta concentración de azúcares.
No obstante, la aplicación más importante es la desalinización del agua salada marina para su potabilización, lo cual ha permitido abastecer con agua de calidad a poblaciones situadas en lugares donde los recursos hidráulicos son insuficientes.