Descenso crioscópico
Esta mayor concentración produce un descenso crioscópico adicional en la parte no congelada que, si la temperatura sigue bajando volverá a congelarse parcialmente, repitiéndose este proceso de congelación parcial-concentración-descenso crioscópico adicional a lo largo de la curva b-c, hasta llegar al punto eutéctico de la mezcla, representado como c, donde el incremento de concentración del soluto ya no produce nuevo descenso crioscópico y solidifica el conjunto.
Las primeras investigaciones sobre este fenómeno se deben al químico francés François-Marie Raoult y datan de 1882.
Otros científicos, entre los que destacan Jacobus Henricus van 't Hoff, Wilhelm Ostwald y Ernst Otto Beckmann, ampliaron posteriormente los estudios sobre el descenso crioscópico.
El químico francés François-Marie Raoult estudió las propiedades de las disoluciones con diversos disolventes, como agua, benceno o ácido acético, y publicó sus resultados en 1882.
El desorden se debe a que las partículas (moléculas, átomos o iones) de un sólido ocupan una posición fija y solo vibran alrededor de esa posición.
Por el contrario, en un líquido las partículas están en movimiento y no tienen una posición determinada.
Esta última es superior a la primera porque la disolución tiene más entropía que el disolvente líquido.
De esta forma, la nueva ecuación para el descenso crioscópico tomó la siguiente forma: El factor i fue explicado por el químico sueco Svante August Arrhenius cuando desarrolló entre 1883 y 1887 la teoría de la disociación electrolítica, según la cual las moléculas de los electrolitos se disocian en mayor o menor extensión en iones cargados eléctricamente, capaces de transportar la corriente eléctrica, existiendo un equilibrio entre las moléculas no disociadas y los iones.
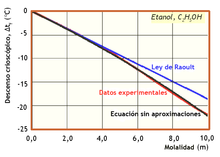
La fórmula de Raoult del descenso crioscópico solo da valores iguales a los experimentales cuando las disoluciones son muy diluidas.
La primera parte es una integral directa y para resolver la segunda hay que expresar la entalpía en función de la temperatura.
Con esta ecuación se obtienen curvas (en negro en la figura de la derecha) que coinciden muy bien con los valores experimentales (en rojo).
[10] El agua que se encuentra en contacto con la atmósfera alcanza temperaturas mucho más bajas y llega a congelarse; sin embargo, el agua líquida que queda por debajo no alcanza temperaturas tan bajas, pero sí que se encuentra a uno o dos grados bajo cero.
Se puede calcular de forma aproximada hasta qué temperatura puede mantenerse el agua del mar sin llegar a congelarse.
[11] Conociendo que la constante crioscópica del agua vale 1,86 °C·kg/mol se puede calcular el descenso crioscópico como: Por lo que el agua del mar puede alcanzar una temperatura de -2,2 °C sin congelarse.
Muchos insectos, por ejemplo, producen concentraciones elevadas de glicerol, sorbitol o manitol durante el invierno.
Estas proteínas tienen un mecanismo de funcionamiento que no se basa en el descenso crioscópico y una efectividad unas 500 veces mayor.
Las determinaciones se han de realizar para distintas concentraciones y extrapolar los resultados para una dilución infinita, debido a que la ecuación de Raoult solo se cumple en ese caso.
La leche se puede adulterar añadiendo agua sin que sea apreciable a simple vista.
Existen múltiples aplicaciones analíticas para el descenso crioscópico de los líquidos corporales (sangre, orina, lágrimas, etc.).
Un resultado mayor al normal puede indicar condiciones tales como la enfermedad de Addison, insuficiencia cardíaca congestiva o choque circulatorio.
Las medidas inferiores a los valores normales pueden indicar aldosteronismo, diabetes insípida, excesiva ingesta de líquidos, necrosis tubular renal o pielonefritis severa.
[26] Si aumenta la glucosa en sangre (hiperglucemia, presente en la diabetes) o la urea (patologías del riñón) su valor puede ser significativo.
[27] Este ensayo permite determinar, cuando los valores son superiores a lo normal, deshidratación, diabetes insípida, hiperglucemia, hipernatremia, consumo de metanol, consumo de etilenglicol, necrosis tubular renal, accidente cerebrovascular o traumatismo craneal que provoca deficiencia de hormona antidiurética (diabetes insípida) y uremia.
Para integrar se hace una aproximación: Aproximación 1) Si se supone que la entalpía molar de fusión del disolvente puro es constante en el intervalo de temperaturas que se estudia, se puede integrar la ecuación anterior entre el límite de concentración cero, que corresponde a x1 = 1 y T = Tfus*, y el límite x1 que corresponde a la temperatura de congelación de la disolución, Tfus Llamando ∆Tc = T*fus - Tfus al descenso crioscópico y haciendo la aproximación Tf·T*fus ≈ (T*fus)2, suponiendo una disolución diluida, queda: Ahora se puede poner el logaritmo en función de la fracción molar del soluto: En este momento, se siguen haciendo aproximaciones: Aproximación 2) Se puede desarrollar el ln(1 -x2) con una serie de McLaurin y se queda solo con el primer término: Aproximación 3) Se aproxima la fracción molar del soluto a su molalidad, m, omitiendo los moles de soluto en el denominador cuando se sumen a los moles de disolvente: donde M1 es la masa molar del disolvente expresada en kg/mol.
[28] Los valores se han analizado usando la expresión obtenida en la deducción termodinámica de la constante crioscópica: Las constantes crioscópicas serán elevadas si lo son las temperaturas de congelación y las masas molares, ya que son directamente proporcionales.
El agua, por el contrario, tiene una masa molar baja, la menor entre todos los disolventes mostrados en la tabla, lo que da lugar a una constante crioscópica baja, la menor de las listadas.
Sin embargo, las constantes crioscópicas serán elevadas si las entalpías de fusión son bajas.