

La fotosíntesis ( / ˌfoʊtəˈsɪnθəsɪs / FOH -tə- SINTH - ə -sis ) [ 1 ] es un sistema de procesos biológicos mediante el cual los organismos fotosintéticos , como la mayoría de las plantas, algas y cianobacterias , convierten la energía luminosa , generalmente de la luz solar, en la energía química necesaria para alimentar su metabolismo . La fotosíntesis generalmente se refiere a la fotosíntesis oxigénica , un proceso que produce oxígeno. Los organismos fotosintéticos almacenan la energía química así producida dentro de compuestos orgánicos intracelulares (compuestos que contienen carbono) como azúcares, glucógeno , celulosa y almidones . Para utilizar esta energía química almacenada, las células de un organismo metabolizan los compuestos orgánicos a través de la respiración celular . La fotosíntesis juega un papel fundamental en la producción y el mantenimiento del contenido de oxígeno de la atmósfera de la Tierra, y suministra la mayor parte de la energía biológica necesaria para la vida compleja en la Tierra. [2]
Algunas bacterias también realizan fotosíntesis anoxigénica , que utiliza bacterioclorofila para dividir el sulfuro de hidrógeno como reductor en lugar de agua, produciendo azufre en lugar de oxígeno. Las arqueas como Halobacterium también realizan un tipo de fotosíntesis anoxigénica sin fijación de carbono , donde el fotopigmento retinal más simple y sus derivados microbianos de rodopsina se utilizan para absorber la luz verde y alimentar las bombas de protones para sintetizar directamente el trifosfato de adenosina (ATP), la "moneda energética" de las células. Esta fotosíntesis arqueal podría haber sido la forma más temprana de fotosíntesis que evolucionó en la Tierra, ya en el Paleoarcaico , precediendo a la de las cianobacterias (ver la hipótesis de la Tierra Púrpura ).
Aunque los detalles pueden diferir entre especies , el proceso siempre comienza cuando la energía de la luz es absorbida por los centros de reacción , proteínas que contienen pigmentos fotosintéticos o cromóforos . En las plantas, estas proteínas son clorofilas (un derivado de la porfirina que absorbe los espectros rojo y azul de la luz, reflejando así el verde) contenidas dentro de los cloroplastos , abundantes en las células de las hojas . En las bacterias están incrustadas en la membrana plasmática . En estas reacciones dependientes de la luz, se utiliza algo de energía para quitar electrones de sustancias adecuadas, como el agua, produciendo gas oxígeno. El hidrógeno liberado por la división del agua se utiliza en la creación de dos moléculas importantes que participan en procesos energéticos: nicotinamida adenina dinucleótido fosfato reducido (NADPH) y ATP.
En las plantas, las algas y las cianobacterias, los azúcares se sintetizan mediante una secuencia posterior de reacciones independientes de la luz denominada ciclo de Calvin . En este proceso, el dióxido de carbono atmosférico se incorpora a compuestos orgánicos ya existentes, como el bisfosfato de ribulosa (RuBP). [3] Utilizando el ATP y el NADPH producidos por las reacciones dependientes de la luz, los compuestos resultantes se reducen y se eliminan para formar más carbohidratos, como la glucosa . En otras bacterias, se utilizan diferentes mecanismos, como el ciclo de Krebs inverso, para lograr el mismo fin.
Los primeros organismos fotosintéticos probablemente evolucionaron temprano en la historia evolutiva de la vida utilizando agentes reductores como hidrógeno o sulfuro de hidrógeno, en lugar de agua, como fuentes de electrones. [4] Las cianobacterias aparecieron más tarde; el exceso de oxígeno que producían contribuía directamente a la oxigenación de la Tierra , [5] lo que hizo posible la evolución de la vida compleja. La tasa promedio de energía capturada por la fotosíntesis global es de aproximadamente 130 teravatios , [6] [7] [8] que es aproximadamente ocho veces el consumo total de energía de la civilización humana . [9] Los organismos fotosintéticos también convierten alrededor de 100-115 mil millones de toneladas (91-104 Pg petagramos , o mil millones de toneladas métricas) de carbono en biomasa por año. [10] [11] La fotosíntesis fue descubierta en 1779 por Jan Ingenhousz . Demostró que las plantas necesitan luz, no solo aire, tierra y agua.
La fotosíntesis es vital para los procesos climáticos, ya que captura el dióxido de carbono del aire y lo fija en las plantas, los productos cosechados y el suelo. Se estima que los cereales por sí solos fijan 3.825 Tg o 3.825 Pg de dióxido de carbono cada año, es decir, 3.825 millones de toneladas métricas. [12]

La mayoría de los organismos fotosintéticos son fotoautótrofos , lo que significa que son capaces de sintetizar alimentos directamente a partir del dióxido de carbono y el agua utilizando la energía de la luz. Sin embargo, no todos los organismos utilizan el dióxido de carbono como fuente de átomos de carbono para realizar la fotosíntesis; los fotoheterótrofos utilizan compuestos orgánicos, en lugar del dióxido de carbono, como fuente de carbono. [2]
En las plantas, las algas y las cianobacterias, la fotosíntesis libera oxígeno. Esta fotosíntesis oxigénica es, con diferencia, el tipo de fotosíntesis más común que utilizan los organismos vivos. Algunas plantas que aman la sombra (esciofitas) producen niveles tan bajos de oxígeno durante la fotosíntesis que lo utilizan todo ellas mismas en lugar de liberarlo a la atmósfera. [13]
Aunque existen algunas diferencias entre la fotosíntesis oxigénica en plantas , algas y cianobacterias , el proceso general es bastante similar en estos organismos. También existen muchas variedades de fotosíntesis anoxigénica , utilizada principalmente por bacterias, que consumen dióxido de carbono pero no liberan oxígeno. [14] [15]
El dióxido de carbono se convierte en azúcares en un proceso llamado fijación de carbono ; la fotosíntesis captura energía de la luz solar para convertir el dióxido de carbono en carbohidratos . La fijación de carbono es una reacción redox endotérmica . En líneas generales, la fotosíntesis es lo opuesto a la respiración celular : mientras que la fotosíntesis es un proceso de reducción del dióxido de carbono a carbohidratos, la respiración celular es la oxidación de carbohidratos u otros nutrientes a dióxido de carbono. Los nutrientes utilizados en la respiración celular incluyen carbohidratos, aminoácidos y ácidos grasos. Estos nutrientes se oxidan para producir dióxido de carbono y agua, y para liberar energía química para impulsar el metabolismo del organismo .
La fotosíntesis y la respiración celular son procesos distintos, ya que tienen lugar a través de diferentes secuencias de reacciones químicas y en diferentes compartimentos celulares (respiración celular en las mitocondrias ). [16] [17]
La ecuación general para la fotosíntesis propuesta por primera vez por Cornelis van Niel es: [18]
Dado que el agua se utiliza como donante de electrones en la fotosíntesis oxigenada, la ecuación para este proceso es:
Esta ecuación enfatiza que el agua es a la vez un reactivo en la reacción dependiente de la luz y un producto de la reacción independiente de la luz, pero al cancelar n moléculas de agua de cada lado se obtiene la ecuación neta:
Otros procesos sustituyen otros compuestos (como el arsenito ) por agua en la función de suministro de electrones; por ejemplo, algunos microbios utilizan la luz solar para oxidar el arsenito a arsenato : [19] La ecuación para esta reacción es:
La fotosíntesis se produce en dos etapas. En la primera etapa, las reacciones dependientes de la luz o reacciones luminosas capturan la energía de la luz y la utilizan para fabricar el transportador de hidrógeno NADPH y la molécula de almacenamiento de energía ATP . Durante la segunda etapa, las reacciones independientes de la luz utilizan estos productos para capturar y reducir el dióxido de carbono.
La mayoría de los organismos que utilizan la fotosíntesis oxigenada utilizan luz visible para las reacciones dependientes de la luz, aunque al menos tres utilizan radiación infrarroja de onda corta o, más específicamente, radiación roja lejana. [21]
Algunos organismos emplean variantes aún más radicales de la fotosíntesis. Algunas arqueas utilizan un método más simple que emplea un pigmento similar a los que se utilizan para la visión en los animales. La bacteriorodopsina cambia su configuración en respuesta a la luz solar, actuando como una bomba de protones. Esto produce un gradiente de protones de forma más directa, que luego se convierte en energía química. El proceso no implica la fijación de dióxido de carbono ni libera oxígeno, y parece haber evolucionado de forma independiente de los tipos más comunes de fotosíntesis. [22]

En las bacterias fotosintéticas, las proteínas que recogen la luz para la fotosíntesis están incrustadas en las membranas celulares . En su forma más simple, esto implica la membrana que rodea a la propia célula. [23] Sin embargo, la membrana puede estar fuertemente plegada en láminas cilíndricas llamadas tilacoides , [24] o agrupada en vesículas redondas llamadas membranas intracitoplasmáticas . [25] Estas estructuras pueden llenar la mayor parte del interior de una célula, lo que le da a la membrana una superficie muy grande y, por lo tanto, aumenta la cantidad de luz que las bacterias pueden absorber. [24]
En las plantas y las algas, la fotosíntesis se lleva a cabo en orgánulos llamados cloroplastos . Una célula vegetal típica contiene alrededor de 10 a 100 cloroplastos. El cloroplasto está rodeado por una membrana. Esta membrana está compuesta por una membrana interna de fosfolípidos, una membrana externa de fosfolípidos y un espacio intermembrana. Envuelto por la membrana hay un fluido acuoso llamado estroma. Incrustados dentro del estroma hay pilas de tilacoides (grana), que son el sitio de la fotosíntesis. Los tilacoides aparecen como discos aplanados. El tilacoide en sí está rodeado por la membrana tilacoide, y dentro del volumen cerrado hay un lumen o espacio tilacoide. Incrustados en la membrana tilacoide hay complejos proteicos de membrana integrales y periféricos del sistema fotosintético.
Las plantas absorben la luz principalmente utilizando el pigmento clorofila . La parte verde del espectro de luz no se absorbe sino que se refleja, que es la razón por la que la mayoría de las plantas tienen un color verde. Además de la clorofila, las plantas también utilizan pigmentos como carotenos y xantofilas . [26] Las algas también utilizan clorofila, pero hay otros pigmentos presentes, como ficocianina , carotenos y xantofilas en las algas verdes , ficoeritrina en las algas rojas (rodófitas) y fucoxantina en las algas pardas y diatomeas , lo que da como resultado una amplia variedad de colores.
Estos pigmentos se encuentran incrustados en plantas y algas en complejos llamados proteínas antena. En estas proteínas, los pigmentos están dispuestos para trabajar juntos. Esta combinación de proteínas también se denomina complejo captador de luz . [27]
Aunque todas las células de las partes verdes de una planta tienen cloroplastos, la mayoría de ellos se encuentran en estructuras especialmente adaptadas llamadas hojas . Ciertas especies adaptadas a condiciones de fuerte luz solar y aridez , como muchas especies de Euphorbia y cactus , tienen sus principales órganos fotosintéticos en sus tallos. Las células de los tejidos interiores de una hoja, llamadas mesófilo , pueden contener entre 450.000 y 800.000 cloroplastos por cada milímetro cuadrado de hoja. La superficie de la hoja está recubierta de una cutícula cerosa resistente al agua que protege la hoja de la evaporación excesiva de agua y disminuye la absorción de luz ultravioleta o azul para minimizar el calentamiento . La capa transparente de la epidermis permite que la luz pase a través de las células del mesófilo en empalizada donde tiene lugar la mayor parte de la fotosíntesis.

En las reacciones dependientes de la luz , una molécula del pigmento clorofila absorbe un fotón y pierde un electrón . Este electrón es absorbido por una forma modificada de clorofila llamada feofitina , que pasa el electrón a una molécula de quinona , iniciando el flujo de electrones por una cadena de transporte de electrones que conduce a la reducción final de NADP a NADPH . Además, esto crea un gradiente de protones (gradiente de energía) a través de la membrana del cloroplasto , que es utilizado por la ATP sintasa en la síntesis de ATP . La molécula de clorofila finalmente recupera el electrón que perdió cuando una molécula de agua se divide en un proceso llamado fotólisis , que libera oxígeno .
La ecuación general para las reacciones dependientes de la luz en las condiciones de flujo de electrones no cíclico en plantas verdes es: [28]
No todas las longitudes de onda de la luz pueden soportar la fotosíntesis. El espectro de acción fotosintética depende del tipo de pigmentos accesorios presentes. Por ejemplo, en las plantas verdes , el espectro de acción se asemeja al espectro de absorción de las clorofilas y los carotenoides con picos de absorción en luz violeta-azul y roja. En las algas rojas , el espectro de acción es luz azul-verde, lo que permite que estas algas utilicen el extremo azul del espectro para crecer en las aguas más profundas que filtran las longitudes de onda más largas (luz roja) utilizadas por las plantas verdes sobre el suelo. La parte no absorbida del espectro de luz es lo que da a los organismos fotosintéticos su color (por ejemplo, plantas verdes, algas rojas, bacterias púrpuras ) y es la menos efectiva para la fotosíntesis en los respectivos organismos .
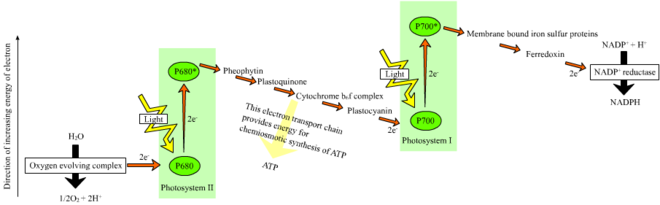
En las plantas , las reacciones dependientes de la luz ocurren en las membranas tilacoides de los cloroplastos , donde impulsan la síntesis de ATP y NADPH . Las reacciones dependientes de la luz son de dos formas: cíclicas y no cíclicas .
En la reacción no cíclica, los fotones son capturados en los complejos de antena de recolección de luz del fotosistema II por la clorofila y otros pigmentos accesorios (ver diagrama a la derecha). La absorción de un fotón por el complejo de antena suelta un electrón mediante un proceso llamado separación de carga fotoinducida . El sistema de antena está en el núcleo de la molécula de clorofila del centro de reacción del fotosistema II. Ese electrón suelto es absorbido por la molécula aceptora de electrones primaria , la feofitina . A medida que los electrones son transportados a través de una cadena de transporte de electrones (el llamado esquema Z que se muestra en el diagrama), se genera un potencial quimiosmótico al bombear cationes de protones ( H + ) a través de la membrana y hacia el espacio tilacoide . Una enzima ATP sintasa usa ese potencial quimiosmótico para producir ATP durante la fotofosforilación , mientras que el NADPH es un producto de la reacción redox terminal en el esquema Z. El electrón ingresa a una molécula de clorofila en el Fotosistema I. Allí se excita aún más por la luz absorbida por ese fotosistema . Luego, el electrón pasa a lo largo de una cadena de aceptores de electrones a los que transfiere parte de su energía . La energía entregada a los aceptores de electrones se utiliza para mover iones de hidrógeno a través de la membrana tilacoide hacia el lumen . El electrón finalmente se utiliza para reducir la coenzima NADP con un H + a NADPH (que tiene funciones en la reacción independiente de la luz); en ese punto, el camino de ese electrón termina.
La reacción cíclica es similar a la no cíclica, pero se diferencia en que genera solo ATP y no se crea NADP (NADPH) reducido. La reacción cíclica tiene lugar solo en el fotosistema I. Una vez que el electrón es desplazado del fotosistema, pasa a través de las moléculas aceptoras de electrones y regresa al fotosistema I, desde donde fue emitido, de ahí el nombre de reacción cíclica .
El transporte lineal de electrones a través de un fotosistema dejará el centro de reacción de ese fotosistema oxidado . Elevar otro electrón requerirá primero la re-reducción del centro de reacción. Los electrones excitados perdidos del centro de reacción ( P700 ) del fotosistema I son reemplazados por transferencia desde la plastocianina , cuyos electrones provienen del transporte de electrones a través del fotosistema II . El fotosistema II, como primer paso del esquema Z , requiere una fuente externa de electrones para reducir su centro de reacción de clorofila a oxidada . La fuente de electrones para la fotosíntesis en plantas verdes y cianobacterias es el agua. Dos moléculas de agua se oxidan por la energía de cuatro reacciones sucesivas de separación de carga del fotosistema II para producir una molécula de oxígeno diatómico y cuatro iones de hidrógeno . Los electrones producidos se transfieren a un residuo de tirosina redox-activo que se oxida por la energía de P680 + . Esto restablece la capacidad de P680 para absorber otro fotón y liberar otro electrón fotodisociado . La oxidación del agua es catalizada en el fotosistema II por una estructura redox-activa que contiene cuatro iones de manganeso y un ion de calcio ; este complejo que desprende oxígeno une dos moléculas de agua y contiene los cuatro equivalentes oxidantes que se utilizan para impulsar la reacción de oxidación del agua (diagramas de estado S de Kok). Los iones de hidrógeno se liberan en el lumen del tilacoide y, por lo tanto, contribuyen al potencial quimiosmótico transmembrana que conduce a la síntesis de ATP . El oxígeno es un producto de desecho de las reacciones dependientes de la luz, pero la mayoría de los organismos de la Tierra utilizan el oxígeno y su energía para la respiración celular , incluidos los organismos fotosintéticos . [29] [30]
En las reacciones independientes de la luz (o "oscuras"), la enzima RuBisCO captura CO 2 de la atmósfera y, en un proceso llamado ciclo de Calvin , utiliza el NADPH recién formado y libera azúcares de tres carbonos , que luego se combinan para formar sacarosa y almidón . La ecuación general para las reacciones independientes de la luz en las plantas verdes es [28] : 128

La fijación del carbono produce el intermedio de azúcar de tres carbonos , que luego se convierte en los productos finales de carbohidratos . Los azúcares de carbono simples que produce la fotosíntesis se utilizan luego para formar otros compuestos orgánicos , como el material de construcción celulosa , los precursores de la biosíntesis de lípidos y aminoácidos , o como combustible en la respiración celular . Esto último ocurre no solo en las plantas sino también en los animales cuando el carbono y la energía de las plantas pasan a través de una cadena alimentaria .
La fijación o reducción del dióxido de carbono es un proceso en el que el dióxido de carbono se combina con un azúcar de cinco carbonos , la ribulosa 1,5-bisfosfato , para producir dos moléculas de un compuesto de tres carbonos, el glicerato 3-fosfato , también conocido como 3-fosfoglicerato. El glicerato 3-fosfato, en presencia de ATP y NADPH producidos durante las etapas dependientes de la luz, se reduce a gliceraldehído 3-fosfato . Este producto también se conoce como 3-fosfogliceraldehído (PGAL) o, de forma más genérica, como triosa fosfato. La mayoría (cinco de seis moléculas) del gliceraldehído 3-fosfato producido se utilizan para regenerar la ribulosa 1,5-bisfosfato para que el proceso pueda continuar. Las triosas fosfatos que no se "reciclan" de esta manera a menudo se condensan para formar hexosas fosfatos, que finalmente producen sacarosa , almidón y celulosa , así como glucosa y fructosa . Los azúcares producidos durante el metabolismo del carbono producen esqueletos de carbono que pueden utilizarse para otras reacciones metabólicas como la producción de aminoácidos y lípidos .

En condiciones cálidas y secas , las plantas cierran sus estomas para evitar la pérdida de agua. En estas condiciones, el CO2 disminuirá y el gas oxígeno , producido por las reacciones luminosas de la fotosíntesis, aumentará, provocando un aumento de la fotorrespiración por la actividad oxigenasa de la ribulosa-1,5-bisfosfato carboxilasa/oxigenasa (RuBisCO) y una disminución de la fijación de carbono. Algunas plantas han desarrollado mecanismos para aumentar la concentración de CO2 en las hojas en estas condiciones. [31]
Las plantas que utilizan el proceso de fijación de carbono C 4 fijan químicamente el dióxido de carbono en las células del mesófilo añadiéndolo a la molécula de tres carbonos fosfoenolpiruvato (PEP), una reacción catalizada por una enzima llamada PEP carboxilasa , creando el ácido orgánico de cuatro carbonos ácido oxaloacético . El ácido oxaloacético o malato sintetizado por este proceso se transloca luego a células de la vaina del haz especializadas donde se encuentran la enzima RuBisCO y otras enzimas del ciclo de Calvin, y donde el CO 2 liberado por la descarboxilación de los ácidos de cuatro carbonos se fija luego por la actividad de RuBisCO a los ácidos 3-fosfoglicéricos de tres carbonos . La separación física de RuBisCO de las reacciones de luz generadoras de oxígeno reduce la fotorrespiración y aumenta la fijación de CO 2 y, por tanto, la capacidad fotosintética de la hoja . [32] Las plantas C 4 pueden producir más azúcar que las plantas C 3 en condiciones de alta luz y temperatura . Muchas plantas de cultivo importantes son plantas C 4 , incluyendo maíz , sorgo , caña de azúcar y mijo . Las plantas que no utilizan PEP-carboxilasa en la fijación de carbono se denominan plantas C 3 porque la reacción de carboxilación primaria , catalizada por RuBisCO, produce los ácidos 3-fosfoglicéricos de tres carbonos directamente en el ciclo de Calvin-Benson . Más del 90% de las plantas utilizan la fijación de carbono C 3 , en comparación con el 3% que utiliza la fijación de carbono C 4 ; [33] sin embargo, la evolución de C 4 en más de sesenta linajes de plantas lo convierte en un ejemplo sorprendente de evolución convergente . [31] La fotosíntesis C 2 , que implica la concentración de carbono por descomposición selectiva de la glicina fotorrespiratoria, es tanto un precursor evolutivo de C 4 como un mecanismo útil de concentración de carbono por derecho propio. [34]
Las xerófitas , como los cactus y la mayoría de las suculentas , también utilizan la carboxilasa PEP para capturar dióxido de carbono en un proceso llamado metabolismo ácido de las crasuláceas (CAM). A diferencia del metabolismo C4 , que separa espacialmente la fijación de CO2 a PEP del ciclo de Calvin, el CAM separa temporalmente estos dos procesos. Las plantas CAM tienen una anatomía foliar diferente a la de las plantas C3 , y fijan el CO2 por la noche, cuando sus estomas están abiertos. Las plantas CAM almacenan el CO2 principalmente en forma de ácido málico a través de la carboxilación de fosfoenolpiruvato a oxaloacetato , que luego se reduce a malato. La descarboxilación del malato durante el día libera CO2 dentro de las hojas, lo que permite la fijación de carbono a 3-fosfoglicerato por RuBisCO. El CAM es utilizado por 16.000 especies de plantas. [35]
Las plantas que acumulan oxalato de calcio , como Amaranthus hybridus y Colobanthus quitensis , muestran una variación de la fotosíntesis en la que los cristales de oxalato de calcio funcionan como depósitos dinámicos de carbono , que suministran dióxido de carbono (CO 2 ) a las células fotosintéticas cuando los estomas están parcial o totalmente cerrados. Este proceso se denominó fotosíntesis de alarma . En condiciones de estrés (p. ej., déficit de agua ), el oxalato liberado de los cristales de oxalato de calcio se convierte en CO 2 por una enzima oxalato oxidasa , y el CO 2 producido puede apoyar las reacciones del ciclo de Calvin . El peróxido de hidrógeno reactivo (H 2 O 2 ), el subproducto de la reacción de la oxalato oxidasa, puede ser neutralizado por la catalasa . La fotosíntesis de alarma representa una variante fotosintética que se suma a las conocidas vías C4 y CAM. Sin embargo, la fotosíntesis de alarma, a diferencia de estas vías, funciona como una bomba bioquímica que recoge carbono del interior del órgano (o del suelo ) y no de la atmósfera. [36] [37]
Las cianobacterias poseen carboxisomas , que aumentan la concentración de CO 2 alrededor de RuBisCO para aumentar la tasa de fotosíntesis. Una enzima, la anhidrasa carbónica , ubicada dentro del carboxisoma, libera CO 2 de los iones de hidrocarbonato disueltos (HCO−
3). Antes de que el CO 2 pueda difundirse, la RuBisCO concentrada dentro del carboxisoma lo absorbe rápidamente. HCO−
3Los iones se forman a partir del CO2 fuera de la célula por acción de otra anhidrasa carbónica y son bombeados activamente hacia el interior de la célula por una proteína de membrana. No pueden atravesar la membrana porque están cargados y, dentro del citosol, se convierten nuevamente en CO2 muy lentamente sin la ayuda de la anhidrasa carbónica. Esto hace que el HCO−
3Los iones se acumulan dentro de la célula desde donde se difunden hacia los carboxisomas. [38] Los pirenoides en las algas y las antocerotas también actúan para concentrar el CO 2 alrededor de RuBisCO. [39]
El proceso general de la fotosíntesis se lleva a cabo en cuatro etapas: [11]
Las plantas suelen convertir la luz en energía química con una eficiencia fotosintética del 3 al 6 %. [40] [41] La luz absorbida que no se convierte se disipa principalmente como calor , y una pequeña fracción (1 al 2 %) se reemite como fluorescencia de clorofila en longitudes de onda más largas (más rojas) . Este hecho permite medir la reacción luminosa de la fotosíntesis mediante el uso de fluorómetros de clorofila . [42]
La eficiencia fotosintética de las plantas reales varía con la frecuencia de la luz que se convierte, la intensidad de la luz , la temperatura y la proporción de dióxido de carbono en la atmósfera , y puede variar del 0,1% al 8%. [43] En comparación, los paneles solares convierten la luz en energía eléctrica con una eficiencia de aproximadamente el 6-20% para paneles producidos en masa , y por encima del 40% en dispositivos de laboratorio . Los científicos están estudiando la fotosíntesis con la esperanza de desarrollar plantas con mayor rendimiento . [41]
La eficiencia de las reacciones tanto luminosas como oscuras se puede medir, pero la relación entre ambas puede ser compleja. Por ejemplo, la reacción luminosa crea moléculas de energía ATP y NADPH , que las plantas C3 pueden utilizar para la fijación de carbono o la fotorrespiración . [44] Los electrones también pueden fluir a otros sumideros de electrones. [45] [46] [47] Por esta razón, no es raro que los autores diferencien entre el trabajo realizado en condiciones no fotorrespiratorias y en condiciones fotorrespiratorias . [48] [49] [50]
La fluorescencia de clorofila del fotosistema II puede medir la reacción luminosa, y los analizadores de gas infrarrojos pueden medir la reacción oscura . [51] Un fluorómetro de clorofila integrado y un sistema de intercambio de gases pueden investigar las reacciones luminosas y oscuras cuando los investigadores utilizan los dos sistemas separados juntos. [52] Los analizadores de gas infrarrojos y algunos sensores de humedad son lo suficientemente sensibles para medir la asimilación fotosintética de CO 2 y de Δ H 2 O utilizando métodos confiables . El CO 2 se mide comúnmente en μmols / ( m 2 / s ), partes por millón o volumen por millón; y el H 2 O se mide comúnmente en mmols / (m 2 /s) o en mbars . Al medir la asimilación de CO 2 , ΔH 2 O, temperatura de la hoja, presión barométrica , área de la hoja y radiación fotosintéticamente activa (PAR), es posible estimar "A" o asimilación de carbono, "E" o transpiración , "gs" o conductancia estomática y "Ci" o CO 2 intracelular . [53] Sin embargo, es más común utilizar la fluorescencia de clorofila para la medición del estrés de la planta , cuando sea apropiado, porque los parámetros más comúnmente utilizados FV/FM e Y(II) o F/FM' se pueden medir en unos pocos segundos, lo que permite la investigación de poblaciones de plantas más grandes. [50]
Los sistemas de intercambio de gases que ofrecen control de los niveles de CO 2 , por encima y por debajo del ambiente , permiten la práctica común de medición de curvas A/Ci, a diferentes niveles de CO 2 , para caracterizar la respuesta fotosintética de una planta. [53]
Los sistemas de intercambio de gases con fluorómetro de clorofila integrados permiten una medición más precisa de la respuesta y los mecanismos fotosintéticos. [51] [52] Si bien los sistemas estándar de fotosíntesis con intercambio de gases pueden medir Ci, o los niveles de CO2 subestomático , la adición de mediciones de fluorescencia de clorofila integradas permite una medición más precisa de C C, la estimación de la concentración de CO2 en el sitio de carboxilación en el cloroplasto, para reemplazar a Ci. [52] [54] La concentración de CO2 en el cloroplasto se puede estimar con la medición de la conductancia del mesófilo o g m utilizando un sistema integrado. [51] [52] [55]
Los sistemas de medición de la fotosíntesis no están diseñados para medir directamente la cantidad de luz que absorbe la hoja, pero el análisis de la fluorescencia de la clorofila , la absorbancia de P700 y P515 y las mediciones de intercambio de gases revelan información detallada sobre, por ejemplo, los fotosistemas , la eficiencia cuántica y las tasas de asimilación de CO 2 . Con algunos instrumentos, incluso se puede analizar la dependencia de la longitud de onda de la eficiencia fotosintética . [56]
Un fenómeno conocido como paseo cuántico aumenta significativamente la eficiencia del transporte de energía de la luz. En la célula fotosintética de un alga , bacteria o planta existen moléculas sensibles a la luz llamadas cromóforos dispuestos en una estructura con forma de antena llamada fotocomplejo. Cuando un fotón es absorbido por un cromóforo, se convierte en una cuasipartícula denominada excitón , que salta de cromóforo en cromóforo hacia el centro de reacción del fotocomplejo, un conjunto de moléculas que atrapa su energía en una forma química accesible al metabolismo de la célula. Las propiedades ondulatorias del excitón le permiten cubrir un área más amplia y probar varios caminos posibles simultáneamente, lo que le permite "elegir" instantáneamente la ruta más eficiente, donde tendrá la mayor probabilidad de llegar a su destino en el mínimo tiempo posible.
Como este movimiento cuántico se produce a temperaturas mucho más altas que las que suelen producirse en los fenómenos cuánticos, sólo es posible en distancias muy cortas. Los obstáculos en forma de interferencias destructivas hacen que la partícula pierda sus propiedades ondulatorias durante un instante antes de recuperarlas una vez que se libera de su posición bloqueada mediante un "salto" clásico. Por tanto, el movimiento del electrón hacia el fotocentro se cubre con una serie de saltos y movimientos cuánticos convencionales. [57] [58] [59]
Se ha determinado que los fósiles de organismos fotosintéticos filamentosos tienen 3.400 millones de años de antigüedad. [60] [61] Estudios más recientes también sugieren que la fotosíntesis puede haber comenzado hace unos 3.400 millones de años, [62] [63] aunque la primera evidencia directa de la fotosíntesis proviene de membranas tilacoides preservadas en sílex de 1.750 millones de años de antigüedad . [64]
La fotosíntesis oxigénica es la principal fuente de oxígeno en la atmósfera de la Tierra , y su aparición más temprana a veces se conoce como la catástrofe del oxígeno . La evidencia geológica sugiere que la fotosíntesis oxigénica, como la de las cianobacterias , se volvió importante durante la era Paleoproterozoica hace unos dos mil millones de años. La fotosíntesis moderna en las plantas y la mayoría de los procariotas fotosintéticos es oxigénica, utilizando agua como donante de electrones , que se oxida a oxígeno molecular en el centro de reacción fotosintético .

Varios grupos de animales han formado relaciones simbióticas con algas fotosintéticas . Estas son más comunes en corales , esponjas y anémonas de mar . Los científicos presumen que esto se debe a los planes corporales particularmente simples y las grandes áreas de superficie de estos animales en comparación con sus volúmenes . [65] Además, algunos moluscos marinos , como Elysia viridis y Elysia chlorotica , también mantienen una relación simbiótica con los cloroplastos que capturan de las algas en su dieta y luego almacenan en sus cuerpos (ver Cleptoplastia ). Esto permite que los moluscos sobrevivan únicamente por fotosíntesis durante varios meses a la vez. [66] [67] Algunos de los genes del núcleo de la célula vegetal incluso se han transferido a las babosas , de modo que los cloroplastos pueden recibir las proteínas que necesitan para sobrevivir. [68]
Una forma aún más cercana de simbiosis puede explicar el origen de los cloroplastos. Los cloroplastos tienen muchas similitudes con las bacterias fotosintéticas , incluyendo un cromosoma circular, ribosoma de tipo procariota y proteínas similares en el centro de reacción fotosintética . [69] [70] La teoría endosimbiótica sugiere que las bacterias fotosintéticas fueron adquiridas (por endocitosis ) por las primeras células eucariotas para formar las primeras células vegetales. Por lo tanto, los cloroplastos pueden ser bacterias fotosintéticas que se adaptaron a la vida dentro de las células vegetales. Al igual que las mitocondrias , los cloroplastos poseen su propio ADN , separado del ADN nuclear de sus células hospedantes vegetales y los genes en este ADN de cloroplasto se parecen a los que se encuentran en las cianobacterias . [71] El ADN en los cloroplastos codifica proteínas redox como las que se encuentran en los centros de reacción fotosintética. La hipótesis CoRR propone que esta co-ubicación de los genes con sus productos genéticos es necesaria para la regulación redox de la expresión genética y explica la persistencia del ADN en los orgánulos bioenergéticos . [72]
Se excluyen los organismos simbióticos y cleptoplásicos :
A excepción de los euglenidos, que se encuentran dentro de los Excavata , todos ellos pertenecen a los Diaphoretickes . Archaeplastida y la fotosintética Paulinella obtuvieron sus plástidos, que están rodeados por dos membranas, a través de endosimbiosis primaria en dos eventos separados, al engullir una cianobacteria. Los plástidos de todos los demás grupos tienen un origen de algas rojas o verdes, y se conocen como los "linajes rojos" y los "linajes verdes". La única excepción conocida es el ciliado Pseudoblepharisma tenue , que además de sus plástidos que se originaron a partir de algas verdes también tiene una bacteria de azufre púrpura como simbionte. En los dinoflagelados y euglenidos, los plástidos están rodeados por tres membranas, y en las líneas restantes por cuatro. Un nucleomorfo , remanente del núcleo algal original ubicado entre las membranas interna y externa del plástido, está presente en los criptofitos (de un alga roja) y cloraracniofitos (de un alga verde). [73] Algunos dinoflagelados que perdieron su capacidad fotosintética la recuperaron más tarde a través de nuevos eventos endosimbióticos con diferentes algas. Si bien pueden realizar la fotosíntesis, muchos de estos grupos eucariotas son mixótrofos y practican la heterotrofia en diversos grados.
Se cree que los primeros sistemas fotosintéticos, como los de las bacterias verdes y moradas del azufre y las bacterias verdes y moradas no azufradas , eran anoxigénicos y utilizaban otras moléculas además del agua como donantes de electrones . Se cree que las bacterias verdes y moradas del azufre utilizaban hidrógeno y azufre como donantes de electrones. Las bacterias verdes no azufradas utilizaban varios aminoácidos y otros ácidos orgánicos como donantes de electrones. Las bacterias moradas no azufradas utilizaban una variedad de moléculas orgánicas no específicas. El uso de estas moléculas es coherente con la evidencia geológica de que la atmósfera primitiva de la Tierra era altamente reductora en ese momento . [74]
Con una posible excepción de Heimdallarchaeota , la fotosíntesis no se encuentra en archaea . [75] Haloarchaea son fototróficas y pueden absorber energía del sol, pero no recolectan carbono de la atmósfera y, por lo tanto, no son fotosintéticas. [76] En lugar de clorofila, utilizan rodopsinas, que convierten la energía de la luz en gradientes de iones, pero no pueden mediar reacciones de transferencia de electrones. [77] [78]
En las bacterias se conocen actualmente ocho linajes fotosintéticos: [79] [80] [81] [82]
La capacidad bioquímica de utilizar el agua como fuente de electrones en la fotosíntesis evolucionó una vez, en un ancestro común de las cianobacterias actuales (antes llamadas algas verdeazuladas). El registro geológico indica que este evento transformador tuvo lugar temprano en la historia de la Tierra, al menos hace 2450–2320 millones de años (Ma), y, se especula, mucho antes. [83] [84] Debido a que la atmósfera de la Tierra casi no contenía oxígeno durante el desarrollo estimado de la fotosíntesis, se cree que las primeras cianobacterias fotosintéticas no generaron oxígeno. [85] La evidencia disponible de los estudios geobiológicos de rocas sedimentarias del Arcaico (>2500 Ma) indica que la vida existió hace 3500 Ma, pero la pregunta de cuándo evolucionó la fotosíntesis oxigénica aún no tiene respuesta. Una ventana paleontológica clara sobre la evolución de las cianobacterias se abrió alrededor de 2000 Ma, revelando una biota de cianobacterias ya diversa. Las cianobacterias siguieron siendo los principales productores primarios de oxígeno a lo largo del Eón Proterozoico (2500–543 Ma), en parte porque la estructura redox de los océanos favoreció a los fotoautótrofos capaces de fijar nitrógeno . [86] [87] Las algas verdes se unieron a las cianobacterias como los principales productores primarios de oxígeno en las plataformas continentales cerca del final del Proterozoico , pero solo con las radiaciones mesozoicas (251–66 Ma) de dinoflagelados, cocolitofóridos y diatomeas la producción primaria de oxígeno en las aguas de las plataformas marinas tomó forma moderna. Las cianobacterias siguen siendo fundamentales para los ecosistemas marinos como productores primarios de oxígeno en los giros oceánicos, como agentes de fijación biológica de nitrógeno y, en forma modificada, como los plástidos de las algas marinas. [88]
Aunque algunos de los pasos de la fotosíntesis aún no se comprenden completamente, la ecuación fotosintética general se conoce desde el siglo XIX.

Jan van Helmont comenzó a investigar este proceso a mediados del siglo XVII, cuando midió cuidadosamente la masa del suelo que utilizaba una planta y la masa de la planta a medida que crecía. Después de notar que la masa del suelo cambiaba muy poco, planteó la hipótesis de que la masa de la planta en crecimiento debía provenir del agua , la única sustancia que añadía a la planta en maceta. Su hipótesis era parcialmente exacta : gran parte de la masa obtenida proviene del dióxido de carbono y del agua. Sin embargo, esto fue un punto de referencia para la idea de que la mayor parte de la biomasa de una planta proviene de los insumos de la fotosíntesis, no del suelo en sí.
Joseph Priestley , químico y ministro religioso , descubrió que cuando aislaba un volumen de aire bajo un frasco invertido y quemaba una vela en él (que emitía CO2 ), la vela se consumía muy rápidamente, mucho antes de que se quedara sin cera . Descubrió además que un ratón podía "dañar" el aire de manera similar. Luego demostró que una planta podía restaurar el aire que la vela y el ratón habían "dañado". [89]
En 1779, Jan Ingenhousz repitió los experimentos de Priestley y descubrió que la influencia de la luz solar sobre la planta era lo que podía hacer que ésta reviviera a un ratón en cuestión de horas. [89] [90]
En 1796, Jean Senebier , pastor , botánico y naturalista suizo , demostró que las plantas verdes consumen dióxido de carbono y liberan oxígeno bajo la influencia de la luz . Poco después, Nicolas-Théodore de Saussure demostró que el aumento de masa de la planta a medida que crece no podía deberse solo a la absorción de CO2 sino también a la incorporación de agua. De este modo, se esbozó la reacción básica mediante la cual los organismos utilizan la fotosíntesis para producir alimentos (como la glucosa ). [91]
Cornelis Van Niel realizó descubrimientos clave que explican la química de la fotosíntesis. Al estudiar las bacterias púrpuras del azufre y las bacterias verdes , fue el primero en demostrar que la fotosíntesis es una reacción redox dependiente de la luz en la que el hidrógeno reduce (dona sus átomos como electrones y protones ) el dióxido de carbono.
Robert Emerson descubrió dos reacciones luminosas al probar la productividad de las plantas utilizando diferentes longitudes de onda de luz. Con el rojo solo, las reacciones luminosas se suprimieron. Cuando se combinaron el azul y el rojo, el resultado fue mucho más sustancial. Por lo tanto, hubo dos fotosistemas, uno que absorbe longitudes de onda de hasta 600 nm, el otro hasta 700 nm. El primero se conoce como PSII, el segundo como PSI. PSI contiene solo clorofila "a", PSII contiene principalmente clorofila "a" con la mayor parte de la clorofila "b" disponible, entre otros pigmentos. Estos incluyen ficobilinas, que son los pigmentos rojo y azul de las algas rojas y azules, respectivamente, y fucoxantol para las algas pardas y las diatomeas. El proceso es más productivo cuando la absorción de cuantos es igual tanto en PSII como en PSI, lo que garantiza que la energía de entrada del complejo de antena se divida entre los sistemas PSI y PSII, lo que a su vez impulsa la fotoquímica. [11]
Robert Hill pensaba que un complejo de reacciones consistía en un intermediario para el citocromo b 6 (ahora una plastoquinona), y que otro era del citocromo f a un paso en los mecanismos de generación de carbohidratos. Estos están unidos por la plastoquinona, que requiere energía para reducir el citocromo f. Hill realizó experimentos adicionales para demostrar que el oxígeno desarrollado durante la fotosíntesis de las plantas verdes provenía del agua en 1937 y 1939. Demostró que los cloroplastos aislados emiten oxígeno en presencia de agentes reductores no naturales como el oxalato de hierro , el ferricianuro o la benzoquinona después de la exposición a la luz. En la reacción de Hill: [92]
A es el aceptor de electrones. Por lo tanto, en presencia de luz, el aceptor de electrones se reduce y se desprende oxígeno. Samuel Ruben y Martin Kamen utilizaron isótopos radiactivos para determinar que el oxígeno liberado en la fotosíntesis provenía del agua.

Melvin Calvin y Andrew Benson , junto con James Bassham , dilucidaron el proceso de asimilación del carbono (el ciclo fotosintético de reducción del carbono) en las plantas. El ciclo de reducción del carbono se conoce como ciclo de Calvin , pero muchos científicos lo denominan ciclo de Calvin-Benson, Benson-Calvin o incluso ciclo de Calvin-Benson-Bassham (o CBB).
El científico ganador del Premio Nobel Rudolph A. Marcus pudo posteriormente descubrir la función y el significado de la cadena de transporte de electrones.
Otto Heinrich Warburg y Dean Burk descubrieron la reacción de fotosíntesis cuántica I que divide el CO 2 , activada por la respiración. [93]
En 1950, Otto Kandler presentó la primera evidencia experimental de la existencia de fotofosforilación in vivo utilizando células intactas de Chlorella e interpretando sus hallazgos como formación de ATP dependiente de la luz . [94] En 1954, Daniel I. Arnon et al. descubrieron la fotofosforilación in vitro en cloroplastos aislados con la ayuda de P 32 . [95] [96]
Louis NM Duysens y Jan Amesz descubrieron que la clorofila "a" absorberá una luz, oxidando el citocromo f, mientras que la clorofila "a" (y otros pigmentos) absorberá otra luz pero reducirá este mismo citocromo oxidado, lo que indica que las dos reacciones de luz están en serie.
En 1893, el botánico estadounidense Charles Reid Barnes propuso dos términos, fotosintaxis y fotosíntesis , para el proceso biológico de síntesis de compuestos complejos de carbono a partir de ácido carbónico, en presencia de clorofila, bajo la influencia de la luz . El término fotosíntesis se deriva del griego phōs (φῶς, destello) y sýnthesis (σύνθεσις, ordenar), [97] [98] [99] mientras que otra palabra que él designó fue fotosintaxis , de sýntaxis (σύνταξις, configuración). Con el tiempo, el término fotosíntesis se volvió de uso común. El descubrimiento posterior de bacterias fotosintéticas anoxigénicas y la fotofosforilación hicieron necesaria la redefinición del término. [100]
A finales de los años 1940 en la Universidad de California, Berkeley , los químicos Melvin Calvin , Andrew Benson, James Bassham y una veintena de estudiantes e investigadores que utilizaban el isótopo de carbono-14 y las técnicas de cromatografía en papel, resolvieron los detalles del metabolismo fotosintético del carbono. [101] La vía de fijación de CO2 por el alga Chlorella en una fracción de segundo en luz resultó en una molécula de tres carbonos llamada ácido fosfoglicérico (PGA). Por ese trabajo original e innovador, Melvin Calvin recibió un Premio Nobel de Química en 1961. Paralelamente, los fisiólogos vegetales estudiaron los intercambios de gases en las hojas utilizando el nuevo método de análisis de gases infrarrojos y una cámara foliar donde las tasas fotosintéticas netas oscilaban entre 10 y 13 μmol de CO2 · m −2 ·s −1 , con la conclusión de que todas las plantas terrestres tienen las mismas capacidades fotosintéticas, que están saturadas de luz a menos del 50% de la luz solar. [102] [103]
Más tarde, entre 1958 y 1963, en la Universidad de Cornell , se informó que el maíz cultivado en el campo tenía tasas fotosintéticas foliares mucho mayores de 40 μmol CO 2 ·m −2 ·s −1 y no se saturaba con luz solar casi total. [104] [105] Esta tasa más alta en el maíz era casi el doble de las observadas en otras especies como el trigo y la soja, lo que indica que existen grandes diferencias en la fotosíntesis entre las plantas superiores. En la Universidad de Arizona, una investigación detallada del intercambio de gases en más de 15 especies de monocotiledóneas y dicotiledóneas descubrió por primera vez que las diferencias en la anatomía de las hojas son factores cruciales para diferenciar las capacidades fotosintéticas entre las especies. [106] [107] En pastos tropicales, incluyendo maíz, sorgo, caña de azúcar, pasto bermuda y en el amaranto dicotiledóneo, las tasas fotosintéticas de las hojas fueron alrededor de 38−40 μmol CO 2 ·m −2 ·s −1 , y las hojas tienen dos tipos de células verdes, es decir, la capa externa de células mesófilas que rodean una vaina de células vasculares clorofílicas muy compactas. Este tipo de anatomía fue denominada anatomía de Kranz en el siglo XIX por el botánico Gottlieb Haberlandt mientras estudiaba la anatomía de las hojas de la caña de azúcar. [108] Las especies de plantas con las mayores tasas fotosintéticas y anatomía de Kranz no mostraron fotorrespiración aparente, un punto de compensación de CO 2 muy bajo , una temperatura óptima alta, altas resistencias estomáticas y menores resistencias del mesófilo para la difusión de gases y tasas nunca saturadas a plena luz del sol. [109] La investigación en Arizona fue designada como un Clásico de Citación en 1986. [107] Estas especies fueron posteriormente denominadas plantas C4 ya que el primer compuesto estable de fijación de CO2 en la luz tiene cuatro carbonos como malato y aspartato. [110] [111] [112] Otras especies que carecen de anatomía de Kranz fueron denominadas tipo C3 como el algodón y el girasol, ya que el primer compuesto de carbono estable es el PGA de tres carbonos. A 1000 ppm de CO2 en la medición del aire, tanto las plantas C3 como las C4 tenían tasas fotosintéticas foliares similares alrededor de 60 μmol CO2 · m −2 ·s −1 indicando la supresión de la fotorrespiración en las plantas C3. [106] [107]

Hay cuatro factores principales que influyen en la fotosíntesis y varios factores conexos. Los cuatro principales son: [113]
La fotosíntesis total está limitada por una serie de factores ambientales, entre ellos la cantidad de luz disponible, la superficie de las hojas que tiene una planta para captar luz (el sombreado de otras plantas es una limitación importante de la fotosíntesis), la velocidad a la que se puede suministrar dióxido de carbono a los cloroplastos para sustentar la fotosíntesis, la disponibilidad de agua y la disponibilidad de temperaturas adecuadas para llevar a cabo la fotosíntesis. [114]

El proceso de fotosíntesis proporciona la principal entrada de energía libre a la biosfera y es una de las cuatro formas principales en las que la radiación es importante para la vida vegetal. [115]
El clima de radiación dentro de las comunidades vegetales es extremadamente variable, tanto en el tiempo como en el espacio.
A principios del siglo XX, Frederick Blackman y Gabrielle Matthaei investigaron los efectos de la intensidad de la luz ( irradiancia ) y la temperatura en la tasa de asimilación del carbono.
Estos dos experimentos ilustran varios puntos importantes: primero, se sabe que, en general, las reacciones fotoquímicas no se ven afectadas por la temperatura . Sin embargo, estos experimentos muestran claramente que la temperatura afecta la tasa de asimilación de carbono, por lo que debe haber dos conjuntos de reacciones en el proceso completo de asimilación de carbono. Estas son la etapa "fotoquímica" dependiente de la luz e independiente de la temperatura, y la etapa independiente de la luz y dependiente de la temperatura. En segundo lugar, los experimentos de Blackman ilustran el concepto de factores limitantes . Otro factor limitante es la longitud de onda de la luz. Las cianobacterias, que residen varios metros bajo el agua, no pueden recibir las longitudes de onda correctas requeridas para causar la separación de carga fotoinducida en los pigmentos fotosintéticos convencionales. Para combatir este problema, las cianobacterias tienen un complejo de recolección de luz llamado Ficobilisoma . [116] Este complejo está formado por una serie de proteínas con diferentes pigmentos que rodean el centro de reacción.

A medida que aumentan las concentraciones de dióxido de carbono, la velocidad a la que se producen azúcares mediante las reacciones independientes de la luz aumenta hasta que se ve limitada por otros factores. RuBisCO , la enzima que captura el dióxido de carbono en las reacciones independientes de la luz, tiene una afinidad de unión tanto por el dióxido de carbono como por el oxígeno. Cuando la concentración de dióxido de carbono es alta, RuBisCO fijará el dióxido de carbono. Sin embargo, si la concentración de dióxido de carbono es baja, RuBisCO se unirá al oxígeno en lugar del dióxido de carbono. Este proceso, llamado fotorrespiración , utiliza energía, pero no produce azúcares.
La actividad de la oxigenasa RuBisCO es desventajosa para las plantas por varias razones:
La vía de recuperación de los productos de la actividad de la oxigenasa RuBisCO se conoce más comúnmente como fotorrespiración, ya que se caracteriza por el consumo de oxígeno dependiente de la luz y la liberación de dióxido de carbono.
Esta incorporación inicial de carbono a los compuestos orgánicos se conoce como fijación de carbono.
Se estima que los organismos fotosintéticos eliminan100 × 10 15 gramos de carbono/año fijados por organismos fotosintéticos. Esto equivale a4 × 10 18 kJ/año de energía libre almacenada en carbono reducido. (en la Parte 8: "La fotosíntesis global y la atmósfera")
La tasa media global de fotosíntesis es de 130 TW.