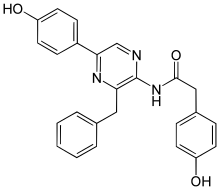
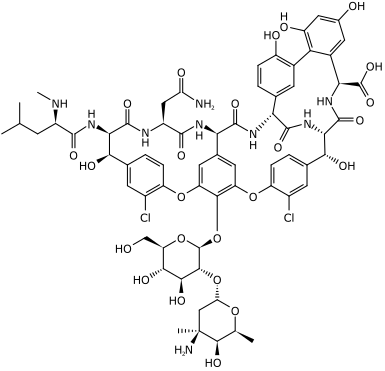
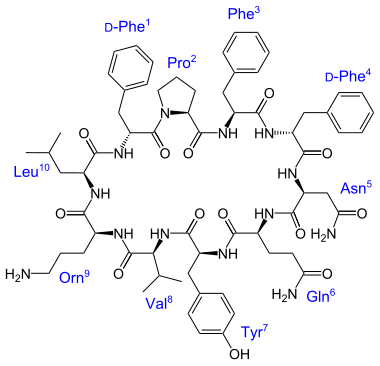
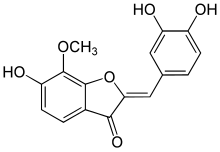
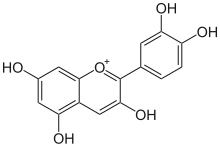
Ruta del ácido shikímico
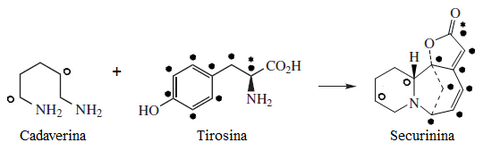
El intermediario principal es el ácido shikímico, un compuesto originalmente aislado de plantas del género Illicium.
Es raro encontrarlo libre: más bien funge como residuo estructural de metabolitos más complejos, por ejemplo antibióticos como la ansatrienina, las trienomicinas, las tiazinotrienomicinas, la asukamicina y en los ácidos grasos ω-ciclohexílicos de ciertas bacterias termófilas y mesófilas (como Alicyclobacillus), por ejemplo el ácido ω-ciclohexilundecanoico.
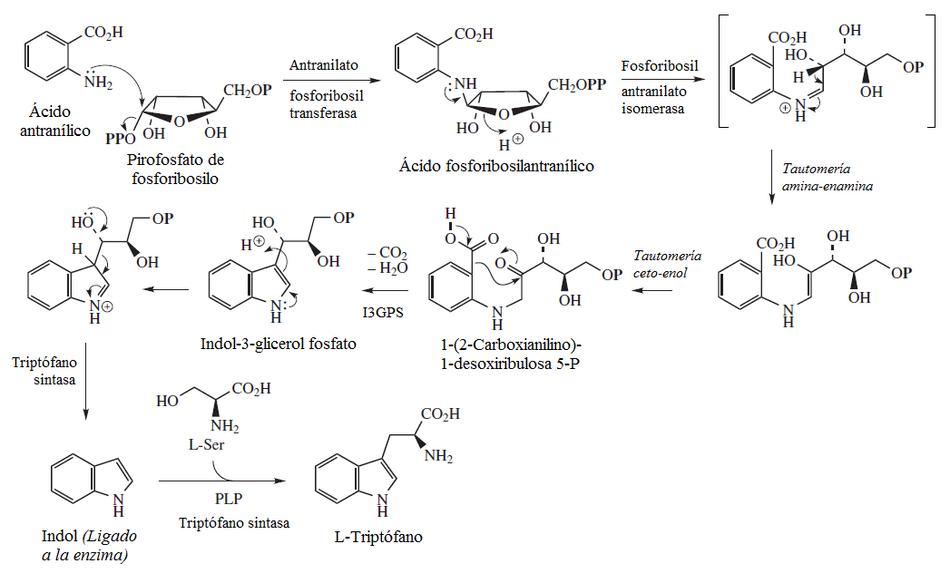
Al producto formado se adiciona una molécula de amoniaco para dar el ácido 4-amino-3-desoxi-D-arabino heptulosónico-7-fosfato (aminoDHAP).
Después, la DHQ sintasa cataliza el cierre de un anillo para producir el ácido 4-amino-3-deshidroquínico (aminoDHQ).
Una vez que la condensación ha ocurrido, el mitosano sufre interconversiones de grupos funcionales.
El AHBA también es precursor de otros productos naturales anticáncer tales como la rifamicina y la ansamicina.
Estas quinonas se derivan del ácido isocorísmico y de un precursor adicional con 4 carbonos proporcionados por el ácido 2-oxoglutárico, que se incorpora mediante un mecanismo que implica la coenzima tiamina difosfato (TPP), de manera análoga a la piruvato descarboxilasa.
Sin embargo, se encuentra que el fragmento terpenoide reemplaza al grupo carboxilo, y el análogo descarboxilado no está involucrado.
La transformación del ácido 1,4-dihidroxinaftoico en naftoquinona isoprenilada parece estar catalizada por un único enzima.
Esto implica la alquilación, la descarboxilación del β-cetoácido resultante, y finalmente una oxidación a la p-quinona.
Se ha encontrado que los seres vivos pueden catabolizar la tirosina, la fenilalanina y los fenilpropanoides a esqueletos aromáticos con una cadena lateral de dos carbonos.
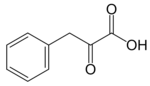
Este compuesto se oxida a ácido fenilacético por acción de una aldehído deshidrogenasa (EC 1.2.1.5).
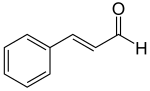
Por otro lado, el ácido fenilpirúvico sufre una descarboxilación oxidativa para formar fenilacetaldehído, el cual se puede incorporar a la ruta anteriormente descrita.
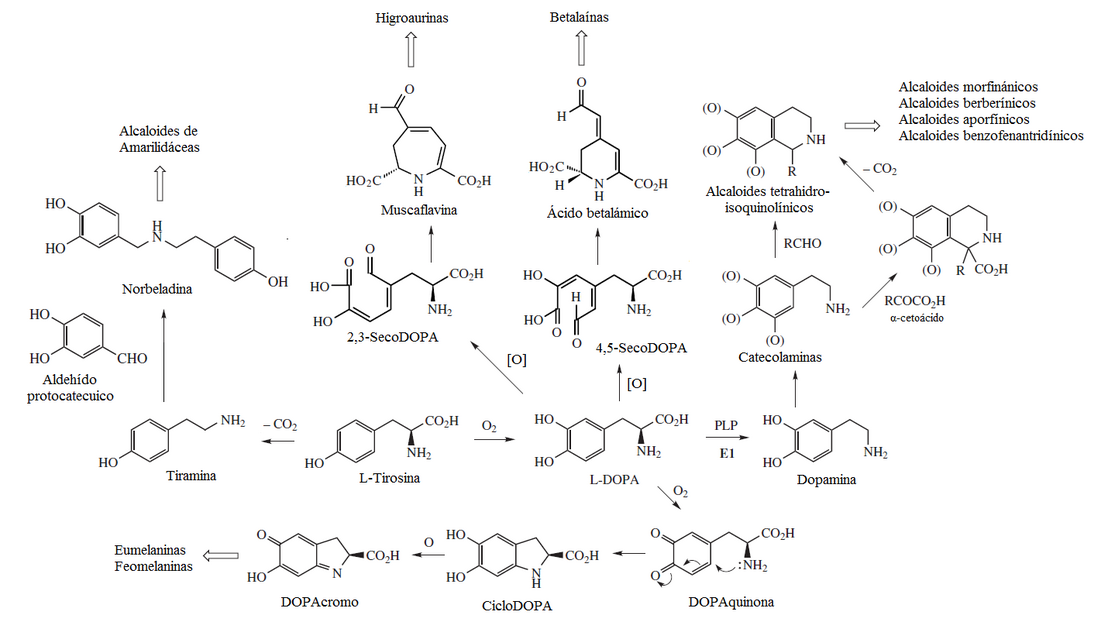
La oxidación de esta molécula proporciona norepinefrina que luego es metilada para dar epinefrina.
La PNMT usa la S-adenosilmetionina como cofactor para donar el grupo metilo a la norepinefrina, formando así la adrenalina.
Esta reacción es catalizada por enzimas oxidativas y normalmente es controlada por proteínas de dirección.
[27] Los organismos productores de estas enzimas son cruciales para los ciclos ecológicos (por ejemplo, crecimiento / muerte / descomposición / rebrote, ciclo del carbono y restauración del suelo) porque permiten que el tejido vegetal se descomponga rápidamente, liberando la materia orgánica para su reutilización en las nuevas generaciones de vida.
A su vez, las chalconas forman uno de los grupos fitoquímicos más extendidos y representativos en las plantas angiospermas: los flavonoides.
Las 'auronas producen un cierre furanoide (en lugar del piranoide de los flavonoides) y se encuentran restringidas taxonómicamente.
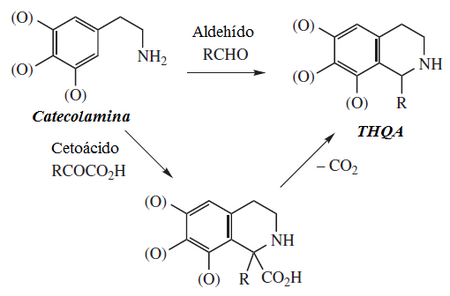
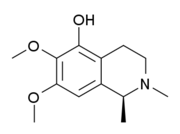
Los alcaloides isoquinolínicos y tetrahidroisoquinolínicos (THIQ) comprenden una diversa gama de compuestos ampliamente distribuidos principalmente en el reino vegetal.
[34] La salinosporamida A (Marizomib) es un potente inhibidor del proteasoma que se estudia como posible agente anticanceroso.
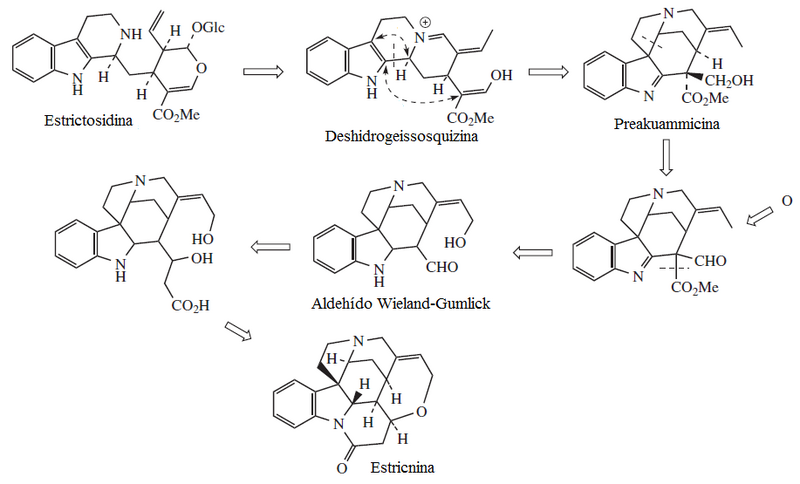
Los compuestos carbonílicos condensados con triptamina más comunes son el ácido pirúvico, el cual forma 1-metil β-carbolinas (como la harmina) o aldehídos como la secologanina.
Un derivado de la prekuamicina, la estemadenina, puede formar distintos alcaloides tales como la elipticina: La prekuamicina también es precursora de los sistemas tipo andranginina: La secodina sufre ciclizaciones posteriores para formar los alcaloides tipo Cataranthus.
Muchos alcaloides que contienen un grupo metilo o hidroximetilo en la posición 8 están presentes en el cornezuelo en cantidades mínimas.
La oxidación del metilo terminal de la agroclavina forma el ácido lisérgico, uno de los alcaloides del ergot más conocidos: El ácido lisérgico puede incorporarse a una polipéptido sintasa no ribosomal para formar alcaloides más complejos, como la β-ergocriptina.
Estos alcaloides del cornezuelo manifiestan una variedad compleja de propiedades farmacológicas.
[58][59] El ácido quinurénico es un alcaloide quinolínico que se forma a partir de un catabolito del triptófano, la quinurenina.
Cuando la cetona tautomeriza a enol, se finaliza así la formación del anillo de quinolina.
Este compuesto se oxida a ácido fenilacético por acción de una aldehído deshidrogenasa (EC 1.2.1.5).
Por otro lado, el ácido fenilpirúvico sufre una descarboxilación oxidativa para formar fenilacetaldehído, el cual se puede incorporar a la ruta anteriormente descrita.