Condensación aldólica
En una condensación aldólica entre un aldehído y una cetona, la cetona actúa como nucleófilo, ya que su carbono carbonilo no posee un alto carácter electrofílico debido al efecto inductivo positivo (+I) y al impedimento estérico.
En ciertos casos, se pueden utilizar carbonilos β,γ insaturados como nucleófilos para reaccionar con aldehídos α-carbonílicos, los cuales son altamente electrofílicos.
[9][10] Si la cetona presenta ambos carbonos α enolizables, entonces se puede formar la condensación aldólica cruzada con el benzaldehído en ambas posiciones.
[11] En ocasiones, los factores estéricos, anquiméricos, inductivos o mesoméricos pueden afectar los rendimientos de la síntesis.
Por ejemplo, La reacción entre la mentona ((2S, 5R) -2-isopropil-5-metilciclohexanona) y anisaldehído (4-metoxibenzaldehído) es complicada debido al impedimento estérico del grupo cetona.
Este obstáculo se supera mediante el uso de una base fuerte como el hidróxido de potasio y un disolvente muy polar como el DMSO en la siguiente reacción:[12] En la condensación de Knoevenagel se lleva a cabo una condensación aldólica en la que el nucleófilo es un carbono activado (ácido) situado entre dos grupos electroatractores, los cuales forman un carbanión estabilizado por resonancia, por ejemplo un compuesto β-dicarbonílico.
En donde el electroatractor Z puede ser un carbonilo (cetona, éster o menos común, aldehído), nitro (-NO2) o nitrilo (-CN) Debido a que el carbono intermedio entre ambos carbonilos es más ácido, la condensación se lleva a cabo en condiciones básicas más suaves, por lo general en presencia de una amina no nucleofílica, en la forma de clorhidrato o acetato de la misma.
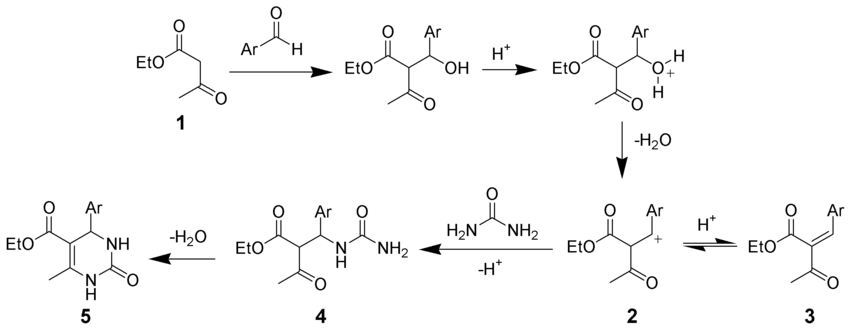
[13] Cuando el nucleófilo es un β-cetoéster, puede preceder una descarboxilación con pérdida del alcohol en lugar de una deshidratación, aplicando calor y un catalizador adecuado.